Журнал "Гастроэнтерология" Том 57, №2, 2023
Вернуться к номеру
Метаболізм вільних жирних кислот у пацієнтів із захворюваннями шлунково-кишкового тракту залежно від індексу маси тіла
Авторы: Степанов Ю.М., Мосійчук Л.М., Кленіна І.А., Карачинова В.А., Шевцова О.М., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
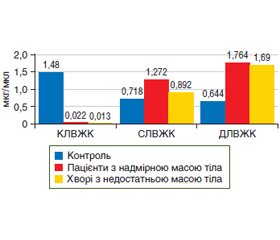
Мета дослідження: проаналізувати вміст вільних жирних кислот (ВЖК) у сироватці крові пацієнтів з надмірною вагою та недостатньою масою тіла при захворюваннях шлунково-кишкового тракту. Матеріали та методи. Обстежено 31 пацієнта із захворюваннями шлунково-кишкового тракту. Серед них було 19 (61,3 %) чоловіків і 12 (38,7 %) жінок, медіана віку становила 39 (27; 48) років. Залежно від результатів дослідження складу тіла за допомогою багатофункціонального монітора TANITA МС-780МА (Японія) вони були розподілені на такі групи: пацієнти з надмірною вагою (індекс маси тіла (ІМТ) понад 25,0 кг/м2) і пацієнти з недостатньою вагою (ІМТ менше за 18,5 кг/м2). Визначення спектра ВЖК у сироватці крові пацієнтів здійснювали за допомогою газового хроматографа з полум’яно-іонізаційним детектором Chromatek-Crystal 5000. Контрольну групу становили 16 практично здорових осіб. Статистичну обробку результатів здійснювали за допомогою пакета прикладних програм Statistica 6.1. Результати. У пацієнтів зі зміною маси тіла мало місце статистично значуще зниження медіани сумарного вмісту коротколанцюгових насичених ВЖК (С4:0) порівняно з контролем, переважно за рахунок зменшення вмісту масляної кислоти в 67 разів (p = 0,001) при підвищеному ІМТ і в 114 разів (p = 0,002) — при зниженому ІМТ. Водночас аналіз сироваткового спектра насичених ВЖК із середньою довжиною карбонового ланцюга показав вірогідне підвищення вмісту капринової кислоти в 14 разів (р < 0,01), ундецилової кислоти — у 19 разів (р < 0,01) і лауринової кислоти — у 25 разів (р < 0,001) у пацієнтів зі зміною маси тіла. Уміст капронової кислоти збільшувався в групі пацієнтів з надмірною масою тіла в 3,9 раза (р = 0,046) порівняно з контрольною групою і в 2,6 раза (р > 0,05) — порівняно з пацієнтами з недостатньою масою тіла. Сумарний вміст мононенасичених ВЖК у сироватці крові пацієнтів з підвищеним і зниженим ІМТ вірогідно підвищувався в 32 рази (р < 0,001) і 19 разів (р = 0,001) відповідно порівняно з контролем. Сумарно поліненасичені ВЖК у сироватці крові пацієнтів обох груп виявлялися в слідовій кількості. У пацієнтів з надмірною масою тіла порівняно з контролем в 38 разів (р < 0,01) підвищувався вміст trans-ВЖК елаїдинової (С18:1(trans-9)) кислоти, тоді як у пацієнтів з недостатньою масою тіла відзначено зниження вмісту лінолеаїдинової (С18:2(trans-9,12)) кислоти в 11,7 раза (р < 0,05). Кореляційний аналіз виявив позитивний зв’язок між ІМТ і збільшеним вмістом у сироватці крові насиченої капронової кислоти (r = 0,39; р = 0,019); мононенасичених кислот — пальмітолеїнової (r = 0,33; р = 0,045) і гептадеценової (r = 0,35; р = 0,034); жирних кислот trans-конфігурації — елаїдинової (r = 0,43; р = 0,009) і лінолеаїдинової (r = 0,43; р = 0,007). Висновки. У пацієнтів із хворобами шлунково-кишкового тракту встановлено дисбаланс у жирнокислотному спектрі сироватки крові. На тлі тенденції до зниження сумарного вмісту коротколанцюгових насичених ВЖК відзначено значне зростання вмісту мононенасичених ВЖК і trans-ВЖК, особливо при підвищеному ІМТ. У всіх пацієнтів визначалася слідова кількість вмісту фракцій поліненасичених ВЖК. Отримані результати можуть бути використані при удосконаленні диференційованого лікування метаболічних порушень у пацієнтів з патологією шлунково-кишкового тракту.
Background. The purpose of the study is to analyze the content of free fatty acids (FFA) in the blood serum of overweight and underweight patients with gastrointestinal diseases. Materials and methods. Thirty-one patients with gastrointestinal diseases were examined, 19 (61.3 %) men and 12 (38.7 %) women with a median age of 39 (27; 48) years. Depending on the results of the body composition study with the multifunctional monitor TANITA MC-780MA (Japan), they were divided into the following groups: overweight patients (body mass index (BMI) more than 25.0 kg/m2) and underweight persons (BMI below 18.5 kg/m2). Determination of the FFA spectrum in the blood serum was carried out using a gas chromatograph with a flame ionization detector Chromatek-Crystal 5000. The control group consisted of 16 practically healthy people. Statistical processing of the results was carried out using the Statistica 6.1 application program package. Results. Patients with a change in body weight reported a statistically significant decrease in the median total content of short-chain saturated FFA (C4:0) mainly due to a decrease in the butyric acid content by 67 times (p = 0.001) with increased BMI and by 114 times (p = 0.002) with decreased BMI compared to controls. At the same time, the analysis of the serum spectrum of saturated FFA with an average carbon chain length showed a probable increase in the content of capric acid by 14 times (p < 0.01), undecyl acid by 19 times (p < 0.01), and lauric acid by 25 times (p < 0.001) in patients with changes in body weight. The content of caproic acid increased in the group with excessive body weight by 3.9 times (p = 0.046) compared to controls and by 2.6 times (p > 0.05) compared to underweight patients. The total content of monounsaturated FFA in the blood serum of patients with increased and decreased BMI increased significantly by 32 times (p < 0.001) and 19 times (p = 0.001), respectively, compared to controls. The total content of polyunsaturated FFA in the blood serum of patients of both groups was found in a trace amount. Overweight patients had a 38-fold (p < 0.01) increase in the trans-FFA elaidic acid (C18:1(trans-9)) compared to controls, while underweight patients had a decrease in linoelaidic acid (C18:2(trans-9,12)) by 11.7 times (p < 0.05). Correlation analysis revealed a positive relationship between BMI and increased serum content of saturated caproic acid (r = 0.39; p = 0.019); monounsaturated acids — palmitoleic (r = 0.33; р = 0.045) and heptadecenoic (r = 0.35; р = 0.034); trans-configuration fatty acids — elaidic (r = 0.43; p = 0.009) and linoelaidic (r = 0.43; p = 0.007). Conclusions. Patients with gastrointestinal diseases had an imbalance in the fatty acid spectrum of the blood serum. Against the background of the tendency to decrease the total content of short-chain saturated FFA, a significant increase in the content of monounsaturated FFA and trans-FFA was noted, especially with increased BMI. In all patients, the trace amount of polyunsaturated FFA fractions was found. The obtained results can be used to improve the differential treatment of metabolic disorders in patients with gastrointestinal tract pathology.
захворювання шлунково-кишкового тракту; вільні жирні кислоти; індекс маси тіла
gastrointestinal diseases; free fatty acids; body mass index
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Roux-en-Y gastric bypass surgery alters serum metabolites and fatty acids in patients with morbid obesity / N.N. Wijayatunga et al. Diabetes/metabolism research and reviews. 2018. Vol. 34(8). P. e3045.
- Changes in plasma free fatty acids in obese patients before and after bariatric surgery highlight alterations in lipid metabolism / S.J. Hierons et al. Sci Rep. 2022. № 12. P. 15337.
- Changes in body mass index and incidence of diabetes: A longitudinal study of Alberta’s Tomorrow Project Cohort / M. Ye et al. Preventive medicine. 2018. Vol. 106. P. 157-163.
- Free Fatty Acid Receptors as new potential therapeutic target in inflammatory bowel diseases / A. Bartoszek et al. Pharmacol Res. 2020. № 152. P. 104604.
- Crohn’s disease recurrence updates: first surgery vs. surgical relapse patients display different profiles of ileal microbiota and systemic microbial-associated inflammatory factors / E. Russo et al. Front Immunol. 2022. № 13. P. 886468.
- Regulation of Intestinal Inflammation by Dietary Fats / A.R. Basson et al. Front Immunol. 2020. № 11. P. 604989.
- Wark G., Samocha-Bonet D., Ghaly S., Danta M. The Role of Diet in the Pathogenesis and Management of Inflammatory Bowel Disease: A Review. Nutrients. 2020. Vol. 13(1). P. 135.
- Participation of Short-Chain Fatty Acids and Their Receptors in Gut Inflammation and Colon Cancer / M.D. Carretta et al. Front Physiol. 2021. № 12. P. 662739.
- Regulatory role of short-chain fatty acids in inflammatory bowel di–sease / Z. Zhang et al. Cell Communication and Signaling. 2022. № 20. P. 64.
- Cummins E.P., Crean D. Hypoxia and inflammatory bowel disease. Microbes Infect. 2017. Vol. 19(3). P. 210-221.
- Schönfeld P., Wojtczak L. Short- and medium-chain fatty acids in energy metabolism: the cellular perspective. J Lipid Res. 2016. Vol. 57(6). P. 943-54.
- Kimura I., Ichimura A., Ohue-Kitano R., Igarashi M. Free Fatty Acid Receptors in Health and Disease. Physiol Rev. 2020. Vol. 100(1). P. 171-210.
- Ravaut G., Légiot A., Bergeron K.-F., Mounier C. Monounsaturated Fatty Acids in Obesity-Related Inflammation. Int J Mol Sci. 2021. Vol. 22(1). P. 330.
- Role of free fatty acids in endothelial dysfunction / A. Ghosh et al. J Biomed Sci. 2017. Vol. 24(1). P. 50.
- Free Fatty Acids’ Level and Nutrition in Critically Ill Patients and Association with Outcomes: A Prospective Sub-Study of PermiT Trial / Y.M. Arabi et al. Nutrients. 2019. Vol. 11(2). P. 384.
- Спектр жирних кислот сироватки крові пацієнтів із хронічними дифузними захворюваннями печінки залежно від етіології та морфологічних особливостей / Ю. Степанов та ін. Гастро–ентерологія. 2018. Т. 52. № 3. С. 127-134.
- Ichihara K., Fukubayashi Y. Preparation of fatty acid methyl esters for gas-liquid chromatography. J Lipid Res. 2010. Vol. 51(3). P. 635-640.
- Circulating short-chain fatty acids in type 2 diabetic patients and overweight/obese individuals / D. Salamone et al. Acta diabetologica. 2022. Vol. 59(12). P. 1653-1656.
- Ilyés T., Silaghi C.N., Crăciun A.M. Diet-Related Changes of Short-Chain Fatty Acids in Blood and Feces in Obesity and Metabolic Syndrome. Biology. 2022. Vol. 11(11). 1556.
- Gut microbiota and short chain fatty acids: implications in glucose homeostasis / P. Portincasa et al. Int J Mol Sci. 2022. Vol. 23(3). P. 1105.
- Huang L., Gao L., Chen C. Role of Medium-Chain Fatty Acids in Healthy Metabolism: A Clinical Perspective. TEM. 2021. Vol. 32(6). P. 351-366.
- Antagonism Between Saturated and Unsaturated Fatty –Acids in ROS Mediated Lipotoxicity in Rat Insulin-Producing Cells / W. Gehrmann et al. Cell Physiol Biochem. 2015. Vol. 36(3). P. 852-65.
- Videla L.A., Hernandez-Rodas M.C., Metherel A.H., Valenzuela R. Influence of the nutritional status and oxidative stress in the desaturation and elongation of n-3 and n-6 polyunsaturated fatty acids: Impact on non-alcoholic fatty liver disease. Prostaglandins Leukot Essent Fatty Acids. 2022. Vol. 181. P. 102441.
- D’Angelo S., Motti M.L., Meccariello R. ω-3 and ω-6 Polyunsaturated Fatty Acids, Obesity and Cancer. Nutrients. 2020. Vol. 12(9). P. 2751.
- Relationship of the Reported Intakes of Fat and Fatty –Acids to Body Weight in US Adults / S.K. Raatz et al. Nutrients. 2017. Vol. 9(5). P. 438.
- The Effect of Trans Fatty Acids on Human Health: Regulation and Consumption Patterns / D. Pipoyan et al. Foods. 2021. Vol. 10(10). P. 2452.
- Pros and cons of CLA consumption: an insight from clinical evidences / S. Benjamin et al. Nutrition & Metabolism. 2015. № 12. P. 20.