Международный неврологический журнал Том 18, №8, 2022
Вернуться к номеру
Частота когнітивних порушень у пацієнтів інтегрованого інсультного блоку у різних періодах інсульту
Авторы: Фломін Ю.В.
Медичний центр «Універсальна клініка «Оберіг», м. Київ, Україна
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
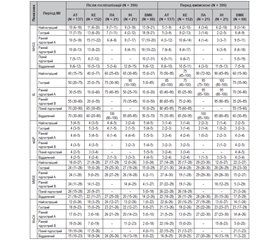
Актуальність. У багатьох пацієнтів після мозкового інсульту (МІ) спостерігаються постінсультні когнітивні порушення (ПІКП), що асоціюються з функціональною неспроможністю та новими захворюваннями. Мета дослідження: за допомогою оціночних шкал виявити ПІКП на початку лікування та перед випискою з інтегрованого інсультного блоку (ІІБ) у різних періодах МІ з урахуванням його типу та підтипу. Матеріали та методи. Проаналізовані вік, стать, тип і підтип, оцінки за Mini-Mental State Examination (MMSE) та Montreal Cognitive Assessment (MoCA) пацієнтів з МІ, які у 2010–2018 рр. у різних періодах захворювання були госпіталізовані в ІІБ. Усі МІ були поділені на внутрішньомозковий крововилив (ВМК) та ішемічний МІ (ІМІ), а останні додатково розподілені на 4 етіологічні підтипи. У разі оцінки за MMSE = 0–24 бали або за MoCA = 0–25 балів ПІКП вважали наявними, а при MMSE = 25–30 балів або MoCA = 26–30 балів — відсутніми. Кількісні змінні були відображені у вигляді медіани та міжквартильного інтервалу (МКІ). Статистичний аналіз проводився за допомогою пакета MedCalc®. Результати. У дослідження включені 399 пацієнтів: 60,7 % чоловіків, медіана віку 66,2 року (МКІ 58,5–76,3), у 331 (82,9 %) діагностовано ІМІ, у 68 (17,1 %) — ВМК. Більшість пацієнтів (64,2 %) були госпіталізовані протягом перших 30 днів. Початкова оцінка за MMSE варіювала від 0 до 30 балів (медіана 20 балів, МКІ 2–27), а ПІКП були наявні у 240 (60,2 %) осіб. Початкова оцінка за MoCA також була у межах від 0 до 30 балів (медіана 15 балів, МКІ 1–24), а ПІКП були виявлені у 356 (89,2 %) учасників дослідження. Перед випискою, згідно з оцінкою за MMSE, ПІКП були наявні у 192 (48,2 %) пацієнтів, а відповідно до MoCA — у 324 (81,2 %) пацієнтів. Тяжкість неврологічних, функціональних та когнітивних порушень була вищою у тих пацієнтів, які були госпіталізовані у найгострішому (0–24 години), гострому (1–7 днів) та ранньому підгострому (8–90 днів) періодах МІ; утім, перед випискою медіани оцінок як неврологічного дефіциту та функціональної спроможності, так і ПІКП значуще (p < 0,05) зменшились. В усіх періодах МІ оцінки як за MMSE, так і за MoCA були статистично значуще (p < 0,0001) нижчими при ВМК порівняно з ІМІ і при кардіоемболічному порівняно з лакунарним підтипом ІМІ. Згідно з оцінками як за MMSE, так і за MoCA, частота ПІКП після госпіталізації була статистично значуще (p < 0,001) вищою, ніж перед випискою з ІІБ. Висновки. Для пацієнтів ІІБ характерна висока частота ПІКП після госпіталізації у різних періодах захворювання. Значно нижча частота ПІКП перед випискою порівняно з початковою може вказувати на позитивний вплив лікування в ІІБ на відновлення когнітивних функцій після МІ.
Background. Many patients after cerebral stroke (CS) experience post-stroke cognitive impairment (PSCI) associated with disability and morbidity. The purpose of the study was to detect PSCI using rating scales in different stroke phases upon admission and at discharge from the comprehensive stroke unit (CSU) taking into account its type and subtype. Materials and methods. The age, sex, type and subtype, Mini-Mental State Examination (MMSE) and Montreal Cognitive Assessment (MoCA) scores of patients with CS who were admitted to the CSU in 2010–2018 at various disease phases were analyzed. All CS were classified as intracerebral hemorrhage (ICH) or ischemic CS (ICS), and the latter were divided into 4 etiologic subtypes. If a patient’s MMSE total score was 0–24 or MoCA was 0–25 points, PSCI were considered as present, and with MMSE score of 25–30 or MoCA of 26–30 as absent. Quantitative variables were shown as median and interquartile range (IQR). Statistical analysis was done with the MedCalc® software. Results. The study enrolled 399 patients: 60.7 % were men, median age was 66.2 years (IQR 58.5–76.3), 331 (82.9 %) had ICS, and 68 (17.1 %) had ICH. Most of them (64.2 %) were admitted within 30 days from stroke onset. The initial MMSE score varied from 0 to 30 points (median of 20, IQR 2–27), and PSCI were present in 240 (60.2 %) participants. The baseline MoCA score also ranged from 0 to 30 (median of 15, IQR 1–24), and PSCI were detected in 356 (89.2 %) of patients. At discharge, 192 (48.2 %) patients had PSCI according to the MMSE score, and 324 (81.2 %) subjects had PSCI according to the MoCA. The severity of neurologic, functional, and cognitive impairment was higher in patients who were admitted in the hyperacute (0–24 hours), acute (1–7 days), and early subacute (8–90 days) stroke phase; however, at discharge the median scores of neurological deficit, functional state, and PSCI significantly (p < 0.05) decreased. In all CS phases, both MMSE and MoCA scores were significantly (p < 0.0001) lower in ICH compared with ICS and in cardioembolic compared with lacunar ICS subtype. Both MMSE and the MoCA assessments showed that that the PSCI rate upon admission was significantly (p < 0.001) higher than at discharge from the CSU. Conclusions. CSU patients are characterized by a high rate of PSCI upon admission at all stroke phases. A significantly lower rate of PSCI at discharge compared with baseline may indicate a positive effect of CSU treatment on cognitive recovery after CS.
мозковий інсульт; постінсультні когнітивні порушення; Mini-Mental State Examination; Montreal Cognitive Assessment; період інсульту; інтегрований інсультний блок
cerebral stroke; post-stroke cognitive impairment; Mini-Mental State Examination; Montreal Cognitive Assessment; stroke phase; comprehensive stroke unit