Журнал "Гастроэнтерология" Том 56, №4, 2022
Вернуться к номеру
Актуальні аспекти застосування Афосилу при коморбідній патології печінки
Авторы: Осьодло Г.В., Бойчак М.П., Федорова О.О.
Українська військово-медична академія МО України, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Стаття присвячена огляду даних сучасної літератури щодо доцільності застосування комбінованих гепатопротекторів-холеретиків при коморбідній патології печінки. Пошук літератури проведений у базах даних Scopus, Web of Science, PubMed та інших. Обґрунтовано доцільність застосування комплексу Афосил при хронічних дифузних захворюваннях печінки різної етіології, функціональних порушеннях жовчного міхура й жовчовивідних шляхів, при поєднаних захворюваннях печінки й біліарного тракту, а також за наявності метаболічних розладів, супутньої патології серцево-судинної і сечовидільної систем.
The article reviews the data of the modern literature on the advisability of using combined hepatoprotectors-choleretics in comorbid liver pathology. The literature search was conducted in the Scopus, Web of Science, PubMed and other databases. The advisability of using the Afosil complex in chronic diffuse liver diseases of various etiologies, functional disorders of the gallbladder and biliary tract, combined diseases of the liver and biliary tract, as well as in the presence of metabolic disorders, concomitant pathology of the cardiovascular and urinary systems has been substantiated.
коморбідна патологія печінки; гепатопротектори; холеретики; Афосил; екстракт артишоку; силімарин; фосфокомплекс силібіну; вітамін Е; піперин; огляд
comorbid liver pathology; hepatoprotectors; choleretics; Afosil; artichoke extract; silymarin; phosphocomplex of silybin; vitamin E; piperine; review
/66.jpg)
- Бабак О.Я., Просоленко К.О. Порівняльна оцінка варіантів коморбідності неалкогольної жирової хвороби печінки з артеріальною гіпертензією за даними багатофакторного аналізу. Сучасна гастроентерологія. 2020. 1(111). 5-10.
- Беловол А.Н., Князькова И.И. Клиническая фармакология гепатопротекторов. Ліки України. 2019. 5–6. 18-25.
- Гепатопротекторы: от теории к практике / Губергриц Н.Б. и др. Донецк: Лебедь, 2012. 156 с.
- Гринцов Е.Ф., Гладух Е.В., Мороз В.А., Федосов А.Ю., Семенов А.Н. Перспективы применения в клинической медицине препаратов на основе артишока. Фармация Казахстана. 2017. № 10. С. 24-28.
- Губергриц Н.Б., Фоменко П.Г., Лукашевич Г.М., Голубова О.А. Фармакотерапевтические эффекты и клинические возможности эталонного препарата силимарина. Фарматека. 2012. 2. 24-31.
- Губергриц Н.Б., Беляева Н.В., Клочков А.Е., Фоменко П.Г., Лукашенко Г.М. Энгилен: от разносторонних терапевтических возможностей к эффективному клиническому применению. Участковый врач. 2019. № 6(76). С. 26-36.
- Губергриц Н.Б., Фоменко П.Г., Голубова О.О., Лукашевич Г.М. Перспективи застосування сучасного натурального гепатопротектора при неалкогольному стеатогепатиті в поєднанні з хронічним безкам’яним холециститом. Практикуючий лікар. 2012. 4. 40-50.
- Дегтярева И.И. Клиническая гастроэнтерология: Рук-во для врачей. Москва: МИА, 2004. 616 с.
- Дегтярева И.И., Козачок Н.Н., Лыховский О.И., Лапчинская И.И., Скрыпник И.Н., Козел Н.П., Невойт А.П. Эффективность применения холивера при заболеваниях гепатобилиарной системы. Сучасна гастроентерологія. 2003. 3(13). 80-85.
- Клінічна фармакологія: Підручник для студентів і лікарів / Абдуєва Ф.М., Бичкова О.Ю., Бондаренко І.О. та ін. За заг. ред. М.І. Яблучанського і В.М. Савченка. Харків: ХНУ імені В.Н. Каразіна, 2011. 405 с.
- Ковальов В.М. Фармакогнозія з основами біохімії рослин: підручник для студ. вищих фармац. установ освіти та фармац. факультетів вищих мед. установ освіти ІІІ–ІV рівнів акредитації / В.М. Ковальов, О.І. Павлій, Т.І. Ісакова; за ред. В.М. Ковальова. Харків: Прапор; НФаУ, 2004. 703 с.
- Компендиум. Лікарські препарати: https://compendium.com.ua/dec/557534/
- Марушко Ю.В., Асонов А.О. Властивості екстрактів артишоку, куркуми, розторопші та їх використання в гастроентерологічній практиці. Практикуючий лікар. 2017. Т. 6. № 2. С. 30-36.
- Опарин А.Г., Лаврова Н.В., Благовещенская А.В. Гепатопротекторы: тактика клинического применения. Схiдноєвропейський журнал внутрiшньої та сiмейної медицини. 2016. № 1. С. 75-81.
- Осьодло Г.В., Федорова О.О. Комбінований захист печінки — основа сучасної гепатопротекції. Рациональная фармакотерапия. 2016. № 2(39). С. 45-52.
- Поготова Г.А., Горчакова Н.О., Белєнічев І.Ф., Чекман І.С. Гепатотропні засоби: органопротекторна дія (огляд літератури). Вісник проблем біології і медицини. 2015. 1(117). 17-27.
- Радченко О.М. Вибір гепатопротектора для лікування уражень печінки. Здоров’я України 21 сторіччя. 2020. 1. 14-15.
- Скрипник І.М. Медикаментозні ураження печінки: аспекти доказовості та реалії медичної практики. Здоров’я України. 2020. 9(478). 37.
- Скрыпник И.Н. Оценка терапевтических подходов к лечению неалкогольного стеатогепатита в Украине и его взаимосвязь с факторами риска: результаты открытого мультицентрового проспективного исследования DIREG_L_04443. Сучасна гастроентерологія. 2013. № 2. С. 64-71.
- Степанов Ю.М., Бреславець Ю.С., Зав’ялова І.Ю. та ін. Ефективність комбінованого гепатопротектора форслів у лікуванні хронічних дифузних захворювань печінки. Гастроентерологія. 2014. 4(54). 63-69.
- Степанов Ю.М., Филиппова А.Ю. Неалкогольный стеатогепатит: современные аспекты диагностики, клиники, лечения. Гастроентерологія: Міжвід. зб. Дніпропетровськ, 2004. Вип. 35. С. 409-424.
- Ткач С.М., Доготарь В.Г. Эффективность и безопасность комбинированной гепатопротекции при хронических токсических поражениях печени. Здоров’я України 21 сторіччя. 2019. 17(462). 40-41.
- Харченко Н.В., Анохіна Г.А., Чекман С.І. Гепатопротектори в лікуванні захворювань печінки: клініко-біохімічні механізми дії. Новости медицины и фармации. Гастроэнтерология. 2013. 457. 5-6.
- Харченко Н.В., Фадеенко Г.Д., Кочуева М.Н. Гепатопротекторы в лечении коморбидной патологии: особенности использования. 2016, листопад. № 4(42).
- Чекман И.С., Липкан Г.Н. Растительные лекарственные средства. Киев: Колос, 1993. 384 с.
- Чекман И.С. Биохимическая фармакодинамика. Киев: Колос, 1991. 201 с.
- Чернявский В.В., Сизенко А.К. Гепатопротекторы в реалиях доказательной медицины и клинической практики. Здоров’я України 21 сторіччя. 2013. 17. 318.
- Abenavoli L., Greco M., Nazionale I., Peta V., Milic N., Accattato F., Foti D., Gulletta E., Luzza F. Effects of Mediterranean diet supplemented with silybin-vitamin E-phospholipid complex in overweight patients with non-alcoholic fatty liver disease. Expert Rev Gastroenterol Hepatol. 2015. 9(4). 519-527. DOI: 10.1586/17474124.2015.1004312.
- Alhumayyd M.S., Bukhari I.A., Almotrefi A.A. Effect of piperine, a major component of black pepper, on the pharmacokinetics of domperidone in rats. J Physiol Pharmacol. 2014 Dec. 65(6). 785-789.
- Amini M.R., Sheikhhossein F., Talebyan A., Bazshahi E., Djafari F., Hekmatdoost A. Effects of Artichoke Supplementation on Liver Enzymes: A Systematic Review and Meta-Analysis of Randomi–zed Controlled Trials. Clin Nutr Res. 2022 Jul 25. 11(3). 228-239.
- Artichoke leaf extract for treating hypercholesterolaemia / B. Wider, M.H. Pittler, J. Thompson-Coon, E. Ernst. Cochrane Database of Systematic Reviews. 2013. № 3. Art. № CD003335.
- Artichoke, cynarin and cyanidin downregulate the expression of inducible nitric oxide synthase in human coronary smooth muscle cells / N. Xia, A. Pautz, U. Wollscheid et al. Molecules. 2014. Vol. 19. № 3. P. 3654-3668.
- Atal S., Atal S., Vyas S., Phadnis P. Bio-enhancing Effect of Piperine with Metformin on Lowering Blood Glucose Level in Alloxan Induced Diabetic Mice. Pharmacognosy Res. 2016 Jan-Mar. 8(1). 56-60. doi: 10.4103/0974-8490.171096.
- Brahma Naidu P., Nemani H., Meriga B., Mehar S.K., Potana S., Ramgopalrao S. Mitigating efficacy of piperine in the physiological derangements of high fat diet induced obesity in Sprague Dawley rats. Chem Biol Interact. 2014 Sep 25. 221. 42-51. doi: 10.1016/ j.cbi.2014.07.008.
- Brigelius-Flohe R., Traber M.G. Nutr Res. 1999. 13. 1145-1155.
- Buddington K.K., Donahoo J.B., Buddington R.K. Dietary oligofructose and inulin protect mice from enteric and systemic pathogens and tumor inducers. J Nutr. 2002. 132. 3. 472-477.
- Bundy R., Walker A.F., Middleton R.W., Wallis C., Simpson H.C. Artichoke leaf extract (Cynara scolymus) reduces plasma cholesterol in otherwise healthy hypercholesterolemic adults: a randomized, double blind placebo controlled trial. Phytomedicine. 2008. 15(9). P. 668-675.
- Chemical and Biological Properties of S-1-Propenyl-l-Cysteine in Aged Garlic Extract / Y. Kodera, M. Ushijima, H. Amano et al. Molecules. 2017. Vol. 22. № 4. P. 570.
- Dajani A.I., Abu Hammour A.M.A., Zakaria M.A. et al. Essential phospholipids as a supportive adjunct in the management of patients with NAFLD. Arab J Gastroenterol. 2015. Vol. 16. № 3–4. P. 99-104.
- de Avelar C.R., Pereira E.M., de Farias Costa P.R., de Jesus R.P., de Oliveira L.P.M. Effect of silymarin on biochemical indicators in patients with liver disease: Systematic review with meta-analysis. World J Gastroenterol. 2017 Jul 21. 23(27). 5004-5017. doi: 10.3748/wjg.v23.i27.5004. PMID: 28785154; PMCID: PMC5526770.
- de Souza Grinevicius V.M., Kviecinski M.R., Santos Mota N.S. et al. Piper nigrum ethanolic extract rich in piperamides causes ROS overproduction, oxidative damage in DNA leading to cell cycle arrest and apoptosis in cancer cells. J Ethnopharmacol. 2016 Aug 2. 189. 139-147. doi: 10.1016/ j.jep.2016.05.020.
- Di Sario A., Bendia E., Taffetani S., Omenetti A., Candelaresi C., Marzioni M., De Minicis S., Benedetti A. Hepatoprotective and antifibrotic effect of a new silybin-phosphatidylcholine-Vitamin E complex in rats. Dig Liver Dis. 2005. 37 (11). 869-876. DOI: 10.1016/j.dld.2005.05.011.
- Doucette C.D., Rodgers G., Liwski R.S., Hoskin D.W. Pipe–rine from black pepper inhibits activation-induced proliferation and effector function of T lymphocytes. J Cell Biochem. 2015 Nov. 116(11). 2577-2588. doi: 10.1002/jcb.25202.
- Duangjai A., Ingkaninan K., Praputbut S., Limpeanchob N. Black pepper and piperine reduce cholesterol uptake and enhance translocation of cholesterol transporter proteins. J Nat Med. 2013 Apr. 67(2). 303-310. doi: 10.1007/s11418-012-0682-7.
- El Hamss R., Idaomar M., Alonso-Moraga A., Munoz Serrano A. Antimutagenic properties of bell and black peppers. Food Chem Toxicol. 2003 Jan. 41(1). 41-47.
- Emendörfer F. et al. Antispasmodic activity of fractions and cynaropicrin from Cynara scolymus on guinea-pig ileum. Biol Pharm Bull. 2005 May. 28(5). 902-904.
- Emim J.A., Oliveira A.B., Lapa A.J. Pharmacological eva–luation of the anti-inflammatory activity of a citrus bioflavonoid, hesperidin, and the isoflavonoids, duartin and claussequinone, in rats and mice. J Pharm Pharmacol. 1994. 46. 2. 118-122.
- Essential phospholipids for nonalcoholic fatty liver disease associated with metabolic syndrome: A systematic review and network meta-analysis / A.I. Dajani, B. Popovic. World J Clin Cases. 2020 Nov 6. 8(21). 5235-5249. doi: 10.12998/wjcc.v8.i21.5235.
- Fanoudi S., Alavi M.S., Karimi G., Hosseinzadeh H. Milk thistle (Silybum Marianum) as an antidote or a protective agent against natural or chemical toxicities: a review. Drug Chem Toxicol. 2018 Jul 22. 1-15.
- Federico A., Dallio M., Di Fabio G., Zarrelli A., Zappavigna S., Stiuso P., Tuccillo C., Caraglia M., Loguercio C. Silybin-Phosphatidylcholine complex protects human gastric and liver cells from oxidative stress. In Vivo. 2015. 29(5). 569-575.
- Federico A., Trappoliere M., Tuccillo C., de Sio I., Di Leva A., Del Vecchio Blanco C., Loguercio C. A new silybin-vitamin E-phospholipid complex improves insulin resistance and liver damage in patients with non-alcoholic fatty liver disease: preliminary observations. Gut. 2006. 55(6). 901-902. DOI: 10.1136/gut.2006.091967.
- Ferenci P. Silymarin in the Treatment of Liver Diseases: What Is the Clinical Evidence? Clinical Liver Disease. 2016. 7(1). 8-10.
- Gibson G.R., Beatty E.R., Wang X., Cummings J.H. Selective stimulation of bifidobacteria in the human colon by oligofructose and inulin. Gastroenterology. 1995. 108. 4. 975-982.
- Gillessen А., Schmidt H.-J. Silymarin as Supportive Treatment in Liver Diseases: A Narrative Review. Adv Ther 2020 Apr. 37(4). 1279-1301. doi: 10.1007/s12325-020-01251-y. Epub 2020 Feb 17.
- Grattagliano I., Diogo C.V., Mastrodonato M., de Bari O., Persichella M., Wang D.Q., Liquori A., Ferri D., Carratu M.R., Oliveira P.J., Portincasa P. A silybin-phospholipids complex counteracts rat fatty liver degener ation and mitochondrial oxidative changes. World J Gastroenterol. 2013. 19(20). 3007-3017. DOI: 10.3748/wjg.v19.i20.3007.
- Gundermann K.J., Gundermann S., Drozdzik M., Mohan Prasad V.G. Essential phospholipids in fatty liver: a scientific update. Clin Exp Gastroenterol. 2016. Vol. 63. № 9. P. 105-117.
- Gundermann K.-J., Kuenker A., Kunts E., Drozdzik M. Асtivity of EPL from soybean in liver diseases. Pharmacological Reports. 2011. Vol. 63. P. 643-659.
- Hinou J., Harvala C., Philianos S. Polyphenolic substances of Cynara scolymus L. leaves. Ann Pharm Fr. 1989. 47. 2. 95-98.
- Hirano T., Higa S., Arimitsu J., Naka T. et al. Flavonoids such as luteolin, fisetin and apigenin are inhibitors of interleukin-4 and interleukin-13 production by activated human basophils. Int Arch Allergy Immunol. 2004. 134. 2. 135-40 Epub 2004 Ma.
- Huang J., Zhang T., Han S., Cao J., Chen Q., Wang S. The inhibitory effect of piperine from Fructus piperis extract on the degra–nulation of RBL-2H3 cells. Fitoterapia. 2014 Dec. 99. 218-226. doi: 10.1016/j.fitote.2014.10.001.
- Janakiraman K., Manavalan R. Studies on effect of pipe–rine on oral bioavailability of ampicillin and norfloxacin. Afr J Tradit Complement Altern. Med. 2008 Apr 10. 5(3). 257-262.
- Karwande V., Borade R. Phytochemicals of nutraceutical importance. Scitus Academics LLC, 2016. 275 p.
- Fang J., Xia C., Cao Z. et al. Apigenin inhibits VEGF and HIF-1 expression via PI3K/AKT/p70S6K1 and HDM2/p53 pathways. FASEB J. 2005. 19.3. 342-53.
- Kaur N., Gupta A.K. Applications of inulin and oligofructose in health and nutrition. J Biosci. 2002. 27(7). 703-714.
- Kharbanda C., Alam M.S., Hamid H., Javed K., Bano S., Ali Y., Dhulap A., Alam P., Pasha M.A. Novel Piperine Derivatives with Antidiabetic Effect as PPAR-γ Agonists. Chem Biol Drug Des. 2016 Sep. 88(3). 354-362. doi: 10.1111/cbdd.12760.
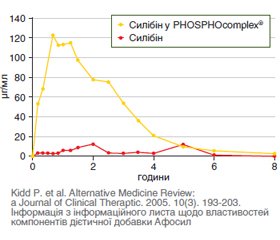
- Kidd P., Head K. A review of the bioavailability and clinical efficacy of milk thistle phytosome: a silybin-phosphatidylcholine complex (Siliphos). Altern Med Rev. 2005 September. 10(3). 193-203.
- Kleessen B., Schwarz S., Boehm A., Fuhrmann H. et al. Jerusalem artichoke and chicory inulin in bakery products affect faecal microbiota of healthy volunteers. Br J Nutr. 2007. 98. 3. 540-9. Epub 2007 Apr. 23.
- Lai L.H., Fu Q.H., Liu Y., Jiang K., Guo Q.M., Chen Q.Y., Yan B., Wang Q.Q., Shen J.G. Piperine suppresses tumor growth and metastasis in vitro and in vivo in a 4T1 murine breast cancer model. Acta Pharmacol Sin. 2012 Apr. 33(4). 523-530. doi: 10.1038/aps.2011.209.
- LDL-cholesterol-lowering effect of a dietary supplement with plant extracts in subjects with moderate hypercholesterolemia / N. Ogier, M.J. Amiot, S. Georgé et al. Eur J Nutr. 2013. Vol. 52. № 2. P. 547-557
- Lee S.W., Rho M.C., Park H.R., Choi J.H., Kang J.Y., Lee J.W., Kim K., Lee H.S., Kim Y.K. Inhibition of diacylglycerol acyltransferase by alkamides isolated from the fruits of Piper longum and Piper nigrum. J Agric Food Chem. 2006 Dec 27. 54(26). 9759-9763.
- Liu Y., Yadev V.R., Aggarwal B.B., Nair M.G. Inhibitory effects of black pepper (Piper nigrum) extracts and compounds on human tumor cell proliferation, cyclooxygenase enzymes, lipid peroxidation and nuclear transcription factor-kappa-B-Nat Prod Commun. 2010 Aug. 5(8). 1253-1257.
- Loguercio С., Andreone P., Brisc C. et al. Silybin combined with phosphatidylcholine and vitamin E in patients with nonalcoholic fatty liver disease: a randomized controlled trial. Free Radical Bio–logy & Medicine. 2012. Vol. 52(9). P. 1658-1665. DOI: 10.1016/j.freeradbiomed.2012.02.008.
- Majdalawieh A.F., Carr R.I. In vitro investigation of the potential immunomodulatory and anti-cancer activities of black pepper (Piper nigrum) and cardamom (Elettaria cardamomum). J Med Food. 2010 Apr. 13(2). 371-381.
- Malaguarnera M., Motta M., Vacante M., Malaguarnera G., Caraci F., Nunnari G., Gagliano C., Greco C., Chisari G., Drago F., Bertino G. Silybin-vitamin E-phospholipids complex reduces liver fibrosis in patients with chronic hepatitis C treated with pegylated interferon α and ribavirin. Am J Transl Res. 2015. 7(11). 2510-2518.
- Mangia A., Santoro R., Copetti M. Treatment optimization and prediction of HCV clearance in patients with acute HCV infection. J Hepatol. 2013. Vol. 59 (2). P. 21-28.
- Mehmood M.H., Gilani A.H. Pharmacological basis for the medicinal use of black pepper and piperine in gastrointestinal disorders. J Med Food. 2010 Oct. 13(5). 1086-1096.
- Meng S. et al. Roles of chlorogenic acid on regulating glucose and lipids metabolism: a review. Evidence-based Complementary and Alternative Medicine. 2013. Vol. 2013. P. 801457.
- Metabolic management in overweight subjects with naive impaired fasting glycaemia by means of a highly standardized extract from Cynara scolymus: a double-blind, placebo-controlled, randomi–zed clinical trial / M. Rondanelli, A. Opizzi, M. Faliva et al. Phytother Res. 2014. Vol. 28. № 1. P. 33-41.
- Miccadei S., Di Venere D., Cardinali A., Romano F. et al. Antioxidative and apoptotic properties of polyphenolic extracts from edible part of artichoke (Cynara scolymus L.) on cultured rat hepatocytes and on human hepatoma cells. Nutr Cancer. 2008. 60. 2. 276-283.
- Monforte M.T., Trovato A., Kirjavainen S., Forestieri A.M. et al. Biological effects of hesperidin, a Citrus flavonoid (note II): hypolipidemic activity on experimental hypercholesterolemia in rat. Farmaco. 1995. 50. 9. 595-599.
- Ohtsuki K., Abe A., Mitsuzumi H., Kondo M. et al. Glucosyl hesperidin improves serum cholesterol composition and inhibits hypertrophy in vasculature. J Nutr Sci Vitaminol (Tokyo). 2003. 49. 6. 447-450.
- Ouyang D.Y., Zeng L.H., Pan H., Xu L.H., Wang Y., Liu K.P., He X.H. Piperine inhibits the proliferation of human prostate cancer cells via induction of cell cycle arrest and autophagy. Food Chem Toxicol. 2013 Oct. 60. 424-430. doi:10.1016/j.fct.2013.08.007.
- Pares A., Planas R., Torres M. et al. Effects of silymarin in alcoholic patients with cirrhosis of the liver: results of a controlled, double-blind, randomized and multicenter trial. J Hepatol. 1998. Vol. 28. № 4. P. 615-621.
- Pattanaik S., Hota D., Prabhakar S., Kharbanda P., Pandhi P. Effect of piperine on the steady-state pharmacokinetics of phenytoin in patients with epilepsy. Phytother Res. 2006 Jun., 12.
- Peppercorn M.A., Goldman P. Caffeic acid metabolism by gnotobiotic rats and their intestinal bacteria. Proc Natl Acad Sci USA. 1972. 69. 6. 1413-1415.
- Pharmacological Studies of Artichoke Leaf Extract and Their Health Benefits / M. Ben Salem, H. Affes, K. Ksouda et al. Plant Foods Hum Nutr. 2015. Vol. 70. № 4. P. 441-453.
- Pilat T.L., Kuz’mina L.P., Gurevich K.G., Khanfer’yan R.A., Radysh I.V., Bezrukavnikova L.M. et al. Nutritional prevention and rehabilitation in gastrointestinal diseases. Moscow, 2019. 36 p. (In Russ.) https://irioh.ru/doc/scie-report/metodRecGastro.pdf.
- Pittler M.H., Thompson C.J., Ernst E. Artichoke leaf extract for treating hypercholesterolaemia. Cochrane Database Syst. Rev. 2002. Issue 3. Art. № CD003335. DOI: 10.1002/14651858.CD003335.
- Pradeep C.R., Kuttan G. Effect of piperine on the inhibition of lung metastasis induced B16F-10 melanoma cells in mice. Clin Exp Metastasis. 2002. 19(8). 703-708.
- Pradeep K., Mohan C.V.R., Gobianand K., Karthikeyan S. Silymarin modulates the oxidant-antioxidant imbalance during die–thylnitrosamine induced oxidative stress in rats. Eur J Pharmacol. 2007 Apr 10. 560(2–3). 110-6.
- Prashant A., Rangaswamy C., Yadav A.K., Reddy V., Sowmya M.N., Madhunapantula S. In vitro anticancer activity of ethanolic extracts of Piper nigrum against colorectal carcinoma cell lines. Int J Appl Basic Med Res. 2017 Jan-Mar. 7(1). 67-72. doi: 10.4103/2229-516X.198531.
- Rambaldi A., Jacobs B.P., Gluud C. Milk thistle for alcoholic and/or hepatitis B or C virus liver diseases. Cochrane Database Syst Rev. 2007 Oct 17. 2007(4). CD003620. doi: 10.1002/14651858.CD003620.pub3. PMID: 17943794; PMCID: PMC8724782.
- Rockey D.C. Antifibrotic therapy in chronic liver disease. Clin Gastroenterol Hepatol. 2005. 3(2). 95-107.
- Rossoni G., Grande S., Galli C., Visioli F. Wild artichoke prevents the age-associated loss of vasomotor function. J Agric Food Chem. 2005. 53. 26. 10291-10296.
- Saenz Rodriguez T., Garcia Gimenez D., de la Puerta Vazquez R. Choleretic activity and biliary elimination of lipids and bile acids induced by an artichoke leaf extract in rats. Phytomedicine. 2002. 9. 8. 687-693.
- Salekzamani S., Ebrahimi-Mameghani M., Rezazadeh K. The antioxidant activity of artichoke (Cynara scolymus): A systema–tic review and meta-analysis of animal studies. Phytother Res. 2019. Vol. 33. № 1. P. 55-71.
- Sama V., Nadipelli M., Yenumula P., Bommineni M.R., Mullangi R. Effect of piperine on antihyperglycemic activity and pharmacokinetic profile of nateglinide. Arzneimittelforschung. 2012 Aug. 62(8). 384-388. doi: 10.1055/s-0032-1314849.
- Schuppan D., Strosser W., Burkard G. et al. Verminderung der Fibrosierungsaktivitt du rch Legalon bei chronischen Lebererkrankungen. Z. Allg. Med. 1998. 74. 577-584.
- Serviddio G., Bellanti F., Giudetti A.M., Gnoni G.V., Petrella A., Tamborra R., Romano A.D., Rollo T., Vendemiale G., Altomare E. A silybin-phospholipid complex prevents mitochondrial dysfunction in a rodent model of nonalcoholic steatohepatitis. J Pharmacol Exp Ther. 2010. 332(3). 922-32. DOI: 10.1124/jpet.109.161612.
- Shoba G., Joy D., Joseph T., Majeed M., Rajendran R., Srinivas P.S. Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers. Planta Med. 1998. 64(4). 353-356. doi: 10.1055/s-2006-957450.
- Singh A., Rao A.R. Evaluation of the modulatory influence of black pepper (Piper nigrum, L.) on the hepatic detoxication system. Cancer Lett. 1993 Aug 16. 72(1–2). 5-9.
- Son D.J., Akiba S., Hong J.T., Yun Y.P., Hwang S.Y., Park Y.H., Lee S.E. Piperine inhibits the activities of platelet cytosolic phospholipase A2 and thromboxane A2 synthase without affecting cyclooxygenase-1 activity: different mechanisms of action are involved in the inhibition of platelet aggregation and macrophage inflammatory response. Nutrients. 2014 Aug 22. 6(8). 3336-3352. doi: 10.3390/ nu6083336.
- Srinivasan K. Black pepper and its pungent principle-pipe–rine: a review of diverse physiological effects. Crit Rev Food Sci. Nutr. 2007. 47(8). 735-748.
- Srinivasan M., Sudheer A.R., Menon V.P. Ferulic acid: therapeutic potential through its antioxidant property. Journal of Cli–nical Biochemistry and Nutrition. 2007. Vol. 40. № 2. P. 92-100.
- Suarez M., Boque N., Del Bas J.M., Mayneris-Perxachs J., Arola L., Caimari A. Mediterranean diet and multi-ingredient-based interventions for the management of non-alcoholic fatty liver disease. Nutrients. 2017. 9(10). pii: E1052. DOI: 10.3390/nu9101052.
- Sun S.S., Wu Y.X., Cheng M.L., Chen C.W., Peng Y.S., Miao Q., Bian Z.L., Wang X.J., Fu Q.C. Experimental study of silybin-phospholipid complex intervention on amiodarone-induced fatty liver in mice. Chinese Journal of Hepatology. 2019. 27(1). 45-50. DOI: 10.3760/cma.j.issn.1007-3418.2019.01.010.
- Tak J.K., Lee J.H., Park J.W. Resveratrol and piperine enhance radiosensitivity of tumor cells. BMB. Rep. 2012 Apr. 45(4). 242-246.
- Tharmalingam N., Kim S.H., Park M., Woo H.J., Kim H.W., Yang J.Y., Rhee K.J., Kim J.B. Inhibitory effect of piperine on Helicobacter pylori growth and adhesion to gastric adenocarcinoma cells. Infect Agent Cancer. 2014 Dec 16. 9(1). 43. doi: 10.1186/1750-9378-9-43. eCollection 2014.
- Ardalani H., Jandaghi P., Meraji A., Hassanpour Moghadam M. The Effect of Cynara scolymus on Blood Pressure and BMI in Hypertensive Patients: A Randomized, Double-Blind, Placebo-Controlled, Clinical Trial. Complement Med Res. 2020. 27(1). 40-46. doi: 10.1159/000502280. Epub 2019 Sep 4. PMID: 31484191.
- The influence of supplementation with artichoke (Cynara scolymus L.) extract on selected redox parameters in rowers / S.A. Skarpanska, S.L. Pilaczynska, P. Basta et al. Int J Sport Nutr Exerc Metab. 2008. Vol. 18. № 3. P. 313-327.
- Thiel A., Buskens C., Woehrle T., Etheve S., Schoenma–kers A., Fehr M., Beilstein P. Black pepper constituent piperine: genotoxicity studies in vitro and in vivo. Food Chem Toxicol. 2014 Apr. 66. 350-357. doi: 10.1016/j.fct.2014.01.056.
- Venkatesh S., Durga K.D., Padmavathi Y., Reddy B.M., Mullangi R. Influence of piperine on ibuprofen induced antinociception and its pharmacokinetics. Arzneimittelforschung. 2011. 61(9). 506-509.
- Verspohl E.J., Ploch M., Windeck T., Klaes M., Schmidt T., Bauer K. Effect of two artichoke extracts (36_U and 36_EB) on rat ileum (with respect to bowel syndrome) and the peristaltic threshold. Phytomedicine. 2008 Nov. 15(11). 1002-1009.
- Voroneanu L., Nistor I., Dumea R. et al. Silymarin in Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Diabetes Res. 2016. 2016. 5147468. Published online 2016 Jun 1. doi: 10. 1155/2016/5147468.
- Wittemer S.M., Ploch M., Windeck T., Muller S.C. et al. Bioavailability and pharmacokinetics of caffeoylquinic acids and flavonoids after oral administration of Artichoke leaf extracts in humans. Phytomedicine. 2005. 12. 1–2. 28-38.
- Wittemer S.M., Veit M. Validated method for the determination of six metabolites derived from artichoke leaf extract in human plasma by high-performance liquid chromatography-coulometric-array detection. J Chromatogr B Analyt Technol Biomed Life Sci. 2003. 793. 2. 367-375.
- Wongpa S., Himakoun L., Soontornchai S., Temcharoen P. Antimutagenic effects of piperine on cyclophosphamide-induced chromosome aberrations in rat bone marrow cells. Asian Pac J Cancer Prev. 2007 Oct-Dec. 8(4). 623-627.
- Yaffe P.B., Power Coombs M.R., Doucette C.D., Walsh M., Hoskin D.W. Piperine, an alkaloid from black pepper, inhibits growth of human colon cancer cells via G1 arrest and apoptosis triggered by endoplasmic reticulum stress. Mol Carcinog. 2015 Oct. 54(10). 1070-1085. doi: 0.1002/mc.22176.
- Yan J.-J. et al. Protective effects of ferulic acid in amyloid precursor protein plus presenilin-1 transgenic mouse model of Alzheimer disease. Biological & Pharmaceutical Bulletin. 2013. 36(1). 140-143.
- Yang Z., Zhuang L., Lu Y. et al. Effects and tolerance of silymarin (milk thistle) in chronic hepatitis C virus infection patients: a meta-analysis of randomized controlled trials. Biomed Res Int. 2014. 2014. 941085.
- Zhang Y., Wang X., Ma L., Dong L., Zhang X., Chen J., Fu X. Anti-inflammatory, antinociceptive activity of an essential oil recipe consisting of the supercritical fluid CO2 extract of white pepper, long pepper, cinnamon, saffron and myrrh in vivo. J Oleo Sci. 2014. 63(12). 1251-1260.
- Zhong S., Fan Y., Yan Q. et al. The therapeutic effect of silymarin in the treatment of nonalcoholic fatty disease: A meta-analysis (PRISMA) of randomized control trials. Medicine (Baltimore). 2017 Dec. 96(49). e9061. doi:10.1097/MD.0000000000009061.
- Zhu X., Zhang H., Lo R. Phenolic compounds from the leaf extract of artichoke (Cynara scolymus L.) and their antimicrobial activities. J Agric Food Chem. 2004 Dec 1. 52(24). 7272-7278.
- Zhu X.F., Zhang H.X., Lo R. Antifungal activity of Cynara scolymus L. extracts. Fitoterapia. 2005 Jan. 76(1). 108-111.