Архив офтальмологии Украины Том 10, №3, 2022
Вернуться к номеру
Особливості раннього післяопераційного періоду хірургічного лікування катаракти у хворих на цукровий діабет 2-го типу
Авторы: Кирпичников О.В.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Медичний центр «Зір 100 %», м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
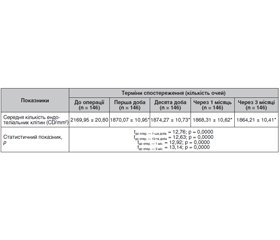
Актуальність. Катаракта — основна причина сліпоти в усьому світі, яка також є одним із найчастіших очних ускладнень, що супроводжують ЦД. Золотим стандартом хірургії катаракти сьогодні є факоемульсифікація (ФЕК) з імплантацією задньокамерної інтраокулярної лінзи (ІОЛ). Через вихідне пошкодження гематоофтальмічного бар’єра у хворих на ЦД ризик розвитку неінфекційного запалення після ФЕК вищий на понад 30 %, якщо порівняти із соматично здоровими пацієнтами. Матеріали та методи. Під спостереженням перебувало 80 пацієнтів (146 очей) із катарактою, хворих на цукровий діабет 2-го типу, яким виконувалася ФЕК з імплантацією ІОЛ. У всіх пацієнтів супутньою була непроліферативна діабетична ретинопатія. Пацієнтам до операції та у післяопераційному періоді проводили дослідження гостроти зору, внутрішньоочного тиску, ендотеліальну біомікроскопію, оптичну когерентну томографію сітківки, біомікроскопію. Результати. Виконання ФЕК з імплантацією ІОЛ у хворих на цукровий діабет 2-го типу дозволило: статистично значуще підвищити некориговану гостроту зору в 7 разів на 1-шу, 10-ту добу та через 3 місяці (tдо опер. — 1-ша доба = 8,75, tдо опер. — 10-та доба = 9,30, tдо опер. — 3 міс. = = 8,19; p = 0,0000), у 6 разів через 1 місяць (tдо опер. — 1 міс. = 7,45; p = 0,0000) спостережень після оперативного втручання; статистично значуще підвищити максимально кориговану гостроту зору в 5 разів на 1-шу добу, через 1 та 3 місяці (tдо опер. — 1-ша доба = 6,95, tдо опер. — 1 міс. = 5,95, tдо опер. — 3 міс. = 6,43; p = 0,0000), у 6 разів на 10-ту добу (tдо опер. — 10-та доба = 7,32; p = 0,0000) спостережень після оперативного втручання; статистично значуще знизити ВОТ на 7 % через 1 місяць (tдо опер. — 1 міс. = 2,94; p = 0,004) і на 10 % через 3 місяці (tдо опер. — 3 міс. = 5,34; p = 0,0000) та середню кількість ендотеліальних клітин на 16 % на 1-шу добу, 10-ту добу, через 1 і 3 місяці (tдо опер. — 1-ша доба = 12,76, tдо опер. — 10-та доба = 12,63, tдо опер. — 1 міс. = 12,92, tдо опер. — 3 міс. = 13,14, p = 0,0000) спостережень після оперативного втручання; а також підвищити товщину фовеальної зони сітківки на 10 % на 1-шу добу (tдо опер. — 1-ша доба = 14,14; p = 0,0000), на 12 % на 10-ту добу (tдо опер. — 10-та доба = 18,37; p = 0,0000), на 16 % через 1 місяць (tдо опер. — 1 міс. = 23,79; p = 0,0000) та на 19 % через 3 місяці (tдо опер. — 3 міс. = 26,73; p = 0,0000) спостережень після оперативного втручання.
Background. Cataract is the main cause of blindness worldwide, which is also one of the most common eye complications associated with diabetes mellitus. Currently, the gold standard of cataract surgery is phacoemulsification (PHACO) with posterior chamber intraocular lens (IOL) implantation. Due to the initial damage of the blood-ocular barrier in patients with diabetes, the risk of developing non-infectious inflammation after PHACO is higher by more than 30 % compared to somatically healthy patients. Materials and methods. Eighty patients (146 eyes) with cataract and type 2 diabetes who underwent PHACO with IOL implantation were under observation. All of them had concomitant non-proliferative diabetic retinopathy. Patients were examined for visual acuity, intraocular pressure, and underwent endothelial biomicroscopy, optical coherence tomography, and biomicroscopy before and after surgery. Results. Performing PHACO with IOL implantation in patients with type 2 diabetes made it possible: to statistically significantly increase the uncorrected visual acuity by 7 times on days 1, 10 and in 3 months (tpreoper. — day 1 = 8.75, tpreoper. — day 10 = 9.30, tpreoper. — 3 months = 8.19; p = 0.0000), by 6 times in 1 month (tpreoper. — 1 month = 7.45; p = 0.0000) of follow-up; to increase statistically significantly the maximum corrected visual acuity by 5 times on the first day, in 1 and 3 months (tpreoper. — day 1 = 6.95, tpreoper. — 1 month = 5.95, tpreoper. — 3 months = 6.43; p = 0.0000), by 6 times on day 10 (tpreoper. — day 10 = 7.32; p = 0.0000); to reduce statistically significantly the IOP by 7 % after 1 month (tpreoper. — 1 month = 2.94; p = 0.004), and by 10 % after 3 months (tpreoper. — 3 months = 5.34; p = 0.0000) and the average number of endothelial cells by 16 % on day 1, 10, in 1 and 3 months (tpreoper. — day 1 = 12.76, tpreoper. — day 10 = 12.63, tpreoper. — 1 month = 12.92, tpreoper. — 3 months = 13.14; p = 0.0000), as well as to increase the thickness of the foveal zone of the retina by 10 % on the first day (tpreoper. — day 1 = 14.14; p = 0.0000), by 12 % on day 10 (tpreoper. — day 10 = 18.37; p = 0.0000), by 16 % after 1 month (tpreoper. — 1 month = 23.79; p = 0.0000) and by 19 % three months (tpreoper. — 3 months = 26.73; p = 0.0000) after surgery.
катаракта; факоемульсифікація; післяопераційні ускладнення; цукровий діабет 2-го типу
cataract; phacoemulsification; postoperative complications; type 2 diabetes
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Wild S., Roglic G., Green A., Sicree R., King H. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030. Diabetes Сare. 2004 May 1. 27(5). 1047-53.
- Ragab M., Rashed L.A. EfPHACOt of experimentally induced diabetes mellitus on the exocrine part of pancreas of adult male albino rat and the possible protective role of Silymarin: light and electron microscopic study. Journal of Advanced Pharmacy Education & Research. Jan-Mar. 2018. 8(1).
- Khazaii R., Kamareh S. Relationship between Diabetes and Periodontal Disease: A Review оf Literature. Annals of Dental Specialty. 2018 Jan 1. 6(1). 57.
- Mohammadi S.F., Hashemi H., Mazouri A., Rahman A.N., Ashrafi E., Mehrjardi H.Z., et al. Outcomes of cataract surgery at a referral center. Journal оf Ophthalmic & Vision Research. 2015 July. 10(3). 250.
- Patel P.M., Jivani N., Malaviya S., et al. Cataract: A major secondary diabetic complication. Int. Curr. Pharm. J. 2012. 1(7). 180-185.
- L Wan X.H., Zhao G.H. Meta-analysis of the risk of cataract in type 2 diabetes. BMC Ophthalmol. 2014. 14. 8.
- Olafsdottir E., Andersson D.K., Stefansson E. The prevalence of cataract in a population with and without type 2 diabetes mellitus. Acta Ophthalmol. 2012. 90(4). 334-340.
- Machan C.M., Hrynchak P.K., Irving E.L. Age-related cataract is associated with type 2 diabetes and statin use. Optom. Vis. Sci. 2012. 89(8). 1165-1171.
- Malot J. Cost of cataract surgery in public hospital. Fr. Opthtal. 2011. 34(1). 10-16.
- Peterson S.R., Silva P.A., Murtha T.J., Sun J.K. Cataract Surgery in Patients with Diabetes: Management Strategies. Semin. Ophthalmol. 2018. 33(1). 75-82.
- Draganic V., Vukosavljevic M., Milivojevic M., et al. Evolution of cataract surgery: smaller incision — less complications. Vojnosanit Pregl. 2012. 69(5). 385-388.
- Haddad N.M., Sun J.K., Abujaber S., et al. Cataract surgery and its complications in diabetic patients. Semin. Ophthalmol. 2014. 29(5-6). 329-337.
- Muller M., Kohnen T. Incisions for biaxial and coaxial microincision cataract surgery. Ophthalmologe. 2010. 107 (2). 108-115.
- Gupta A., Gupta V. Diabetic maculopathy and cataract surgery. Ophthalmology Clinics of North America. 2001 Dec. 14(h). 625-zshch.
- Стебловська І.С. Оптимізація хірургічного лікування вікової катаракти: автореф. дис. … канд. мед. наук. Київ, 2018. 18 с.