Судинні захворювання головного мозку, або цереброваскулярна патологія, є важливим чинником інвалідизації і смерті населення розвинутих країн. Поширеність інсультів у світі становить від 150 до 200 на 100 тис. населення, причому останніми роками зазначений показник має тенденцію до зростання [1, 2].
Україна посідає одне з перших місць у Європі за показниками цереброваскулярної захворюваності й смертності від інсульту: щорічно реєструють близько 100–110 тис. інсультів [3]. За даними офіційної статистики, 30–40 % хворих на інсульт помирають протягом перших 30 днів і 50 % — протягом 1 року від початку захворювання, 20–40 % — потребують сторонньої допомоги (12,5 % первинної інвалідності), і тільки близько 10 % повертаються до повноцінного життя [3, 4].
В оптимізації функціонального відновлення і зниження вираженості інвалідизації в осіб, які перенесли інсульт, важлива роль відводиться постінсультній реабілітації, яка може зменшити ступінь пошкодження мозку й покращити результат інсульту. З цією метою використовуються методи метаболічної корекції патобіохімічних порушень, обумовлених ішемією і реперфузією, медикаментозний захист нейронів і відновлення функції ураженої тканини мозку.
Серед усіх препаратів, що зменшують частоту і тяжкість постінсультних проявів, все більшу увагу привертає амантадин [5], який протягом багатьох років з успіхом застосовувався для лікування паркінсонізму, що обумовлено його здатністю покращувати дофамінергічну передачу в центральній нервовій системі (ЦНС) за рахунок стимуляції продукції дофаміну й пригнічення його зворотного захоплення.
Нейропротективні можливості амантадину пов’язують з його антагонізмом до NMDA-рецепторів, що призводить до пригнічення глутаматної ексайтотоксичності [5]. Також доведено, що він підтримує рівновагу між гальмівними й збудливими процесами в ЦНС, запобігає пошкодженню нейронів і зменшує ступінь порушення свідомості [6].
Слід зазначити, що амантадини існують у вигляді двох солей — сульфату й гідрохлориду. Різні солі схожі за фармакодинамічними параметрами, але різняться фармакокінетикою: амантадину сульфат забезпечує більш стабільну концентрацію препарату в плазмі і, відповідно, в головному мозку, краще переноситься і викликає менше побічних ефектів [18].
Крім того, амантадину сульфат випускається не тільки в таблетках, він також має інфузійну форму випуску, що робить саме цю сіль незамінною для призначення пацієнтам у постінсультному періоді, у тому числі при порушенні свідомості [18].
Патогенетичні ланки оксидативного стресу при інсульті й обґрунтованість призначення амантадину сульфату
У відповідь на ішемічне пошкодження мозку розвивається нейронально-гліальна деструкція, яка відбувається за законами гострого запалення і має адаптаційно-пристосувальний характер. При цьому важливу роль відіграє нейротрансмітерний дисбаланс [7]. У відповідь на судинне пошкодження підвищується активність глутаматергічних нейронів, збільшується вивільнення збудливої амінокислоти глутамату і, як наслідок, посилюється шкідлива дія на клітину. У процесі виснаження адаптаційних можливостей розвивається ацидоз, іонний дисбаланс, зростає концентрація збуджуючих амінокислот (в тому числі глутамату), утворюються вільні радикали. Окиснювальні радикали сприяють вивільненню цитокінів, а також вивільненню пресинаптичними нервовими закінченнями надлишкової кількості глутамату, який чинить цитотоксичну дію (феномен глутаматної ексайтотоксичності). Агресивні метаболіти кисню й продукти перекисного окиснення ліпідів потенціюють ней-ротоксичний ефект глутамату. Отже, нейрони і глія стають об’єктом впливу каскаду нейродеструктивних процесів, що викликають порушення їх структурно-функціональної цілісності [7, 11]. Ключову роль у каскаді клітинного пошкодження відіграє внутрішньоклітинне підвищення вмісту іонів кальцію і натрію.
Збудлива дія глутамату опосередковується через рецептори N-метил-D-аспартату (NMDA-рецептори). Інтенсивне пошкодження клітин, що спостерігається при інсульті, призводить до набухання нейронів і їх лізису (некрозу) внаслідок масивної стимуляції NMDA-рецепторів [9]. У пошкодженні нейронів, обумовленому NMDA-рецепторами, виділяють два компоненти: швидкий натрійзалежний компонент, що приводить до негайного набряку клітини, і повільний кальційзалежний компонент, що обумовлює відстрочену деструкцію клітини. В умовах низької інтенсивності активації NMDA-рецепторів кальційзалежний компонент превалює [10, 12].
Надмірне накопичення кальцію всередині клітини в ішемізованих нейронах за рахунок зв’язування з внутрішньоклітинним рецептором кальмодуліном викликає активацію клітинних ферментів (протеїнкіназ, ліпаз, нуклеаз), що обумовлюють утворення NO, вільних радикалів, руйнування внутрішньоклітинних білків, фосфоліпідів, нуклеїнових кислот. Комбінація цих патобіохімічних процесів призводить до загибелі нейронів шляхом як некрозу, так і апоптозу (запрограмована загибель) [8, 11].
Обґрунтуванням застосування амантадину в пацієнтів, які перенесли інсульт, є здатність препарату активно стимулювати виділення дофаміну з нейрональних депо, збільшувати чутливість дофамінергічних рецепторів до нейромедіатора і навіть в умовах дефіциту дофаміну в базальних гангліях нормалізовувати в них нейрофізіологічні процеси [6, 14, 15].
Будучи блокатором NMDA-глутаматних рецепторів, амантадин перериває наростання викиду глутамату, чим пригнічує глутаматну ексайтотоксичність, що лежить в основі запуску патобіохімічних механізмів постішемічного каскаду. Порівняно з іншими молекулами, здатними блокувати NMDA-рецептори (Wang T. еt al., 2014), амантадин виконує цю функцію швидше за інші [16]. У дослідженні T.A. Blanpied еt al. встановлено, що ця ефективність амантадину обумовлена стабілізацією закритого стану каналу, а також інгібуванням потоків іонів кальцію і натрію через канали NMDA-рецепторів [17].
Амантадин має м’яку антихолінергічну дію, яка здійснюється за рахунок блокади вивільнення ацетилхоліну, опосередкованого NMDA-рецепторами, що забезпечує ефективність його призначення при екстрапірамідних рухових порушеннях.
У подвійному сліпому дослідженні Р. König et al. (1996) порівнювалася ефективність лікування амантадином (100 мг) і біпериденом (2 мг) у пацієнтів з екстрапірамідними руховими розладами, що виникали внаслідок застосування галоперидолу [32]. Ефекти лікування були оцінені для інтенсивності екстрапірамідних рухових розладів, кількісної оцінки психотичних симптомів, оцінки побічних ефектів і настрою пацієнтів на 0, 3, 7, 14, 28-й день терапії і після припинення прийому препарату.
Усі пацієнти отримували галоперидол і левомепромазин (для транквілізації/індукції сну) і відповідний протипаркінсонічний засіб протягом 14 днів. Характеристики пацієнтів у жодній групі істотно не розрізнялися. У групі лікування амантадином 2 пацієнти вибули через недотримання режиму терапії, у групі біперидену — 5 (3 — через відсутність ефекту від лікування, 1 — унаслідок недотримання режиму терапії, 1 — через виражене збудження ЦНС). Усі результати, зареєстровані за допомогою різних інструментів оцінки, показали значне покращання щодо екстрапірамідної рухової симптоматики, яке було аналогічним для обох груп лікування.
Автори дослідження дійшли висновку, що застосування амантадину у випадках екстрапірамідних рухових розладів видається виправданим і є корисною альтернативою іншим антихолінергічним препаратам.
Завдяки тому, що амантадину сульфат є агоністом дофамінових рецепторів, а також підвищує рівень норадреналіну, його застосування може бути корисним у лікуванні втоми при розсіяному склерозі, що обумовлена низьким рівнем норадреналіну й дофаміну.
Ефективність терапії амантадином для лікування втоми, викликаної розсіяним склерозом, була продемонстрована в подвійному сліпому рандомізованому порівняльному дослідженні, проведеному L.B. Krupp et al. (1996) [33]. У ньому взяли участь 93 пацієнти, які перебували на амбулаторному лікуванні й отримували амантадин, пемолін або плацебо. Первинними кінцевими точками була оцінка ступеня стомлюваності за шкалою Fatigue Severity Scores (FSS) і модифікованою шкалою для пацієнтів з розсіяним склерозом — Modified Fatigue Impact Scale (MFIS), самозвіту пацієнтів із суб’єктивною оцінкою лікування; вторинними кінцевими точками — оцінка сну, депресії і життєвого тонусу.
Результати дослідження показали, що в пацієнтів, які отримували амантадин, спостерігалося більш виражене зниження стомлюваності за шкалою FSS і MS-FS, ніж у пацієнтів, які отримували плацебо і пемалін. Згідно із суб’єктивною оцінкою пацієнтів у кінці дослідження, амантадин перевершував плацебо і пемалін у лікуванні втоми, викликаної розсіяним склерозом: 79 % пацієнтів, які отримували амантадин, порівняно з 52 %, які отримували плацебо, і 32 %, які отримували пемолін, вважали за краще медикаментозну терапію порівняно з відсутністю лікування (р = 0,03).
Пізніше були вивчені інші властивості амантадину сульфату, які свідчили про нейропротективні ефекти препарату. Так, у дослідженні Nakano et al. (2019) було встановлено, що амантадин підвищує рівень глутатіону — потужного антиоксиданту, який захищає клітину від шкідливого впливу токсичних агентів і вільних радикалів [19]. У дослідженні Ossola et al. (2011) амантадин продемонстрував захисні нейропротективні властивості: зменшував активацію мікроглії, індукував експресію гліального нейротрофічного фактора в мікроглії та астроглії, тим самим сприяв виживанню й диференціюванню нейронів [22]. Крім того, було доведено, що амантадин інгібує запальну активацію мікроглії шляхом зменшення вироблення запальних цитокінів (інтерферон γ і фактор некрозу пухлини α) на 30 %, що забезпечує захист нейронів від пошкодження [20, 21].
Усі ці роботи демонструють прямі нейропротективні властивості амантадину сульфату, які в ранньому реабілітаційному періоді постінсультних пацієнтів можуть сприяти скороченню зони пенумбри й забезпечувати збереження або відновлення рухових і когнітивних функцій.
Нейропротективні властивості амантадину сульфату при лікуванні пацієнтів у ранньому реабілітаційному постінсультному періоді
Існує кілька повідомлень про потенційну ефективність амантадину в пацієнтів, які перенесли різні види інсульту. D.R. Khasanova еt al. порівнювали клінічну ефективність інфузій амантадину (n = 20) і сульфату магнію (n = 20) в гострому періоді ішемічного інсульту. У пацієнтів, які отримували амантадин, спостерігалися більш виражені відновлення свідомості і регрес неврологічного дефіциту, особливо в ранньому реабілітаційному періоді лікування [25].
На 10-й день група, яка отримувала амантадин, продемонструвала значне зниження неврологічного дефіциту — на 39,1 % за шкалою NIHSS, особливо при легкому інсульті, але незалежно від віку або підтипу інсульту; відповідне зниження в контрольній групі досягло 24,4 %. Аналогічним чином через 3 місяці лікування неврологічний дефіцит за шкалою NIHSS у групі амантадину знизився на 58,7 %, у той час як у контрольній групі — на 41,8 %. Показники за шкалою Ренкіна були вищими в групі, що отримувала амантадин, ніж у групі, яка використовувала стандартну терапію, ці відмінності спостерігалися і через 3 місяці терапії. Тоді як показники індексу повсякденного життя Бартел наприкінці терапії значно збільшилися в обох групах лікування, без істотних відмінностей між групами [25].
У невеликому дослідженні О. Krivonos еt al. у пацієнтів з ішемічним інсультом до 90-го дня від початку захворювання на тлі терапії амантадином у дозі 200 мг/добу відзначали більш виражений регрес неврологічного дефіциту, ніж у хворих на тлі стандартної терапії [34].
У роботі Akcil еt al. (2018) вивчали вплив амантадину на відновлення нейрокогнітивних функцій після субарахноїдального крововиливу протягом 6 місяців. Група з п’яти пацієнтів отримувала стандартну терапію плюс амантадин протягом 30 днів, у той час як інші сім пацієнтів використовували стандартне лікування. Результати дослідження свідчать про те, що додавання амантадину до стандартного лікування в ранній період субарахноїдального крововиливу може покращити відновлення нейрокогнітивних функцій [27].
У дослідженні А.М. Leclerc et al. [26] протягом 3,7 року оцінювались ефективність і безпека застосування амантадину й модафінілу для лікування гострого інсульту, починаючи з відділення інтенсивної терапії.
У дослідженні взяли участь 87 пацієнтів: 41 (47 %) — з ішемічним інфарктом мозку, 29 (33 %) — з геморагічним інсультом і 17 (20 %) — із субарахноїдальним крововиливом. На початку лікування, у діапазоні 1–27 днів після інсульту, 71 пацієнту (82 %) призначався амантадин, 13 (15 %) — модафініл і 3 (3 %) — два препарати. Серед усіх пацієнтів 77 % мали сонливість, 32 % — недотримувались команди, 28 % — недостатньо відкривали очі, 17 % — мали низькі показники за шкалою коми Глазго. Найпоширеніша початкова доза становила 100 мг двічі на день як для амантадину (86 %), так і для модафінілу (54 %).
Із 79 пацієнтів, включених до оцінки ефективності, 42 (53 %) були визнані такими, які відповідають на терапію, у тому числі 34/62 (55 %), які отримували монотерапію амантадином, і 8/24 (33 %), які отримували як амантадин, так і модафініл. Жоден пацієнт, який отримував монотерапію модафінілом, не був визнаний респондером (рис. 1). Середній час від початку до відповіді на терапію становив 3 (2,5) дні.
Респондентів частіше виписували додому або на термінову реабілітацію порівняно з тими, хто не відповідав на терапію (90 % проти 62 %, р = 0,006). Серед пацієнтів, які вижили, 63/72 (88 %) при виписці з лікарні був призначений амантадину сульфат.
При оцінці безпеки лікування було встановлено, що найчастішим побічним ефектом при призначенні амантадину сульфату було порушення сну (n = 12). Прийом амантадину був припинений у 10 пацієнтів у середньому через 6 (2,18) днів після початку лікування. Рішення про припинення приймалося лікарями, причини включали тривале неспання після 8 і 9 днів лікування (n = 2) або побічні ефекти препарату, зокрема збудження (n = 2), занепокоєння (n = 1), делірій (n = 1), судоми (n = 1), подовження інтервалу QT без аритмії (n = 1). В одного пацієнта прийом модафінілу був припинений через 5 днів після початку лікування через безсоння і збудження (рис. 2).
/36_2.jpg)
У двох дослідженнях, які були проведені Gao et al., було доведено, що призначення амантадину сульфату може бути корисним при лікуванні наслідків цереброваскулярних подій. У ретроспективному когортному дослідженні було продемонстровано, що амантадин (100–200 мг/добу перорально) прискорює одужання в пацієнтів з персистуючим вегетативним станом після тяжкого крововиливу в мозок порівняно з аналогічною контрольною групою [28]. У другому дослідженні призначення амантадину в дозі 150–200 мг/добу перорально позитивно впливало на неврологічне відновлення в 7 пацієнтів після тяжкого церебрального крововиливу, що було оцінено за допомогою шкали відновлення після коми [29].
У пілотному відкритому дослідженні вивчався вплив амантадину (100 мг) на вербальні функції в пацієнтів з афазією після перенесеного інсульту або інших ушкоджень головного мозку з використанням усного тесту на асоціацію слів. Було доведено, що призначення амантадину значно покращувало генерацію слів [30].
Ефективність і безпека призначення амантадину при порушенні вігільності в пацієнтів із транзиторними ішемічними атаками, викликаними органічними церебральними порушеннями, травмами головного мозку, а також у післяопераційному періоді були показані в дослідженні W. Gehlen [31]. У ньому взяли участь 52 пацієнти, середній вік яких становив 73 роки. Протягом 9 днів вони отримували інфузії амантадину в дозі 200 мг 1 раз на день. У 92 % випадків лікування було визнано ефективним, а переносимість була оцінена як «дуже добра» або «добра» в 96 % випадків.
Завдяки центральному стимулюючому ефекту інфузії амантадину сульфату протягом багатьох років призначалися для симптоматичного лікування порушень вігільності й активності. Ефективність і переносимість амантадину сульфату для лікування цих порушень вивчались у постмаркетинговому дослідженні, проведеному J. Jorg et al. (2000) [35] за участю 316 пацієнтів на базі 42 спеціалізованих клінік. Із усіх 316 пацієнтів 152 (48,1 %) мали інсульт, 49 (15,6 %) — мультиінфарктний синдром, 39 (12,3 %) — травматичне пошкодження мозку, 22 (7 %) — субарахноїдальний крововилив, 121 (38,3 %) — інші діагнози
Середня добова доза амантадину сульфату становила 200 мг (від 50 до 900 мг) і практично не змінювалася протягом усього періоду спостереження. Більшість пацієнтів (60,5 %) отримували лікування протягом 14 днів. У 32,6 % тривалість лікування становила від 7 до 13 днів, у 6,6 % — менше за 7 днів.
Функціональна незалежність оцінювалася за допомогою шкали FIM (міра функціональної незалежності). Покращання цього показника починалося вже на 3-й день і тривало далі — з 44,3 (день 0) до 62,7 (день 14) (рис. 3).
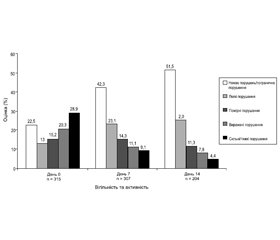
Вігільність і активність оцінювалися за рейтингом WVAR (Wuppertal Vigilance and Drive Disorder Rating). Після лікування амантадину сульфатом ступінь порушення зменшувалася за всіма оцінюваними параметрами — просторового сприйняття, неспання, уваги, орієнтації, пам’яті, мовлення, спілкування, настрою, активності, відповідної поведінки, емоційності, готовності до співпраці й соціальної взаємодії (рис. 4).
Для глобальної оцінки ступеня захворювання використовувалася шкала клінічного глобального враження (CGI). Після лікування амантадину сульфатом було встановлено зниження тяжкості захворювання, пов’язане з одночасним покращанням стану. Якщо до лікування 55,8 % пацієнтів мали тяжкий або вкрай тяжкий стан, то після призначення амантадину сульфату на 7-й і 14-й день терапії ці показники знизилися до 38,5 і 35,3 % відповідно. При цьому на 7-й і 14-й день збільшилася кількість хворих, які мають помірний ступінь тяжкості захворювання, — з 5,2 до 16,2 і 25 % відповідно.
Отже, до кінця дослідження ефективність терапії амантадину сульфатом продемонстрована у 87,4 % пацієнтів, дуже добра переносимість — у 92,6 %, що свідчить про сприятливе співвідношення ризику/користі.
На думку авторів дослідження, підвищення вігільності й активності за допомогою амантадину сульфату і пов’язане з цим покращання функціональної незалежності пацієнтів призводять до зниження залежності від догляду, скорочення термінів госпіталізації і більш раннього початку реабілітації.
У вітчизняному дослідженні В.А. Гриб і співавт. [8] порівнювали ефективність загальноприйнятої терапії і лікувальної схеми з додатковим застосуванням амантадину сульфату у хворих у гострий період ішемічного інсульту.
У дослідження увійшло 40 хворих, серед яких було 24 чоловіки і 16 жінок (середній вік — 64 (43–78) роки), які надійшли у відділення судинної неврології через 8,5 (2–14) год після початку ішемічного інсульту. 7 хворих, які були госпіталізовані в межах терапевтичного вікна, мали протипоказання для проведення тромболізису, зокрема високий рівень артеріального тиску і/або активованого часткового тромбопластинового часу, введення прямих антикоагулянтів упродовж останніх 48 годин, застосування непрямих антикоагулянтів, нещодавні внутрішні кровотечі. Атеротромботичний інсульт був у 13 (32,5 %) пацієнтів, 9 (22,5 %) хворих мали кардіоемболічний інсульт, 12 (30 %) — були з кількома ймовірними причинами, 6 (15 %) осіб мали, імовірно, криптогенний інсульт.
Після закінчення найгострішої фази, тобто на 4-й день після початку інсульту (гострий період), методом випадкових чисел пацієнти були рандомізовані на дві групи: 17 хворих І групи отримували загальноприйняте лікування; 23 хворим ІІ групи поряд із загальноприйнятою терапією додатково застосовувалися 500 мл розчину (200 мг) амантадину сульфату в/в 1 раз на добу 5 днів з подальшим переходом на таблетовану форму препарату — 100 мг 2 р/д (2 місяці). Дослідження проводилось на 4, 10, 14-й день і через 2 місяці після інсульту.
Позитивна динаміка функціонального стану за шкалою NIHSS відбувалась у двох групах обстежуваних пацієнтів (рис. 5), середній бал яких на 4-й день інсульту становив 12,04 ± 0,57. Помітна різниця між показниками шкали в обох групах спостерігалась уже на 10-й день після початку інсульту: І група — 10,41 ± 0,59; ІІ група — 7,96 ± 0,74 (р = 0,052). Через 2 місяці спостереження відзначили, що у 7 хворих, які отримували амантадину сульфат, було повне відновлення функцій, у той же час такий результат спостерігали в 4 пацієнтів І групи. У 14 пацієнтів ІІ групи було менше за 5 балів за шкалою NIHSS, у І групі таких хворих було троє. За шкалою NIHSS функціональний стан пацієнтів, які отримували базову терапію, становив 5,53 ± 0,69; у ІІ групі — 2,49 ± 0,78 (р = 0,009).
Основним критерієм ефективності лікування хворого на інсульт є швидка позитивна динаміка рівня свідомості, а в подальшому — відновлення неврологічного дефіциту. Через тиждень лікування амантадину сульфатом було помітне виражене відновлення свідомості пацієнтів і явне покращання мовлення у хворих з афазією порівняно з групою контролю (р < 0,05).
Біспектральний індекс (BIS) — це параметр, що забезпечує пряме вимірювання ефекту загальної анестезії і седації, а завдяки можливості обчислювання безперервної електроенцефалографії він дозволяє контролювати рівень свідомості та його динаміку під час проведення різних лікувальних опцій. На рис. 6, 7 відзначена позитивна динаміка з вірогідними змінами показників BIS на 4-й і 10-й дні інсульту: І група — 74,00 ± 11,16 і 86,53 ± 8,92 (р < 0,001) відповідно, що свідчило про ефективність обох методів лікування.
Проте рівень свідомості на 10-й день після мозкової події у хворих ІІ групи вірогідно відрізнявся від даних пацієнтів І групи: 94,58 ± 8,92 проти 86,53 ± 8,92 (р < 0,001). Слід нагадати, що BIS = 100 — це показник ясної свідомості. Тобто на 10-й день більшість хворих ІІ групи перебували в стані ясної свідомості.
Автори дослідження зробили висновок, що використання амантадину сульфату в комплексі із загальноприйнятою терапією ішемічного інсульту патогенетично доцільне й показане як нейропротективна (церебропротективна) терапія. У гострий період інсульту рекомендовано введення 500 мл розчину (200 мг) амантадину сульфату в/в (упродовж 3 годин) 5 днів, після чого продовжити його застосування в таблетованій формі: 1 табл. (100 мг) двічі на день упродовж 2 місяців.
Отже, клінічна ефективність антагоніста NMDA-глутаматних рецепторів — амантадину сульфату в постінсультній реабілітації пацієнтів була підтверджена в достатньої кількості хворих, які отримували даний препарат у процесі проведення контрольованих досліджень з використанням контрольних лікарських засобів або плацебо. Значне клінічне покращання при лікуванні інсульту дозволяє виділити амантадини, що мають нейропротективні властивості, як ефективний засіб для корекції порушень свідомості, вігільності й когнітивних порушень унаслідок судинного пошкодження мозку. Їх раннє призначення після інсульту забезпечує зниження тяжкості й зменшення розмірів первинних і вторинних ушкоджень мозку.
Американська асоціація неврологів, Американський конгрес реабілітаційної медицини і Національний інститут досліджень в галузі інвалідності, незалежного життя і реабілітації (2018) рекомендують дорослим пацієнтам з травматичним або судинним ушкодженням мозку й порушенням свідомості призначення амантадину в дозі 100–200 мг на добу протягом 4–16 тижнів для прискорення функціонального відновлення [36].
Висновки
— За даними офіційної статистики, 30–40 % хворих з інсультом помирають протягом перших 30 днів і 50 % — протягом 1 року від початку захворювання, 20–40 % потребують сторонньої допомоги (12,5 % первинної інвалідності), і тільки близько 10 % повертаються до повноцінного життя.
— В оптимізації функціонального відновлення і зниження вираженості інвалідизації в осіб, які перенесли інсульт, важлива роль відводиться постінсультній реабілітації, яка може зменшити ступінь пошкодження мозку і покращи результат інсульту. З цією метою використовується амантадину сульфат, що чинить нейропротективну дію.
— Нейропротективна дія амантадину сульфату обумовлена блокадою NMDA-глутаматних рецепторів, завдяки чому він пригнічує глутаматну ексайтотоксичність, що лежить в основі запуску патобіохімічних механізмів постішемічного каскаду.
— Численні рандомізовані клінічні дослідження демонструють ефективність і безпечність застосування амантадину сульфату в пацієнтів, які перенесли інсульт. Доведено, що його застосування забезпечує корекцію порушень свідомості, вігільності й когнітивних розладів унаслідок судинного пошкодження мозку. Раннє призначення амантадину сульфату після інсульту знижує тяжкість і зменшує розмір первинних і вторинних ушкоджень мозку.
— Американська асоціація неврологів, Американський конгрес реабілітаційної медицини і Національний інститут досліджень у галузі інвалідності, незалежного життя і реабілітації (2018) рекомендують дорослим пацієнтам із судинним ушкодженням мозку і порушенням свідомості призначення амантадину в дозі 100–200 мг на добу протягом 4–16 тижнів для прискорення функціонального відновлення.
Отримано/Received 25.05.2022
Рецензовано/Revised 04.06.2022
Прийнято до друку/Accepted 13.06.2022
/36.jpg)

/36_2.jpg)
/37.jpg)
/38.jpg)