Вступ
Збереження здоров’я нації є першочерговою медико-соціальною проблемою, у вирішенні якої беруть участь фахівці на всіх рівнях надання медичної допомоги. Здоров’я підлітків, як важлива складова цієї проблеми, залежить багато в чому від якості довкілля, умов освіти та навчання, виховання в сім’ї, матеріальної забезпеченості, побуту, організації медичного обслуговування. Особливістю перебігу захворювань у сучасних умовах є поліморбідність та коморбідність, які обумовлені сукупністю патологічних процесів в індивіда, які діагностуються як нозологічні форми, синдроми, клініко-діагностичні ознаки та симптоми. Особливості патогенезу багатьох неінфекційних захворювань досить часто залежать від статі хворого, що нерідко впливає на прояви та перебіг цих захворювань. У той же час наявність тих чи інших захворювань впливає на стан репродуктивної системи. Украй важливого значення це набуває в підлітковому віці, тому що саме процеси статевого дозрівання формують репродуктивний потенціал як індивіда, так і країни в цілому.
Останніми роками багато досліджень присвячені вивченню витоків формування метаболічного синдрому. Доведено, що основні складові метаболічного синдрому починають формуватися саме в підлітковому віці [1–3, 7, 8, 12, 16]. По-перше, це стосується серцево-судинних захворювань, висока смертність від яких призвела до зміщення акцентів у практичній охороні здоров’я на первинному рівні на діагностику і лікування саме кардіоваскулярної патології. У той же час більшість дослідників розглядають неалкогольний стеатогепатоз, що є початковою стадією неалкогольної жирової хвороби печінки (НАЖХП), як фактор ризику кардіоваскулярних захворювань, що сприяє їх прогресуванню [3, 7, 8, 12, 13]. Незважаючи на те, що формально діагностика й лікування НАЖХП є сферою діяльності гастроентеролога, насправді це мультидисциплінарне захворювання. Саме тому в даний час активно обговорюється питання про розгляд НАЖХП як печінкового компонента метаболічного синдрому [5, 8, 14].
На сьогодні встановлено патогенетичний взаємозв’язок між наявністю гіпогонадизму в чоловіків і порушеннями вуглеводного й ліпідного обміну [9, 11, 12, 16]. Такий тісний взаємозв’язок між цими станами дає можливість припустити наявність патогенетичних паралелей між дефіцитом тестостерону (Тст) і формуванням НАЖХП. Однак у сучасній літературі лише поодинокі роботи присвячені пошуку зв’язку між гіпогонадизмом і НАЖХП. Визначення взаємного впливу НАЖХП та стану гіпоандрогенії (ГА) в юнаків є актуальною проблемою, тому що на початку формування цих коморбідних станів можуть бути досить ефективними профілактичні та лікувальні заходи.
Мета дослідження: виявити прогностичні чинники, які сприяють формуванню стеатозу печінки в юнаків із гіпоандрогенією.
Матеріали та методи
Нами були обстежені 157 юнаків віком від 14 до 18 років із затримкою статевого дозрівання (ЗСД). ЗСД І ступеня була у 76 юнаків (48 %), ЗСД ІІ ступеня — у 60 (38 %), ЗСД ІІІ ступеня — у 21 юнака (14 %). У половини хворих було виявлено дефіцит маси тіла, у 62 юнаків (34 %) визначалась нормальна маса тіла, у 13 (8 %) — надлишкова вага та в 13 (8 %) — ожиріння. Для об’єктивізації андрогенного статусу у хворих було визначено вміст тестостерону. Залежно від ступеня гіпоандрогенії пацієнтів було розподілено на групи [3]:
— 0-ва група: рівень Тст був в межах до 12,0 нмоль/л;
— 1-ша група: підлітки, у яких рівень Тст був в межах від 12,0 до 8,0 нмоль/л;
— 2-га група: підлітки, у яких рівень Тст був в межах від 7,0 до 4,0 нмоль/л;
— 3-тя група: підлітки, у яких рівень Тст був менший ніж 4,0 нмоль/л.
У кожній групі юнаків було розподілено за наявністю або відсутністю ознак НАЖХП. Діагноз НАЖХП було встановлено за клініко-лабораторними та ультразвуковими ознаками [4, 8, 14].
Морфофункціональний стан гепатобіліарної системи вивчали із застосуванням ультразвукового дослідження за загальноприйнятою методикою на апараті «SLE-101 РС» MEDELCOM (УЗ-ознаки стеатозу печінки: помірна гепатомегалія, підвищення ехогенності паренхіми та зменшення звукопровідності. УЗ-ознаки стеатозу підшлункової залози: підвищення ехогенності паренхіми, нечіткі контури органа, підвищення зернистості [4, 6, 8, 10]. Проведено біохімічне дослідження крові уніфікованими методами. Визначення рівня γ-глутамілтранспептидази (ГГТ), аспартатамінотрансферази (АСТ), аланінамінотрансферази (АЛТ)1, лужної фосфатази (ЛФ) проводили за допомогою стандартного набору фірми «СпайнЛаб» (Україна) на спектрофотометрі «SOLAR PV 1251C», загального білірубіну і його фракцій, загального холестерину (ЗХ), тригліцеридів (ТГ), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) в сироватці крові проводили на напівавтоматичному фотометрі «Cormay Multi» (Польща) за допомогою стандартних наборів фірми «СпайнЛаб» (Україна).
Рівні холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ, ммоль/л), коефіцієнта атерогенності (КА, Од) розраховували за формулами: ХС ЛПНЩ = ЗХ – ХС ЛПВЩ – (ТГ/2,2); КА = = (ЗХ – ХС ЛПВЩ)/ХС ЛПВЩ.
Для оцінки наявності інсулінорезистентності визначався індекс НОМА = (G0 • Ins0)/22,5, де G0 — рівень глюкози плазми крові натще, ммоль/л; Ins0 — вміст імунореактивного інсуліну у сироватці крові натще, мкОД/мл.
У групах досліджень розраховували середню величину (М), середню помилку показників (m), референтний інтервал для значень досліджуваних показників контрольної групи (М ± m за р < 0,05). Для визначення вірогідності відмінностей показників використовували параметричні та непараметричні критерії: Стьюдента, Вілкоксона — Манна — Уїтні та критерій справжньої значущості (HSD Тьюкі).
Для вивчення взаємозв’язків між змінними проводили кореляційний аналіз із визначенням парних коефіцієнтів (Пірсона і Спірмена), що вказують на ступінь (тісноту) зв’язку між статистичними чинниками.
Для визначення значущих прогностичних клініко-анамнестичних та гормонально-метаболічних ознак щодо формування порушень функціонального стану гепатобіліарної системи при ГА використовувався системно-інформаційний аналіз, методика неоднорідної послідовної статистичної процедури Вальда із застосуванням інформаційної міри Кульбака. Якщо величина загальної інформативності ознаки Ij < 0,3, результат вважався статистично невірогідним. Створення бази даних та статистична обробка результатів проводилися з використанням пакетів прикладних програм Microsoft Excel та SPSS 17.0.
Результати та обговорення
Патологічні прояви з боку органів травлення мали місце у 106 (68 %) юнаків. Хворі з гіпоандрогенією були розподілені на групи за показниками рівня андрогенної насиченості: гіпоандрогенія 0-го ст. — 13 юнаків (12 %); гіпоандрогенія 1-го ст. — 18 (17 %), гіпоандрогенія 2-го ст. — 22 юнаки (21 %), а з найнижчим вмістом тестостерону в дослідження були включені 53 юнаки (50 %).
У клінічній симптоматиці в обстежених підлітків визначалися больовий та диспептичний синдроми незалежно від ступеня ГА (рис. 1, 2). У всіх хворих були скарги диспептичного характеру, а болі у животі відмічались у 73 юнаків (67 %), з переважною локалізацією у верхніх відділах живота, причому в половини — після прийму їжі, а у третини — натще. Порушення моторики травного тракту (печія та відрижка) зустрічались у 59 % хворих. Половина обстежених юнаків скаржилась на запори. У 42 % хворих із гіпоандрогенією апетит був підвищеним, а у 34 % — зниженим.
За даними анамнезу, у групі юнаків із гіпоандрогенією та патологією з боку травної системи було виявлено обтяжену спадковість щодо захворювань репродуктивної системи у 13 (12 %) хворих, щодо ожиріння — у 19 (18 %) юнаків. Потрібно відзначити, що обтяжена щодо ожиріння спадковість зустрічалась тільки у хворих із гіпоандрогенією 3-го ступеня. Щодо гастроентерологічної патології, батьки обстежених хворих мали захворювання органів травлення лише в 7 (6,6 %) юнаків.
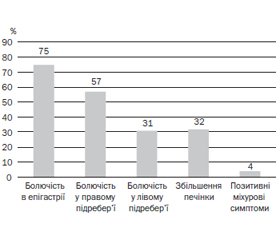
При пальпації живота (рис. 3) не було виявлено різниці в симптомах залежно від ступеня гіпоандрогенії. У більшості підлітків було виявлено болючість при пальпації в епігастрії та правому підребер’ї, у третини хворих також відмічалась болючість у лівому підребер’ї. У 32 % юнаків пальпаторно визначалось незначне збільшення печінки (на 1–2 см нижче від реберної дуги). У 4 % юнаків із гіпоандрогенією були виявлені позитивні міхурові симптоми.
/7.jpg)
Загальноприйняті біохімічні дослідження функцій печінки визначили, що середні рівні загального білірубіну та печінкових ферментів знаходились у межах норми та статистично значуще не відрізнялись по групах. Але зростання ступеня ГА супроводжувалося тенденцією до підвищення рівня досліджених ферментів. Отримані дані свідчать про те, що в юнаків із гіпоандрогенією значущих порушень функціонального стану печінки, ймовірно, ще немає (табл. 1). При порівнянні частоти збільшення вмісту АЛТ вище від верхньої межі норми встановлено, що при зростанні андрогенного дефіциту активність цього ферменту, яка є однією зі скринінгових ознак НАЖХП, зростає. Так, у групі хворих з 0-м ступенем зниження рівня тестостерону підвищення активності АЛТ (> 26 Од/л) реєструвалось у 25 %, а при найбільше вираженій ГА визначалась майже вдвічі частіше у 48 % юнаків (χ2 < 0,05).
Дані щодо ліпідного спектра крові в юнаків із гіпоандрогенією подані в табл. 2.
Аналіз показників ліпідного спектра крові в дітей та підлітків із гіпоандрогенією показав, що у 75 % хворих виявляються патологічні зміни рівня ліпідів, у тому числі у 42 % — підвищення рівня загального холестерину, у 47 % — зниження вмісту ХС ЛПВЩ та підвищення рівня ТГ, у 57 % — підвищення рівня ХС ЛПНЩ та КА. Слід відмітити, що саме підвищений вміст ХС ЛПНЩ вірогідно частіше визначався у юнаків із ГА 3-го ст. порівняно з хворими, у яких значення тестостерону були на нижній межі норми (відповідно 60 та 44 %, χ2 < 0,01). Тобто зміни в ліпідограмі атерогенної спрямованості наростали пропорційно дефіциту андрогенів.
/8.jpg)
Що стосується вуглеводного обміну, то рівень глюкози натще майже у всіх юнаків із ГА не перевищував верхньої межі норми. Визначення стану інсулінорезистентності за підвищенням індексу НОМА-IR вірогідно частішим було в юнаків із ГА 3-го ст. (45 %) порівняно з хворими з ГА 0-го ст. (25 %), χ2 < 0,05. Слід підкреслити, що в більшості обстежених юнаків мала місце недостатня відповідно до віку маса тіла. Лише в групі хворих із ГА 3-го ст. в 10 юнаків (19 %) визначались надлишкова маса тіла та ожиріння.
Для уточнення морфофункціонального стану печінки проводилось ультразвукове дослідження (табл. 3, рис. 4).
/9.jpg)
При проведенні УЗД було встановлено збільшення розмірів печінки та підвищення ехогенності печінки у 32 % обстежених із гіпоандрогенією. Таким чином, за даними УЗД, ознаки стеатогепатозу відзначались майже у третини юнаків із гіпоандрогенією. Причому частота збільшення печінки в юнаків із ГА зростала відповідно до ступеня андрогенної недостатності та була вірогідно вищою в юнаків із ГА 3-го ст. порівняно з хворими з ГА 0-го ст. Збільшення розмірів жовчного міхура зустрічалось практично у всіх обстежених із гіпоандрогенією, а наявність згустків жовчі (біліарного сладжу) виявлена більше ніж у половини хворих незалежно від ступеня ГА. У 76 % юнаків із ГА УЗ-дослідження виявило аномалії форми жовчного міхура, що може призводити до застою жовчі. Привертає увагу той факт, що майже у третини юнаків із гіпоандрогенією виявлено УЗ-ознаки стеатозу підшлункової залози незалежно від ступеня дефіциту андрогенів.
Отримані нами результати вказують на те, що в юнаків із ГА на фоні метаболічних порушень має місце формування як стеатозу печінки, так і стеатозу підшлункової залози, що при прогресуванні може призводити до формування її зовнішньосекреторної недостатності. Також гіпотонія жовчного міхура, особливо в поєднанні з неоднорідністю жовчі, є несприятливою прогностичною ознакою щодо розвитку жовчнокам’яної хвороби.
На підставі проведеного дослідження було визначено найбільш інформативні ознаки щодо формування НАЖХП у юнаків із ГА та розраховано їх прогностичні коефіцієнти (ПК) (табл. 4).
/9_2.jpg)
Таким чином, проведення медико-статистичної процедури прогнозування щодо формування стеатозу печінки (стадія НАЖХП) у юнаків із ГА виявило, що значущими інформативними прогностичними чинниками є надлишкова вага або ожиріння, підвищення активності амінотрансфераз, вмісту ХС ЛПНЩ і, відповідно, коефіцієнта атерогенності, наявність інсулінорезистентності за індексом HOMA. Це збігається з сучасними поглядами на патогенез НАЖХП. Але саме наше дослідження довело, що навіть нормальна маса тіла за ІМТ, нормальні показники коефіцієнта атерогенності можуть сприяти формуванню НАЖХП. Що стосується дефіциту тестостерону, то прогностично несприятливими щодо ризику розвитку стеатозу печінки визначились рівні від 12,0 до 8,0 нмоль/л. Таким чином, навіть не наднизький уміст андрогенів може сприяти формуванню НАЖХП. Можливо, досить низький рівень тестостерону надає поштовх метаболічним порушенням або підтримує їх і стає тригером щодо формування стеатозу печінки. У подальшому до прогресування коморбідної патології можуть залучатися й інші чинники, природа яких потребує уточнення. З іншого боку, можливо, формування та прогресування НАЖХП посилює дефіцит андрогенів.
Висновки
1. У третини юнаків із гіпоандрогенією, за даними УЗД, є ознаки НАЖХП на стадії стеатозу. Частота виявлення НАЖХП підвищується на фоні збільшення дефіциту андрогенів.
2. У третини юнаків із гіпоандрогенією є УЗ-ознаки стеатозу підшлункової залози незалежно від ступеня ГА.
3. У 73 % юнаків із гіпоандрогенією виявлено дисфункціональні розлади біліарного тракту, а саме гіпотонію жовчного міхура незалежно від ступеня ГА та аномалій форми жовчного міхура, що сприяє застою жовчі.
4. У половини юнаків із гіпоандрогенією виявлено УЗ-ознаки жовчнокам’яної хвороби незалежно від ступеня ГА.
5. У 75 % юнаків із ГА та гепатобіліарною патологією виявлено дисліпідемію атерогенної спрямованості.
6. До прогностично значущих чинників формування стеатозу печінки в юнаків із гіпоандрогенією відносяться: наявність інсулінорезистентності за індексом НОМА, підвищений або нормальний індекс маси тіла, підвищення рівня ХС ЛПНЩ та коефіцієнта атерогенності, зниження вмісту тестостерону та підвищення активності АЛТ та АСТ.
Таким чином, результати проведених досліджень свідчать про необхідність включення до діагностичного алгоритму в юнаків із гіпоандрогенією показників ліпідограми, активності АЛТ та АСТ, УЗД печінки, жовчовивідних шляхів та підшлункової залози. Для профілактики та лікування гепатобіліарної патології в юнаків із ГА може бути доцільним застосування дієтичної корекції, гепатопротекторів (препаратів ліпоєвої кислоти, есенціальних фосфоліпідів), призначення препаратів урсодезоксихолевої кислоти в разі наявності біліарного сладжу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація щодо внеску авторів. Страшок Л.А., Турчина С.І. — концепція та дизайн, Косовцова Г.В., Бузницька О.В., Завеля Е.М., Ісакова М.Ю., Єщенко А.В., Хоменко М.А. — збір та обробка матеріалів, Страшок Л.А., Завеля Е.М., Бузницька О.В., Хоменко М.А. — аналіз отриманих даних, написання тексту.
Отримано/Received 02.06.2022
Рецензовано/Revised 15.06.2022
Прийнято до друку/Accepted 22.06.2022
Список литературы
1. Зелінська Н.Б. Ожиріння та метаболічний синдром у дітей. Клінічна ендокринологія та ендокрнинна хірургія. 2013. № 4(45). С. 62-72. https://doi.org/10.24026/1818-1384.4(45).2013.78635
2. Мкртумян А.М., Егшатян Л.В. Влияние андрогенного дефицита на состояние углеводного обмена у мужчин. Ожирение и метаболизм. 2017. Т. 14. № 3. С. 19-24. https://doi.org/10.14341/OMET2017319-24
3. Турчина С.І., Костенко Т.П., Косовцова Г.В., Вародова О.В. Критерії визначення гіпоандрогенії у хлопчиків-підлітків. Український журнал дитячої ендокринології. 2020. № 4. С. 14-19. https://doi.org/10.30978/UJPE2020-4-14
4. Наказ МОЗ України від 29.01.2013 № 59. Уніфікований клінічний протокол медичної допомоги дітям із захворюваннями органів травлення.
5. Пархоменко Л.К., Страшок Л.А., Турчина С.І. та ін. Механізми формування стеатозу печінки в юнаків із гіпоандрогенією. Репродуктивна ендокринологія. 2021. № 1(57). С. 79-83. http://dx.doi.org/10.18370/2309-4117.2021.57.79-83
6. Степанов Ю.М., Завгородня Н.Ю., Лук’яненко О.Ю. Клініко-сонографічні особливості стеатозу підшлункової залози у дітей з надмірною вагою та ожирінням. Гастроентерологія. 2017. Т. 51. № 4. С. 249-256. http://dx.doi.org/10.22141/2308-2097.51.4.2017.119290
7. Antonio L., Wu F.C., O’Neill T.W. et al. Associations between sex steroids and the development of metabolic syndrome: a longitudinal study in European men. J. Clin. Endocrinol. Metab. 2015. Vol. 100. № 4. P. 1396-1404. http://dx.doi.org/10.1210/jc.2014-4184
8. Chalasani N., Younossi Z., Lavine J.E. et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018. Vol. 67. № 1. P. 328-357. http://dx.doi.org/10.1002/hep.29367
9. Cunningham G.R. Testosterone and metabolic syndrome. Asian J. Androl. 2015. Vol. 17. № 2. P. 192-196.
10. European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J. Hepatol. 2016. Vol. 64. № 6. P. 1388-1402. http://dx.doi.org/10.1016/j.jhep.2015.11.004
11. Ebrahimi F., Christ-Crain M. Metabolic syndrome and hypogonadism — two peas in a pod. Swiss Med. Wkly. 2016. Vol. 21. № 146. P. 4283. https://doi.org/10.4414/smw.2016.14283
12. Khazai B., Golden S.H., Colangelo L.A. et al. Association of endogenous testosterone with subclinical atherosclerosis in men: the multi-ethnic study of atherosclerosis. Clin. Endocrinol. (Oxf.). 2016. Vol. 84. № 5. P. 700-707. https://doi.org/10.1111/cen.12997
13. Mody A., White D., Kanwal F., Garcia J.M. Relevance of low testosterone to non-alcoholic fatty liver disease. Cardiovasc. Endocrinol. 2015. Vol. 4. № 3. P. 83-89. http://dx.doi.org/10.1097/XCE.0000000000000057
14. Степанов Ю.М., Абатуров О.Є., Завгородня Н.Ю., Скирда І.Ю. Неалкогольна жирова хвороба печінки в дітей: сучасний погляд на можливості діагностики та лікування (I частина). Гастроентерологiя. 2015. № 2. С. 99-107.
15. Vos M.B., Abrams S.H., Barlow S.E. et al. NASPGHAN Clinical Practice Guideline for the Diagnosis and Treatment of Nonalcoholic Fatty Liver Disease in Children: Recommendations from the Expert Committee on NAFLD (ECON) and the North American Society of Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN). J. Pediatr. Gastroenterol. Nutr. 2017. Vol. 64. № 2. P. 319-334. http://dx.doi.org/10.1097/MPG.0000000000001482
16. Winter A.G., Zhao F., Lee R.K. Androgen deficiency and metabolic syndrome in men. Transl. Androl. Urol. 2014. Vol. 3. № 1. P. 50-58. http://dx.doi.org/10.3978/j.issn.2223-4683.2014.01.04
/9.jpg)

/7.jpg)
/8.jpg)
/9_2.jpg)