Газета «Новости медицины и фармации» №1 (778), 2022
Вернуться к номеру
Серцево-легенева і церебральна реанімація: нові рекомендації Європейської ради з реанімації 2021 року
Авторы: Усенко Л.В., Царьов О.В., Кобеляцький Ю.Ю.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Навесні 2021 року були опубліковані нові рекомендації Європейської ради з реанімації (ERC’2021), які внесли низку змін до алгоритму серцево-легеневої реанімації (СЛР) [1, 2], і рекомендації щодо інтенсивної терапії постреанімаційного періоду, розроблені спільно з Європейським товариством інтенсивної медицини (ESICM) [3]. Пандемія COVID-19, що викликала розвиток світової кризи, привела до глобального переосмислення можливостей використання існуючих медичних ресурсів, і найбільш критично це стосувалося інтенсивної медицини, що зумовило численні обмеження щодо можливості проведення ефективної СЛР. У 2020 р. було опубліковано низку рекомендацій Європейської ради з реанімації та Американської асоціації серця (АНА), що стосувалися особливостей проведення СЛР в умовах пандемії COVID-19 [4, 5]. На сьогодні однозначних відповідей на проблему, що виникла, немає, але це завдання вимагає свого вирішення.
Частота позагоспітальної зупинки кровообігу в Європі варіює від 67 до 170 випадків на 100 000 населення на рік. При цьому виживання на етапі виписки з лікарні залишається на досить низькому рівні й у середньому становить 8 % (від 0 до 18 %) [6].
Необхідно підкреслити, що в європейських країнах, у яких припинення життєпідтримуючої терапії у відділеннях інтенсивної терапії (тобто здійснення пасивної евтаназії в пацієнтів у випадках розвитку несприятливого неврологічного статусу) є рутинною практикою, добрий неврологічний результат реєструється в понад 90 % пацієнтів, які перенесли зупинку кровообігу, і більшість із них повертаються до роботи.
Навпаки, у країнах, де не практикується припинення життєпідтримуючої терапії, неврологічні результати менш сприятливі (лише близько 50 %) і характеризуються більшим рівнем інвалідизації. Так, розвиток персистуючого вегетативного стану реєструється в 33 % випадків [6].
Серед осіб, які перенесли зупинку кровообігу й мали добре неврологічне відновлення, найчастіше відзначалися когнітивні порушення, швидка стомлюваність, проблеми в емоційній сфері, що були характерними факторами, які зумовлюють зниження якості життя.
Сучасні організаційні принципи надання допомоги базуються на «ланцюжку виживання», який включає: раннє розпізнавання зупинки кровообігу й повідомлення відповідним службам, швидкий початок СЛР, включно з ранньою дефібриляцією, а також надання спеціалізованої допомоги на ранньому етапі постреанімаційного періоду.
Первинним механізмом зупинки кровообігу на догоспітальному етапі в 76 % випадків є розвиток фібриляції шлуночків (ФШ) [7]. Цей факт наголошує на важливості суспільно доступної дефібриляції з використанням автоматичних зовнішніх дефібриляторів — AED (Automatic External Defibrillator), що дозволяє забезпечити умови для проведення ранньої дефібриляції в місцях значного скупчення людей, яка продемонструвала свою високу ефективність у всьому світі. Однак, згідно з європейськими даними, частота використання автоматичних зовнішніх дефібриляторів залишається досить низькою і становить у середньому 28 % (від 3,8 до 59 % у різних країнах Європи) [6]. На превеликий жаль, в Україні за останні роки впровадження суспільно доступної дефібриляції так і залишилося на рівні окремих спорадичних випадків. Оскільки основний успіх СЛР, що забезпечує добрі неврологічні результати, досягається, згідно з даними світової статистики, саме на догоспітальному етапі, особливого значення набуває системна підготовка диспетчерів служби невідкладної медичної допомоги, які по телефону зможуть консультувати осіб, які звернулися по допомогу, та інструктувати непрофесіоналів щодо проведення СЛР до моменту приїзду бригади невідкладної медичної допомоги, як це вже давно реалізовано за кордоном.
Базова підтримка життя (Basic Life Support — BLS)
Основний акцент при навчанні непрофесіоналів повинен бути зроблений на таких ознаках критичного стану, як несвідомий стан і порушення зовнішнього дихання, які повинні використовуватися як маркери настання зупинки кровообігу. Отже, для непрофесіоналів за наявності двох ознак — потерпілий непритомний і після відновлення прохідності дихальних шляхів не дихає або погано дихає — необхідно викликати швидку допомогу, звернутися до оточуючих по допомогу й негайно розпочати СЛР. За наявності автоматичного зовнішнього дефібрилятора необхідно його увімкнути й дотримуватися його команд.
Зазначені діагностичні критерії зупинки кровообігу для непрофесіоналів отримали своє обґрунтування в результаті проведеного аналізу 345 випадків проведення непрофесіоналами компресії грудної клітки пацієнтам, які були непритомні, але не мали зупинки кровообігу. У результаті в цій категорії пацієнтів була виявлена невелика частота розвитку ускладнень у вигляді переломів ребер і ключиці (у 1,7 % випадків) і болю в ділянці грудної клітки в місці проведення компресії (у 8,7 % випадків). При цьому серйозніших, а тим більше фатальних ускладнень при проведенні компресії грудної клітки у пацієнтів із збереженим спонтанним кровообігом не було встановлено [8–10]. Отримані дані послужили обґрунтуванням для навчання непрофесіоналів зазначеним маркерам можливої зупинки кровообігу, оскільки гіпердіагностика клінічної смерті краща, ніж її нерозпізнавання і, відповідно, непроведення СЛР пацієнтам, яким вона буквально життєво необхідна.
Важливо відзначити, що агональне дихання (гаспінг) у перші хвилини зупинки кровообігу спостерігається в 40 % пацієнтів, і його наявність асоційована з вищим рівнем виживання [11].
Сучасний комплекс СЛР являє собою алгоритм С-А-В (А — Аirway, В — Вreathing, С — Сirculation). Отже, першим етапом після діагностики зупинки кровообігу є негайний початок компресій грудної клітки, і лише потім — відновлення прохідності дихальних шляхів і штучне дихання.
Компресія грудної клітки
Фундаментальною проблемою штучної підтримки кровообігу є дуже низький (менше за 30 % від норми) рівень серцевого викиду, що створюється при компресії грудної клітки. Правильно проведена компресія забезпечує підтримання артеріального тиску (АТ) систоли на рівні 60–80 мм рт.ст., у той час як діастолічний АТ рідко перевищує 40 мм рт.ст. і, як наслідок, обумовлює низький рівень мозкового (30–60 % від норми) і коронарного (5–20 % від норми) кровотоку [12]. При проведенні компресії грудної клітки коронарний перфузійний тиск підвищується лише поступово, тому з кожною черговою паузою, необхідною для проведення дихання «з рота в рот», він швидко знижується. Необхідно щонайменше 20 компресій, щоб досягти максимально можливого рівня системної гемодинаміки. При цьому було показано, що відношення числа компресій до частоти дихання, що дорівнює 30 : 2, є найефективнішим [12].
Проведене дослідження в інтубованих пацієнтів показало, що компресія грудної клітки, яка проводиться правильно, генерує дихальний об’єм, що дорівнює 40 мл, що є недостатнім для адекватної вентиляції [13]. Однак у випадках, коли реаніматор не знає, як проводити штучне дихання «з рота в рот», або не бажає робити це, від нього вимагається проведення тільки однієї компресії грудної клітки — так званої безвентиляційної СЛР (compression — only resuscitation) [1].
Слід підкреслити, що правильне й безперервне проведення компресії грудної клітки є основною запорукою успіху реанімаційних заходів.
Тому основний акцент сучасних рекомендацій ставиться на мінімізації будь-яких пауз, що припиняють проведення компресії грудної клітки [1].
Частота компресії повинна становити 100–120 на 1 хвилину, глибина компресій повинна бути не менше за 5 см, але не більше ніж 6 см. За даними дослідження, проведеного в 9136 пацієнтів, глибина компресії в діапазоні 4–5,5 см асоціювалася з кращим рівнем виживання [14, 15]. Глибина компресій понад 6 см вірогідно асоціювалася з вищою частотою розвитку переломів ребер і грудини [1, 16].
Особливості BLS в умовах пандемії COVID-19
Як у європейських, так і в американських рекомендаціях велика увага приділяється ризикам зараження як непрофесіоналів, які надають першу допомогу, так і медичного персоналу при проведенні серцево-легеневої реанімації в пацієнтів з можливим або підтвердженим інфікуванням коронавірусною інфекцією, оскільки основним механізмом передачі SARS-CoV-2 є повітряно-краплинний шлях безпосередньо від пацієнта або при дотику до забруднених поверхонь. Необхідно відзначити, що завислі частки аерозолю від інфікованого пацієнта можуть залишатися в повітрі протягом тривалого часу, що вимагає особливих запобіжних заходів з обов’язковим використанням засобів індивідуального захисту (ЗІЗ) [4, 5, 17].
Мінімально необхідний перелік ЗІЗ від потрапляння крапель повинен включати: рукавички, короткий фартух з рукавами, водонепроникну хірургічну маску. Для захисту очей і обличчя необхідно використовувати водостійку хірургічну маску із захисним козирком/щитком або захисні окуляри.
Мінімальний перелік засобів індивідуального захисту для забезпечення повітряної біобезпеки включає: рукавички, довгий халат з рукавами, фільтруючу маску (FFP3), респіратор N99 (або FFP2, N95 при недоступності FFP3).
Особливих запобіжних заходів при контакті з кров’ю не передбачено.
Міжнародний об’єднаний комітет з реанімації (ILCOR) сформулював такі питання, присвячені ризику інфікування під час проведення СЛР:
1. Чи має місце утворення аерозолю під час проведення компресії грудної клітки або дефібриляції?
2. Чи збільшується передача вірусної інфекції під час проведення компресії грудної клітки, дефібриляції або використання комплексу СЛР загалом?
3. Який тип ЗІЗ є оптимальним для захисту від інфікування осіб, які проводять компресію грудної клітки, дефібриляцію або комплекс СЛР у цілому?
При проведенні компресії грудної клітки утворення аерозолю можливе, оскільки вона сама по собі генерує невеликі дихальні об’єми. У разі, коли реаніматор під час проведення СЛР перебуває в безпосередній близькості від дихальних шляхів пацієнта, можлива передача вірусної інфекції. Однак не було виявлено доказів, що електрична дефібриляція здатна генерувати аерозолі, а використання адгезивних електродів дозволяє провести дефібриляцію без прямого контакту між оператором дефібрилятора й пацієнтом.
На підставі проведеного систематичного огляду ILCOR було запропоновано такі рекомендації щодо проведення СЛР в умовах пандемії COVID-19:
1. Компресія грудної клітки і в цілому здійснення комплексу СЛР можуть призводити до формування аерозолів.
2. В умовах пандемії COVID-19 непрофесійним реаніматорам рекомендується проводити безвентиляційну (без проведення штучного дихання) СЛР, а також використовувати AED.
3. Непрофесійні реаніматори, які мають підготовку й бажання, можуть провести штучне дихання дітям на додаток до компресії грудної клітки.
4. В умовах пандемії COVID-19 медичним працівникам рекомендується використовувати засоби індивідуального захисту при проведенні процедур, пов’язаних з утворенням аерозолів при СЛР.
5. Для медичних працівників є раціональним розглянути можливість проведення дефібриляції до моменту надягання засобів індивідуального захисту у тих випадках, коли, на думку реаніматорів, переваги цього кроку можуть перевищувати ризик інфікування [4, 5, 17].
У цілому проведення BLS для непрофесіоналів будується на наступних принципах:
- Приділяти увагу особистій безпеці!
- Діагноз зупинки кровообігу встановлюється за наявності двох ознак: потерпілий непритомний і погано дихає.
- Для визначення ознак свідомості треба поторсати й голосно окликнути постраждалого й паралельно оцінити адекватність зовнішнього дихання.
- Для оцінки зовнішнього дихання не рекомендується маневр відкриття дихальних шляхів і наближення реаніматора до рота й носа потерпілого з метою мінімізації ризику зараження. Оцінювати наявність і адекватність зовнішнього дихання в потерпілого необхідно лише візуально!
- При проведенні СЛР одним реаніматором по змозі необхідно увімкнути функцію гучного зв’язку в телефоні для спілкування з диспетчером служби швидкої медичної допомоги й дотримуватися його інструкцій. Оскільки коронавірус поширюється повітряно-краплинним шляхом, до початку проведення компресії грудної клітки й використання AED треба покласти тканину/рушник/захисну медичну маску на рот і ніс потерпілого для зниження ризику інфікування (рис. 1).
- Після проведення СЛР реаніматори повинні якнайшвидше ретельно вимити руки з милом і/або продезінфікувати антисептиком.
Американською асоціацією серця було запропоновано алгоритм проведення СЛР в умовах пандемії COVID-19, поданий на рис. 2.
Розширена підтримка життя (Advanced Life Support — ALS)
А. Штучне підтримання кровообігу
Загалом правила проведення компресії грудної клітки подані в таких положеннях:
1. Глибина компресії не менше за 5 см, але не більше ніж 6 см.
2. Частота компресій повинна становити 100–120 за хвилину з мінімізацією, наскільки це можливо, пауз у проведенні.
3. Забезпечення після компресії грудної клітки її повної декомпресії, не допускаючи руками спротиву, при цьому руки не повинні відриватися від грудної клітки.
4. Відношення числа компресій до частоти дихання без протекції дихальних шляхів (через лицьову маску) або з протекцією ларингеальною маскою має становити 30 : 2 і здійснюватися з паузою на проведення штучної вентиляції легень (ШВЛ) за рахунок високого ризику розвитку аспірації.
5. В інтубованих пацієнтів компресія грудної клітки повинна проводитися з частотою 100–120 на 1 хвилину, вентиляція — з частотою 10 на 1 хвилину (у разі використання мішка Амбу — 1 вдих кожні 5 секунд), без паузи під час проведення ШВЛ (тому що компресія грудної клітки з одночасним роздмухуванням легень збільшує коронарний перфузійний тиск) [2].
Використання механічних пристроїв для проведення компресії грудної клітки може бути корисним у низці випадків, полегшуючи проведення СЛР, наприклад, у процесі транспортування або винесення пацієнта з приміщень, коли незручно проводити ручну компресію, а також у разі необхідності пролонгованого проведення СЛР [2].
В. Відновлення прохідності дихальних шляхів
Золотим стандартом забезпечення прохідності дихальних шляхів є інтубація трахеї. При цьому необхідно зазначити, що, згідно з даними дослідження [7], проведення інтубації трахеї в пацієнтів із зупинкою кровообігу було пов’язане із затримкою компресії грудної клітки тривалістю в середньому 110 секунд (від 113 до 146 секунд), а у 25 % випадків інтубація тривала понад 3 хвилини. Тому спроба інтубації трахеї повинна тривати не більше ніж 5 секунд, і, якщо за цей час інтубація не вдається, необхідно негайно припинити спроби інтубації і почати проведення компресії грудної клітки й ШВЛ мішком Амбу (або респіратором) через лицьову маску з резервуарним мішком і обов’язковою подачею кисню в мішок зі швидкістю 10–15 л/хв у співвідношенні 30 : 2. Через 2 хвилини необхідно зробити повторну спробу інтубації трахеї або використовувати альтернативні методи забезпечення прохідності дихальних шляхів. Рекомендується навчати інтубації трахеї без припинення компресії грудної клітки. Коротка пауза в компресіях допускається в момент проведення ендотрахеальної трубки через голосові зв’язки, при цьому пауза не повинна перевищувати 5 секунд [2].
Підвищення успішності інтубації трахеї може забезпечити використання відеоларингоскопії. З метою верифікації знаходження ендотрахеальної трубки рекомендується використання капнографії [2].
Однак інтубація трахеї є досить складною навичкою, що вимагає тривалого навчання й постійної практики. Так, в одному з досліджень було показано, що лише після проведення інтернами-анестезіологами близько 125 інтубацій в операційний рівень успішних інтубацій починав досягати 95 % [18]. Загалом у країнах Євросоюзу під час підготовки лікарів-анестезіологів критерієм освоєння інтубації трахеї вважається проведення учнями понад 3 тисячі інтубацій за період навчання в резидентурі. При цьому необхідно відзначити, що інтубація трахеї на догоспітальному етапі в постраждалих з різними критичними станами залишається незадовільною через численні безуспішні спроби, що призводять до погіршення результатів і навіть фатальних ускладнень. Так, у США парамедики вважаються навченими інтубації трахеї після проведення лише 5 успішних спроб у клініці, при цьому жодної в дітей, що є недостатнім. Ці факти привели до переосмислення пріоритетності інтубації трахеї на догоспітальному етапі порівняно з протекцією дихальних шляхів ларингеальною маскою I-gel. У США і Великій Британії було проведено рандомізоване клінічне дослідження серед > 9000 пацієнтів з догоспітальною зупинкою кровообігу, яким парамедики забезпечували відновлення прохідності дихальних шляхів початковим використанням ларингомаски I-gel, порівняно з інтубацією трахеї. У результаті не було виявлено вірогідних відмінностей між групами за рівнем сприятливих наслідків у постреанімаційному періоді (mRS 3; 6,4 проти 6,8 %; P = 0,33) [19]. Усі ці факти привели до активного обговорення проблеми на сторінках міжнародних медичних журналів.
С. Штучна підтримка дихання
При проведенні ШВЛ методом «з рота в рот» кожен штучний вдих повинен проводитися протягом 1 секунди (не форсовано), одночасно слід спостерігати за екскурсією грудної клітки з метою досягнення оптимального дихального об’єму й запобігання попаданню повітря в шлунок. При цьому тривалість проведення двох штучних вдихів «з рота в рот» не повинна перевищувати 10 секунд, після чого необхідно негайно продовжити компресію грудної клітки. Дихальний об’єм повинен становити 500–600 мл (6–7 мл/кг), частота дихання — 10/хв з метою недопущення гіпервентиляції. Дослідженнями було показано, що гіпервентиляція під час СЛР, підвищуючи внутрішньоторакальний тиск, знижує венозне повернення до серця й зменшує серцевий викид, асоціюючись з низьким рівнем виживання таких хворих [20].
Шлях введення лікарськихзасобів
Як і в попередніх рекомендаціях, використовуються два основних доступи для введення препаратів [2]:
а) внутрішньовенний, у центральні або периферичні вени. Оптимальним шляхом введення є центральні вени — підключична й внутрішня яремна, оскільки забезпечується доставка препарату, що вводиться, у центральну циркуляцію. Для досягнення цього ефекту при введенні в периферичні вени препарати повинні бути розведені в 20 мл фізіологічного розчину;
б) внутрішньокістковий шлях — внутрішньокісткова ін’єкція лікарських препаратів у плечову або великогомілкову кістку забезпечує адекватну плазмову концентрацію, за часом порівнянну з введенням препаратів у центральну вену. Використання механічних пристроїв для внутрішньокісткового введення лікарських препаратів забезпечує простоту й доступність даного шляху введення.
Фармакологічне забезпечення реанімації [2]:
1. Адреналін:
а) при електричній активності без пульсу (ЕАБП)/асистолії — 1 мг кожні 3–5 хвилин внутрішньовенно;
б) при ФШ/шлуночковій тахікардії (ШТ) без пульсу адреналін вводиться лише після третього неефективного розряду електричної дефібриляції в дозі 1 мг. Надалі ця доза вводиться кожні 3–5 хвилин внутрішньовенно (тобто перед кожною другою дефібриляцією) настільки довго, наскільки зберігається ФШ/ШТ без пульсу. При цьому необхідно відзначити, що після відновлення самостійного кровообігу навіть маленькі дози адреналіну (50–100 мкг) можуть спричинити розвиток тахікардії, ішемії міокарда, ФШ/ШТ без пульсу. Тому в ранньому післяреанімаційному періоді адреналін більше не вводиться, а за необхідності вазопресорної підтримки використовується норадреналін або мезатон.
Ми хотіли б відзначити ще один практичний момент, який не обговорюється в рекомендаціях ERC’2021, але який нам видається важливим. Так, у нашій практиці з початку СЛР і забезпечення венозного доступу ми відразу підключаємо вазопресорну підтримку (зазвичай мезатоном). Після відновлення самостійного гемодинамічно ефективного ритму в цьому випадку є підпора загального периферичного опору судин, що не допускає повторної зупинки кровообігу внаслідок критичної гіпотензії. А з урахуванням того факту, що більше ніж у половині випадків пацієнтам, які перенесли зупинку кровообігу, у ранньому постреанімаційному періоді потрібна вазопресорна підтримка, цей підхід може підвищувати ефективність СЛР [20].
2. Аміодарон — антиаритмічний препарат першої лінії при ФШ/ШТ без пульсу, рефрактерній до електроімпульсної терапії, вводиться після 3-го неефективного розряду в початковій дозі 300 мг (розведеній в 20 мл 5% розчину глюкози або фізіологічного розчину), а після 5-го неефективного розряду повторно одноразово вводиться ще 150 мг.
3. Лідокаїн — застосовується в разі відсутності аміодарону (при цьому він не повинен використовуватися як доповнення до аміодарону) — початкова доза 100 мг (1–1,5 мг/кг) внутрішньовенно, при необхідності додатково болюсно вводиться по 50 мг (при цьому загальна доза не повинна перевищувати 3 мг/кг протягом першої години).
4. Бікарбонат натрію — рутинне застосування в процесі СЛР або після відновлення самостійного кровообігу не рекомендується.
Зупинка кровообігу є комбінацією респіраторного й метаболічного ацидозу. Найбільш оптимальним методом корекції ацидемії при зупинці кровообігу є проведення компресії грудної клітки, додатковий позитивний ефект забезпечується проведенням вентиляції. Бікарбонат натрію викликає низку несприятливих ефектів внаслідок генерації СО2, що дифундує в клітини:
- посилення внутрішньоклітинного ацидозу;
- негативна інотропна дія на ішемізований міокард;
- порушення кровообігу в головному мозку за рахунок наявності високоосмолярного натрію;
- зміщення кривої дисоціації оксигемоглобіну вліво, що може знижувати доставку кисню тканинам.
Абсолютним показанням для введення бікарбонату натрію є розвиток життєзагрозливої гіперкаліємії [21], а також випадки зупинки кровообігу, асоційованої з гіперкаліємією або передозуванням трициклічних антидепресантів, у дозі 50 ммоль (50 мл 8,4% розчину) або 1 ммоль/кг в/в [2].
5. Хлорид кальцію — у дозі 10 мл 10% розчину внутрішньовенно (6,8 ммоль Сa2+) при гіперкаліємії, гіпокальціємії, передозуванні блокаторів кальцієвих каналів [2].
Дефібриляція
Проведення ранньої дефібриляції протягом перших 3–5 хвилин з моменту зупинки кровообігу забезпечує рівень виживання 50–70 %, що можна реалізувати тільки при впровадженні загальнодоступної дефібриляції. Кожна хвилина затримки проведення дефібриляції знижує виживання пацієнтів у постреанімаційному періоді на етапі виписки з лікарні на 10–12 %. При цьому необхідно зазначити, що низка проведених досліджень використання AED лікарськими бригадами в лікарняних умовах порівняно з використанням професійних дефібриляторів показала зниження рівня виживання пацієнтів [7].
Виділяють трифазну час-залежну модель розвитку фібриляції шлуночків, яка включає фази, що розвиваються послідовно:
- електричну (перші 4–5 хвилин), під час якої ефективним методом усунення ФШ є електрична дефібриляція;
- циркуляторну (наступні 5–10 хвилин — пролонгована ФШ), ефективним методом її усунення є попереднє проведення компресії грудної клітки і лише надалі — електричної дефібриляції;
- метаболічну, при якій необхідне проведення метаболічної терапії [20].
Слід підкреслити, що безперервна компресія грудної клітки може бути корисною на ранніх стадіях ФШ, в електричну і циркуляторну фазу, тоді як додаткова вентиляція більш значущою стає в пізню — метаболічну фазу ФШ. Також було встановлено, що проведення перед дефібриляцією компресії грудної клітки протягом 180 секунд може бути корисним (коротший, 30–60 с, як і довший період, > 180 с, неефективні) [7].
При виявленні на кардіомоніторі/дефібриляторі ФШ/ШТ без пульсу необхідно негайно нанести один розряд електричної дефібриляції. Відразу після нанесення розряду дефібриляції слід продовжити компресію грудної клітки та інші компоненти СЛР протягом 2 хвилин, і лише потім провести оцінку ритму за ЕКГ і в разі відновлення синусового ритму оцінити його гемодинамічну ефективність за наявності пульсу на сонній артерії. Навіть якщо дефібриляція буде ефективною і за даними ЕКГ відновиться синусовий ритм, дуже рідко відразу після дефібриляції він є гемодинамічно ефективним (тобто здатним генерувати пульс, а отже, і кровообіг). Зазвичай потрібно проведення ≥ 1 хвилини компресії грудної клітки для відновлення самостійного кровообігу (пульсу). При цьому необхідно наголосити, що в разі відновлення гемодинамічно ефективного ритму додаткова компресія грудної клітки не призведе до повторного розвитку ФШ. І навпаки, у разі відновлення лише організованої біоелектричної активності серця, але гемодинамічно неефективної, припинення проведення компресії грудної клітки неминуче призведе до рефібриляції шлуночків.
Вищевикладені факти є обґрунтуванням негайного початку проведення компресії грудної клітки після розряду дефібриляції протягом 2 хвилин і лише наступної оцінки ритму за ЕКГ, а в разі відновлення синусового ритму — оцінки пульсації на сонній артерії.
Проміжок між проведенням розряду дефібриляції і продовженням компресії грудної клітки не повинен перевищувати 5 секунд [2].
Оцінка ритму/пульсу також не повинна перевищувати 5 секунд — у разі збереження на ЕКГ ФШ/ШТ без пульсу необхідно нанести повторний розряд дефібриляції з більш високою енергією і продовжити компресію грудної клітки протягом 2 хвилин. У разі відновлення синусового ритму за даними ЕКГ-моніторингу, але відсутності пульсу необхідно негайно продовжити компресію грудної клітки протягом 2 хв з наступною оцінкою ритму й пульсу:
розряд → СЛР протягом 2 хв → оцінка ритму/пульсу → розряд → СЛР протягом 2 хв.
Монофазна дефібриляція більше не використовується у зв’язку з тим, що дефібрилятори такого типу вже не випускаються, а сам принцип, реалізований у старих моделях дефібриляторів, є малоефективним і викликає виражене постдефібриляційне пошкодження міокарда.
Біфазна дефібриляція, що використовує меншу енергію розряду, значно ефективніша й меншою мірою викликає пошкодження й постреанімаційну дисфункцію міокарда порівняно з еквівалентною енергією монофазного імпульсу [7, 20].
Початковий рівень енергії для біфазних дефібриляторів повинен становити 150 Дж (або нижче, з урахуванням рекомендацій заводу — виробника конкретного біфазного дефібрилятора, залежно від реалізованої в ньому форми електричного імпульсу) з подальшою ескалацією енергії при повторних розрядах [2].
При проведенні електричної дефібриляції важливим є правильне розташування електродів (один праворуч по парастернальній лінії нижче від ключиці, інший — ліворуч по середньопахвовій лінії в проєкції верхівки серця). Для стандартних електродів (неадгезивних) у момент нанесення розряду необхідно забезпечити силу докладання на електроди в межах 8 кг з обов’язковим використанням спеціального електропровідного гелю для дефібриляції, а за його відсутності — прокладок, змочених будь-яким струмопровідним розчином. Неприпустиме використання «сухих» електродів, оскільки це значно знижує ефективність дефібриляції (зводячи її майже нуля) і викликає опіки шкірних покривів [20].
Рекомендується переважне використання адгезивних (самоклейних) електродів, а не стандартних, оскільки їх застосування є більш зручним, вивільняє руки й дозволяє мінімізувати паузи перед проведенням дефібриляції. У даний час всі сучасні моделі дефібриляторів поряд зі стандартними електродами комплектуються самоклейними електродами.
Якщо пацієнт має імплантований електрокардіостимулятор, то електроди дефібрилятора повинні розміщуватися на відстані як мінімум 8 см від нього. У цій ситуації також рекомендується використання передньо-заднього розташування електродів [2, 21].
Потенційно оборотні причини СЛР
Імовірність сприятливого результату СЛР при ЕАБП/асистолії (як і при рефрактерній ФШ/ШТ) можна підвищити, тільки якщо є потенційно оборотні причини зупинки кровообігу, що піддаються лікуванню. Вони подані у вигляді універсального алгоритму «чотири Г — чотири Т» (рис. 3).
Моніторинг під час проведення СЛР
У нових рекомендаціях велика увага приділяється моніторингу, що дозволяє оцінити якість і ефективність реанімаційних заходів, які проводяться за рахунок використання таких технологій:
1. Пристрої, що дозволяють оцінити якість проведеної СЛР за частотою і глибиною компресій грудної клітки, а вентиляції — за частотою та об’ємом. Дана технологія реалізована в низці сучасних дефібриляторів і є пристроєм, який розташовується на грудній клітці пацієнта, і на нього виконується компресія в процесі СЛР. При цьому на кардіомоніторі дефібрилятора відображаються параметри компресії і вентиляції, що проводиться, а також є можливість голосової підказки правильності проведення реанімаційних заходів. Саме цей пристрій дозволяє контролювати оптимальну глибину (не менше за 5 см і не більше ніж 6 см) і частоту компресії, не допускати гіпервентиляції.
2. Капнографія, що дозволяє верифікувати положення ендотрахеальної трубки, оцінити якість СЛР, що проводиться, будучи раннім індикатором відновлення самостійного гемодинамічно ефективного кровообігу.
3. Ультразвукове дослідження для виявлення в процесі СЛР потенційно оборотних причин зупинки кровообігу згідно з алгоритмом «чотири Г — чотири Т» (тампонада серця, тромбоемболія легеневої артерії (ТЕЛА), пневмоторакс), а також ідентифікації псевдоелектричної активності без пульсу [2].
Тривалість реанімаційних заходів
СЛР необхідно проводити так довго, як довго зберігається на ЕКГ фібриляція шлуночків, оскільки при цьому забезпечується мінімальний метаболізм у міокарді, що забезпечує потенційну можливість відновлення самостійного кровообігу.
У разі зупинки кровообігу за механізмом ЕАБП/асистолії за відсутності потенційно оборотної причини (алгоритм «чотири Г — чотири Т») СЛР проводять протягом 30 хвилин, при її неефективності — припиняють.
Раніше рекомендувалося проведення СЛР понад 30 хвилин лише у випадках загального переохолодження, втоплення в крижаній воді й передозування лікарських препаратів. Проте останніми роками з’явилося безліч повідомлень про успіх СЛР з добрими неврологічними наслідками в разі пролонгації реанімаційних заходів понад 30 хвилин, що дає авторам право порушувати питання про перегляд часових меж проведення СЛР, особливо за наявності механічних пристроїв для компресії грудної клітки або портативних апаратів штучного кровообігу (АШК).
У зв’язку з цим у рекомендації ERC’2021 було внесено зміни. Так, якщо причиною зупинки кровообігу є ТЕЛА і в процесі СЛР був проведений тромболізис, реанімаційні заходи необхідно проводити протягом 60–90 хвилин з моменту введення тромболітичних препаратів [2].
Екстракорпоральна підтримка життя
Дослідження дедалі більше розширюють можливості систем невідкладної перфузійної реанімації (EPR — Emergency Perfusion Resuscitation). Дані системи є портативними АШК, що забезпечують екстракорпоральну підтримку кровообігу в пацієнтів у стані клінічної смерті, у яких стандартний комплекс СЛР неефективний, але при цьому є потенційно оборотна причина, на яку можна впливати специфічними методами терапії. Потенційно оборотними причинами, для яких показане застосування EPR, є: гострий коронарний тромбоз — для проведення черезшкірного коронарного втручання (ЧКВ), масивна ТЕЛА — для проведення емболектомії, тяжке загальне переохолодження — для екстракорпорального зігрівання пацієнта. Необхідно підкреслити, що ці апарати можуть, крім екстракорпорального зігрівання, забезпечити індукцію лікувальної гіпотермії в постреанімаційному періоді [2].
Особливості АLS в умовах пандемії COVID-19
Головний акцент у рекомендаціях Європейської ради з реанімації робиться на тому, що ніколи не можна ставити під загрозу безпеку медичних працівників. Він базується на тому положенні, що час, необхідний для безпеки реаніматорів, які надають допомогу, є прийнятною частиною процесу СЛР [2].
Необхідно зазначити, що в момент виникнення пандемії в Китаї в місті Ухань при аналізі 136 пацієнтів з тяжкою формою COVID-19, у яких мала місце внутрішньолікарняна зупинка кровообігу, у 87,5 % її причиною були респіраторні порушення. За механізмом зупинки кровообігу у 89,7 % випадків була зареєстрована асистолія, у 4,4 % — ЕАБП і лише у 5,9 % випадків — ФШ/ШТ без пульсу. Отже, у більшості випадків зупинки кровообігу в пацієнтів з COVID-19 не було потреби в проведенні електричної дефібриляції. Це стало наслідком системного гіпоксичного впливу і/або прямого пошкодження серця коронавірусом. Причому з усіх зазначених випадків зупинки кровообігу в Ухані лише чотири пацієнти (2,9 %) мали виживання протягом 30 днів, і лише в одного з них було зареєстровано сприятливе неврологічне відновлення [22].
У даний час можливості інтенсивної терапії тяжкого COVID-19 ще вкрай обмежені й проведення СЛР у даної категорії пацієнтів у разі розвитку зупинки кровообігу малоперспективне у зв’язку з настанням необоротної поліорганної недостатності, у тому числі в пацієнтів з так званим постковідним синдромом, число яких зростає. Але, на наш погляд, правильніше говорити про фази розвитку коронавірусної хвороби, і це уявлення останнім часом почало термінологічно оформлюватись у міжнародній літературі як «довготривалий ефект коронавірусної хвороби» (long-COVID) [23].
Проведення СЛР у пацієнтів з COVID-19 у внутрішньолікарняних умовах має базуватись на таких принципах:
- раннє виявлення всіх пацієнтів із захворюванням, схожим на COVID-19, які схильні до ризику гострого погіршення стану або розвитку зупинки кровообігу;
- використання систем моніторингу, що дозволяють на ранньому етапі виявляти розвиток критичного стану з метою недопущення зупинки кровообігу й проведення «незахищеної» СЛР;
- після виклику реанімаційної бригади лікарні до пацієнта із зупинкою кровообігу в разі, якщо негайно доступний дефібрилятор, рекомендується його підключення і, за наявності ФШ/ШТ без пульсу, проведення розряду дефібриляції. При збереженні ФШ/ШТ без пульсу, якщо вже надіті ЗІЗ, необхідно розпочати проведення компресії грудної клітки. Якщо ЗІЗ ще не одягнені, допустимо проведення двох додаткових розрядів (що можливе лише при застосуванні професійного дефібрилятора), доки інші медичні працівники надягають ЗІЗ;
- постійна доступність ЗІЗ для медперсоналу при проведенні СЛР. Незважаючи на те, що надягання ЗІЗ може викликати короткочасну затримку початку СЛР, безпека медперсоналу повинна мати пріоритетне значення;
- при проведенні ШВЛ необхідно переконатися, що між мішком Амбу й лицьовою маскою (ларингомаскою, ендотрахеальною трубкою) знаходиться бактеріально-вірусний фільтр (з функцією тепло- і вологообміну або HEPA-фільтр) для фільтрації повітря, що видихається;
- діагностика зупинки кровообігу повинна ґрунтуватися на ознаці наявності/відсутності пульсу на сонній артерії, при цьому не допускається вислуховування дихання наближенням до обличчя пацієнта;
- якщо компресія грудної клітки ще не була розпочата, необхідно надіти пацієнтові кисневу маску й почати оксигенотерапію, яку слід продовжувати доти, доки не буде доставлений мішок Амбу;
- компресію грудної клітки й ШВЛ за допомогою мішка Амбу й лицьової маски з подачею кисню необхідно проводити у співвідношенні 30 : 2, роблячи паузу на компресію в момент проведення вентиляції з метою мінімізації ризику утворення аерозолю. З цією ж метою один реаніматор повинен двома руками щільно тримати маску, а другий реаніматор, що забезпечує компресію грудної клітки, після закінчення циклу повинен провести 2 вдихи мішком Амбу;
- спеціально підготовлений медичний персонал повинен на ранній стадії забезпечити відновлення прохідності дихальних шляхів (ларингеальна маска, інтубація трахеї), щоб мінімізувати тривалість ШВЛ за допомогою лицьової маски;
- відеоларингоскопія для інтубації трахеї має перевагу, що дозволяє забезпечити дистанціювання від дихальних шляхів пацієнта;
- за необхідності пролонгованої СЛР слід розглянути можливість використання механічних пристроїв для компресії грудної клітки [4, 5, 17].
Особливості проведення СЛР у пацієнтів, які перебувають у prone position
У разі зупинки кровообігу в неінтубованих пацієнтів, які перебувають у prone position, за умови, що медперсонал одягнений у ЗІЗ, необхідно негайно перевернути пацієнта на спину перед початком СЛР.
В інтубованих пацієнтів можна розпочати проведення компресії грудної клітки шляхом натискання на спину пацієнта (рис. 4а), що може забезпечити деяку перфузію життєво важливих органів доти, поки медперсонал готується повернути пацієнта на спину, — цей маневр має бути попередньо відпрацьований медичною командою.
Техніка проведення компресії грудної клітки в пацієнтів, які перебувають у prone position, полягає в проведенні компресій між лопатками зі стандартною глибиною компресії (не менше за 5 см, але не більше ніж 6 см) і частотою 2 компресії на 1 секунду.
У положенні на животі можливе також проведення електричної дефібриляції з використанням адгезивних самоклейних електродів. При цьому використовують такі варіанти розташування електродів дефібрилятора:
- передньо-заднє (рис. 4б);
- біаксилярне (обидві пахви) (рис. 4в) [24].
При наданні медичної допомоги пацієнтам з COVID-19 виникає ціла низка етичних проблем:
- обмеженість комунікації з родичами в разі смерті хворого;
- неприпустимо використовувати категоріальні або загальні критерії (наприклад, вікові пороги) для визначення правочинності пацієнта отримувати чи не отримувати певні медичні ресурси;
- ключовою проблемою СЛР під час пандемії COVID-19 є складність надійного балансу ризику для тих, хто надає допомогу, і потенційної користі для пацієнта;
- роблячи все можливе для окремого пацієнта, медичні працівники повинні однаковою мірою усвідомлювати свою відповідальність перед своїми родичами, колегами й ширшою спільнотою [4, 5, 17].
Інтенсивна терапія постреанімаційного синдрому
На сучасному етапі термін «постреанімаційна хвороба», запроваджений В.А. Неговським (1972), був замінений на термін «постреанімаційний синдром», який можна визначити як специфічний патологічний стан, що розвивається в організмі пацієнта внаслідок ішемії, викликаної тотальним порушенням кровообігу й реперфузії після успішної СЛР, і характеризується тяжкими розладами різних ланок гомеостазу на фоні порушеної функції ЦНС і розвитку поліорганної недостатності [25–27].
Прогностична оцінка стану в постреанімаційному періоді
Коматозний стан протягом 48 годин і більше є предиктором поганого неврологічного результату. Якщо через 72 години після зупинки кровообігу неврологічний дефіцит становить ≤ 5 балів за шкалою коми Глазго, відсутня рухова реакція у відповідь на больове подразнення або зіничний рефлекс, то ці ознаки є предиктором розвитку вегетативного стану, що персистує [3].
Принципи інтенсивної терапії постреанімаційного періоду
Інтенсивна терапія постреанімаційного періоду націлена на фактори, що спричинили зупинку кровообігу й реперфузійне ушкодження органів.
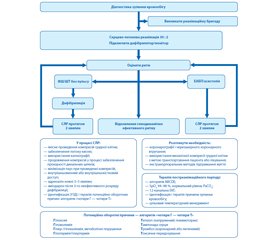
Оксигенація і вентиляція. Артеріальна гіпероксія має бути виключена, рівень FiO2 повинен забезпечувати SрO2 94–98 %, оскільки проведення ШВЛ зі 100% киснем у першу годину постреанімаційного періоду асоціюється з поганими неврологічними наслідками за рахунок створення додаткового оксидативного стресу для постішемічних нейронів.
Підтримка нормоксемії (РаО2 75–100 мм рт.ст.) і недопущення гіпоксемії (РаО2 < 60 мм рт.ст.); підтримання нормокапнії — рівня РаСО2 35–45 мм рт.ст. Необхідно підкреслити, що вазодилатація судин головного мозку, зумовлена гіповентиляцією, призводить до підвищення внутрішньочерепного тиску (ВЧТ), так само як і вазоконстрикція, спричинена гіпервентиляцією, збільшує церебральне ішемічне пошкодження [3].
Рання оптимізація гемодинаміки. Унаслідок зриву авторегуляції мозкового кровотоку в постреанімаційному періоді рівень церебрального перфузійного тиску (ЦПТ) стає залежним від рівня середнього артеріального тиску (САТ): ЦПТ = САТ — ВЧТ. Тому дуже важливим є підтримання нормотензії: систолічний АТ має бути понад 100 мм рт.ст., САТ — понад 65 мм рт.ст. Рекомендується використання інвазивного вимірювання АТ і підтримка цільових значень гемодинаміки за рахунок корекції інфузійною терапією можливої гіповолемії і використання вазопресорних та інотропних препаратів.
Фармакологічне забезпечення для досягнення цільових значень інтенсивної терапії:
- моніторинг рівня лактату, що є маркером адекватності перфузії органів, і підтримання його в межах норми;
- корекція гіпокаліємії, що обумовлює розвиток шлуночкової аритмії;
- діурез > 0,5 мл/кг/годину;
- використання седативних препаратів та опіоїдів короткої дії для можливості оцінки неврологічного статусу пацієнта;
- не рекомендується рутинне застосування міорелаксантів (крім забезпечення цільового температурного менеджменту);
- тромбопрофілактика й профілактика розвитку стресорних виразок шлунково-кишкового тракту;
- підтримка цільового рівня глікемії 7,8–10,0 ммоль/л. При перевищенні верхньої межі рівня глюкози — корекція інсуліном короткої дії, не допускаючи при цьому розвитку гіпоглікемії (< 4,0 ммоль/л);
- початок якомога більш раннього ентерального харчування;
- не рекомендується рутинне проведення антибіотикопрофілактики;
- не рекомендується рутинне використання глюкокортикоїдів [3].
Контроль судомної активності. Судомний синдром, особливо ранній епістатус, є предиктором несприятливого результату. З метою виявлення судомної активності й оцінки ефективності дії призначених протисудомних препаратів рекомендується використання електроенцефалографії (ЕЕГ).
Для усунення судомної активності рекомендується застосування леветирацетаму або натрію вальпроату як препаратів першої лінії на додаток до седативних препаратів. Рутинне введення протисудомних препаратів із профілактичною метою не рекомендується [3].
Цільовий температурний менеджмент. Лікувальна гіпотермія є найбільш перспективним методом нейропротекторного захисту головного мозку, і з позицій доказової медицини це єдиний метод, який забезпечує зниження летальності, що покращує неврологічне відновлення в пацієнтів, які перенесли зупинку кровообігу з розвитком постреанімаційного синдрому. Усім пацієнтам без свідомості в постреанімаційному періоді необхідно забезпечити підтримання температури тіла в діапазоні 32–36 °С.
У сучасних рекомендаціях робиться акцент на підтриманні перш за все нормотермії і недопущенні розвитку гіпертермії (> 37,7 °С) у перші 72 години постреанімаційного періоду, оскільки ризик несприятливого неврологічного результату підвищується з кожним градусом вище за температуру 37 °С [3].
Алгоритм інтенсивної терапії в постреанімаційному періоді поданий на рис. 5.
На закінчення необхідно наголосити, що вкрай важливе впровадження сучасного протоколу серцево-легеневої і церебральної реанімації в клінічну практику лікувальних закладів і навчання на його основі медичного персоналу, а також стандартизованого протоколу інтенсивної терапії постреанімаційного періоду відповідно до місцевих особливостей і можливостей.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості під час підготовки цієї статті.
Список литературы
Список літератури знаходиться в редакції

/11_m.jpg)
/12_m.jpg)
/13_m.jpg)
/14_m.jpg)