Журнал «Здоровье ребенка» Том 16, №8, 2021
Вернуться к номеру
Механізми дії внутрішньоядерних мікроРНК. Частина 1. Вплив мікроРНК на транскрипцію
Авторы: Абатуров О.Є., Бабич В.Л., Русакова О.О.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У науковому огляді наведені механізми дії внутрішньоядерних мікроРНК, а саме вплив внутришньоядерних мікроРНК на транскрипцію. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka. Автори наводять відмінності між ядерними і цитоплазматичними функціями мікроРНК. Підкреслено, що регуляція транскрипції мікроРНК здійснюється переважно за рахунок формування гетерохроматину, а контроль над трансляцією виконується за допомогою різноманітних механізмів. Результатом дії мікроРНК здебільшого є зниження експресії гена. Однак у деяких випадках мікроРНК можуть посилювати активність експресії генів. Внутрішньоядерні мікроРНК здатні індукувати передтрансляційний сайленсинг білоккодуючих генів, активувати транскрипцію, змінювати транскриптом нкРНК, брати участь у регуляції альтернативного сплайсингу. Показано, що мікроРНК-опосередкований транскрипційний сайленсинг індукований малими РНК в ядрі клітини, які сприяють метилюванню ДНК і спільно з протеїнами Argonaute беруть участь у модифікації хроматину. При мікроРНК-опосередкованому транскрипційному сайленсингу відбуваються рекрутинг ДНК-метилтрансфераз, формування РНК-індукованого транскрипційного сайленсингового комплексу, взаємодія мікроРНК із промоторасоційованими нкРНК і ДНК цільових генів, формування гетерохроматину. Авторами наведено, що формування гетерохроматину відбувається в кілька етапів: ініціація збірки, збірка і поширення гетерохроматину. Таким чином, мікроРНК можуть проявляти себе регуляторами різних процесів, та відмінності між функціями та ефектами дії мікроРНК залежать від їх розташування в ядрі чи в цитоплазмі клітини. МікроРНК в ядрі клітини здійснюють контроль над транскрипцією, у цитоплазмі — над трансляцією. Механізм дії внутрішньоядерних мікроРНК включає індукування передтрансляційного сайленсингу білоккодуючих генів, активування транскрипції, змінювання транскриптому нкРНК, участь у регуляції альтернативного сплайсингу.
The scientific review presents the mechanisms of action of intranuclear miRNAs, namely the influence of intranuclear miRNAs on transcription. To write the article, information was searched using Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka databases. The authors cite differences between nuclear and cytoplasmic functions of miRNAs. It is emphasized that the regulation of miRNA transcription is carried out mainly due to the formation of heterochromatin, and the control of translation is performed by various mechanisms. The result of microRNA action in most cases is a decrease in gene expression. However, in some cases, miRNAs can enhance gene expression activity. Intranuclear miRNAs are able to induce pretranslational silencing of protein-encoding genes, activate transcription, alter ncRNA transcriptome, and participate in the regulation of alternative splicing. It is shown that microRNA-mediated transcriptional silencing is induced by small RNAs in the cell nucleus, which promote DNA methylation and together with Argonaute proteins are involved in chromatin modification. In microRNA-mediated transcriptional silencing, DNA methyltransferases are recruited, RNA-induced transcriptional silencing complex is formed, microRNA interacts with promoter-associated nсRNAs and DNA of target genes, and heterochromatin is formed. The authors state that the formation of heterochromatin occurs in several stages: the initiation of assembly, assembly and distribution of heterochromatin. Thus, miRNAs can act as regulators of various processes and differences between the functions and effects of miRNAs depend on their location in the nucleus or cytoplasm of the cell. MicroRNAs in the cell nucleus control transcription, in the cytoplasm — translation. The mechanism of action of intranuclear miRNAs includes induction of pretranslational silencing of protein-encoding genes, activation of transcription, alteration of ncRNA transcriptomes, participation in the regulation of alternative splicing.
мікроРНК; мікроРНК-опосередкований транскрипційний сайленсинг; транскрипція; гетерохроматин; протеїни Argonaute (AGO); огляд
microRNA; miRNA; miR; microRNA-mediated transcriptional silencing; transcription; heterochromatin; Argonaute proteins; review
Вступ
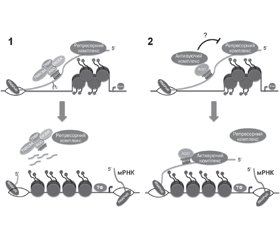
Вплив мікроРНК на транскрипцію
/59.jpg)
Висновки
- Allshire R.C., Madhani H.D. Ten principles of heterochromatin formation and function. Nat. Rev. Mol. Cell Biol. 2018 Apr. 19(4). 229-244. doi: 10.1038/nrm.2017.119.
- Bayne E.H., White S.A., Kagansky A. et al. Stc1: a critical link between RNAi and chromatin modification required for heterochromatin integrity. Cell. 2010, Mar 5. 140(5). 666-77. doi: 10.1016/j.cell.2010.01.038.
- Benetti R., Gonzalo S., Jaco I. et al. A mammalian microRNA cluster controls DNA methylation and telomere recombination via Rbl2-dependent regulation of DNA methyltransferases. Nat. Struct. Mol. Biol. 2008 Mar. 15(3). 268-79. doi: 10.1038/nsmb.1399.
- Catalanotto C., Cogoni C., Zardo G. MicroRNA in Control of Gene Expression: An Overview of Nuclear Functions. Int. J. Mol. Sci. 2016, Oct 13. 17(10). pii: E1712.
- Cheng X., Blumenthal R.M. Mammalian DNA methyltransferases: a structural perspective. Structure. 2008 Mar. 16(3). 341-50. doi: 10.1016/j.str.2008.01.004.
- Creamer K.M., Partridge J.F. RITS-connecting transcription, RNA interference, and heterochromatin assembly in fission yeast. Wiley Interdiscip. Rev. RNA. 2011 Sep-Oct. 2(5). 632-46. doi: 10.1002/wrna.80.
- Goto D.B., Nakayama J. RNA and epigenetic silencing: insight from fission yeast. Dev. Growth Differ. 2012 Jan. 54(1). 129-41. doi: 10.1111/j.1440-169X.2011.01310.x.
- Grewal S.I., Jia S. Heterochromatin revisited. Nat. Rev. Genet. 2007 Jan. 8(1). 35-46. Doi: 10.1038/nrg2008.
- Holoch D., Moazed D. Small-RNA loading licenses Argonaute for assembly into a transcriptional silencing complex. Nat. Struct. Mol. Biol. 2015 Apr. 22(4). 328-35. doi: 10.1038/nsmb.2979.
- Khan A.W. Nuclear functions of microRNAs relevant to the cardiovascular system. Translational Research. 2021. 230. 151-163. doi:10.1016/j.trsl.2020.11.004.
- Kim D.H., Saetrom P., Snøve O. Jr, Rossi J.J. MicroRNA-directed transcriptional gene silencing in mammalian cells. Proc. Natl Acad. Sci. USA. 2008, Oct 21. 105(42). 16230-5. doi: 10.1073/pnas.0808830105.
- King V.M., Borchert G.M. MicroRNA Expression: Protein Participants in MicroRNA Regulation. Methods Mol. Biol. 2017. 1617. 27-37. doi: 10.1007/978-1-4939-7046-9_2.
- Lejeune E., Bayne E.H., Allshire R.C. On the connection between RNAi and heterochromatin at centromeres. Cold Spring Harb. Symp. Quant Biol. 2010. 75. 275-83. doi: 10.1101/sqb.2010.75.024.
- Li F., Martienssen R., Cande W.Z. Coordination of DNA replication and histone modification by the Rik1-Dos2 complex. Nature. 2011, Jul 3. 475(7355). 244-8. doi: 10.1038/nature10161.
- Liu H., Lei C., He Q. et al. Nuclear functions of mammalian MicroRNAs in gene regulation, immunity and cancer. Mol. Cancer. 2018, Feb 22. 17(1). 64. doi: 10.1186/s12943-018-0765-5.
- Matsui M., Chu Y., Zhang H. et al. Promoter RNA links transcriptional regulation of inflammatory pathway genes. Nucleic Acids Res. 2013 Dec. 41(22). 10086-109. doi: 10.1093/nar/gkt777.
- Mazzoccoli L., Robaina M.C., Apa A.G. et al. MiR-29 silencing modulates the expression of target genes related to proliferation, apoptosis and methylation in Burkitt lymphoma cells. J. Cancer Res. Clin. Oncol. 2018 Mar. 144(3). 483-497. doi: 10.1007/s00432-017-2575-3.
- Mohr A.M., Mott J.L. Overview of microRNA biology. Semin. Liver Dis. 2015 Feb. 35(1). 3-11. doi: 10.1055/s-0034-1397344.
- Nakama M., Kawakami K., Kajitani T. et al. DNA-RNA hybrid formation mediates RNAi-directed heterochromatin formation. Genes. Cells. 2012 Mar. 17(3). 218-33. doi: 10.1111/j.1365-2443.2012.01583.x.
- Napoli S. Targeting Promoter-Associated RNAs by siRNAs. Methods Mol. Biol. 2017. 1543. 209-219. doi: 10.1007/978-1-4939-6716-2_11.
- Place R.F., Li L.C., Pookot D. et al. MicroRNA-373 induces expression of genes with complementary promoter sequences. Proc. Natl Acad. Sci. USA. 2008, Feb 5. 105(5). 1608-13. doi: 10.1073/pnas.0707594105.
- Portnoy V., Huang V., Place R.F., Li L.C. Small RNA and transcriptional upregulation. Wiley Interdiscip Rev. RNA. 2011 Sep-Oct. 2(5). 748-60. doi: 10.1002/wrna.90.
- Sadakierska-Chudy A. MicroRNAs: Diverse Mechanisms of Action and Their Potential Applications as Cancer Epi-Therapeutics. Biomolecules. 2020. 10(9). 1285. https://doi.org/10.3390/biom10091285.
- Schalch T., Job G., Shanker S. et al. The Chp1-Tas3 core is a multifunctional platform critical for gene silencing by RITS. Nat. Struct. Mol. Biol. 2011, Nov 13. 18(12). 1351-7. doi: 10.1038/nsmb.2151.
- Shanker S., Job G., George O.L. et al Continuous requirement for the Clr4 complex but not RNAi for centromeric heterochromatin assembly in fission yeast harboring a disrupted RITS complex. PLoS Genet. 2010, Oct 28. 6(10). e1001174. doi: 10.1371/journal.pgen.1001174.
- Toscano-Garibay J.D., Aquino-Jarquin G. Transcriptional regulation mechanism mediated by miRNA-DNA•DNA triplex structure stabilized by Argonaute. Biochim. Biophys. Acta. 2014 Nov. 1839(11). 1079-83. doi: 10.1016/j.bbagrm.2014.07.016.
- Verdel A., Jia S., Gerber S. et al. RNAi-mediated targeting of heterochromatin by the RITS complex. Science. 2004, Jan 30. 303(5658). 672-6. Doi: 10.1126/science.1093686.
- Younger S.T., Pertsemlidis A., Corey D.R. Predicting potential miRNA target sites within gene promoters. Bioorg. Med. Chem. Lett. 2009, Jul 15. 19(14):3791-4. doi: 10.1016/j.bmcl.2009.04.032.
- Yu C.Y., Kuo H.C. The emerging roles and functions of circular RNAs and their generation. J. Biomed. Sci. 2019. 26(1). 29. doi: 10.1186/s12929-019-0523-z.

/56.jpg)
/56_2.jpg)
/57.jpg)
/58.jpg)
/59_2.jpg)
/60.jpg)