Журнал «Медицина неотложных состояний» Том 17, №7, 2021
Вернуться к номеру
Застосування поглинача вільних кисневих радикалів едаравону у хворих на субарахноїдальний крововилив (аналітичний огляд)
Авторы: Галушко О.А., Заграничний Т.С.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
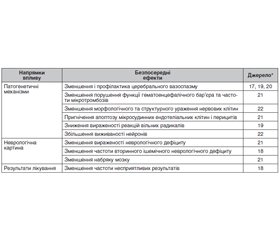
Актуальність. Поглинач вільних кисневих радикалів ксаврон (едаравон) сприяє зменшенню зони ішемічного ушкодження й істотному поліпшенню віддалених наслідків інсульту, а тому широко використовується в лікуванні ішемічного інсульту. Проте роль едаравону в лікуванні хворих на субарахноїдальний крововилив досі не з’ясована. Мета: дослідити можливість та ефективність застосування поглинача вільних кисневих радикалів ксаврону (едаравону) в комплексі терапії у хворих на субарахноїдальний крововилив. Матеріали та методи. Було проведено пошук досліджень та систематичних оглядів за ключовими словами: «гострий інсульт»; «субарахноїдальний крововилив», «геморагічна трансформація», «едаравон» у базі даних Google Scholar, опублікованих за період з 2003 по 2021 рік. Результати. Застосування едаравону у хворих на субарахноїдальний крововилив супроводжувалося активацією протизапальних і зниженням прозапальних пептидів, активацією антиапоптозних механізмів, зниженням перекисного окислення ліпідів і зменшенням окислювальної травми, зменшенням проникності гематоенцефалічного бар’єра та вираженості набряку головного мозку. Висновки. Основні ефекти едаравону (ксаврону) сприяли зменшенню неврологічного дефіциту, прискоренню швидкості відновлення неврологічних порушень та покращенню функціональних результатів лікування. Таким чином, введення едаравону у хворих на субарахноїдальний крововилив є вірогідно ефективним та безпечним.
Background. The free radical scavenger edaravon helps to reduce the area of ischemic injury and improve the long-term effects of stroke and is therefore widely used in the treatment of ischemic stroke. However, the role of edaravone in the treatment of patients with subarachnoid hemorrhage has not yet been clarified. The purpose was to investigate the feasibility and effectiveness of the use of the free radical scavenger xavron (edaravon) in the treatment of patients with subarachnoid hemorrhage. Materials and methods. A search was conducted for studies and systematic reviews for the keywords: “acute stroke”; “subarachnoid hemorrhage”, “hemorrhagic transformation”, “edaravon” in the Google Scholar database published between 2003 and 2021. Results. The use of edaravone in patients with subarachnoid hemorrhage was accompanied by the activation of anti-inflammatory and reduction of pro-inflammatory peptides, activation of anti-apoptotic mechanisms, reduction of lipid peroxidation, oxidative trauma, the permeability of the brain swelling. Conclusions. The main effects of edaravon (xavron) have been found to reduce neurological deficits, accelerate the recovery of neurological disorders, and improve functional outcomes. Thus, the introduction of edaravone in patients with subarachnoid hemorrhage has been proven to be reliably effective and safe.
гострий інсульт; субарахноїдальний крововилив; едаравон; огляд
acute stroke; subarachnoid hemorrhage; edaravon; review
Вступ
Матеріали та методи
Результати
Висновки
- Хобзей Н.К., Мищенко Т.С., Голик В.А., Ипатов А.В. Эпидемиология инсульта, клинические и экспертные аспекты в Украине. Судинні захворювання головного мозку. 2010. № 4. С. 2-6.
- Галушко О.А. Особливості виникнення та перебігу електролітних порушень в гострий період інсульту у хворих на цукровий діабет. Медицина неотложных состояний. 2017. № 1(80). С. 87-92.
- Fisher M. Neuroprotection of acute ischemic stroke. Where are we? Neuroscientist. 1999. № 5. 392-401.
- Сучасні принципи діагностики та лікування хворих із гострим ішемічним інсультом та ТІА (Адаптована клінічна настанова). К.: Видавець Д.В. Гуляєв, 2012. 144 с.
- Moretti A., Ferrari F., Villa R.F. Neuroprotection for ischae-mic stroke: current status and challenges. Pharmacol. Ther. 2015. Feb. 146. 23-34.
- Kern R., Nagayama M., Toyoda K., Steiner T., Hennerici M.G., Shinohara Y. Comparison of the European and Japanese guidelines for the management of ischemic stroke. Cerebrovasc. Dis. 2013. 35(5). 402-8.
- Watanabe K., Tanaka M., Yuki S., Hirai M., Yamamoto Y. Насколько эффективен эдаравон при лечении острого ишемического инсульта и бокового амиотрофического склероза? Міжнар. неврологіч. журнал. 2018. № 6(100). С. 46-58.
- В Україні анонсовано появу нового препарату Ксаврон (едаравон) для лікування гострого ішемічного інсульту і бічного аміотрофічного склерозу. Аптека. 2018. № 31(1152). С. 2.
- Edaravone Acute Infarction Study Group. Effect of a novel free radical scavenger, edaravone (MCI-186), on acute brain infarction. Randomized, placebo-controlled, double-blind study at multicenters. Cerebrovasc. Dis. 2003. 15(3). 222-9.
- Kaste M., Murayama S., Ford G.A., Dippel D.W., Walters M.R., Tatlisumak T. Safety, tolerability and pharmacokinetics of MCI-186 in patients with acute ischemic stroke: new formulation and dosing regimen. Cerebrovasc. Dis. 2013. 36. 196-204.
- Ohta Y., Takamatsu K., Fukushima T., Ikegami S., Takeda I., Ota T. et al. Efficacy of the free radical scavenger, edaravone, for motor palsy of acute lacunar infarction. Intern. Med. 2009. 48. 593-6.
- Feng S., Yang Q., Liu M., Li W., Yuan W., Zhang S., Wu B., Li J. Едаравон для лікування гострого ішемічного інсульту. Кохранівська база даних систематичних оглядів, 2011. Вип. 12. Стаття № CD007230. doi: 10.1002/14651858.CD007230.pub2.
- Kimura K., Aoki J., Sakamoto Y., Kobayashi K., Sakai K., Inoue T. et al. Administration of edaravone, a free radical scavenger, during t-PA infusion can enhance early recanalization in acute stroke patients a preliminary study. J. Neurol. Sci. 2012. 313. 132-6.
- Пилипенко М.М. Гострий інсульт: патофізіологія, клініко-діагностичні аспекти, інтенсивна терапія. Розділ 8.3 в кн.: Анестезіологія та інтенсивна терапія: підручник. Том 2. Окремі питання анестезіології та інтенсивної терапії за ред. професора І.П. Шлапака. К.: Фенікс, 2015. 500 с.
- Лоскутов О.А., Бондар М.В., Тодуров Б.М., Гуменюк М.І., Галушко О.А., Марков Ю.І., Кучинська І.А. Оцінка передопераційного статусу пацієнта і підготовка до хірургічного втручання. К., 2019. 228 с.
- Поліщук М.Є., Галушко О.А., Гуменюк М.І., Тріщинська М.А. Інфузійна терапія в неврології і нейрохірургії. К.: Книга-плюс, 2020. 304 с.
- Hasegawa S., Hasegawa Y., Miura M. Current Therapeutic Drugs Against Cerebral Vasospasm after Subarachnoid Hemorrhage: A Comprehensive Review of Basic and Clinical Studies. Curr. Drug Deliv. 2017 Sep 6. 14(6). 843-52. doi: 10.2174/1567201813666160808100937.
- Munakata A., Ohkuma H., Nakano T., Shimamura N., Asano K., Naraoka M. Effect of a free radical scavenger, edaravone, in the treatment of patients with aneurysmal subarachnoid hemorrhage. Neurosurgery. 2009 Mar. 64(3). 423-8; discussion 428-9. doi: 10.1227/01.NEU.0000338067.83059.EB.
- Munakata A., Ohkuma H., Shimamura N. Effect of a free radical scavenger, edaravone, on free radical reactions: related signal transduction and cerebral vasospasm in the rabbit subarachnoid hemorrhage model. Acta Neurochir. Suppl. 2011. 110(Pt. 2). 17-22. doi: 10.1007/978-3-7091-0356-2_4.
- Nakagomi T., Yamakawa K., Sasaki T., Saito I., Takakura K. Effect of edaravone on cerebral vasospasm following experimental subarachnoid hemorrhage. J. Stroke Cerebrovasc. Dis. 2003 Jan. 12(1). 17-21.
- Fumoto T., Naraoka M., Katagai T., Li Y., Shimamura N., Ohkuma H. The Role of Oxidative Stress in Microvascular Disturbances after Experimental Subarachnoid Hemorrhage. Transl. Stroke Res. 2019 Dec. 10(6). 684-694. doi: 10.1007/s12975-018-0685-0.
- Cai Z., Zhang H., Song H., Piao Y., Zhang X. Edaravone combined with cinepazide maleate on neurocyte autophagy and neurological function in rats with subarachnoid hemorrhage. Exp. Ther. Med. 2020 Jan. 19(1). 646-50. doi: 10.3892/etm.2019.8240.
- Mishina M., Komaba Y., Kobayashi S., Kominami S., Fukuchi T., Mizunari T., Teramoto A., Katayama Y. Administration of free radical scavenger edaravone associated with higher frequency of hemorrhagic transformation in patients with cardiogenic embolism. Neurol. Med. Chir. (Tokyo). 2008 Jul. 48(7). 292-7.
- Powers W.J., Rabinstein A.A., Ackerson T., Adeoye O.M., Bambakidis N.C., Becker K. et al. Guidelines for the Early Mana-gement of Patients With Acute Ischemic Stroke: 2019 Update to the 2018 Guidelines for the Early Management of Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2019 Dec. 50(12). e344-e418. doi: 10.1161/STR.0000000000000211.

/22.jpg)