Вступ
Зниження кісткової маси, що супроводжує старіння організму та різні патологічні процеси, є однією з найбільш значущих медико-соціальних проблем сучасної медицини, оскільки воно пов’язане зі зменшенням міцності кісткових структур [1, 2] і, відповідно, зі збільшенням частоти переломів [2, 3].
У широкій клінічній практиці втрату кісткової маси пов’язують з розвитком остеопорозу (ОП). Остеопороз — системне метаболічне захворювання скелета, що характеризується зменшенням кісткової маси, порушенням мікроархітектоніки кісткової тканини (КТ), що призводить до підвищення ламкості кісток і ризику переломів при мінімальній травмі [4]. Остеопоротичні переломи можуть виникати при падінні з висоти власного зросту, кашлі, чиханні і взагалі без будь-якого травматичного втручання.
Однак існує й інша причина зниження мінеральної щільності кісткової тканини (МЩКТ) — остеомаляція (ОМ), яка також супроводжується зменшенням міцності кісткових структур і зростанням ризику переломів у міру розвитку процесу [5–7]. При цьому, незважаючи на однаковий клінічний результат (переломи), морфоструктурні, етіологічні та патогенетичні характеристики ОП та ОМ різняться якісно [8–10].
Остеомаляція — накопичення на поверхні кістки потовщених шарів немінералізованого остеоїда, що призводить до зниження маси мінералізованої кістки. В результаті, хоча загалом при остеомаляції загальний обсяг КТ (мінералізованої та немінералізованої) в нормі, жорсткість і механічна компетентність зменшуються, а ризик перелому збільшується [5, 11]. Проте ОМ діагностується лише шляхом використання методів морфологічного контролю [7, 8, 12]. У дорослих людей цей процес часто перебігає безсимптомно [7, 8], так само як і ОП, що являє собою до виникнення перелому «безмовну хворобу».
Остеопороз та ОМ не є взаємовиключними процесами, і втрата кісткової маси в одних пацієнтів може бути викликана ОП, в інших — ОМ, а в третіх — одночасно ОП та ОМ [8].
Мета: вивчити морфологічні та морфометричні зміни кісткової тканини при остеопорозі та остеомаляції.
Матеріали та методи
Досліджували КТ 56 постменопаузальних жінок (середній вік — 62,30 ± 2,74 року) під час ендопротезування з приводу перелому шийки стегнової кістки. Із них 46 пацієнток, які працювали в несприятливих виробничих умовах, мали зниження МЩКТ: ОП — у 31 жінки, ОМ — у 15; 10 жінок були без метаболічних розладів КТ.
Фрагмент КТ забирали під час оперативного втручання. Готували недекальциновані зрізи КТ [13]. Досліджували гістоморфометричні параметри утворення кістки: об’єм остеоїда (%) некальцифікованої кістки, поверхня остеобластів — частина (%) загального периметра КТ, вкрита остеобластами, та резорбції кістки: поверхня кістки з ерозіями — частина (%) поверхні кістки, вкрита лакунами резорбції [13, 14].
Функціональну активність ядер клітин КТ визначали за допомогою методу диференціального забарвлення ядер із різною функціональною активністю [13]. У кожному випадку досліджували по 100 клітин КТ.
Постійно гістологічні препарати досліджували методом світлової мікроскопії із застосуванням світлового мікроскопа «CarlZeiss», морфометричні дослідження проводили із застосуванням ліцензійного програмного забезпечення «ВидеоТест-МастерМорфология» (ООО «ВидеоТест»).
Результати та обговорення
В результаті проведених досліджень виявлені відмінності морфометричних показників кісткоутворення та резорбції КТ у хворих на ОП та ОМ. При ОМ товщина остеоїда була в 2,2 раза (р < 0,05) більшою, ніж у пацієнтів з ОП, і в 1,8 раза (р < 0,05), ніж у пацієнтів без метаболічних розладів в КТ. Статистично вірогідних відмінностей товщини остеоїда у пацієнтів з ОП і у пацієнтів без метаболічних розладів в КТ не виявлено. Аналогічні зміни спостерігали відносно поверхні остеоїда, тобто частини загального периметра губчастої КТ, вкритої остеоїдом. Вона була статистично більшою (р < 0,05) у пацієнтів з ОМ. В свою чергу, поверхня остеобластів, тобто частина загального периметра губчастої КТ, вкритої активними остеобластами, суттєво не відрізнялася в усіх групах дослідження.
Привертає увагу те, що при ОП більша поверхня КТ вкрита лакунами резорбції, про що свідчила більша на 30,7 % (р < 0,05) площа ерозованої поверхні порівняно з пацієнтами з ОМ. У пацієнтів з ОМ та у хворих без метаболічних змін в КТ не спостерігали статистично вірогідних відмінностей в резорбції КТ (табл. 1).
Виявлені також відмінності функціональної активності клітин КТ: у пацієнтів без метаболічних порушень КТ переважали клітини з високою та проміжною функціональною активністю ядер. У пацієнтів з ОМ показники функціональної активності КТ були на рівні пацієнтів без метаболічних порушень у КТ. У пацієнтів з ОП зменшувалась кількість клітин з високою та проміжною функціональною активністю ядер на 18,8 % (р < 0,05) та 10,0 % (р < 0,05) відповідно порівняно з пацієнтами з ОМ, при цьому збільшувалась кількість клітин з низькою функціональною активністю ядер в 2,1 раза (р < 0,05) (табл. 2).
/16.jpg)
В результаті проведених морфологічних досліджень у пацієнтів без метаболічних розладів виявлено, що губчаста кістка представлена широкими анастомозуючими кістковими балками, які містять нечисленні вузькі судинні канали (рис. 1). У губчастій КТ чітко видно розташовані в лакунах зрілі кісткові клітини — остеоцити овальної або витягнутої форми, виявлені функціонально активні остеобласти (рис. 2). В окремих ділянках КТ помітні відростки остеоцитів. У кістковому матриксі чітко простежуються базофільні лінії склеювання, що розділяють кісткові пластинки. Кортикальний шар представлений компактною кісткою з рівномірно розташованими остеоцитами, рівномірно оксифільним матриксом.
Губчаста кістка у пацієнтів з ОП суттєво відрізнялася від такої у хворих без метаболічних порушень. У постійних гістологічних препаратах кісток хворих на ОП спостерігали витончення і зменшення кількості кісткових балок. В окремих ділянках руйнувалось з’єднання кісткових балок між собою, балки мали вигляд округло-овальних структур (рис. 3). Кількість остеоцитів зменшувалася, місцями вони розташовувалися нерівномірно по площі КТ. Спостерігалися осередки КТ з безклітинними лакунами та взагалі безклітинні ділянки (рис. 4, 5). Канали остеонів були розширені. Матрикс мав слабо оксифільне забарвлення, інтенсивність забарвлення була меншою порівняно з пацієнтами без метаболічних порушень. Базофільні лінії склеювання, на відміну від пацієнтів без метаболічних порушень, погано диференціювалися.
Щодо кортикального шару, то спостерігали ділянки витончення кортикального шару, в деяких випадках з ознаками декомпактизації. Матрикс мав меншу інтенсивність оксифілії, зменшувалась кількість остеоцитів, спостерігались лакуни без остеоцитів, меншою, ніж у пацієнтів без метаболічних порушень, була функціональна активність фібробластів і їх кількість.
На постійних гістологічних препаратах кісток хворих на ОП спостерігали лакуни резорбції КТ (рис. 3).
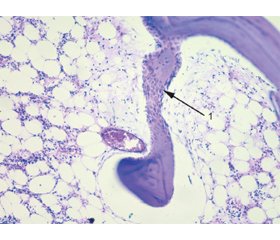
У пацієнтів з ОМ спостерігали схожі зміни в КТ хворих з ОП (рис. 6). У постійних гістологічних препаратах кісток хворих з ОМ спостерігали витончення і зменшення кількості кісткових балок, розширення каналів остеонів, ділянки витончення кортикального шару. Разом з тим порівняно більшою була оксифілія матриксу, а також меншою поверхня КТ, вкрита лакунами резорбції, ніж у пацієнтів з ОП, спостерігали поодинокі остеокласти (рис. 7).
Основною відмінністю КТ при ОМ порівняно з такою при ОП було збільшення товщини остеоїда (рис. 8, 9), спостерігали нашарування значних мас остеоїда на окремих кісткових балках. Функціональна активність і кількість остеобластів були співставні з показниками хворих без метаболічних порушень (рис. 10).
/18.jpg)
Таким чином, у результаті проведених досліджень встановлено, що ступінь дисбалансу між синтезом матриксу і його мінералізацією визначається особливостями розвитку ОП і ОМ. При ОМ збільшується товщина остеоїда та поверхня КТ, покрита остеоїдом. Функціональна активність остеобластів і навіть резорбція КТ вірогідно не змінюються. Отже, зниження якісних характеристик (міцність) КТ відбувається за рахунок метаболічних порушень. При ОП товщина остеоїда зменшується, а площа поверхні, покрита остеоїдом, вірогідно не змінюється. Функціональна активність остеобластів знижена, резорбція прискорена. У результаті міцність КТ знижується і за допомогою метаболічних змін, і через порушення балансу на клітинному рівні при перебудові КТ.
Зниження МЩКТ і виникнення низькоенергетичних переломів може бути результатом не тільки ОП, але й ОМ. При призначенні лікування необхідно провести диференційно-діагностичні заходи, що визначають причину зниження кісткової маси. Біопсія, необхідна для діагностики ОМ, є інвазивною маніпуляцією, потрібна розробка чітких критеріїв, що визначають її виконання у пацієнтів зі зниженням кісткової маси.
Висновки
Морфологічні зміни при ОП і ОМ мають спільні ознаки і відмінності. Спільним є витончення кісткових балок, розширення каналів остеонів, наявність безклітинних ділянок і безклітинних лакун. На відміну від ОП, при ОМ збільшується товщина і площа остеоїда, менш виражене зменшення оксифілії матриксу, спостерігається більш висока функціональна активність клітин КТ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 11.10.2021
Рецензовано/Revised 25.10.2021
Прийнято до друку/Accepted 29.10.2021
Список литературы
1. Davison K.S., Kendler D.L., Ammann P., Bauer D.C., Dempster D.W., Dian L., Hanley D.A., Harris S.T., McClung M.R., Olszynski W.P., Yuen C.K. Assessing fracture risk and effects of osteoporosis drugs: bone mineral density and beyond. American J. Medicine. 2009. 122(11). 992-997.
2. Поворознюк В.В., Григор’єва Н.В., Корж М.О. та ін. Епідеміологія переломів проксимального відділу стегнової кістки в Україні: результати двох ретроспективних досліджень. Ортопедия, травматология и протезирование. 2016. 4. 68-74. DOI: 10.15674/0030-59872016468-74.
3. Hooven F.H., Adachi J.D., Adami S., Boonen S., Compston J., Cooper С., Delmas P., Diez-Perez A., Gеhlbach S., Greenspan S.L., LaCroix A., Lindsay R., Netelenbos J.С., Pfeilschifter J., Roux C., Saag K.G., Sambrook P., Silverman S., Siris E., Watts N.B., Anderson F.A. The Global Longitudinal Study of Osteoporosis in Women (GLOW): rationale and study design. Osteoporos. Int. 2009. 20(7). 1107-1116.
4. Kanis J., McCloskey E., Johansson H., Cooper C., Rizzoli R., Reginster J. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporosis International. 2013. 24(1). 23-57. doi: 10.1007/s00198-012-2074-y.
5. Anumula S., Magland J., Wehrlib S.L., Ong H., Song H.K., Wehrli F.W. Multi-modality study of the compositional and mechanical implications of hypomineralization in a rabbit model of osteomalacia. Bone. 2008. 2. 405-413.
6. Ascenzi M.-G., Hetzer N., Lomovtsev A., Rude R., Nattiv A., Favia A. Variation of trabecular architecture in proximal femur of postmenopausal women. J. Biomechanics. 2011. 44(2). 248-256.
7. Arya V., Jain V. Osteomalacia — what the rheumatologist needs to know. Indian J. Rheumatology. 2007. 2(1). 17-22.
8. Аврунин А.С. Остеопороз и остеомаляция — клинико-диагностические проблемы. Травматология России. 2014. 4. 67-76.
9. Boivin G., Bala Y., Doublier A., Farlay D., Ste-Marie L.G., Meunier P.J., Delmas P.D. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 2008. 3. 532-538.
10. Demay M.B., Krane S.M. Disorders of calcification: osteomalacia and rickets. In: Endocrinology: adult and pediatric. Saunders. 2010. 70. 1311-1329.
11. Nazarian A., Arroyo F.J.A., Rosso C., Aran S., Snyder B.D. Tensile properties of rat femoral bone as functions of bone volume fraction, apparent density and volumetric bone mineral density. J. Biomech. 2011. 44(13). 2482-2488.
12. Whyte M.P., Thakker R.V. Rickets and osteomalacia. Medicine. 2009. 37(9). 483-488.
13. Пикалюк В.С., Кутя С.А., Шадуро Д.В. Модификация методики гистологического исследования костной ткани. Морфологія. 2010. 3. 72-76. Режим доступу до журналу: http://www.morphology.dp.ua/_pub/MORPHO-2010-04-03/10pvsikt.pdf
14. Parfitt A.M., Drezner M.K., Glorieux F.H. et al. Bone histomorphometry: standartisation of nomenclature, symbols and units. J. Bone Min. Res. 1987. 6. 595-610.

/16.jpg)
/17.jpg)
/18.jpg)