Резюме
У статті наведено результати експериментального дослідження з вивчення двох способів обробки крові з метою отримання збагаченої тромбоцитами плазми. У зв’язку з широким клінічним використанням збагаченої тромбоцитами плазми в ортопедії і травматології набув актуальності диференційний підхід до використання PRP та L-PRP. Комерційні набори для отримання збагаченої тромбоцитами плазми здебільшого суттєво здорожують процес лікування. До того ж основна увага зосереджена на концентрації тромбоцитів у кінцевому продукті та маркетингових особливостях того чи іншого набору (роздільний гель, форма пробірки, антикоагулянт, активатор і т.д.). Нівелюється роль лейкоцитів в особливостях регенеративного ефекту збагаченої тромбоцитами плазми. Під час роботи кров добровольців оброблялась двома різними способами і вивчався клітинний склад отриманих продуктів. Зразок 1 був для контролю базового клітинного складу крові. Зразок 2 центрифугувався в стерильній пластиковій пробірці, збагачена тромбоцитами плазма забиралась ручним способом. Зразок 3 центрифугувався в стерильному модифікованому ін’єкційному шприці, збагачена тромбоцитами плазма збиралась закрито за рахунок конекторів разом із багатим шаром. За результатами статистичного аналізу, отримані принципові різні біологічні продукти з різною концентрацією тромбоцитів та лейкоцитів. Перший зразок (конт-рольний): концентрація тромбоцитів — (228,69 ± 39,15) × 109/л та лейкоцитів — (5,18 ± 1,32) × 109/л. Другий зразок (пробірка + ручний забір): концентрація тромбоцитів — (429,38 ± 79,92) × 109/л та лейкоцитів — (0,85 ± 0,34) × 109/л. Третій зразок (поршень шприца + закритий вакуумний забір): концентрація тромбоцитів — (541,15 ± 85,49) × 109/л та лейкоцитів — (6,56 ± 1,92) × 109/л. Дані наведені без урахування –12,5% відхилення на розведення цитратом декстрози. Завдяки проведеній роботі лікар ортопед-травматолог має можливість використовувати у своїй практиці максимально прості некомерційні способи отримання PRP та L-PRP залежно від нозології та поставлених клінічних задач.
The paper presents the results of experimental study of two methods for blood processing to obtain platelet-rich plasma (PRP). Due to the widespread clinical use of platelet-rich plasma in orthopedics and traumatology, a differential approach to the use of PRP and leukocyte- and platelet-rich plasma (L-PRP) has become relevant. Most commercial kits for PRP preparation significantly increase the cost of treatment. In addition, the main attention is focused on the concentration of platelets in the final product and the marketing features of a particular kit (separating gel, tube shape, anticoagulant, activator, etc.). The role of leukocytes in the features of the regenerative effect of platelet-rich plasma stays out of focus. The blood of volunteers was processed in two different ways and the cellular composition of the obtained products was analyzed. Sample No. 1 was used as a control for the baseline blood cell composition. Sample No. 2 was centrifuged in a sterile plastic tube, platelet rich plasma was collected manually. Sample No. 3 was centrifuged in a sterile modified syringe, platelet rich plasma was collected using a closed technique by means of connectors together with a rich layer. The results of statistical analysis showed that there were obtained totally different biological products with different concentrations of platelets and leukocytes. The first sample (control) had platelet concentration of (228.69 ± 39.15) × 109/l and leukocyte concentration of (5.18 ± 1.32) × 109/l. In the second sample (tube + manual sampling), platelet concentration was (429.38 ± 79.92) × 109/l and leukocyte concentration — (0.85 ± 0.34) × 109/l. The third sample (syringe plunger + closed vacuum collection) had platelet concentration of (541.15 ± 85.49) × 109/l and leukocytes of (6.56 ± 1.92) × 109/l. The data are given without regard to –12.5% deviation on dilution with citrate dextrose. As the result of the work, orthopedic traumatologists can use the simplest non-commercial methods for obtaining PRP and L-PRP in their practice depending on nosology and clinical tasks.
Вступ
Збагачена тромбоцитами плазма (рatelet rich plasma — PRP) — автологічний продукт, отриманий із крові пацієнта шляхом центрифугування, мембранної сепарації чи буферного розподілу, головною ознакою якого є концентрація тромбоцитів вище від фізіологічної. Тромбоцити являють собою цитоплазматичні тіла без ядер неправильної форми, що утворюються від фрагментації мегакаріоцитів. Вони циркулюють у крові і відіграють ключову роль у гемостазі та загоєнні ран шляхом утворення фібринових згустків [1]. Тромбоцити функціонують як природний резервуар для факторів росту, включаючи тромоцитарний фактор росту (PDGF), епідермальний фактор росту (EGF), трансформуючий фактор росту β1 (TGF-β1), судинний ендотеліальний фактор росту (VEGF), фактор росту фібробластів (FGF), фактор росту гепатоцитів (HGF), інсуліноподібний фактор росту I (IGF-I) та інші [2]. Такі фактори росту вивільняються з альфа-гранул активованих тромбоцитів і беруть участь у важливих клітинних процесах, включаючи мітогенез, хемотаксис, диференціювання та метаболізм. Отже, обґрунтування збільшення концентрації тромбоцитів у скомпроментованій (або пошкодженій) тканині полягає в переконанні, що додаткові тромбоцити призведуть до експоненціального вивільнення множинних біоактивних факторів, а згодом посилять природний процес загоєння.
Багато клінічних досліджень продемонстрували ефективність PRP-терапії в стоматології, комбустіології, щелепно-лицевій, пластичній та ортопедичній хірургії. Фактично автологічні продукти крові вперше були популяризовані в 1990-х роках у щелепно-лицевій та пластичній хірургії [3, 4]. Незважаючи на все більшу кількість доказів PRP як засобу природного зцілення, його клінічна ефективність у лікуванні спортивних травм все ще залишається предметом дискусій.
Основним обмеженням для оцінки клінічних ефектів від PRP є відсутність уніфікованих протоколів отримання та використання збагаченої тромбоцитами плазми (ЗТП). Доступно багато різних комерційних систем, які використовують різні центрифуги та протоколи центрифугування. Концентрації тромбоцитів та лейкоцитів, а відповідно, і факторів росту можуть змінюватися залежно від використовуваної системи [5].
Одним із найважливіших компонентів, що впливає на препарати PRP, є наявність або відсутність лейкоцитів (нейтрофілів, моноцитів, макрофагів та лімфоцитів). Збагачена тромбоцитами плазма, в якій, крім тромбоцитів вище базового рівня, наявні в значній концентрації ще лейкоцити, називається L-PRP. Їх підвищена концентрація може бути корисною, оскільки вони стимулюють імунну відповідь проти інфекцій [6], сприяють хемотаксису, проліферації та диференціації клітин, індукують продукцію позаклітинного матриксу та ангіогенез [7]. Завдяки даним властивостям лейкоцити, що містить L-PRP, часто використовуються для лікування травматичних ушкоджень. Однак лейкоцити також вивільняють запальні цитокіни, наприклад інтерлейкін-1-бета (IL-1β) та фактор некрозу пухлини альфа (TNF-α)), та активні форми кисню, що може згубно впливати на тканини [8].
L-PRP викликає переважно катаболічні та запальні зміни в клітинах: збільшення експресії генів катаболічних маркерів, матричної металопротеїнази 1 (ММР-1), ММР-13, ІЛ-1β, ІЛ-6 та TNF-α та їх відповідної експресії білка та утворення простагландину Е2 (PGE2). На противагу цьому PRP в основному викликає анаболічні зміни: збільшує експресію анаболічних генів, альфа-гладком’язових актинів (α-SMA), колагенів типу I та III. Це вказує на те, що, хоча L-PRP і PRP видаються «безпечними», їх використання може бути шкідливим для загоєння, оскільки викликає катаболічний та запальний вплив на клітини і може подовжити ефект загоєння. З іншого боку, коли PRP використовується для лікування гостро пошкоджених тканин, це може призвести до утворення надмірної рубцевої тканини через сильний потенціал PRP викликати клітинні анаболічні ефекти [9].
/12.jpg)
Все вищесказане спонукає до диференційного підходу при використанні збагаченої тромбоцитами плазми залежно від концентрації лейкоцитів у ній. На сьогодні брендові системи виготовлення та використання збагаченої тромбоцитами плазми, з одного боку, забезпечують бурхливе проведення наукових досліджень та популяризацію регенеративної медицини, а з іншого — призводять до значного збільшення вартості лікування за рахунок витрат на бізнес-процес. Якщо знехтувати маркетинговими особливостями брендових китів для виготовлення збагаченої тромбоцитами плазми, то для практикуючого лікаря більш важливими є клітинний склад ЗТП, безпечність і простота отримання біологічного продукту, з чого і випливає мета нашої роботи.
Мета: розробити та проаналізувати максимально спрощені некомерційні способи отримання PRP та L-PRP.
Матеріали та методи
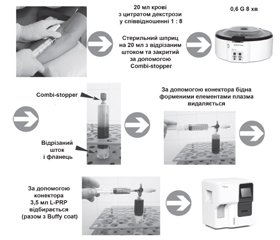
У період із серпня 2020 року по січень 2021 року у 27 здорових добровольців проводився забір трьох зразків крові з кубітальної вени (5, 20 та 20 мл), які в подальшому оброблялись, а отримані біологічні продукти вивчались. Гендерний розподіл такий: чоловіки становили 55,5 %, жінки — 44,5 %. Середній вік добровольців — 34 роки. З метою запобігання згортанню крові та продуктів крові використовували антикоагулянт цитрат декстрози (ACD-A, MacoPharma, Франція) у співвідношенні 1 : 8. Гемоконсервант застосовували з метою запобігання згортанню зразків до моменту їх дослідження на гематологічному аналізаторі, адже від забору крові до аналізу минало близько 30 хв. Немає необхідності використовувати в клінічній роботі антикоагулянти чи гемоконсерванти, адже час від забору крові до початку центрифугування і в подальшому — до введення в таргетну ділянку надто малий для тромбоутворення. У зв’язку з використанням зазначеної кількості цитрату декстрози варто зазначити, що клітинний склад дослідних зразків буде менший порівняно з клінічним біологічним матеріалом на 12,5 % за рахунок розведення.
Перший зразок крові (5 мл) не оброблявся і був контрольним для визначення показників цільної крові. В обох дослідних зразках обробку крові проводили на 0,6 G 8 хв центрифугою Elmi CM-6M (Латвія). Принципова різниця було в тому, що другий зразок центрифугували в стерильній пластиковій пробірці і забір плазми був ручним, третій зразок центрифугували в стерильному закритому поршні шприца і забір плазми проводили закрито за допомогою системи конекторів із захватом лейкоцитарного шару.
Таким чином, отримані від кожного добровольця 1 зразок крові та 2 плазми, багаті тромбоцитами, вивчали за допомогою автоматичного гематологічного аналізатора XP 300 Sysmex Corporation. Каскад отриманих даних проаналізовано за допомогою SPSS Statistics.
Результати
Були отримані такі середні показники. Перший зразок (контрольний): концентрація тромбоцитів — (228,69 ± 39,15) × 109/л та лейкоцитів — (5,18 ± 1,32) × 109/л. Другий зразок (пробірка + ручний забір): концентрація тромбоцитів — (429,38 ± 79,92) × 109/л та лейкоцитів — (0,85 ± 0,34) × 109/л. Третій зразок (поршень шприца + закритий вакуумний забір): концентрація тромбоцитів — (541,15 ± 85,49) × 109/л та лейкоцитів — (6,56 ± 1,92) × 109/л. Дані наведені без урахування –12,5% відхилення на розведення цитратом декстрози.
Висновки
Таким чином, розроблені некомерційні прості два способи обробки крові для отримання PRP чи L-PRP. Були досліджені концентрації тромбоцитів та лейкоцитів, що можна використати в клінічній практиці залежно від поставлених задач. Важливе вивчення диференційного підходу до використання PRP чи L-PRP.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 20.09.2021
Рецензовано/Revised 01.10.2021
Прийнято до друку/Accepted 10.10.2021
Список литературы
1. Midwood K.S., Williams L.V., Schwarzbauer J.E. Tissue repair and the dynamics of the extracellular matrix. Int. J. Biochem. Cell. Biol. 2004. 36. 1031-1037.
2. Zhang J., Wang J.H. Platelet-rich plasma releasate promotes differentiation of tendon stem cells into active tenocytes. Am. J. Sports Med. 2010. 38. 2477-2486.
3. Anitua E. Plasma rich in growth factors: preliminary results of use in the preparation of future sites for implants. Int. J. Oral. Maxillofac. Implants. 1999. 14. 529-535.
4. Whitman D.H., Berry R.L., Green D.M. Platelet gel: an autologous alternative to fibrin glue with applications in oral and maxillofacial surgery. J. Oral. Maxillofac. Surg. 1997. 55. 1294-1299.
5. Castillo T.N., Pouliot M.A., Kim H.J., Dragoo J.L. Comparison of growth factor and platelet concentration from commercial plateletrich plasma separation systems. Am. J. Sports Med. 2011. 39. 266-271.
6. Moojen D.J., Everts P.A., Schure R.M., Overdevest E.P., van Zundert A., Knape J.T. et al. Antimicrobial activity of platelet-leukocyte gel against Staphylococcus aureus. J. Orthop. Res. 2008. 26. 404-410. doi: 10.1002/jor.20519.
7. Wrotniak M., Bielecki T., Gazdzik T.S. Current opinion about using the platelet-rich gel in orthopaedics and trauma surgery. Ortop. Traumatol. Rehabil. 2007. 9. 227-238.
8. McCarrel T.M., Minas T., Fortier L.A. Optimization of leukocyte concentration in platelet-rich plasma for the treatment of tendinopathy. J. Bone Joint. Surg. Am. 2012. 94. e143. doi: 10.2106/JBJS.L.00019.
9. Yiqin Zhou, Jianying Zhang, Haishan Wu, MaCalus V. Hogan, James H.-C. Wang The differential effects of leukocyte-containing and pure platelet-rich plasma (PRP) on tendon stem/progenitor cells - implications of PRP application for the clinical treatment of tendon injuries. Stem Cell Res. Ther. 2015. 6(1). 173. Published online 2015, Sep 15.

/12.jpg)
/13.jpg)