Газета «Новости медицины и фармации» №11 (765), 2021
Вернуться к номеру
Синдром поліорганної недостатності в пацієнтів із тяжким перебігом коронавірусної хвороби (COVID-19)
Авторы: Кучинська І.А. (1, 2), Савченко Б.О. (2, 3), Андрюхов А.Г. (2), Іванченко А.М. (2), Асташкіна Н.В. (2), Гулеватий Є.О. (2), Кащій У.Л. (2)
(1) — Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(2) — Універсальна клініка «Оберіг», м. Київ, Україна
(3) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Спалах гострого респіраторного синдрому, спровокованого коронавірусом (SARS-CoV-2) у грудні 2019 року в місті Ухань (Китай), призвів до світової пандемії (COVID-19). Хоча симптоми коронавірусної інфекції здебільшого мають характер легкого респіраторно-вірусного захворювання й обмежуються такими проявами, як збільшення температури, втрата нюху та смаку, головний біль, інколи кишкові розлади, відомо, що тяжкий перебіг COVID-19 доволі часто супроводжується розвитком синдрому системної запальної відповіді (SIRS — systemic inflammatory response syndrome), синдрому поліорганної дисфункції (MODS — multiplе organ dysfunction syndrome) і синдрому поліорганної недостатності (MOF — multiple organ failure, основний), особливо на пізніх строках тяжкого перебігу хвороби (Liu та співавт., 2020) [1]. Зрозумілим стає той факт, що залучення в процес перебігу захворювання інших органів і систем подовжує тривалість перебування пацієнтів у лікувальному закладі і збільшує летальність. У наведеній статті ми мали на меті дослідити частоту та вираженість органної дисфункції в пацієнтів із тяжким перебігом COVID-19, а також визначити потенційні механізми поліорганної недостатності, спровокованої SARS-CoV-2.
Відомо, що проявами поліорганної дисфункції можуть бути гостра легенева недостатність у поєднанні з однією з таких патологій: гострим пошкодженням печінки, гострим пошкодженням нирок (ГПН), серцево-судинними захворюваннями, а також широким спектром гематологічних відхилень (коагулопатій) та неврологічних розладів. Найважливішим тригером розвитку тяжкого перебігу COVID-19 є прямий і непрямий вплив SARS-CoV-2 на організм людини, й однією з теорій є вплив саме через рецептори ангіотензинконвертуючого ферменту 2 (АГР-2), що наявні в легенях, серці, нирках, яєчках, печінці, лімфоцитах, клітинах нервової системи тощо. Проте на сьогодні дані про виявлення РНК у клітинах зазначених органів надзвичайно контроверсійні. Більше того, порушення роботи органів може бути спричинене дисбалансом цитокінів («цитокіновий шторм»), результатом підвищеного рівня медіаторів запалення, дисфункцією ендотелію, порушенням згортання крові й інфільтрацією запальних клітин в органи [2].
Патогенез SIRS/MODS/MOF
В одному з досліджень (Baud та спів–авт., 2020) тяжкий перебіг COVID-19 спостерігався в 15,7 % пацієнтів серед госпіталізованих, 5 % із цих пацієнтів були переведені у відділення інтенсивної терапії, 2,3 % були заінтубовані, а летальність становила 1,4 % [2]. За даними Lei та співавт. (2020), у пацієнтів із легким перебігом спостерігалися гіпертермія, сухий кашель, міалгія, слабкість, а погіршення перебігу коронавірусної інфекції відмічалося в пацієнтів старшого віку зі супутніми серцево-судинними захворюваннями, патологією нирок, цукровим діабетом (ЦД), високим артеріальним тиском, ожирінням і хронічними респіраторними захворюваннями [3, 4]. Через тиждень після початку захворювання COVID-19 може прогресувати в тяжкий перебіг із гіпоксемією та задишкою та швидко перерости в гострий респіраторний дистрес-синдром (ГРДС) [5].
За період із листопада 2020 по січень 2021 року обстежені та проліковані 394 пацієнти з коронавірусною хворобою, середній вік хворих жіночої статі — 70,1 року (52–91), чоловічої статі — 53,5 року (52–71). Основні дані стосовно розвитку в пацієнтів супутньої органної дисфункції наведені в табл. 1.
COVID-19 і легеневі прояви — основні патофізіологічні аспекти
Пневмонія є найбільш частим та серйозним симптомом COVID-19, виникнення якої супроводжується сухим кашлем, підвищенням температури тіла, вкороченням вдиху, болем у грудній клітці, задишкою, слабкістю і білатеральними дифузними інтерстиціальними інфільтратами, що діагностуються під час виконання комп’ютерної томографії (КТ). Проте такі зміни не завжди є специфічними саме для COVID-19 порівняно з іншими респіраторно-вірусними захворюваннями (Mukherjee та співавт., 2020; Yi та співавт., 2020) [6, 7]. Після маніфестації захворювання, за даними різних авторів, ГРДС розвивається в 17–65 % випадків, погіршує перебіг захворювання і часто призводить до розвитку синдрому поліорганної недостатності та супроводжується високим відсотком летальності (Chen та спів–авт., 2020) [8]. За даними Wu та спів–авт. (2020), ГРДС частіше був діагностований у пацієнтів старшої вікової групи (> 65 років) із супутньою гіпертонічною хворобою (ГХ) та ЦД [9].
Інфекція SARS-CоV-2 може пошкоджувати легені прямим і непрямим впливом. Хоча АГР-2 має захисні властивості проти прогресування гострого пошкодження легень (Imai та співавт., 2005), він є функціональним рецептором для проникнення SARS-CoV та SARS-CoV-2 (Hamming та співавт., 2004) [10]. Приєднання вірусу до АГР-2 та інвазія до клітин-хазяїнів можуть безпосередньо їх інфікувати та посилити прояв запальної реакції, а отже, призвести до загибелі клітин та легеневих ускладнень. АГР-2 — це білок на поверхні клітин, розташованих у верхніх дихальних шляхах (келихоподібні та миготливі епітеліальні клітини), епітелії нижніх дихальних шляхів (альвеолярний тип II) та легеневих судин, таких як гладкі м’язи артерій, а також ендотеліальних клітин вен та артерій. Висока концентрація АГР-2 виявлена саме на поверхні альвеолоцитів легень 2-го типу. Доведено, що інгібування АГР-2 відіграє вирішальну роль у контролі патологічних змін у легенях, індукованих інфекцією SARS-CoV-2, що призводить до гострого пошкодження легень та тяжкої пневмонії (Pyrc та спів–авт., 2007) [11]. На моделі мишей S-білок SARS-CoV зв’язується з АГР-2 і призводить до набряку легень та зниження їх функції за рахунок зростання проникності легеневих судин, індукованої активацією АГР-2 (Imai та спів–авт., 2005) [12]. Оскільки ангіо–тензин-2 (АГ-2) — це ключовий регулятор артеріального тиску й об’єму позаклітинної рідини, очевидно, що інфекція SARS-CoV-2 призводить до інтерстиціального запалення та пошкодження альвеол. Патологічні особливості розвитку гострого респіраторного дистрес-синдрому також пов’язані з активацією шляхів впливу АГ-2, що перешкоджає відповіді адаптаційному імунітету через стимуляцію макрофагів та інших імунних клітин, а також із підвищеними концентраціями інтерлейкіну (IЛ) 6, фактора некрозу пухлини альфа (TNF-α) як основних запальних цитокінів (Yamamoto та співавт., 2011) [13]. Активовані дендритні клітини та макрофаги посилюють фагоцитоз інфікованих апоптотичними вірусами клітин епітелію. Підвищені рівні прозапальних медіаторів, наприклад інтерферону-гамма (IFN-γ), ІЛ (-1β, -6 та -12), та хемокінів, наприклад CXC L10 та CCL2, добре відомих як «цитокіновий шторм» та подальший синдром гіперзапалення, були підтверджені при запаленні легень, індукованому інфекціями SAR-CoV, MERS-CoV, SARS-CoV-2 (Channappanavar і Perlman, 2017; Lei та співавт., 2020) [14, 15]. Отже, патологічні зміни при ГРДС із пошкодженнями альвеолокапілярної мембрани в результаті посиленої проникності легень та витікання набрякової рідини в повітряні простори з подальшим розвитком дихальної недостатності були пов’язані з «цитокіновим штормом». Активація системи комплементу, С4, С3, С5b-9 та манозозв’язуючий лектин, медіатори гострого та хронічного запалення були виявлені в легеневій тканині пацієнтів із COVID-19 після розтину: в клітинах альвеолярного епітелію, деяких пневмоцитах, імунних клітинах й ексудаті альвеол (Gao та співавт., 2020) [16].
Нещодавнє дослідження Ciceri та спів–авт. (2020) продемонструвало чіткий зв’язок розвитку ГРДС з обструктивним тромбозапальним синдромом (MicroCLOTS) у мікросудинах легень пацієнтів із COVID-19 [17]. Утворення мікротромбів у судинних структурах легеневої тканини призводить до легеневої гіпертензії, легеневих кровотеч, інфаркту легень тощо [18]. У поєднанні пряме зараження легень вірусом, «цитокіновий шторм» та утворення мікротромбів слід розглядати як основні механізми легеневої недостатності, індукованої інфекцією SARS-CoV-2.
/10_m.jpg)
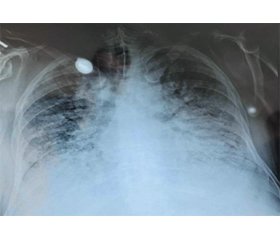
Основними радіологічними проявами маніфестації легеневих уражень COVID-19 є схожі рентгенологічні ознаки, які виявляються і при інших вірусних пневмоніях, а саме двосторонні інфільтрати за типом «матового скла» та консолідаційні інфільтрати легень. Цікаво, що на пізніх стадіях захворювання при виконанні КТ були такі знахідки: плевральний випіт, прогресування поширення інфільтратів та консолідаційних ущільнень.
Із метою спостереження в динаміці за станом легень, прогресування чи зменшення консолідатів, оцінки ефективності проведення респіраторної підтримки, виявлення ускладнень (пневмоторакс, гідроторакс) у клінічній практиці лікарі дедалі частіше використовують реанімаційний ультразвук (POCUS — Point-Of-Care Ultrasound), частиною якого є різновиди протоколу B.L.U.E., LUS (lung ultrasound score) та інші. Саме через низку технічних причин (недоступність КТ у багатьох лікувальних закладах, обмежений ресурс медичного персоналу для транспортування, відсутність достатньої кількості кисню під час транспортування та в кабінеті КТ, нестабільність пацієнта та переважання шкоди транспортування перед користю отриманої інформації внаслідок втрати позитивного тиску у кінці видиху (ПТКВ), відлучення від неінвазивної вентиляції, високе іонізуюче навантаження, контамінація простору під час логістичного скерування інфікованого пацієнта, надлишкова вага, вагітність тощо) ультразвук ввійшов у протокол динамічного спостереження в поєднанні з клінічним оглядом пацієнтів із COVID-19.
/10_m2.jpg)
COVID-19 і серцево-судинні захворювання
Залучення в тяжкий патологічний процес перебігу коронавірусної хвороби органів серцево-судинної системи може виникати або на фоні попередньо наявних захворювань, або за умов виникнення нових епізодів. Пацієнти з наявними в анамнезі захворюваннями серцево-судинної системи мають вищий ризик тяжкого перебігу COVID-19, що, за даними метааналізу (46 248 пацієнтів із підтвердженим COVID-19), особливо стосується супутньої гіпертонічної хвороби (17 %), цукрового діабету (8 %) та ішемічної хвороби серця (ІХС) (5 %) [19]. З іншого боку, існує загальноприйнята думка, що COVID-19 може також чинити несприятливий вплив на стан серцево-судинної системи, завдаючи або посилюючи пошкодження серця, що відображене в дослідженні Wang та спів–авт. (2020), в якому в 7,2 % пацієнтів або спостерігався підвищений рівень тропоніну І, або з’являлися нові електрокардіографічні чи ехокардіографічні аномалії, що свідчать про пошкодження серця [20]. Чіткого опису механізму ураження серця при COVID-19 у літературі не знайдено, окрім теорій наявності великої кількості ангіотензинових рецепторів, що підвищує ймовірність прямого вірусного впливу на серцевий м’яз, та опосередкованого впливу наслідків перенесеного «цитокінового шторму», гіпоксії на фоні ГРДС, застосованих методик респіраторної підтримки з недотриманням параметрів протективності, гіповолемії тощо. Підвищення рівня цитокінів внаслідок гіперзапальної відповіді або вторинного гемофагоцитарного лімфогістіоцитозу та збільшення потреби міокарда в кисні в умовах гострої інфекції можуть призвести до нестабільності атеросклеротичних бляшок та травми міокарда, збільшуючи ризик гострої ішемії/інфаркту [21]. Часто в пацієнтів спостерігається тенденція до гіпертензії, а також епізоди появи загрозливих аритмій.
Гематологічні зрушення при COVID-19
SARS-CoV-2-інфекція чинить помітний вплив на систему кровотворення і гемостазу. Найважливішими лабораторними знахідками з прогностичним потенціалом є лімфопенія (зменшення периферичних CD4+ і CD8+ Т-клітин) та лейкопенія, які можуть збільшити ризик бактеріальної інфекції [22]. За даними Mina та співавт. (2020), основними клінічно значущими лабораторними зрушеннями вважають лімфоцитопенію (< 1,0 × 109/л): 96,1 vs 80,4 %; лейкопенію (лейкоцити < 3,7 × 109/л): 61,1 vs 28,1 %, і тромбоцитопенію (тромбоцити < 100 × 109/л): 57,7 vs 31,6 % [23]. Результати метааналізу показали, що тромбоцитопенія суттєво корелює з тяжкістю захворювання (Lippi та співавт., 2020) [24]. Крім того, пікове співвідношення тромбоцитів/лімфоцитів та співвідношення нейтрофілів/лімфоцитів (NLR — neutrophil/leucocytes ratio) є важливими прогностичними предикторами COVID-19 (Terpos та співавт., 2020) [25]. Знижений абсолютний рівень моноцитів і підвищений рівень NLR пов’язані з вищим рівнем смертності (Pakos та спів–авт., 2020). Крім того, аномалії коагуляції, наприклад тяжка тромбоцитопенія, тенденція до гіперкоагуляції крові, низький активований частковий тромбопластиновий час, подовжений протромбіновий час та посилення продуктів розпаду фібрину, збільшують ризик виникнення внутрішньосудинної коагуляції серед госпіталізованих пацієнтів (Becker та співавт., 2020) [26]. Частота розвитку легеневої тромбоемболії, за даними літератури, спостерігалася близько в 10 % критично хворих на COVID-19 (Moores та співавт., 2020). Зростання симптомів захворювання корелює з підвищеними концентраціями медіаторів запалення (наприклад, TNF-α, індукований IFN-γ білок 10 [IP-10], MCP-1, білки запалення макрофагів 1A [MIP1A], колонієстимулюючий фактор гранулоцитів, інтерлейкінів) [2, 6, 7], а також з індукцією «цитокінового шторму» та синдрому гіперзапалення (Lillicrap, 2020; Quirch та співавт., 2020). Крім того, показники запалення, такі як лактатдегідрогеназа, C-реактивний білок (СРБ) та IЛ-6, допомагають виявити випадки бактеріального інфікування та вплинути на схему лікування та наслідки захворювання (Chen та спів–авт., 2020c; Li та спів–авт., 2020c; Ling, 2020). CРБ та NLR як біомаркери запалення використовуються для діагностики та оцінки багатьох захворювань, а значення СРБ понад 100 мг/л є показником тяжкої бактеріальної інфекції (Cals та співавт., 2010; Gille-Johnson та співавт., 2012) [27].
Збільшення рівнів інших біомаркерів, таких як сироватковий D-димер, феритин та прокальцитонін, супроводжується поганим прогнозом для одужання пацієнтів із тяжким перебігом коронавірусної інфекції (Huang та співавт., 2020). Підвищений D-димер може відображати прогрес тромбозу глибоких вен та/або емболії легеневої артерії, а також може передбачати як тяжкість, так і прогностичний відсоток летальності, проте завжди має оцінюватися паралельно з клінічною картиною та додатковими інструментальними обстеженнями (Aggarwal та співавт., 2020). Додатково, лактатдегідрогеназа є неспецифічним показником різних патологічних станів із клітинною загибеллю та масивним пошкодженням тканин (Wu та спів–авт., 2020) [29].
Гостре пошкодження нирок при коронавірусній хворобі
Гостре пошкодження нирок — це різка втрата функції нирок, що розвивається протягом 7 днів й оцінюється за зниженням темпу діурезу, підвищенням креатиніну тощо (критерії KDIGO). Частота розвитку ГПН, за даними літератури, коливається від 0,5 до 19 %, однак дослідження, що продемонструвало максимальну частоту (19 %), повідомляло лише про дані критично хворих пацієнтів, що пояснює дуже високий рівень захворюваності [30]. Більшість пацієнтів, які брали участь у даних дослідженнях, мали вихідну задовільну функцію нирок без хронічної хвороби нирок в анамнезі. Щодо середнього часу для розвитку ГПН від моменту надходження до лікарні, Zhou та співавт. повідомляють про медіану — 15 діб, тоді як Cheng та спів–авт. наголошують на тому, що в більшості пацієнтів, у яких розвивалося ГПН, часовий термін збігався з 7-ю добою від моменту надходження в стаціонар [31, 32]. Хоча точний патогенез ураження нирок при COVID-19 потребує вивчення, відомо, що ГПН при COVID-19 часто супроводжують сепсис, поліорганна недостатність та шок, що підтверджується гострим канальцевим некрозом під час аутопсії [33]. Як альтернатива в дослідженні, заснованому на одноклітинному аналізі транскриптомів (транскриптом — сукупність усіх транскриптів, синтезованих однією клітиною чи групою клітин, включаючи матричні РНК і некодуючі РНК), довели експресію рецептора АГ-2 у клітинах нирок, вказуючи на високу вірогідність прямого пошкодження ниркових клітин SARS-CoV-2. Це підтверджується нещодавнім виявленням SARS-CoV-2 у зразках сечі інфікованих пацієнтів [34].
У деяких пацієнтів метаболічні наслідки ГПН неможливо адекватно контролювати за допомогою консервативного лікування; отже, може знадобитися замісна ниркова терапія — діаліз (RRT — renal replacement therapy). Однак, як відомо, конвекційна техніка проведення гострого діалізу може викликати утворення тромбів, а також потребує використання дорогих витратних матеріалів, залучення додаткової кількості персоналу, що може збільшити економічні витрати родини пацієнта та посилити перевантаження медичного персоналу.
Не виявлено закономірної появи мікросудинного тромбозу в ниркових зразках пацієнтів із COVID-19. У препаратах ниркової тканини в пацієнтів із COVID-19 під час розтину рідкою знахідкою були фібринові тромби в клубочкових ділянках, пов’язані з тяжкою травмою ендотелію (Su et al., 2020) [35].
SARS-CoV-2 і захворювання печінки
За даними літератури, ураження печінки посідає майже друге місце після пошкодження легень у разі тяжкого перебігу SARS-CoV-2. Легкі та транзиторні пошкодження печінки, за даними Wong та співавт. (2020), виникають у 0,7–7,8 % пацієнтів, а в 14,8–53,1 % пацієнтів із COVID-19 супроводжуються аномальним рівнем аланінамінотрансферази, аспартатамінотрансферази та білірубіну протягом хвороби, причому білірубін мав найменше підвищення. Крім того, автори повідомили, що тяжкість ураження печінки пропорційна тяжкості COVID-19 [36]. Найбільш частими причинами, крім фонових захворювань печінки, у пацієнтів із коронавірусною інфекцією можуть бути медикаментозно-індуковане ураження (антипіретики, анти–біотики, противірусні засоби), сепсис та системна запальна відповідь. На фоні недостатнього харчування, застосування стероїдів, супутніх інфекційних ускладнень, неконтрольованого перебігу ЦД у пацієнтів із тяжкими печінковими проявами часто може розвиватися нециротична гіперамоніємія. Накопичення вільного іону NH4+ в цитозолі впливає на мембранний потенціал і роботу внутрішньоклітинних ферментів — він конкурує з іонними насосами для Na+ і K+. У нормі рівень аміаку —11–35 мкмоль/л або 15–45 мкг/дл. Продукт зв’язування аміаку з глутаміновою кислотою — глутамін є осмотично активною речовиною. Він призводить до затримки води в клітинах та їх набухання, що викликає набряк тканин. У разі нервової тканини це може спровокувати розвиток набряку мозку, кому і смерть. Одним зі способів боротьби із загрозливою для життя гіперамоніємією, крім забезпечення адекватної респіраторної підтримки, нормалізації рівня глікемічного профілю, нормалізації кислотно-лужного складу крові, підтримки задовільного рівня альбуміну сироватки крові, діалізу/перитонеального діалізу, використання лактулози, є налагодження задовільного клінічного харчування пацієнтів в умовах відділення інтенсивної терапії (використання збалансованого ентерального та/чи парентерального харчування), а також застосування додаткових медикаментозних засобів, наприклад Lola (L-ornithine L-aspartat).
Неврологічні розлади при COVID-19
Існує припущення, що вірусна інвазія в центральну нервову систему за допомогою SARS-CoV-2 можлива через синапси, як це спостерігається в разі інфікування іншими коронавірусами, такими як SARS-CoV; і може призвести до низки неврологічних ускладнень, включаючи атаксію, судоми, невралгію, непритомність, гострі цереброваскулярні захворювання та енцефалопатію [37]. Mao та спів–авт. (2020) повідомляють, що 36,4 % їх когорти пацієнтів мали неврологічні прояви, а у пацієнтів з тяжким перебігом коронавірусного захворювання більше шансів мати гострі цереброваскулярні захворювання, порушення свідомості та пошкодження скелетних м’язів [38]. Крім того, Li та співавт. висунули теорію про те, що саме потенційна вірусна інвазія може відігравати часткову роль у патофізіології гострої дихальної недостатності в пацієнтів із COVID-19 [39].
Киснева терапія/респіраторна підтримка
Як правило, пацієнтам із гіпоксемією при COVID-19 стартово рекомендується неінвазивна оксигенотерапія (назальні канюлі, маски з резервуаром) із перевагою до використання високопотокових назальних канюль. Перевага надається неінвазивній вентиляції з постійним позитивним тиском у дихальних шляхах та тиском підтримки, а не з двофазним позитивним тиском [40]. Запропоновано підтримувати цільове периферичне насичення киснем артеріальної крові (SpO2) 92–96 %. Ендотрахеальна інтубація показана лише при гострому погіршенні або відсутності результату проведення неінвазивної респіраторної підтримки шляхом оцінки клінічного стану пацієнта, кислотно-лужного стану крові, неврологічного статусу, гемодинамічних параметрів та оцінки ROX-індексу в тренді. При тяжкому ГРДС рекомендується вентиляція в положенні на животі протягом 16 годин на добу [41]. Додаткові рятувальні заходи включають екстракорпоральну мембранну оксигенацію, що виступає в ролі бриджинг-терапії і не є панацеєю.
Лікування інших проявів захворювання
Після діагностики сепсису якнайшвидше слід розпочати стандартну терапію, що включає введення рідинного болюсу та раннє використання вазопресорів при тенденції до гіпотензії [43, 44]. Настійно рекомендується профілактика тромбоемболічних ускладнень, перевагу віддають низькомолекулярним гепаринам, а також рекомендується застосування нефармакологічних методів, таких як періодичні пневматичні компресійні панчохи тощо.
Висновки
У тяжких випадках перебігу COVID-19, крім ураження легень, у патологічний процес долучаються й інші різні органи, такі як серце, печінка та нирки, а також гематологічна та нервова системи, що в кінцевому результаті стимулює розвиток поліорганної недостатності. SARS-CоV-2 може безпосередньо вторгнутись у клітини різних органів хазяїна через рецептори АГ-2. З іншого боку, активація системи комплементу, «цитокіновий шторм», порушення регульованої імунної відповіді, дисфункція системи коагуляції та інфільтрація запальних клітин при інфекції SARS-CoV-2 можуть також спричинити поліорганну дисфункцію в пацієнтів із коронавірусною хворобою. Клініцисти повинні мати розуміння про клінічні, лабораторні та рентгенологічні особливості COVID-19 у критично хворих із MODS/MOF, оскільки розширення знань із патофізіології індукованої SARS-CоV-2 поліорганної недостатності може в кінцевому результаті призвести до покращення результатів лікування пацієнтів із COVID-19 та зменшення летальності.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
Список літератури знаходиться в редакції

/9_m.jpg)
/8_m.jpg)
/9_m2.jpg)