Резюме
Актуальність. Матеріали, що деградують після імплантації в кісткову тканину, знаходяться в полі зору ортопедів та травматологів. До таких матеріалів належать полілактиди, які є ідеальним біоматеріалом для створення кісткових імплантатів в умовах друкування на 3D-принтері, особливо імплантатів складної форми й різних розмірів. Мета дослідження: провести порівняльний аналіз перебудови кістки в умовах імплантації 3D-друкованих гвинтів із полілактиду в метадіафізарний та діафізарний дефекти стегнової кістки щурів. Матеріали та методи. Порівняльний аналіз перебудови кістки в умовах імплантації 3D-друкованих гвинтів із полілактиду Ingeo™ Biopolymer 4032D в метадіафізарний та діафізарний дефекти стегнової кістки щурів проведено на 15, 30, 90, 180 та 270-ту добу. Ділянки кістки з імплантатами були досліджені гістологічним методом із визначенням індексу остеоінтеграції. Результати. Установлено, що в усі терміни дослідження імплантати зберігали форму, були оточені кістковою тканиною. Індекс остеоінтеграції на 270-ту добу в метафізарних та діафізарних дефектах становить 97,1 та 94,3 % відповідно і статично більший порівняно з 15-ю добою в 2,2 та 2,3 раза (p < 0,001). Висновки. Імплантати із полілактиду Ingeo™ Biopolymer 4032D є біосумісними, характеризуються високими остеоінтегративними якостями, не викликають запалення в прилеглих м’яких тканинах та кістковому мозку, не призводять до деструктивних змін кістки в ділянці імплантації. На кінцевий термін дослідження (270 діб) деградація біоматеріалу не встановлена, що надає можливість використати його як фіксатор або для заповнення порожнин у компактній та губчастій кістках на тривалий термін.
Background. Materials degrading after implantation into bone are in the field of actual vision of orthopediс surgeon. These materials include polylactides, which are the ideal material for creating bone implants in 3D-printer, especially implants of complex shapes and different sizes. The purpose of the study is to conduct a comparative analysis of bone remodeling under conditions of implantation of polylactide 3D-printed screws into metadiaphyseal and diaphyseal defects of the rat femur. Materials and methods. Comparative analysis of bone remodeling under conditions of implantation of polylactide Ingeo™ Biopolymer 4032D 3D-printed screws into the metadiaphyseal and diaphyseal defects of the rat femur for 15, 30, 90, 180 and 270 days are conducted. After implantation of polylactide, areas of bone with implants were examined by the histological method with the determination of the osteointegration index. Results. It was found that for all the study periods the implants kept their shape, were surrounded by bone tissue. The osseointegration index on the 270th day in metadiaphyseal and diaphyseal defects is 97.1 and 94.3 %, respectively, and is statistically higher compared to the 15th day by 2.2 and 2.3 times (p < 0.001). Conclusions. The polylactide-based Ingeo™ Biopolymer 4032D implants are biocompatible, have high osteointegration qualities, do not cause inflammation in the surrounding soft tissues and bone marrow, do not lead to destructive changes of the bone in the implantation sites. At the end of the study (270 days), the degradation of polylactide is not found, which makes it possible to use it for fixation or filling cavities in compact and spongy bones for a long time.
Вступ
Останніми роками в ортопедії та травматології поряд із металевими фіксаторами для остеосинтезу певну нішу займають матеріали, що мають здатність до біодеградації з подальшим заміщенням їх кістковою тканиною. Найбільш часто використовують матеріали на основі полілактидів та полігліколідів. Особливістю цих матеріалів є біодеградація в тканинах із формуванням нетоксичного для організму продукту метаболізму — молочної кислоти, яка у подальшому розщеплюється до CO2 і H2O [14, 15]. Полілактиди існують у формі двох ізомерів: полі-D-лактиду та полі-L-лактиду, які відрізняються динамікою біодегрдації, із більшим терміном для полі-L-лактиду [8]. Полілактиди використовують як імплантати, також на їх основі створюють композити [9]. Останніми роками в медицині, у тому числі і в ортопедії та травматології, для виготовлення імплантатів використовують 3D-принтери. Полілактиди є ідеальним біоматеріалом для створення кісткових імплантатів в умовах друкування на 3D-принтері, особливо імплантатів складної форми й різних розмірів [11, 12]. Раніше проведені нами експериментальні дослідження показали, що полілактид є біосумісним матеріалом, що демонструє високі остеокондуктивні та остеоінтегративні властивості [3, 5].
Упродовж дослідження важливим аспектом є порівняння перебудови полілактиду в різних за складом ділянках кістки (компактній та губчастій) на ранні та віддалені терміни дослідження.
Мета дослідження: провести порівняльний аналіз перебудови кістки в умовах імплантації 3D-друкованих гвинтів із полілактиду в метадіафізарний та діафізарний дефекти стегнової кістки щурів.
Матеріали та методи
Експериментальне дослідження остеоінтеграції, біосумісності та біодеградації матеріалу з полілактиду Ingeo™ Biopolymer 4032D проведене на 35 нелінійних білих щурах-самцях 6-місячного віку популяції експериментально-біологічної клініки ДУ «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка НАМН України». Матеріали планування дослідження з використанням щурів ухвалені локальним комітетом з біоетики (протокол № 158 від 21.11.2016 р.). Експеримент виконаний відповідно до міжнародних та національних вимог гуманного поводження з піддослідними тваринами — Європейської конвенції про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей (Страсбург, 1986) та Закону України «Про захист тварин від жорстокого поводження» (№ 3447-IV від 21.02.2006). Хірургічні втручання у щурів здійснені під загальним внутрішньом’язовим знеболюванням (кетамін, 50 мг/кг живої маси) в умовах асептики та антисептики. Для виведення тварин з експерименту обраний спосіб декапітації (з поперед-нім ефірним наркозом) у зв’язку з необхідністю отримання крові для подальших досліджень — клінічних та біохімічних.
Для виготовлення імплантатів використано полілактид, що являє собою продукт полімеризації L- і D-форм лактиду (співвідношення від 24 : 1 до 32 : 1) [10]. Імплантати у вигляді гвинтів створені за допомогою персонального 3D-принтера «Ultimaker 3» (технологія друку методом наплавлення, товщина шару біополімеру 0,1–0,2 мм). Виготовлені з гвинтів імплантати вводили у стандартні дірчасті дефекти, створені за допомогою стоматологічного бора в дистальному метадіафізі та середній частині діафіза стегнових кісток щурів (рис. 1).
Порівняльне дослідження проведене у двох групах відповідно до ділянки імплантації зразка полілактиду:
— 1-ша група — моделювання дефекту в метадіафізарному відділі стегнової кістки;
— 2-га група — моделювання дефекту в середній частині діафіза стегнової кістки.
Тварин виводили з експерименту на 15, 30, 90, 180 та 270-ту добу після операції.
Техніка виконання хірургічного втручання. Передньолатеральним доступом у дистальному метафізі лівої стегнової кістки моделювали дірчастий дефект діаметром 2 мм та глибиною 3 мм, у середній частині діафіза правої стегнової кістки — діаметром 2 мм та глибиною 2 мм. Дефекти обробляли антисептиком (Декасан®) та імплантували дослідний зразок відповідного розміру. Рани обробляли антибіотиком (Біцилін®-3), шкіру зашивали одиночними вузловими швами.
Для морфологічних досліджень вилучали стегнові кістки з ділянками дефекту, що був заповнений полілактидом. Матеріал обробляли гістологічними методами за рекомендаціями Д.С. Саркісова, Ю.Л. Перова [7]. Після фіксації в розчині 10% нейтрального формаліну, декальцинації в 4% розчині азотної кислоти матеріал зневоднювали в етиловому спирті (від 70 до 96º). Для подальшого зневоднювання матеріал занурювали у суміш Нікіфорова (етиловий спирт та етиловий ефір 1 : 1), потім поміщали в целоїдин. Зрізи (8–10 мкм) виготовляли на санному мікротомі «Reichert», забарвлювали гематоксиліном Вейгерта та еозином, а також пікрофуксином за Ван Гізоном. Гістологічні зрізи досліджували у світловому мікроскопі Olympus ВХ 63 (Carl Zeiss). Для морфометричного оцінювання остеоінтеграції імплантата застосовували планіметричну окулярну сітку. У полі зору світлового мікроскопа MICROS (Aвстрія) при збільшенні в 100 разів окремо підраховували кількість точок (перетинів сторін квадратів сітки), що припадали на периметр імплантата в кістковому ложі (ділянку періоста не враховували) та на кісткову тканину на межі з імплантатом. Показник останньої, наведений у відсотках від показника периметра імплантата, є індексом остеоінтеграції [2]. Статистичну обробку отриманих цифрових даних виконували за методом Стьюдента, різницю вважали статистично значущою у разі р < 0,05.
Результати та обговорення
На всі терміни дослідження щури були активними, вільно переміщалися в клітці та нормально харчувались.
За макроскопічною оцінкою імплантованих зразків біоматеріалу встановлено, що матеріал щільно розташовувався в діафізарних і метадіафізарних відділах стегнових кісток, ознак запалення та деструкції прилеглих м’яких тканин не виявлено.
На підставі мікроскопічної оцінки на 15-ту добу дослідження компактної кістки з біоматеріалом, імплантованим у дефект, було встановлено, що в обох групах порівняння в кортексі зберігалися невеликі зони щільного прилягання полілактиду без формування проміжних тканин, однак на більшості територій між кортексом та імплантатом розташовувалася незріла кісткова тканина з невеликими прошарками сполучної тканини або остеоїду. У кортексі, який прилягав до імплантата, в обох групах виявлені ділянки без клітин та з порушенням забарвлення матриксу, що може бути наслідком відтворення дефекту. У глибоких ділянках контакту імплантата з кістковим мозком у діафізарній частині стегнової кістки імплантат був оточений вузьким прошарком незрілої кісткової тканини з перевагою у ділянках, розташованих під кортексом. Однак щільність новосформованої кістки була більшою в метадіафізарних дефектах на ділянках контакту імплантата з кістковими трабекулами губчастої кістки.
Над імплантатами виявлено формування періоста зі щільно розташованими колагеновими волокнами та фібробластами проміж ними. За даними літератури, особливістю локальної реакції на сторонній предмет є присутність багатоядерних клітин, що можуть виконувати функцію резорбції імплантата [4, 16]. Однак у проведеному нами дослідженні навколо полілактиду не встановлено появи цих клітин, що вказує на високу біосумісність матеріалу та відсутність частинок деградації. Крім того, на цей термін у кістковому мозку навколо імплантатів не встановлено ознак запального процесу. Тобто особливістю перебудови кістки навколо імплантата з полілактиду в обох ділянках стегнової кістки є односпрямований характер формування кісткової тканини.
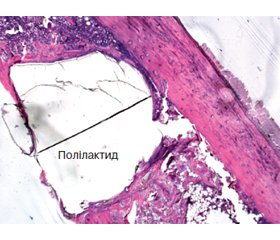
Через 30 діб у двох групах порівняння імплантати зберігали форму, щільно розташовувалися в ложі кістки. Виявлений щільний контакт між кортексом та імплантатами, а в ділянках кістково-мозкового каналу (рис. 2) та губчастій кістці (рис. 3) поверхня імплантатів була вкрита вузьким шаром зрілої кісткової тканини. На невеликих територіях на поверхні імплантата розташовувалися прошарки сполучної тканини або остеоїду між імплантатом та новоутвореною кістковою тканиною.
Через 90 діб відмінностей від попереднього терміну дослідження в структурній організації кістки та її розташуванні на поверхні імплантатів не встановлено. У групах порівняння картини перебудови кортексу були подібні. У діафізарному дефекті у кістково-мозковому каналі імплантат був оточений зрілою кістковою тканиною у вигляді вузького прошарку. У метадіафізарному дефекті площа кісткової тканини в ділянках губчастої кістки навколо імплантата була більшою порівняно з попереднім терміном.
На подальші терміни дослідження — 180 та 270-ту добу імплантати в обох групах порівняння не мали ознак деструкції, були оточені зрілою кістковою тканиною з низькою щільністю остеоцитів, які розташовані в вузьких лакунах. Матрикс кортексу був забарвлений рівномірно, що свідчить про відсутність ділянок остеолізису. Навколо імплантатів, розташованих у метадіафізарних ділянках, кісткові трабекули формували дрібнопетлясту сітку, що вказує на відсутність локальних остеопоротичних змін (рис. 4). У діафізарних дефектах імплантати щільно контактували з кортексом, а в ділянках кістково-мозкового каналу були оточені вузьким шаром зрілої кісткової тканини (рис. 5).
/68.jpg)
Відомо, що частою реакцією кістки на імплантати є формування локальних ділянок лізису навколо них [13]. У нашому дослідженні характерних змін у вигляді розрідження трабекулярної сітки губчастої кістки в ділянках метафіза та резорбційних порожнин у кортексі не виявлено. Це свідчить про те, що в умовах імплантації полілактиду в різні частини стегнової кістки він не призводить до остеопоротичних змін, тобто матеріал за механічними якостями має високу тропність до кісткової тканини. Визначено відсутність деградації дослідженого біоматеріалу. Відомо, що залежно від технології виготовлення та фізико-механічних особливостей матеріалу полілактиди можуть зберігати форму після імплантації в кістку від 12–24 міс. залежно від складу композиту [1, 6], що розширяє можливості їх використання у разі проведення остеосинтезу. Крім того, висока тропність полілактидів до кісткової тканини дає підставу використати їх для заповнення «критичних» дефектів.
Відомо, що найбільш критичними для визначення стабільності імплантатів є ранні та пізні терміни, у зв’язку з цим дослідження остеоінтеграції було проведено на 15-ту та 270-ту добу (табл. 1). Індекс остеоінтеграції був статично більший порівняно з 15-ю добою в 2,2 та 2,3 раза в метафізарних та діафізарних дефектах відповідно, що свідчить про високі остеоінтегративні якості імплантатів. Різниці між показниками індексу остеоінтеграції імплантатів у метадіа-фізарних та діафізарних дефектах на пізні терміни не встановлено.
Висновки
1. Досліджений полілактид Ingeo™ Biopolymer 4032D, який було імплантовано в метадіафізарний та діафізарний дефекти стегнової кістки щурів, є біосумісним та має високі остеоінтегративні якості, не викликає запалення в оточуючих м’яких тканинах та кістковому мозку, не викликає деструктивні зміни кістки в ділянках імплантації.
2. На кінцевий термін дослідження (270-та доба) 3D-друковані імплантати із полілактиду зберігали форму, деградації біоматеріалу не встановлено, що надає можливість використати їх як фіксатори або для заповнення порожнин у компактній та губчастій кістках на тривалий термін.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Отримано/Received 28.04.2021
Рецензовано/Revised 12.05.2021
Прийнято до друку/Accepted 25.05.2021
Список литературы
1. Агаджанян В.В., Пронских А.А., Демина В.А., Гомзяк В.И., Седуш Н.Г., Чвалун С.Н. Биодеградируемые имплантаты в ортопедии и травматологии. Наш первый опыт. Политравма. 2016. № 4. С. 85-93.
2. Автандилов Г.Г. Медицинская морфометрия. М.: Медицина, 1990. 381 c.
3. Дєдух Н.В., Нікольченко О.А., Макаров В.Б. Перебудова кістки навколо полілактиду, імплантованого у діафіз стегнової кістки. Вісник проблем біології і медицини. 2018. № 1(142). С. 275-9. DOI: 10.29254/2077-4214-2018-1-1-142-275-279.
4. Должиков А.А., Колпаков А.Я., Ярош А.Л., Молчанова А.С., Должикова И.Н. Гигантские клетки инородных тел и тканевые реакции на поверхности имплантатов. Курский научно-практический вестник «Человек и его здоровье». 2017. № 3. С. 86-94. DOI: http://dx.doi.org/10.21626/vestnik/2017-3/15.
5. Макаров В.Б., Дедух Н.В., Никольченко О.А. Остеорепарация вокруг полилактида, имплантированного в метадиафизарный отдел бедренной кости (экспериментальное исследование). Ортопедия, травматология и протезирование. 2018. № 2(611). С. 102-7. DOI: http:// dx.doi.org/10/15674/0030-598720182102-107.
6. Макєєв В.Ф., Черпак М.О. Застосування полімерних остеопластичних матеріалів у стоматології. Український стоматологічний альманах. 2013. № 1. С. 116-9.
7. Саркисов Д.С. Микроскопическая техника. М.: Медицина, 1996. 542 с.
8. Bohner M. Resorbable biomaterials as bone graft substitutes. Materials Today. 2010. Vol. 13(1–2). Р. 24-30. DOI: https://doi.org/10.1016/S1369-7021(10)70014-6.
9. Hamad K., Kaseem M., Yang H.W., Deri F., Ko Y.G. Properties and medical applications of polylactic acid: A review. eXPRESS Polymer Letters. 2015. Vol. 9(5). Р. 435-55. DOI: 10.3144/expresspolymlett.2015.42.
10. Kontakis G.M., Pagkalos J.E., Tosounidis T.I., Melissas J., Katonis P. Bioabsorbable materials in orthopaedics. Acta Orthop. Belg. 2007. Vol. 73(2). Р. 159-69.
11. Liu A., Xue G-h, Sun M., Shao H-f, Ma C-y, Gao Q., Gou Z-r, Yan S-g, Liu Y-m, HeY. 3D Printing Surgical Implants at the clinic: A Experimental Study on Anterior Cruciate Ligament Reconstruction. Sci. Rep. 2017. No 6(21704). Р. 1-13. DOI: 10.1038/srep21704.
12. Murphy S.V., Atala A. 3D bioprinting of tissues and organs. Nat. Biotechnol. 2014. Vol. 32(8). Р. 773-85. DOI: 10.1038/nbt.2958
13. Oh T-J, Yoon J., Misch C.E., Lau K. The Causes of Early Implant Bone Loss: Myth or Science? Journal of Periodontology. 2002. Vol. 73(3). Р. 322-33. DOI: 10.1902/jop.2002.73.3.322.
14. Schaschke C., Audic J.L. Editorial: Biodegradable materials. Int. J. Mol. Sci. 2014. Vol. 15. Р. 21468-75. DOI: 10.3390/ijms151121468.
15. Sheikh Z., Najeeb S., Khurshid Z., Verma V., Rashid H., Glogauer M. Biodegradable Materials for Bone Repair and Tissue Engineering Applications. Materials. 2015. № 8. Р. 5744-94. DOI: 10.3390/ma8095273.
16. Steffi C., Shi Z., Kong C.H., Wang W. Modulation of Osteoclast Interactions with Orthopaedic Biomaterials. J. Funct. Biomater. 2018. Vol. 9(1). Р. 18. DOI: 10.3390/jfb9010018.
/66.jpg)

/67.jpg)
/68.jpg)
/68_2.jpg)