Архив офтальмологии Украины Том 9, №1, 2021
Вернуться к номеру
Ураження парних очей на початкових стадіях непроліферативної діабетичної ретинопатії у пацієнтів із цукровим діабетом 2-го типу
Авторы: Риков С.О., Коробов К.В., Могілевський С.Ю.
Національний університет охорони здоров’я України імені П.Л. Шупика*, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
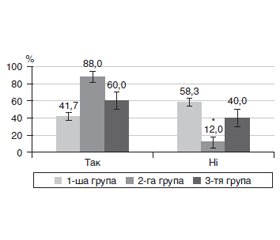
Актуальність. Одним із ранніх мікросудинних ускладнень цукрового діабету 2-го типу (ЦД2) є діабетична ретинопатія (ДР). Основна її причина — тривала гіперглікемія, яка запускає розвиток мікроангіопатії. У цьому плані не до кінця з’ясованим є питання щодо пошкодження парних очей і поширеність ДР на початкових стадіях. Мета: дослідити особливості ураження парних очей на початкових стадіях непроліферативної діабетичної ретинопатії у пацієнтів із цукровим діабетом 2-го типу. Матеріали та методи. Був обстежений 91 пацієнт з ЦД2 (182 ока), у яких, за класифікацією Міжнародної клінічної шкали тяжкості ДР Американської академії офтальмології (2002), ретинопатії не було. Парні очі розподілили на три групи: у 1-шу групу включили 132 парних ока (66 пацієнтів) із рівнем балів за шкалою ETDRS 10; у 2-гу групу ввійшло 25 очей з рівнем балів за шкалою ETDRS 10, а у 3-тю — 25 парних до них очей зі змінами судин сітківки (рівні балів за шкалою ETDRS — 14, 15). Повторно пацієнтів обстежували через 1 рік. Відповідно до шкали балів ETDRS системи клінічних ознак Airlie House визначали мікроаневризми, мікрогеморагії, інтраретинальні зміни мікросудин, ретинальні венозні зміни та неперфузію сітківки. Результати. Більшість (58,3 %) парних очей без початкових змін (1-ша група) протягом 1 року не мали прогресії ДР, у 12,9 % була відмічена поява змін судин сітківки (рівень балів за шкалою ETDRS — 14, 15), у 13,6 % розвивалася початкова, а у 15,2 % — помірна непроліферативна ДР. Найбільший рівень прогресії ДР (88,0 % очей) був притаманний очам без діабетичних судинних змін, які були парними до очей з такими змінами (2-га група), що у 2,1 раза (p < 0,001) перевищувало показник парних очей без діабетичних змін (1-ша група; 41,7 %). Початкові судинні зміни в більшості очей (3-тя група), через 1 рік прогресували до помірної непроліферативної ДР, що було у 4 рази частіше, ніж в очей, які початкових змін не мали (60,0 проти 15,2 %; p < 0,001). ДР на очах 3-ї групи з прогресією мала рівень за EDTRS 43, 47; гострота зору цих очей як до, так і через 1 рік спостереження була суттєво нижчою, ніж у інших групах, а рівень у крові глікованого гемоглобіну у пацієнтів з такими очами був суттєво більшим. Висновки. Проведене дослідження встановило особливості прогресії ранніх стадій ДР у хворих з ЦД2 та значущість початкових змін судин сітківки, за наявністю яких прогресія ДР відбувалася швидше.
Background. One of the early microvascular complications of type 2 diabetes mellitus (T2DM) is diabetic retinopathy (DR). Its main cause is prolonged hyperglycemia, which triggers the development of microangiopathy. In this regard, the issue of damage to paired eyes and the spread of DR in the initial stages has not been fully clarified. The purpose: to study the peculiarities of lesions of paired eyes at the initial stages of non-proliferative diabetic retinopathy in patients with type 2 diabetes mellitus. Materials and methods. We examined 91 patients with T2DM (182 eyes), who did not have retinopathy according to the International Diabetic Retinopathy Severity Scale of the American Academy of Ophthalmology (2002). Paired eyes were divided into three groups: group 1 included 132 paired eyes (66 patients) with 10 points according to the Early Treatment Diabetic Retinopathy Group Study (ETDRS); group 2 consisted of 25 eyes with 10 points on ETDRS, and group 3 — 25 paired eyes with retinal vascular anomalies (14–15 points on ETDRS). The patients were examined again after 1 year. According to the ETDRS, Airlie House classification, microaneurysms, microhemorrhages, intraretinal microvascular abnormalities, retinal vascular abnormalities, and retinal nonperfusion were detected. Results. The majority (58.3 %) of paired eyes without initial changes (group 1) had no progression of DR within 1 year, 12.9 % had vascular anomalies (14–15 points on ETDRS), 13.6 % developed mild, and 15.2 % — moderate non-proliferative DR. The highest progression of DR (88.0 % of eyes) was observed in eyes without diabetic vascular changes, which were paired to eyes with such changes (group 2) that was 2.1 times (p < 0.001) higher than the indicator of paired eyes without diabetic changes (group 1; 41.7 %). Most eyes that had mild vascular changes (group 3) progressed to moderate non-proliferative DR after 1 year, which was four times more often than in eyes that had no initial changes (60.0 versus 15.2 %; p < 0.001). DR in the eyes of group 3 with progression accounted for 43–47 points on EDTRS; the visual acuity of these eyes, both before and after 1 year, was significantly lower than in other groups, and the level of glycated hemoglobin in the blood of patients with such eyes was significantly higher. Conclusions. This study established the features of the progression of early stages of DR in patients with T2DM, and the significance of primary retinal vascular anomalies in the presence of which the progression of DR was faster.
діабетична ретинопатія; цукровий діабет 2-го типу
diabetic retinopathy; type 2 diabetes mellitus
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Ulyte A., Bähler C., Schwenkglenks M., von Wyl V., Gruebner O., Wei W. et al. Measuring diabetes guideline adherence with claims data: systematic construction of indicators and related challenges. BMJ Open. 2019 Apr 24. 9(4). e027138. doi: 10.1136/bmjopen-2018-027138.
- Kowall B., Rathmann W., Stang A., Bongaerts B., Kuss O., Herder C. et al. Perceived risk of diabetes seriously underestimates actual diabetes risk: the KORA FF4 study. PLoS One. 2017 Jan 31. 12(1). e0171152. doi: 10.1371/journal.pone.0171152.
- Lotfy M., Adeghate J., Kalasz H., Singh J., Adeghate E. Chronic complications of diabetes mellitus: a mini review. Curr. Diabetes Rev. 2017. 13(1). 3-10. doi: 10.2174/1573399812666151016101622.
- Khan R.M., Chua Z.J., Tan J.C., Yang Y., Liao Z., Zhao Y. From pre-diabetes to diabetes: diagnosis, treatments and translational research. Medicina. Kaunas. 2019 Aug 29. 55(9). 546. doi: 10.3390/medicina55090546.
- WHO. Global Diabetes Report [Internet]. 2020 [cited 20.10.20]. Available on www.who.int/diabetes/ru/.
- Nowak M.S., Grzybowski A. Rewie of the epidemiology of diabetic retinopathy. Modern Retina. Ophtalmology Times [Internet]. 2018 June 11 [cited 15.07.20]. Available from: https://www.modernretina.com/diabetic-retinopathy/review-epidemiology-diabetic-retinopathy.
- International Diabetes Federation and The Fred Hollows Foundation. Diabetes eye health: A guide for health care professionals. Brussel, Belgium: International Diabetic Federation [Internet]. 2015 [cited 20.10.20]. Available on: https://idf.org/our-activities/care-prevention/eye-health/eye-health-guide.html#sub-content-tab-nav.
- Tronko M.D. Priority issues of diabetology in Ukraine at the present stage and ways to solve them. 2020 [Internet] [cited 20.10.2020]. Available on: http://iem.net.ua/endocrinology_task/ [in Ukrainian].
- Pankiv V.I. Symposium № 156. Diabetes mellitus: definition, classification, epidemiology, risk factors. Int. J. Endocrin. 2013. 55(7). 95-104. Available on: https://cyberleninka.ru/article/n/tsukroviy-diabet-viznachennya-klasifikatsiya-epidemiologiya-faktori-riziku/viewer [in Ukraine].
- Kirsch S., Iroku-Malize T. Eye Conditions in Older Adults: Diabetic Retinopathy. FP Essent. 2016 Jun. 445. 29-37. Quiz 38-9.
- Ghandour R., Nahed M., Rmeileh N.A., Lars J., Norberg M., Eriksson J.W., Husseini A. Complications of type 2 diabetes mellitus in ramallah and al-bireh: the palestinian diabetes complications and control study (PDCCS). Prim. Care Diabetes Dec. 2018. 12(6). 547-57. doi: 10.1016/j.pcd.2018.07.002.
- Safi H., Safi S., Ali H.-M., Hamid A. Early detection of diabetic retinopathy. Survey of Ophthalmology. 2018 Apr. 63(5). 601-8. doi: 10.1016/j.survophthal.2018.04.003.
- Voigt M., Schmidt S., Lehmann T., Köhler B., Kloos C., Voigt U.A., Meller D. et al. Prevalence and progression rate of diabetic retinopathy in type 2 diabetes patients in correlation with the duration of diabetes. Exp. Clin. Endocrinol. Diabetes. 2018 Sep. 126(9). 570-6. doi: 10.1055/s-0043-120570.
- Pankiv V.I. Diabetic retinopathy: a new approach to drug treatment (literature review). Int. J. Endocrin. 2014. 59(3). 93-5. Available on: http://www.mif-ua.com/archive/article/38677 [in Ukranian].
- Lin Y., Jiang H., Liu Y., Gameiro G.R., Gregori G., Dong C., Rundek T. et al. Age-related alterations in retinal tissue perfusion and volumetric vessel density. Invest. Ophthalmol. Vis. Sci. 2019 Feb 1. 60(2). 685-93. doi: 10.1167/iovs.18-25864.
- Eleftheriou C.G., Ivanova E., Sagdullaev B.T. Of neurons and pericytes: The neuro-vascular approach to diabetic retinopathy. Vis. Neurosci. 2020 Aug. 37. 5. doi: 10.1017/S0952523820000048.
- Dedov I.I., Smirnova O.M. Diabetic retinopathy: current problems (the view of a diabetologist). Diabetes Ophthalmology. 2008. 3. 4. Available on: https://cyberleninka.ru/article/n/diabeticheskaya-retinopatiya-sovremennye-problemy-vzglyad-diabetologa/viewer [in Russian].
- Fong D.S., Aiello L., Gardner T.W., King G.L., Blankenship G., Cavallerano J.D., Ferris 3rd F.L. et al. Retinopathy in diabetes. Diabetes Care. 2004 Jan. 27(1). 84-7. doi: 10.2337/diacare.27.2007.s84.
- Kashim R.M., Newton P., Ojo O. Diabetic retinopathy screening: a systematic review on patients' non-attendance. Int. J. Environ. Res. Public Health. 2018 Jan 19. 15(1). 157. doi: 10.3390/ijerph15010157.
- Balashevich L.I., Izmailov A.S. Diabetic ophthalmopathy. SPb.: Man, 2012. 396 [in Russian].
- Vujosevic S., Toma C., Villani E., Gatti V., Brambilla M., Muraca A., Ponziani M.C. et al. Early detection of microvascular changes in patients with diabetes mellitus without and with diabetic retinopathy: comparison between different swept-source OCT-A instruments. J. Diabetes Res. 2019 Jun 12. 254. 7216. doi: 10.1155/2019/2547216.
- Early Treatment Diabetic Retinopathy Study Research Group. Grading diabetic retinopathy from stereoscopic color fundus photographs — an extension of the modified airlie house classification: ETDRS report № 10. Ophthalmology. 2020 Apr. 127(4S). 99-119. doi: 10.1016/j.ophtha.2020.01.030.
- Khatri M., Saxena S., Kumar M., Chabbra A.K., Bhasker S.K., Akduman E.I., Pham H. et al. Resistive index of central retinal artery is a bioimaging biomarker for severity of diabetic retinopathy. Int. J. Retina Vitreous. 2019 Nov 12. 5. 38. doi: 10.1186/s40942-019-0189-4.
- Pappuru R.K., Ribeiro L., Lobo C., Alves D., Cunha-Vaz J. Microaneurysm turnover is a predictor of diabetic retinopathy progression. Br. J. Ophthalmol. 2019. 103(2). 222-26. doi: 10.1136/bjophthalmol-2018-311887.
- Schmidt-Erfurth U., Garcia-Arumi J., Gerendas B.S., Midena E., Sivaprasad S., Tadayoni R., Wolf S. et al. Guidelines for the management of retinal vein occlusion by the European society of retina specialists (EURETINA). Ophthalmologica. 2019. 242(3). 123-62. doi: 10.1159/000502041.
- Cui Y., Zhu Y., Wang J.C., Lu Y., Zeng R., Katz R., Vingopoulos F. et al. Comparison of widefield swept-source optical coherence tomography angiography with ultra-widefield color fundus photography and fluorescein angiography for detection of lesions in diabetic retinopathy. Br. J. Ophthalmol. 2020 Jun 26. bjophthalmol-2020-316245. doi: 10.1136/bjophthalmol-2020-316245.
- Luc K., Schramm-Luc A., Guzik T.J., Mikolajczyk T.P. Oxidative stress and inflammatory markers in prediabetes and diabetes. J. Physiol. Pharmacol. 2019 Dec. 70(6). 111-13. doi: 10.26402/jpp.2019.6.01.
- Giri B., Dey S., Das T., Sarkar M., Banerjee J., Dash S.K. Chronic hyperglycemia mediated physiological alteration and metabolic distortion leads to organ dysfunction, infection, cancer progression and other pathophysiological consequences: an update on glucose toxicity. Biomed. Pharmacother. 2018 Nov. 107. 306-28. doi: 10.1016/j.biopha.2018.07.157.
- Eshaq R.S., Aldalati A.M.Z., Alexander J.S., Harris N.R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. 2017 Dec. 24(4). 229-41. doi: 10.1016/j.pathophys.2017.07.001.
- Hussain M., Awan F.R. Hypertension regulating angiotensin peptides in the pathobiology of cardiovascular disease. Clin. Exp. Hypertens. 2018. 40(4). 344-52. doi: 10.1080/10641963.2017.1377218.

/23.jpg)
/23_3.jpg)
/23_2.jpg)
/24.jpg)
/25.jpg)