Газета «Новости медицины и фармации» №4 (751), 2021
Вернуться к номеру
Орфанні захворювання в онкоендокринології (огляд літератури й власні дані)
Авторы: Тронько М.Д., Кваченюк А.М., Луценко Л.А., Супрун І.С., Охрімчук О.О.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
В 1983 році в США було прийнято законодавчий акт «Orphan Drug Act», завдяки якому вперше прозвучав термін «орфанні хвороби» та визначено 1600 рідкісних хвороб невідомої етіології. Орфанними (від англ. orphan — «сирота, сирітський») названо захворювання, частота поширення яких не перевищує 1 випадок на 2000 населення. На сьогодні Європейським комітетом експертів із рідкісних захворювань зареєстровано приблизно 5000–8000 різних рідкісних захворювань, із них лише 250 орфанних захворювань мають свій шифр у Міжнародній класифікації хвороб (МКХ).
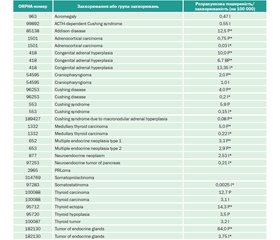
Вважається, що показник поширеності орфанних захворювань не є уніфікованим. У різних країнах/регіонах критерії «орфанності» захворювання відрізняються і їх частота може коливатися. Рівень поширеності даних патологій може бути низьким в одному регіоні (чи популяції) та високим — в іншому. Згідно з даними офіційного веб-сайту Європейського Союзу (ЄС), в Європі будь-яке захворювання, що вражає менше 5 осіб на 10 000, вважається рідкісним [1]. У більшості ж випадків захворювання вважаються орфанними, коли вражається 1 людина на 100 000 і більше. У країнах ЄС від рідкісних захворювань страждає 6–8 % населення, тобто від 27 до 36 мільйонів людей [1]. Розрахункова поширеність орфанних ендокринних захворювань коливається від 0,08 до 64 випадків на 100 000 осіб [2].
Вік маніфестації орфанних захворювань може бути різний, більшість з них діагностують у ранньому віці. Враховуючи труднощі в діагностиці, встановлення правильного діагнозу може бути відтерміновано.
Близько 80 % рідкісних захворювань є результатом генних і хромосомних мутацій, інші обумовлені інфекційними (віруси, бактерії), алергічними агентами або факторами зовнішнього середовища. Для багатьох орфанних захворювань характерна поліорганна ураженість, яка потребує кваліфікованої допомоги лікарів різних спеціальностей.
Таким чином, труднощі в діагностиці, дороге, специфічне та часто пожиттєве лікування, несприятливий прогноз, висока частота інвалідизації пацієнтів обумовлюють медико-соціальне значення орфанних захворювань.
За підтримки ЄС в Європі існує спеціальна програма, що направлена на вирішення різноманітних питань щодо діагностики, лікування й соціального забезпечення хворих з орфанними захворюваннями. В 1997 році Французьким національним інститутом охорони здоров’я та медичних досліджень був створений проєкт «Орфанет» (www.orpha.net). На сьогодні це консорціум із 40 країн, який об’єднує інформацію щодо орфанних захворювань практично в усіх країнах Європи. За даними звіту Orphanet про реєстри захворювань, який опубліковано в травні 2019 року, загальна кількість реєстрів становила: 60 європейських, 80 регіональних, 58 інтернаціональних та 535 національних. З них 1 реєстр з України — це реєстр пацієнтів зі спінальною м’язовою атрофією [2].
У 2014 році прийнято Закон України «Про внесення змін до Основ законодавства України про охорону здоров’я щодо забезпечення профілактики та лікування рідкісних (орфанних) захворювань», яким визначено поняття «рідкісне (орфанне) захворювання» — це захворювання, яке загрожує життю людини або яке хронічно прогресує, призводить до скорочення тривалості життя громадянина або до його інвалідності, поширеність якого серед населення не частіше ніж 1 : 2000.
27.10.2014 року в Україні опубліковано Наказ МОЗ № 778 «Про затвердження переліку рідкісних (орфанних) захворювань» (із змінами, внесеними згідно з Наказами Міністерства охорони здоров’я № 919 від 30.12.2015, № 731 від 29.06.2017, № 2664 від 24.12.2019). У переліку вказано орфанні захворювання, що призводять до скорочення тривалості життя хворих або їх інвалідизації та для яких існують визнані методи лікування. Таким чином, в Україні офіційно затверджено 302 нозології, які віднесено до рідкісних захворювань [3]. Серед них 61 рідкісна ендокринна хвороба (в тому числі розлади харчування та порушення обміну речовин), а також природжені вади розвитку, хромосомні аномалії та рідкісні новоутворення, у визначенні тактики ведення яких ендокринолог бере безпосередню участь [4].
Деякі орфанні захворювання досить часто зустрічаються в практиці ендокринолога. Наприклад, частота виявлення пролактиноми становить 1/1600 осіб (у Бельгії, Великій Британії, Швейцарії та інших країнах ЄС). Від захворювання страждають переважно жінки, особливо пременопаузального віку. Пролактинома становить 66 % клінічно значущих випадків аденоми гіпофіза [5]. Лабораторні та інструментальні методи діагностики дають можливість встановити діагноз пролактиноми, провести диференційну діагностику, а наявність препаратів агоністів дофаміну — призначити коректне лікування.
У випадках підозри інших орфанних захворювань ситуація може бути інакшою. Наприклад, діагностика акромегалії не викликає великих труднощів на момент появи клінічних проявів. Лабораторні методики визначення інсуліноподібного фактора росту 1 (ІФР-1), соматотропного гормона (СТГ) дозволяють діагностувати гіперсоматотропінемію, а магнітно-резонансна томографія (МРТ) гіпофіза — виявити соматотропіному [6]. На сьогодні в Україні офіційно зареєстровано 844 пацієнти з акромегалією, хоча розрахункова кількість пацієнтів з акромегалією в Україні може сягати приблизно 2500. Більш точну цифру поширеності акромегалії спрогнозувати складно, крім того, невідома кількість пацієнтів з неконтрольованою акромегалією. З лікуванням акромегалії в Україні ще складніше, чим зі статистикою, оскільки препарати, що використовуються для корекції гіперсоматотропінемії, дорогі та потребують пожиттєвого призначення. Багато пацієнтів зі встановленим діагнозом не забезпечені медикаментозними препаратами, що призводить до подальшого прогресування захворювання. І це при тому, що в світову клінічну практику впроваджено цілу низку фармакологічних засобів (аналоги соматостатину, антагоністів рецепторів гормона росту та дофамінових рецепторів), які дозволяють значно підвищити ефективність комбінованого лікування аденом гіпофіза. За останні десятиліття в багатьох країнах світу були створені або створюються національні реєстри пацієнтів з різними соціально значущими захворюваннями, включаючи акромегалію, що дає можливість планувати та забезпечувати хворих необхідними препаратами. Опубліковані дані бельгійських (Bex М. et al., 2007), британських (Jenkins et al., 2006), фінських (Kauppinen-Makelin et al., 2005), іспанських (Mestron et al., 2004) та інших національних реєстрів хворих на акромегалію. Низка інших європейських країн ініціювали створення даних національних реєстрів. На жаль, в Україні на сьогодні реєстр хворих на акромегалію не створено, що призводить до зниження якості життя та розвитку ускладнень.
Наводимо клінічний випадок діагностики та тактики ведення хворої на акромегалію.
Пацієнтка К., 1962 р.н., звернулася за консультацією в червні 2020 року зі скаргами на періодичний головний біль, виражену слабкість, підвищену втомлюваність, незначну (2 кг за 6 міс.) втрату ваги.
Вважає себе хворою з 2016 року, коли почала відмічати зміну рис обличчя (збільшення хрящів носа та вушних раковин), збільшення розмірів кистей і стоп (за рік змінила кілька розмірів взуття), періодичний головний біль. З даними скаргами в травні 2017 року звернулася до ендокринолога, який порекомендував лабораторне обстеження та проведення МРТ гіпофіза. За результатами лабораторного обстеження виявлено гіперсоматотропінемію (СТГ — 16,2 нг/мл, ІФР-1 — 628 (норма 36–200) нг/мл, пролактин — норма). При прицільній МРТ гіпофіза: розташування турецького сідла звичайне, його порожнина асиметрично розширена. Краї його дна та стінок чітко відмежовані від оточуючих тканин. Гіпофіз збільшений, розмірами 15,5 × 19,0 × 9,6 мм. Диференціація долей збережена. Нейрогіпофіз без видимих змін. Структура аденогіпофіза на нативних зображеннях неоднорідна за рахунок наявності в правих відділах патологічного об’ємного утворення загальними умовними розмірами 12,0 × 12,7 × 8,6 мм, що має дещо неоднорідний ізоінтенсивний МР-сигнал на Т2WI та помірно гіпоінтенсивний МР-сигнал на Т1WI. При проведенні динамічного дослідження з внутрішньовенним болюсним введенням контрастної речовини вказане утворення з ознаками уповільненого та значно зниженого накопичення контрасту, яке зберігається на відтермінованих зображеннях, що характерно для аденоми. Латеральний контур аденоми досягає медіального контура інтракавернозного сегмента внутрішньої сонної артерії (ВСА) праворуч, але ознак компресії артерії та інвазії процесу в кавернозний синус не виявлено, медіальний контур аденоми пролабує в супраселярну цистерну, стебло гіпофіза деформоване, з девіацією ліворуч. Без відхилень від норми визначаються ділянки перехресту зорових нервів та надсідлоподібної цистерни підоболонкового простору, заповненого спинномозковою рідиною. Кавернозний синус, кавернозний відділ ВСА без видимих змін. Прилеглі відділи головного мозку не змінені.
Проведено додаткові діагностичні дослідження.
Аналіз крові: тиреотропний гормон (ТТГ) — 1,34 мОД/л (норма 0,4—4,0), тироксин вільний (Т4вільн.) — 1,42 нг/дл (норма 0,89–1,76), пролактин — 16,5 нг/мл (норма 2,8–29,2).
Загальний аналіз крові: еритроцити — 4,44 × 1012/л, гемоглобін — 139 г/л, гематокрит — 37,1, тромбоцити — 215 × 109/л, лейкоцити — 3,2 × 109/л, швидкість осідання еритроцитів — 10 мм/год.
Біохімічний аналіз крові: загальний білок — 69,3 г/л (норма 65–86), сечовина — 3,4 ммоль/л (норма 2,1–8,2), креа–тинін — 112 мкмоль/л (норма 71–115), холестерин загальний — 4,61 ммоль/л, білірубін загальний — 20,0 мкмоль/л (норма 0–21), аланінамінотрансфераза — 12,8 о/л (норма 0–45), аспартатаміно–трансфераза — 14,9 о/л (норма 0–40), глюкоза — 4,8 ммоль/л.
Електрокардіографія: синусова аритмія із схильністю до сповільнення частоти серцевих скорочень (ЧСС). Електрична вісь серця відхилена вліво. Порушення провідності за правою ніжкою пучка Гіса. Помірні зміни міокарда. Не виключена гіпертрофія лівого шлуночка.
Рентгенографія органів грудної клітки: інфільтративно-вогнищевої патології не виявлено.
Дослідження функції зовнішнього дихання: нормальна спірометрія.
Ультразвукове дослідження (УЗД) щитоподібної залози: щитоподібна залоза розташована в типовому місці, збільшена за рахунок обох часток. В обох частках визначаються утворення: у правій частці — множинні, розмірами від 4 до 11 мм, у лівій частці — 4, розмірами від 5 до 12 мм, правильної форми, з чіткими межами. Тканина утворень ізоехогенна. Ехоструктура неоднорідна за рахунок ділянок кістоподібної дегенерації. Інша тканина залози помірно гіпоехогенна. Ехоструктура неоднорідна за рахунок наявності множинних дрібних анехогенних включень. Регіонарні лімфатичні вузли не візуалізуються. Сумарний об’єм за методом Brunn (см3) — 18,89. Права частка — 9,61 см3, ліва частка — 9,28 см3. Висновок: ехографічна картина змішаного зоба ІІ ступеня.
УЗД органів черевної порожнини: УЗ-ознаки хронічного холециститу, хронічного панкреатиту.
На основі результатів лабораторних та інструментальних досліджень встановлено клінічний діагноз «ендосупраселярна СТГ-продукуюча аденома гіпофіза. Синдром акромегалії. Змішаний зоб ІІ ст. Еутиреоз».
Зважаючи на наявність об’ємного утворення, з найбільшою ймовірністю аденоми гіпофіза (соматотропіноми), та враховуючи результати обстеження, пацієнтка направлена на консультацію до нейрохірурга з метою хірургічного лікування. 8.08.2017 року проведено трансназальне транссфеноїдальне ендокапсулярне видалення аденоми гіпофіза. Патогістологічний висновок: морфологічна картина відповідає ацидофільній аденомі гіпофіза. Післяопераційний період — без особливостей. Медикаментозне лікування не призначено.
Через 3 міс. (листопад 2017 р.) після оперативного втручання пацієнтка пройшла контрольне обстеження. Результати лабораторних досліджень: СТГ — 0,4 нг/мл, ІФР-1 — 204 нг/мл (норма 36–200), ТТГ — 0,9 мОД/л (норма 0,4–4,0), Т4вільн. — 0,8 нг/дл (норма 0,89–1,76), пролактин — 5,4 нг/мл (норма 2,8–29,2), кортизол — 8,6 мкг/дл (норма 4,3–22,4). МРТ гіпофіза: турецьке сідло сплощене, розміри в межах норми. Патологічних об’ємних утворень у гіпофізарній зоні не виявлено. Гіпофіз розташований на дні турецького сідла, злегка деформований. Розміри гіпофіза — 3,8 × 12,0 × 10 мм. Воронка злегка відхилена вліво. Надселярна група цистерн без особливостей. Хіазма не змінена. Параселярні структури без особливостей. Висновок: стан після трансназальної транссфеноїдальної аденомектомії ендосупраселярної аденоми гіпофіза. Враховуючи виявлення у хворої вторинного гіпотиреозу, призначено L-тироксин 50 мкг/добу.
Восени 2019 року пацієнтка почала відмічати повернення симптомів: головний біль, збільшення розмірів стоп, виражена слабкість, підвищена втомлюваність. Приймає 50 мкг/добу L-тироксину. При лабораторному обстеженні: СТГ — 3,3 нг/мл, ІФР-1 — 288,4 нг/мл (норма 36–200), ТТГ — 0,6 мОД/л (норма 0,4–4,0), Т4вільн. — 1,2 нг/дл (норма 0,89–1,76), пролактин — 6,2 нг/мл (норма 2,8–29,2), кортизол — 5,1 мкг/дл (норма 4,3–22,4). При проведенні МРТ головного мозку виявлено ознаки рецидиву аденоми гіпофіза: у селярній ділянці візуалізується утворення неправильної форми 7 × 4 × 6 мм. У плановому порядку в січні 2020 року пацієнтці проведено повторне трансназальне транссфеноїдальне видалення аденоми гіпофіза. Операція та післяопераційний період — без особливостей. Пацієнтка продовжувала приймати L-тироксин 50 мкг/добу.
У зв’язку з епідеміологічною ситуацією контрольне обстеження пацієнтка пройшла в червні 2020 року та звернулася за консультацією в НДІ ендокринології та обміну речовин ім. В.П. Комісаренка.
Об’єктивний статус: ріст — 167 см, маса тіла — 84 кг, індекс маси тіла — 30,1 м2/кг. Тілобудова нормостенічна. Підвищеного харчування. Шкіра помірної вологості. Язик вологий, збільшений в розмірах, з відбитками зубів. Кістково-суглобовий апарат: збільшені лобні горби, вилицеві дуги, прогнатизм, діастема на верхній і нижній щелепах, збільшені ступні та кисті. Щитоподібна залоза ІІ ст., неоднорідна. Дихання везикулярне. Тони серця звучні. ЧСС — 88 уд/хв. Артеріальний тиск — 130/80 мм рт.ст. Живіт м’який, безболісний. Екзофтальму немає. Очні симптоми негативні.
Результати лабораторних досліджень. Аналіз крові: СТГ — 5,09 нг/мл, ІФР-1 — 465,7 нг/мл (норма 36–200), ТТГ — 0,4 мОД/л (норма 0,4–4,0), Т4вільн. — 0,98 нг/дл (норма 0,89–1,76), пролактин — 5,1 нг/мл (норма 2,8–29,2), кортизол — 6,0 мкг/дл (норма 4,3–22,4), гемоглобін — 5,4 %, глюкоза — 4,93 ммоль/л. Аналіз добової сечі на кортизол — 64 мкг/добу (норма 58–403).
Консультація невропатолога: дисциркуляторна енцефалопатія ІІ ст., астеноневротичний, цефалгічний, вестибулоатаксичний синдроми. Поширений остеохондроз хребта.
Консультація окуліста: ангіопатія сітківки обох очей.
Консультація гінеколога: менопауза.
Консультація кардіолога: ішемічна хвороба серця: стабільна стенокардія напруги 2-го функціонального класу (ФК). Атеросклеротичний кардіосклероз, атеросклероз аорти. Гіпертонічна хвороба 2-ї стадії, 2-й ступінь, ризик 3 (високий). Серцева недостатність (СН) І.
Діагноз: рецидив аденоми гіпофіза (соматотропіноми). Акромегалія, пухлинна стадія, активна форма. Стан після повторних операцій з приводу аденоми гіпофіза (2017, 2020 р.). Післяопераційний гіпопітуїтаризм: вторинний гіпотиреоз у стані медикаментозної компенсації. Змішаний зоб ІІ ст. Ішемічна хвороба серця: стабільна стенокардія напруги 2-го ФК. Атеросклеротичний кардіосклероз, атеросклероз аорти. Гіпертонічна хвороба 2-ї стадії, 2-й ступінь, ризик 3 (високий). СН І. Дисциркуляторна енцефалопатія ІІ ст., астеноневротичний, цефалгічний, вестибулоатаксичний синдроми. Поширений остеохондроз хребта. Хронічний холецистит в стадії ремісії. Хронічний панкреатит в стадії ремісії.
Враховуючи прогресування хвороби, збереження гіперсоматотропінемії, пацієнтці рекомендовано лікування аналогами соматостатину. Проведено триденний тест з аналогом соматостатину короткої дії (октреотид 1,0 підшкірно 3 р/добу) з подальшим контрольним визначенням рівнів СТГ та ІФР-1. Враховуючи позитивний результат триденного тесту з октреотидом (зниження рівня ІФР-1 з 465,7 — 15.06.2020 р. до 267 — 25.06.2020 р.), пацієнтці рекомендована тривала супресивна терапія пролонгованим аналогом соматостатину (ланреотид) — 120 мг підшкірно 1 раз на 28 днів під контролем СТГ та ІФР-1. Також рекомендовано продовжити прийом тироксину в дозі 50 мкг/добу за 30 хв до сніданку.
Не менш складною є ситуація при орфанних спадкових синдромах поєднаного пухлинного ураження різних ендокринних залоз — множинних ендокринних неоплазіях (МЕН, поліендокринопатії). Виділяють такі форми синдромів: МЕН1, МЕН2А (4 варіанти), МЕН2В, МЕН4, хвороба фон Гіппеля — Ліндау (ФГЛ), нейро–фіброматоз 1-го типу, комплекс Карнея та синдром Макк’юна — Олбрайта.
Множинна ендокринна неоплазія 1-го типу (МЕН1) — ендокринний пухлинний синдром, викликаний інактивуючими мутаціями пухлинного гена-супресора МЕN1 у 11q13 локусі. Успадковується автосомно-домінантно, але також може виникати спорадично (без сімейного анамнезу) як результат нових мутацій. МЕН1 характеризується комбінацією паратиреоїдних пухлин, пухлин острівцевих панкреатичних клітин і пухлин аденогіпофіза. Більшість МЕН1 пухлин неагресивні, багато з них мають тривалий повільно прогресуючий розвиток, залишаючись безсимптомними роками. Але пацієнти з нелікованою МЕН1 мають зменшену тривалість життя з 50% ймовірністю смерті до 50 років [7].
Первинний гіперпаратиреоз внаслідок гіперплазії і/або аденоми прищитоподібних залоз — найбільш частий прояв МЕН1 і виникає у близько 90 % пацієнтів [8]. Первинний гіперпаратиреоз при МЕН1 має тривалий безсимптомний перебіг і зазвичай діагностується як випадкова знахідка підвищеного рівня паратгормона у плазмі у пацієнтів з гіперкальціємією і, у деяких випадках, з нормокальціємією. Клінічні прояви можуть включати гіперкальціємію, нефролітіаз, порушення будови кісткової тканини (генералізована фіброзна остеодистрофія). Первинний гіперпаратиреоз у складі МЕН1 відрізняється від не-МЕН1 первинного гіперпаратиреозу [9]:
- молодший вік початку захворювання (20–25 років);
- залученість декількох прищитоподібних залоз;
- високий рівень рецидиву гіперкальціємії після паратиреоїдектомії (50 % через 8–12 років після оперативного втручання).
Пухлини острівцевих клітин підшлункової залози являють собою другий найбільш частий прояв МЕН1, виникаючи у 30–80 % пацієнтів, та можуть бути представлені такими варіантами [7]:
- гастриноми;
- інсуліноми;
- глюкагономи;
- вазоактивні інтестинальні поліпептидоми (ВІП);
- панкреатичні поліпептидоми.
Для цих пухлин характерна мультицентричність і здатність проходити злоякісне переродження. Найчастіше пухлини підшлункової залози у складі МЕН1 є гормонально неактивними. Вони або не виділяють гормони, або виділяють гормонально неактивні пептиди, такі як панкреатична поліпептидаза, хромогранін А, нейротензин, нейрон-специфічна енолаза, або грелін. Гормонально неактивні пухлини підшлункової залози, особливо малого розміру (< 2 см), складно діагностувати стандартними візуалізаційними методами. В таких випадках є ефективним чутливий радіологічний скринінг. Вчасна діагностика цих пухлин дуже важлива, тому що до віку 80 років пенетрантність панкреатичних пухлин становить більше 80 %, а найбільш частою причиною смертності, пов’язаної з МЕН1, є метастатичне ураження [10, 11].
Гастриноми — найбільш часті серед гормонально активних панкреатичних нейроендокринних пухлин і виникають у 40–55 % пацієнтів [12]. Розвитку гастрином передує багатофокусна гіперплазія гастрин-продукуючих клітин. Порівняно з не-МЕН1 гастриномами при синдромі Золлінгера — Еллісона (ЗЕС) гастриноми при МЕН1 часто невеликого розміру (< 0,5 см), мультицентричні і локалізовані у дванадцятипалій кишці, що зменшує ймовірність успішного хірургічного лікування. Близько 20–30 % пацієнтів із ЗЕС мають МЕН1. Серед пацієнтів із МЕН1 ЗЕС з’являється тільки у пацієнтів з первинним гіперпаратиреозом [7]. Тривала МЕН1 і ЗЕС можуть призвести до розвитку карциноїдних пухлин шлунка, які можуть бути високоагресивними [13].
Інсуліноми — на другому місці за частотою з гормонально активних панкреатичних нейроендокринних пухлин при МЕН1. Вони розвиваються у молодому віці (< 35 років) у близько 10–30 % пацієнтів. Інсуліноми при МЕН1 можуть маніфестувати як одиничні макроаденоми підшлункової залози (> 2 cм) або, частіше, як множинні мікроаденоми (< 2 см), розкидані по всій підшлунковій залозі [14]. Інсуліноми можуть бути мультицентричними і метастазувати у регіонарні лімфовузли або печінку [7].
Глюкагономи у пацієнтів з МЕН1 виникають рідко (< 3 %) і можуть перебігати без змін вуглеводного обміну або з гіперглікемією. У деяких пацієнтів спостерігається типове ураження шкіри, відоме як некролітична мігруюча еритема. Іншими симптомами можуть бути: анемія, стоматит, втрата ваги, але часто вони відсутні.
У менше 1 % пацієнтів з МЕН1 у підшлунковій залозі виникають ВІП, пухлини, що секретують панкреатичний поліпептид, та пухлини, що виділяють гормон росту [7].
МЕН1-асоційовані пухлини аденогіпофіза найбільш часто секретують пролактин (60 %) і гормон росту (25 %). Менше ніж 5 % секретують кортикотропін, інші пухлини гормонально неактивні [7]. Порівняно з не-МЕН1 пухлинами аденогіпофіза МЕН1 пухлини аденогіпофіза є більшими (макроаденоми) і більш агресивними, з більшим рівнем інфільтрації пухлинних клітин у нормальну тканину аденогіпофіза. МЕН1-асоційовані пухлини аденогіпофіза важче піддаються лікуванню. При цьому вираженої гістологічної різниці між МЕН1 і не-МЕН1 пухлинами аденогіпофіза немає [15].
Також у пацієнтів з МЕН1 можуть виникати карциноїдні пухлини у бронхах, шлунково-кишковому тракті, підшлунковій залозі та тимусі. Карциноїд тимуса, асоційований з МЕН1, часто гормонально неактивний і високоагресивний [16]. Карциноїди можуть активно секретувати серотонін, соматостатин, кортикотропін і гормон росту.
Для МЕН1 характерні шкірні прояви. Підшкірні ліпоми виявляються у третини пацієнтів з МЕН1. Ці новоутворення мають втрату гетерозиготності у сегменті 11q12-12 і асоційовані з дефективним функціонуванням глобулярного протеїну. Ліпоми при МЕН1 можуть бути ретроперитонеальними, вісцеральними або плевральними. Наявність ангіофібром і колагеном на обличчі може дозволити досимптомне встановлення діагнозу МЕН1 у родичів пацієнта із встановленим діагнозом [7].
Пухлини надниркових залоз виникають у 20–40 % пацієнтів з МЕН1. Ці пухлини, як правило, доброякісні і представлені гормонально неактивними кортикальними аденомами або дифузною чи нодулярною гіперплазією [17, 18]. Адренокортикальні карциноми при МЕН1 зустрічаються рідко.
Аденома щитоподібної залози зустрічається у 5–30 % пацієнтів і не має специфічних, пов’язаних з МЕН1 ознак.
Зустрічаються менінгіоми та інші пухлини центральної нервової системи.
Нейроендокринна пухлина тимуса — рідкісний (3,7 % пацієнтів з МЕН1), але фатальний компонент МЕН1, на рахунку якого майже 20 % МЕН1-асоційованої смертності [19].
Ген, який відповідає за розвиток МЕН1, локалізований у сегменті 11q13 і кодує білок менін. Менін задіяний у регуляції транскрипції і геномної стабільності. Втрата гетерозиготності цієї ділянки асоційована з МЕН1, що дає підстави вважати, що ген чинить пухлиносупресорну функцію. Пацієнти успадковують одну мутовану копію гена, і їм залишається отримати соматичну мутацію другої копії для розвитку пухлини. МЕН1 — автосомно-домінантне захворювання, але спорадичні мутації виникають також. Ідентифікація і генетична характеристика причинного гена відкрили можливість генетичного тестування і ранньої діагностики захворювання. Аналіз послідовності у гені МЕN1 для виявлення мутацій забезпечує найточніше підтвердження статусу носія гена. З розвитком нових технологій, таких як мультиплексна ампліфікація лігованих зондів (MLPA), були відкриті нові мутації у гені МЕN1, що підвищує чутливість генетичного аналізу. В минулому генетичне тестування не знаходило мутації МЕN1 у 10–30 % пацієнтів, в яких були клінічні критерії для діагнозу МЕН1 (наявність щонайменше двох МЕН1-асоційованих пухлин: первинний гіперпаратиреоз, дуоденопанкреатичні нейроендокринні пухлини, пухлини аденогіпофіза) [20]. Таких пацієнтів називають фенокопіями. Наявність фенокопії передбачається при негативному тесті МЕN1 за послідовністю, генною дозою й аналізом гаплотипу 11q13. Фенокопії нараховують до 5 % МЕН1-подібних випадків, у більшості випадків пов’язані з захворюваннями прищитоподібних залоз та аденогіпофіза [21].
Відповідно до даних рандомізованих досліджень, частота МЕН1 становить від 1 випадку на 10 000 чол. до 1 випадку на 100 000 чол. [7, 22]. Характерне формування географічних кластерів як наслідок ефекту засновників (у популяційній генетиці — явище втрати генетичної мінливості при формуванні нової популяції невеликою кількістю людей з більшого числа населення) [23]. Ген МЕН1 має високу пенетрантність. До віку 20 років ген пенетрантний у 50 % і до віку 40 років пенетрантний у 95 %. Не було ідентифіковано випадків типових ознак, асоційованих зі статусом носія гена МЕН1 у пацієнтів молодше 5 років, таким чином, ген не пенетрантний до цього віку [7, 8].
Тактика лікування при МЕН1 залежить від наявних ендокринопатій і стратифікації ризиків. Основним методом лікування пацієнтів з МЕН1 є хірургічне видалення пухлин, у низці випадків показані превентивні втручання [24].
Неліковані пацієнти з МЕН1 мають знижену тривалість життя з 50% ймовірністю смерті до 50 років. Причини смерті пов’язані зі злоякісними пухлинами або наслідками ендокринних порушень [7]. Злоякісні нейроендокринні пухлини підшлункової залози або карциноїдні пухлини тимуса пов’язані зі зростанням ризику смерті у пацієнтів з МЕН1. Близько 70 % пацієнтів з МЕН1 помирають від причин, прямо пов’язаних з МЕН1 [12].
Синдром множинної ендокринної неоплазії 2-го типу (МЕН2) — спадкове захворювання, що характеризується розвитком медулярної карциноми щитоподібної залози, пухлин прищитоподібних залоз і феохромоцитоми. МЕН2 виникає внаслідок мутацій у RET-протоонкогені і передається автосомно-домінантно.
Є два синдроми МЕН2 — МЕН2А і МЕН2В (раніше мав назву МЕН3).
МЕН2А далі класифікується на 4 варіанти, відповідно до наявності її складових. Класична МЕН2А характеризується медулярною карциномою щитоподібної залози, первинним гіперпаратиреозом і феохромоцитомою. Три додаткові варіанти становлять: МЕН2А з вузликовим амілоїдозом шкіри, МЕН2А з хворобою Гіршпрунга і сімейна медулярна карцинома, яка діагностується, коли у пацієнта є патологічний RET геном, і медулярна карцинома, але у сімейному анамнезі відсутня феохромоцитома або гіперпаратиреоз [25].
МЕН2В менш часта, ніж МЕН2А, нараховуючи 5 % випадків МЕН2. Вона характеризується більш агресивною медулярною карциномою (яка виникає у 100 % випадків), феохромоцитомою (50 %), мукозними невромами (95–98 %) і гангліоневромами (40 %). Гіперпаратиреоз відсутній. Крім того, майже в усіх пацієнтів виявляється марфаноїдна тілобудова: високе піднебіння, лійкоподібна деформація грудної клітки, високе склепіння стоп, сколіоз, виступаючі губи. Часто виникають невроми на повіках, кон’юнктиві, слизовій носа та гортані, язику та губах [26].
Медулярна карцинома розвивається фактично в усіх пацієнтів з МЕН2. Найчастіше це перший прояв синдрому, який виникає впродовж першої — третьої декади життя. У пацієнтів з МЕН2А медулярна карцинома, як правило, двостороння і багатофокусна, її розвитку передує гіперплазія С-клітин на відміну від спорадичної медулярної карциноми, яка є односторонньою [27].
Обґрунтування генотип-фенотипової кореляції спадкової медулярної карциноми може скерувати розвиток індивідуального підходу до оцінки і контролю ризиків у дітей-носіїв генотипу. Для довгострокового запобігання розвитку медулярної карциноми у пацієнтів з МЕН2 є ефективною рання тотальна тиреоїдектомія [28–30].
Феохромоцитоми присутні у близько половини МЕН2А пацієнтів. Вони двосторонні у 60–80 % випадків, в той час як спорадичні феохромоцитоми двосторонні у 10 %. Феохромоцитоми діагностуються одночасно з медулярною карциномою або через декілька років. Феохромоцитоми у складі МЕН2А майже завжди доброякісні. Але вони можуть спричиняти загрозливі для життя гіпертонічні кризи або напади аритмії.
Гіперпаратиреоз присутній у близько половини пацієнтів з МЕН2А, але виявляється рідше, ніж феохромоцитоми. Найчастіше проявляється у пацієнтів після 30 років. Гістологічно прищитоподібні залози при МЕН2А складаються з гіперплазованих головних клітин, ця гіперплазія є асиметричною відносно розмірів прищитоподібної залози. Спостерігається підвищена частота додаткових прищитоподібних залоз [31]. Персистуючий або рецидивуючий гіперпаратиреоз не характерний для МЕН2А на відміну від пацієнтів з МЕН1.
МЕН2 спричиняють мутації у трансмембранному протоонкогені RET, локалізовані у 10q11.21. Функція білка, закодованого RET, залишається невизначеною, але відомо, що він є важливим під час ембріонального розвитку нервової системи кишечника і нирок. RET складається з 3 доменів, включаючи домен цистеїнвмісного позаклітинного рецептора, гідрофобний трансмембранний домен і внутрішньоклітинний тирозинкіназний каталітичний домен [32, 33].
Позаклітинний домен взаємодіє з одним з чотирьох лігандів, відомих сьогодні. Ці ліганди — гліальна клітинна лінія — похідне нейротропного фактора (GDNF), нейротурин, персефін і артемін — також взаємодіють з одним з чотирьох корецепторів сімейства рецепторів GDNF-альфа. GDNF відіграє важливу роль у нормальному функціонуванні шляхів, задіяних у нейрогенезі нервової системи кишечника і нирковому органогенезі. Тирозинкіназний каталітичний центр знаходиться у внутрішньоклітинному домені і викликає низхідні сигнальні впливи через різні молекули — вторинні месенджери [34].
Точкові мутації, асоційовані з МЕН2А і її підтипом сімейною медулярною карциномою, ідентифіковані в екзонах 10 і 11. Доведена генотипно-фенотипна кореляція. Класична МЕН2А асоційована з міссенс-мутацією зародкової лінії у кодонах 609, 611, 618 або 620 екзона 10 або кодона 634 екзона 11 у RET-протоонкогені. МЕН2А з вузликовим амілоїдозом шкіри майже завжди асоційована з мутацією кодона 634, в той час як пацієнти з МЕН2А і хворобою Гіршпрунга типово мають мутації у екзоні 10 RET [35].
Є дані, що пацієнти з мутацією у кодоні А883F мають більш латентний розвиток захворювання порівняно з носіями M918T з більш пізньою маніфестацією феохромоцитом [36].
Близько 75 % випадків МЕН2В спорадичні, і пацієнти мають RET-мутації de novo, в той час як 25 % випадків виникають в родинах з проявами МЕН2В в минулому або в даний час. Майже 95 % пацієнтів з МЕН2В мають мутацію зародкової лінії RET в екзоні 16 (кодон M918T) і менше ніж 5 % мають мутацію зародкової лінії RET в екзоні 15 (кодон A883F) [25].
Загальна частота МЕН2 становить 1 випадок на 30 000–50 000 чол. [37, 38].
Найбільш частими видами МЕН2 є MEН2A, MEН2A з сімейною медулярною карциномою і МЕН2B.
Серед пацієнтів із МЕН2А з мутацією гена RET до 50 років захворювання виявляється у 50 %, і до 70 років захворювання розвивається у 70 %. Медулярна карцинома у пацієнтів з МЕН2В зустрічається у ранньому дитячому віці.
Лікування МЕН2 хірургічне. До проведення паратиреоїдектомії або тиреоїдектомії обов’язково потрібно виключити феохромоцитому. Якщо феохромоцитома діагностована, втручання з її приводу проводиться першочергово, з огляду на можливу гемодинамічну нестабільність [39, 40]. При метастатичних ураженнях можуть бути застосовані інгібітори тирозинкінази.
При МЕН2 раннє лікування медулярної карциноми щитоподібної залози може запобігти смерті, а ретельний моніторинг феохромоцитоми може зменшити ризик гіпертензивних кризів. Враховуючи, що пенетрантність медулярної карциноми при МЕН2 становить близько 100 %, у пацієнтів з високим ризиком мутацій RET профілактична тиреоїдектомія показана у немовлячому віці, а у дітей з виявленими мутаціями RET — до 5-річного віку [41, 42].
МЕН4 має клінічні прояви, подібні до МЕН1, але викликана мутаціями у іншому гені. Найбільш типовим проявом МЕН4 є гіперпаратиреоз, на другому місці — пухлини аденогіпофіза. Ризик розвитку панкреатичних нейроендокринних пухлин у пацієнтів з МЕН4 значно нижчий, ніж у пацієнтів з МЕН1 [43].
При МЕН4 виникають мутації у гені циклінзалежного інгібітора кінази (CDKN1B). Цей ген відповідає за синтез білка p27. Як і менін (який кодується геном МЕN1), р27 — пухлинний супресор, що допомагає контролювати ріст і ділення клітин. Мутації у гені CDKN1B зменшують кількість функціонуючого р27, що призводить до безконтрольного росту та розмноження клітин. Таке некероване ділення клітин може призвести до розвитку пухлин в ендокринних залозах та інших тканинах.
Задокументовано 12 підтверджених випадків МЕН4, за розрахунковими даними, її частота у загальній популяції може складати менше 1 випадку на 1 млн чол.
Хвороба фон Гіппеля — Ліндау — рідкісне генетичне захворювання, що характеризується вісцеральними кістами і доброякісними пухлинами у багатьох органах, які мають потенціал до злоякісного переродження. Клінічні прояви хвороби ФГЛ включають розвиток гемангіом сітківки та центральної нервової системи, феохромоцитом, множинних кіст у підшлунковій залозі та нирках і підвищений ризик трансформації ниркових кіст у рак нирки [44, 45]. Широкий діапазон віку і різноманітність форм, у яких проявляється хвороба ФГЛ, утруднює діагностику і лікування уражених пацієнтів, а також їх родичів. Гемангіоми сітківки діагностуються у 50 % пацієнтів з хворобою ФГЛ. Пухлини центральної нервової системи та інших органів виникають у 25 % пацієнтів з хворобою ФГЛ. Пацієнти з хворобою ФГЛ мають підвищений ризик розвитку феохромоцитом, які можуть бути двосторонніми. Феохромоцитоми виникають у 10–50 % пацієнтів з хворобою ФГЛ, залежно від субтипу, обумовленого видом мутації у причинному гені. Більшість (70 %) панкреатичних уражень є простими кістами і рідко бувають з клінічними проявами або перероджуються у злоякісні пухлини.
Хвороба ФГЛ успадковується автосомно-домінантно. Нові мутації виникають у близько 1 : 4,4 мільйона новонароджених і становлять 20 % випадків. Загальна частота хвороби ФГЛ у світі 1 : 32 000 новонароджених, у США — 1 : 36 000 новонароджених. Вік встановлення діагнозу коливається від раннього дитячого до 60–70 років і в середньому становить 26 років [46].
Ген фон Гіппеля — Ліндау — VHL, розміщений на короткому плечі 3-ї хромосоми (3р25.3) і кодує широко експресовану іРНК, що кодує 3 екзони з альтернативним сплайсингом [47]. У результаті два синтезовані білки фон Гіппеля — Ліндау (pVHL), 30 кДа форма (30р) і 19 кДа форма (р19), становлять човниковий механізм між ядром та цитоплазмою, де вони утворюють комплекси з іншими білками. Ці білкові комплекси мають багато функцій: регуляція старіння, кисне-чутливий шлях, мікротубулярна стабільність та орієнтація, формування війок, цитокінова сигнальна система, збирання колагену IV типу у позаклітинному матриксі, регуляція збирання нормального позаклітинного фібронектинового матриксу і пухлинна супресія [46].
Середня тривалість життя у пацієнтів з хворобою ФГЛ становить 49 років, в основному через високу частоту асоційованого світлоклітинного раку нирки. Але ретельні обстеження, що дозволяють провести ранні втручання, можуть подовжити тривалість життя таких пацієнтів.
Нейрофіброматоз 1-го типу (НФ1) — мультисистемне генетичне захворювання, що характеризується шкірними проявами у вигляді плям кольору кави з молоком і пахвовим лентіго, кістковими дисплазіями й розвитком доброякісних і злоякісних пухлин нервової системи, найчастіше нейрофібром. Ендокринологічний інтерес у НФ1 являють собою феохромоцитоми, що зустрічаються у близько 5 % пацієнтів [48, 49].
НФ1 виникає внаслідок мутації або делеції у гені NF1. Нейрофібромін, який кодується геном NF1, є пухлинним супресором, зменшена продукція цього білка результує численними клінічними проявами [50].
Розрахункова частота НФ1 становить 1 випадок на 3000, але насправді може бути більшою через неповне виявлення легких форм захворювання. Близько половини пацієнтів є першим випадком у сім’ї як результат нової генетичної мутації [49].
Середня тривалість життя пацієнтів з НФ1 скорочується на 8 років порівняно з загальною популяцією [51].
Комплекс Карнея — автосомно-домінантний синдром, який проявляється плямистою пігментацією шкіри, ендокринопатіями, ендокринними та неендокринними пухлинами [52]. Ці пухлини включають міксоми шкіри, серця, молочних залоз та інших локалізацій: первинну пігментовану нодулярну адренокортикальну хворобу (PPNAD), псаммоматозні меланотичні шваноми; аденоми аденогіпофіза, що продукують гормон росту, тестикулярні пухлини клітин Сертолі, пухлини щитоподібної залози, аденоми проток молочних залоз, акромегалію внаслідок соматомамотрофної гіперплазії і аденом, незалежних від соматоліберину.
Комплекс Карнея успадковується автосомно-домінантно з варіативною пенетрантністю. Вважається, що кардіальні міксоми виникають з субендотендокардіальних мезенхімальних мультипотентних клітин-попередників. Комплекс Карнея виникає внаслідок мутацій у гені PRKAR1A, який кодує регуляторну субодиницю протеїнкінази А R1α [53]. PRKAR1A може відігравати роль гена — пухлинного супресора, регулюючи активність протеїнкінази А, що, у свою чергу, може стимулювати або пригнічувати ріст і диференціювання клітин. Гени комплексу Карнея асоційовані з геномною нестабільністю, клітинні лінії, отримані з пухлин комплексу Карнея, накопичують хромосомні перебудови, включаючи асоціації теломер і дицентричні хромосоми [54].
Пухлини первинної пігментованої нодулярної адренокортикальної хвороби характеризуються ліпофусцин-вмісними, кортизол-продукуючими вузлами, які оточені атрофованою адренокортикальною і нормальною адреномедулярною тканиною. Природа виникнення цих пухлин не зрозуміла [55]. Макроскопічно поверхня вкрита множинними маленькими вузликами чорного або коричневого кольору. Позапухлинна тканина кори надниркових залоз атрофічна. Мікроскопічно множинні вузлики визначаються в усій товщі кори. Клітини у цих вузликах позитивно фарбуються реактивом Шиффа. Поза корою відмічається інтенсивна –дезорганізація без нормального зонування.
У близько 75 % пацієнтів з комплексом Карнея зустрічається багатовузловий зоб.
З моменту виділення комплексу Карнея в окрему клінічну категорію в 1985 році цей діагноз був встановлений близько 600 пацієнтам у світі [56].
Середня тривалість життя пацієнтів з комплексом Карнея становить 50–55 років, 25 % смертності пацієнтів з цим синдромом обумовлені кардіальними міксомами. Тривалість життя таких пацієнтів може бути подовжена за умови регулярних обстежень і своєчасних втручань [57].
Синдром Макк’юна — Олбрайта діагностується за наявності щонайменше двох з трьох критеріїв: 1) поліоссальна фіброзна остеодисплазія; 2) пігментація шкіри у вигляді плям кольору кави з молоком; 3) автономна ендокринна гіперфункція (наприклад, гонадотропін-незалежне передчасне статеве дозрівання). Також можуть бути присутніми інші ендокринні синдроми, включаючи гіпертиреоз, акромегалію, синдром Кушинга, гіперпролактинемію, гіперпаратиреоз, гінекомастію та гіпофосфатемічну остеомаляцію [58].
Синдром Макк’юна — Олбрайта розвивається внаслідок постзиготичної активуючої мутації гена GNAS1 у локусі 20q13.1-13.2, який кодує протеїн G субодиниці Gs альфа в уражених тканинах. Клінічні прояви синдрому дуже варіативні, залежно від того, які з можливих компонентів домінують [59].
Синдром Макк’юна — Олбрайта — дуже рідкісне спорадичне захворювання. Його частота у популяції оцінюється між 1 випадком на 100 000 чол. і 1 випадком на 1 млн чол. [60].
Тяжкі випадки синдрому з залученням множинних ендокринних тканин розпізнаються у період новонародженості. Випадки синдрому Кушинга і гіпертиреозу також були зафіксовані у періоді новонародженості. Менш тяжкі форми проявляються у ранньому дитинстві — від 0,3 до 9 років. Аденоми гіпофіза, що продукують гормон росту і токсичні аденоми щитоподібної залози, внаслідок GNAS1-мутацій можуть виникати у будь-якому віці. Захворювання з більш пізнім дебютом асоціюються з клінічно більш латентними фенотипами [61].
На сьогодні лікування, спрямованого на причинну молекулярну проблему синдрому, немає. Застосовуються різні препарати для корекції різних ендокринних і метаболічних порушень, включаючи інгібітори ароматази, стероїди, аналоги соматостатину, агоністи дофаміну, бісфосфонати, антагоністи рецепторів естрогену, антитиреоїдні препарати.
При переломах кісток внаслідок диспластичного ураження показане хірургічне втручання. За наявності вузлового або багатовузлового зоба з тиреотоксикозом показане проведення гемітиреоїдектомії або тиреоїдектомії. Лікування синдрому Кушинга у складі синдрому Макк’юна — Олбрайта передбачає двосторонню адреналектомію з подальшою стероїдною замісною терапією [62].
Окремо від невеликої підгрупи пацієнтів з підвищеною періопераційною летальністю і зі злоякісними новоутвореннями, синдром Макк’юна — Олбрайта не пов’язаний з підвищеною смертністю. Захворюваність і втрата працездатності у таких пацієнтів можуть бути високими внаслідок хронічного болю і деформацій кісткової тканини, а також мультигормональних ендокринопатій. Таким чином, прогноз сильно залежить від проявів синдрому Макк’юна — Олбрайта [63].
Враховуючи, що МЕН є мультисистемними захворюваннями з низкою різноманітних проявів, тактика ведення таких пацієнтів є нестандартною і потребує мультидисциплінарного підходу.
Генетичне тестування — базовий елемент у діагностиці МЕН-синдромів. Генетичний скринінг мутацій проводиться у пацієнтів з відповідними клінічними критеріями. Якщо мутація ідентифікована, тим членам сім’ї, які знаходяться у зоні ризику, також проводиться скринінг. Ретельні динамічні обстеження пацієнтів з МЕН, а також безсимптомних носіїв дозволяють виявляти новоутворення на ранній досимптомній стадії і своєчасно провести оперативне лікування, що може зменшити ризик пов’язаної смертності.
Останнім часом прослідковується тенденція до збільшення частоти виявлення орфанних захворювань. Причиною даної ситуації може бути покращення методів лабораторної та інструментальної діагностики, використання генетичних методів діагностики й більш широка обізнаність лікарів щодо орфанних захворювань.
У хірургічному відділі ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України» з 1996 по 2020 р. з множинними ендокринними неоплазіями пройшли лікування 29 пацієнтів. З них МЕН1 була діагностована у 10, МЕН 2А — у 13, МЕН2В — у 5 і синдром фон Гіппеля — Ліндау — в 1 пацієнта.
У травні 2020 р. МОЗ України ініціювало ухвалення Національної стратегії з профілактики, діагностики й лікування рідкісних (орфанних) захворювань, що свідчить про визнання проблеми на державному рівні. Таким чином, визначено не тільки перелік орфанних захворювань, але й прийнято рішення щодо важливості лікування рідкісних (орфанних) захворювань і забезпечення пацієнтів життєво необхідними лікарськими засобами та спеціальним харчуванням. Для реалізації Національної стратегії важливим є збір статистичної інформації про орфанні захворювання в Україні, впровадження ефективних методів ранньої діагностики, лікування та реабілітації хворих, а також підготовка кваліфікованих фахівців. Шлях вирішення даного питання — це забезпечення доступу пацієнтів до високоспеціалізованої медичної допомоги, розробка вітчизняних стандартів з імплементацією міжнародних протоколів діагностики та лікування орфанних захворювань, проведення наукових досліджень у сфері рідкісних орфанних захворювань, а також поглиблення національної і міжнародної співпраці в питаннях тактики ведення пацієнтів з орфанними захворюваннями.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
Список літератури знаходиться в редакції

/8_m.jpg)
/9_m.jpg)