Вступ
Серед хронічної патології органів травлення у дітей одне з найбільш важливих місць на сучасному етапі займають запальні захворювання кишечника, частота яких за останні десятиліття стрімко зросла в усьому світі. Хвороба Крона (ХК) — хронічне імуноопосередковане гранулематозне запальне захворювання травного тракту, що може охоплювати всі його відділи, але найчастіше характеризується ураженням термінального відділу клубової кишки з розвитком ілеоколіту. За літературними даними, світова поширеність ХК у дітей і підлітків дещо варіює в різних країнах і становить від 1,5 до 11,4 випадку на 100 000 населення при загальній оцінці поширення 58 випадків на 100 000 населення [1, 2]. Віковий показник у Північній Америці для дітей віком 10–19 років становить приблизно 3,5 випадку на 100 000 населення. Єдине проспективне педіатричне епідеміологічне дослідження з Північної Америки показало, що частота поширеності хвороби Крона у штаті Вісконсин становила 4,56 випадку на 100 000 населення, що вдвічі більше, ніж показник виразкового коліту [3]. На сьогодні більшість дослідників вважають раннім дебютом захворювання вік молодше 20 років, причому зазначається, що чим раніше настала маніфестація патології, тим складнішим буде її перебіг. Доведено, що розвиток ХК у дитячому віці свідчить про агресивний фенотип захворювання і в останні роки є причиною відносного збільшення ризику розвитку раку та смерті [4, 5]. Важливим є також той факт, що останнім часом відзначається підвищення частоти розвитку хвороби Крона у структурі хронічних запальних захворювань кишечника вже в ранньому дитячому віці при відносно стабільній частоті захворюваності на виразковий коліт. Причини даної негативної динаміки на сьогодні, на жаль, залишаються невідомими. Водночас, згідно зі статистичними даними станом на 2014 рік, в Україні офіційно було зареєстровано менше 100 випадків хвороби Крона в дітей [6], що може свідчити про недостатній рівень діагностики даного захворювання в педіатричній практиці.
Клінічні особливості перебігу патології в дітей
Клінічна картина хвороби Крона в дітей характеризується хвилеподібним перебігом з чергуванням періодів загострень запального процесу та ремісії. До типових клінічних проявів захворювання в дітей відносяться: хронічна діарея (більше 6 тижнів), часто без видимих домішок крові у випорожненнях, абдомінальний біль, що нерідко пов’язаний з прийомом їжі, втрата маси тіла, відставання дитини в рості, наявність анемії (частіше залізодефіцитної), тривала або інтермітуюча лихоманка неясного генезу, наявність періанальних ускладнень [7]. Клінічна симптоматика при ХК може відрізнятися залежно від ступеня тяжкості захворювання та локалізації місця ураження. При ураженні тонкого кишечника у дитини будуть спостерігатися симптоми мальабсорбції та прояви білково-енергетичної недостатності. Локалізація запального процесу в шлунку та дванадцятипалій кишці на початкових етапах може давати клінічну картину хронічного езофагіту або гастродуоденіту. Досить часта локалізація ураження ілеоцекальної ділянки клінічно буде нагадувати картину гострого апендициту при загостренні хвороби Крона в дитини. Варто зазначити, що ХК нерідко має латентну маніфестацію, проявляючись лише затримкою фізичного розвитку дитини, інколи на перший план у клінічній симптоматиці виступають прояви ускладнень патології [8]. До найбільш частих ускладнень ХК відносяться: зовнішні та внутрішні нориці, інфільтрати черевної порожнини, міжкишкові та інтраабдомінальні абсцеси, стриктури кишечника з порушенням прохідності або без нього, анальні тріщини, парапроктит.
Однією з важливих відмінних особливостей, характерних для клінічного перебігу запальних захворювань кишечника (ЗЗК), але здебільшого саме для хвороби Крона, експерти вважають затримку лінійного росту дитини до пубертатного періоду [9]. Дану особливість на сучасному етапі можна пояснити наявністю в організмі дитини хронічного запалення, яке, на думку дослідників, спричиняє негативний вплив прозапальних цитокінів на зони росту кісткової тканини [10]. Максимальна маса кісткової тканини, що зазвичай досягається до кінця пубертатного періоду та виступає як запас кісткової тканини практично на все життя, у пацієнтів з хворобою Крона може зменшуватися майже вдвічі. Важливо відзначити, що відновлення лінійного росту та щільності кісткової тканини на сучасному етапі розглядається як добрий маркер контролю захворювання та успішності лікування, але, на жаль, навіть вчасно та правильно розпочата терапія не завжди дозволяє досягти даної мети. І, як наслідок, діти з хворобою Крона дуже часто не можуть досягти генетично детермінованого зросту та мають підвищений ризик переломів.
Клініцисту важливо пам’ятати, що клінічна картина ЗЗК може проявлятися не лише гемоколітом, але й багатьма позакишковими проявами, що в деяких випадках можуть бути виражені більшою мірою, ніж типові кишкові прояви. Основні позакишкові прояви ХК у дітей мають автоімунний характер та можуть бути пов’язаними (артропатії, артрити, вузловата еритема, афтозний стоматит, увеїт, іридоцикліт та ін.) та не пов’язаними (анкілозуючий спондиліт, первинний склерозуючий холангіт, остеомаляція, псоріаз) з активністю запального процесу. Варто зазначити, що автоімунні прояви, що не пов’язані з активністю запального процесу (наприклад, первинний склерозуючий холангіт), мають тенденцію до прогресування незалежно від перебігу основного захворювання та проведеної терапії і дуже часто визначають несприятливий прогноз хвороби Крона в дітей. Саме частота позакишкових проявів ХК, а також її доволі вагома асоціація з розвитком патології печінки зумовлюють необхідність ретельного обстеження пацієнтів для виявлення захворювання інших органів і систем [11, 12].
Діагностика
Згідно з рекомендаціями Європейського товариства дитячої гастроентерології, гепатології та харчування (ESPGAN) та Європейської організації з вивчення хвороби Крона і коліту (ECCO), діагноз будь-якого запального захворювання кишечника в дітей та підлітків має ґрунтуватися на комбінації даних анамнезу, результатах фізикального, лабораторного й інструментального обстеження [2]. Ретельно проведений фізикальний огляд є початковим етапом діагностичного пошуку в дітей із підозрою на хворобу Крона. Згідно з глобальними практичними рекомендаціями Всесвітньої гастроентерологічної асоціації, при загальному огляді пацієнта з імовірним запальним захворюванням кишечника варто звертати увагу на загальний стан обстежуваного, колір шкірних покривів, показники маси тіла та зросту, а також показники пульсу, артеріального тиску та температури тіла. При огляді черевної стінки звертають увагу на наявність розтягнень шкіри, напруженість м’язів, зміни кишкових звуків (у випадку обструкції), гепатомегалію. Особливим етапом обстеження має бути обов’язковий огляд періанальної ділянки: наявність тріщин, фістул, абсцесів та ін. Варто також брати до уваги високу частоту екстракишкових проявів ХК у дітей та проводити обстеження ротової порожнини, очей, шкірних покривів і суглобів. Згідно з критеріями, розробленими експертами ESPGAN, до обов’язкових скринінгових лабораторних маркерів при підозрі на ХК у дітей відносяться: розгорнутий аналіз крові з визначенням швидкості осідання еритроцитів (ШОЕ), гематокриту, визначення рівня альбумінів, С-реактивного білка, а також показників печінкового профілю (рівні аланінамінотрансферази, аспартатамінотрансферази, білірубіну та γ-глутамілтрансферази) для раннього виключення досить часто асоційованої патології печінки [2]. До обов’язкового обстеження при підозрі на ЗЗК слід віднести також визначення рівня сироваткового заліза, електролітів, показників коагулограми та аналіз калу на приховану кров (адже відомо, що для хвороби Крона досить типовим є тривалий діарейний синдром без наявності видимої крові у випорожненнях). Більш того, експерти вважають, що критично важливим є також виключення наявності кишкових інфекцій — Clostridium difficile, Salmonella, Shigella, Yersinia, Campylobacter. Проте вони зазначають, що виявлення патогена не обов’язково виключає наявність ЗЗК, адже маніфестація захворювання або його загострення можуть бути індуковані саме наявною в організмі дитини кишковою інфекцією [13].
Одним із найбільш значущих неінвазивних маркерів кишкового запалення є фекальний кальпротектин, визначення якого також входить до обов’язкового переліку обстежень згідно з рекомендаціями експертів ESPGAN [2]. На сьогодні все ще не існує ідеального порогового значення фекального кальпротектину для відображення запалення слизової оболонки та прогнозування результату захворювання. Його значення істотно відрізняються у різних дослідженнях з використанням різних еталонних стандартів. Згідно з результатами проведених педіатричних досліджень, у яких одночасно проводились ілеоколоноскопія та визначення рівня неінвазивного фекального маркера запалення для оцінки успіху індукційної терапії при запальних захворюваннях кишечника в дітей, саме показники кальпротектину від 150 до 250 мг/г свідчили на користь ендоскопічної ремісії захворювання. Варто зазначити, що референсні значення фекального кальпротектину мають істотні вікові відмінності. Показник фекального кальпротектину у здорових дітей віком до 1 року в нормі становить < 500 мкг/г випорожнень; від 1 до 4 років — < 100 мкг/г випорожнень; у дітей старше 4 років та дорослих — < 50 мкг/г випорожнень. Підвищення рівня фекального кальпротектину > 50 мкг/г випорожнень у дітей старше 4 років є індикатором для проведення діагностичного ендоскопічного дослідження. На сучасному етапі саме визначення рівня фекального кальпротектину залишається одним із вагомих показників проведення диференціальної діагностики між функціональною та органічною патологією кишечника [14]. Варто лише пам’ятати той факт, що даний фекальний маркер нейтрофільного запалення може дещо підвищуватися і при захворюваннях кишечника вірусної та бактеріальної етіології, а також при таких патологіях, як муковісцидоз і целіакія. Тому в діагностичному пошуку варто орієнтуватися не на якісні, а на кількісні значення його показника. На сучасному етапі як додатковий серологічний маркерів ЗЗК рекомендується також проведення обстеження на ASCA та pASCA (антинейтрофільні цитоплазматичні антитіла) та антитіла до пекарських дріжджів — Saccharomyces cerevisiae IgA та IgG, які в особливо складних випадках допоможуть провести диференціальну діагностику між хворобою Крона та виразковим колітом [15]. Переглянуті експертами ESPGAN критерії діагностики PORTO для верифікації ЗЗК у дітей передбачають обов’язкове обстеження на наявність первинного імунодефіциту у випадку ранньої маніфестації захворювання (до 2-річного віку).
Згідно з критеріями PORTO, що були розроблені з метою визначення обсягу діагностики при ЗЗК у дітей в 2005 році, до обов’язкових рекомендованих інструментальних методів діагностики відноситься проведення езофагогастродуоденоскопії з біопсією (не менше двох зразків із кожного сегмента шлунково-кишкового тракту), ілеоколоноскопії та обов’язкове забезпечення хорошої візуалізації тонкого кишечника при підозрі на хворобу Крона (МРТ, КТ або, за можливості проведення, капсульна ендоскопія) [7, 16]. При підозрі на ураження тонкого кишечника всім пацієнтам показано проведення МРТ-ентерографії або КТ-ентерографії, причому першій діагностичній процедурі віддається перевага у зв’язку з відсутністю променевого навантаження. Методика КТ дозволяє більш точно визначити товщину кишкової стінки, стан регіонарних лімфовузлів, виявити наявність абсцесів і нориць. При цьому використання МРТ дозволяє більш чітко виявити наявність параректальних і тазових ускладнень у пацієнтів з ХК. Ультразвукове дослідження органів черевної порожнини та позачеревного простору, органів малого таза має невеликі можливості щодо верифікації уражень кишечника, проте дозволяє виявити можливі ускладнення захворювання (утворення інфільтрату, абсцесу черевної порожнини, ураження печінки та підшлункової залози) [17].
При наявності періанальних уражень всім пацієнтам показано проведення трансректального ультразвукового або МРТ-дослідження прямої кишки, при виявленні зовнішніх нориць — виконання фістулографії. Проведення капсульної ендоскопії залишається остаточним методом верифікації захворювання, якщо після проведення ендоскопічного обстеження з використанням сучасних методів візуалізації діагноз все ще залишається остаточно не встановленим. Перед проведенням капсульної ендоскопії варто впевнитися у відсутності стриктур тонкого кишечника (за допомогою МР- або КТ-ентерографії) [18]. Одним із важливих і доступних в педіатричній практиці інструментальних методів залишається рентгенконтрастне дослідження кишечника, яке можливе лише за умови виключення кишкової непрохідності. Ураження ілеоцекального кута на рентгенівських знімках проявляється потовщенням ілеоцекального клапана з деформацією сліпої кишки. Частими ускладненнями хвороби Крона у дітей є рубцево-запальні стриктури, що рентгенологічно визначаються як симптом шнура або струни.
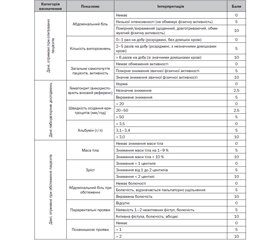
На сучасному етапі для оцінки активності хвороби Крона у дітей використовується розроблений в 1990 році індекс PCDAI (Pediatric Crohn’s Disease Activity Index), який розраховується в балах. До основних критеріїв, за якими проводиться оцінка, відносяться: наявність абдомінального болю як суб’єктивного відчуття дитини та абдомінального болю при проведенні клінічного обстеження, кількість випорожнень на добу, показники маси тіла та зросту дитини, наявність періанальних уражень і позакишкових проявів захворювання (шкірні висипи, артрит, увеїт та ін.), а також такі лабораторні показники, як рівень гемоглобіну/гематокрит, показники сироваткового альбуміну та ШОЕ (табл. 1). Оцінка показників коливається від 0 до 100 балів. При цьому показник від 10 до 30 балів свідчить про легкий ступінь перебігу захворювання, а показник вище 30 балів свідчить на користь середнього або тяжкого перебігу даної патології в дитини [19]. Використання даного індексу може бути корисним не лише на етапі встановлення діагнозу, але й під час контролю проводимої терапії. Згідно з оцінкою експертів, зниження PCDAI на 12,5 бала або більше після терапевтичного втручання точно відображає клінічно значущу відповідь.
/116.jpg)
Сучасні принципи терапії хвороби Крона в дітей
Метою лікування хвороби Крона в дітей є максимально швидке досягнення та максимально довга підтримка ремісії, забезпечення нормальних темпів росту і розвитку дитини, покращення якості життя, профілактика розвитку ускладнень патології та мінімізація виникнення можливих побічних ефектів при проведенні терапевтичних заходів. Вибір тактики лікування при ХК в педіатричній практиці за останні кілька років зазнав суттєвих змін і в цілому залежить від ступеня тяжкості захворювання та наявності у дитини ускладнень. На думку експертів ESPGHAN, вибір терапевтичної тактики має в першу чергу базуватися на розрахунку факторів ризику несприятливого перебігу патології в дитини. До можливих факторів ризику тяжкого перебігу відносяться: ендоскопічно виявлене глибоке виразкове ураження товстого кишечника, тотальне ураження тонкого кишечника, значна затримка лінійного росту дитини, стенозуючий або пенетруючий перебіг на момент маніфестації захворювання, тяжкий остеопороз, глибокі ураження періанальної ділянки та тривале збереження тяжкого перебігу патології навіть при наявності адекватної індукційної терапії [2]. На думку експертів, наявність хоча б одного з наведених факторів дозволяє з високою вірогідністю припустити негативний прогноз захворювання та є основою для вчасного проведення оптимізації лікування з раннім застосуванням препаратів, що мають виражений вплив на перебіг патології (стратегія раннього впровадження імуномодулюючої та біологічної терапії для індукування глибокої ремісії).
На сучасному етапі як терапія першої лінії для індукції ремісії при загостренні хвороби Крона та при первинно виявленому захворюванні у дітей розглядається застосування повного ентерального харчування (ПЕХ) (рівень доказовості 1; 96 % згодних). Згідно з даними проведених досліджень, рівень клінічної відповіді при застосуванні ПЕХ у дітей з хворобою Крона становить близько 80 % і подібний до ефективності застосування кортикостероїдів [20]. Однак варто зазначити, що на сучасному етапі відсутні вірогідні дані щодо ефективності застосування ПЕХ у дітей з ХК, що перебігає з тяжким ізольованим панколітом та ізольованим ураженням ротової порожнини і періанальної ділянки. До основних факторів, які на сучасному етапі впливають на вибір ПЕХ як терапії першої лінії у дітей, відносяться: усвідомлений вибір пацієнта (його родини), відсутність потенційних ускладнень при застосуванні кортикостероїдів, а також позитивний вплив даної лікувальної стратегії на покращення трофічного статусу та розвитку дитини. Тривалість ПЕХ при його застосуванні для індукції ремісії, згідно з рекомендаціями, становить від 6 до 10 тижнів. Клінічне поліпшення зазвичай настає протягом кількох днів, але альтернативна терапія має бути розглянута за відсутності відповіді на лікування протягом 2–4 тижнів. Вибір суміші при ПЕХ здійснюється між стандартними полімерними, спеціалізованими полімерними (імуномодулююча суміш Modulen IBD), що містять спеціальні протизапальні фактори, напівелементними (на основі гідролізатів білка (пептамен юніор)) та елементними формулами. На думку експертів, перевагу при ХК у дітей слід надавати спеціалізованим сумішам, які містять протизапальний трансформуючий фактор росту TGF-В2 (суміш Modulen IBD). Даний фактор відноситься до протизапальних цитокінів, що в нормі містяться у грудному молоці та беруть участь у регуляції та модуляції імунної відповіді, сприяють зниженню запального процесу та репарації пошкодженої тканини. Напівелементні та елементні суміші зазвичай мають перевагу лише в пацієнтів з доведеною непереносимістю білків коров’ячого молока. Згідно з думкою експертів, полімерні суміші є більш оптимальним вибором порівняно з елементними та напівелементними формулами, оскільки вони є економічно вигіднішим варіантом терапії та краще переносяться дітьми через свої смакові властивості [21, 22]. Харчова суміш при ПЕХ зазвичай вводиться через ротову порожнину, дробно, протягом доби. Годування через зонд або гастростому розглядається лише в крайніх випадках, може застосовуватись при абсолютній непереносимості смаку або неможливості отримання адекватної терапевтичної дози суміші при її введенні через рот. Експерти ESPGHAN пропонують поступове введення звичної їжі одночасно зі зменшенням об’єму формули для ПЕХ кожні 2–3 доби протягом 2–3 тижнів. Проведений аналіз 7 рандомізованих плацебо-контрольованих досліджень (РКД) Porto IBD Group та групою експертів ESPGHAN, в якому вивчались результати застосування повного ентерального харчування з метою індукції ремісії ХК у дітей, показав вірогідне покращення стану слизової оболонки кишечника, причому показники повного ендоскопічного загоювання варіювали від 20 до 87 % [23]. Згідно з результатами порівняльного метааналізу кількох проведених РКД щодо порівняння ефективності застосування ПЕХ і глюкокортикоїдів, до яких були включені 204 пацієнти віком від 4 до 18 років, застосування обох стратегій лікування ХК у дітей показало практично рівнозначну ефективність у досягненні індукції ремісії [24, 25]. Отримані результати проведених досліджень дозволяють зробити висновок, що за рахунок доведеного позитивного впливу на репарацію кишечника, більш швидкого відновлення мінералізації кісткової тканини та покращення темпів росту дитини з урахуванням практично повної відсутності побічних ефектів ПЕХ має значні переваги над терапією кортикостероїдами та повинно за можливості застосовуватися в усіх пацієнтів дитячого віку з ХК. Окремо також варто зазначити той факт, що часткове ентеральне харчування в жодному разі не рекомендується експертами ESPGHAN як індукція ремісії захворювання, але воно може сприяти подовженню досягнутої ремісії на фоні спеціалізованої дієти в дітей (рівень доказовості 2; 100 % згодних) [2].
Ще однією стартовою групою препаратів, рекомендованою на сьогодні експертами ECCO та ESPGHAN для індукції ремісії хвороби Крона у дітей, є глюкокортикоїди. Дана група препаратів рекомендована для застосування в пацієнтів із середньотяжкою та тяжкою формами захворювання, а також у випадку неможливості проведення ПЕХ (рівень доказовості 2 у дітей; 96 % згодних). На сучасному етапі перевага віддається пероральному прийому преднізолону (або його аналогів), рекомендована доза для прийому при загостренні ХК для більшості дітей становить 1 мг/кг (максимум до 40 мг/добу). При цьому при недостатній ефективності допускається лише максимальне підвищення дози до 1,5 мг/кг (до 60 мг/добу). У дітей з ураженням ілеоцекальної ділянки є доречним застосування будесоніду, який може значно знизити рівень можливих побічних ефектів системних глюкокортикоїдів (рівень доказовості 2 у дітей; 96 % згодних). Доза будесоніду у дітей практично не відрізняється від дози, що застосовується у дорослих пацієнтів, та становить 9 мг, при цьому для успішної індукції ремісії препарат застосовують як мінімум до чотирьох тижнів, а найбільш оптимальним є призначення його курсом до шести місяців, до повного досягнення ремісії захворювання. Дані щодо застосування глюкокортикоїдів при хворобі Крона в педіатричній практиці дещо обмежені у зв’язку з невеликою кількістю проведених РКД у дітей. Є результати кількох проведених РКД, які свідчать про те, що рівень досягнення ремісії після 30-денного курсу прийому глюкокортикоїдів у дітей з запальними захворюваннями кишечника коливався від 57 до 79 % [26, 27], в іншому дослідженні повідомлялось про досягнення рівня ремісії до 80 %, але зазначалося, що стан загоєння слизової оболонки кишечника був нижчим, ніж при застосуванні ПЕХ [28]. Виникнення основних побічних ефектів при застосування глюкокортикоїдів пропорційно дозі та тривалості курсу терапії. До основних побічних ефектів відносяться затримка лінійного росту, розвиток остеопорозу та зниження функції наднирників, яке може розвинутися вже після першого тижня лікування. З метою мінімізації побічних ефектів при застосуванні кортикостероїдів рекомендований однократний прийом добової дози в ранковий час та одночасний прийом препаратів кальцію та вітаміну D. Згідно з сучасними міжнародними рекомендаціями, категорично не рекомендується використання глюкокортикоїдів як підтримуючої терапії хвороби Крона у дітей.
Застосування антибіотиків при хворобі Крона у дітей на сучасному етапі рекомендовано лише при формі захворювання, що перебігає з періанальними ураженнями та формуванням фістул (рівень доказовості 3; 88 % згодних). Як можливі антибактеріальні засоби в дітей експертами ECCO та ESPGHAN пропонуються метронідазол (у дозі 10–20 мг/кг) та ципрофлоксацин (у дозі 20 мг/кг) (рівень доказовості 3 у дітей; 80 % згодних). Згідно з думкою експертів, антибіотикотерапія періанальних уражень при хворобі Крона в дітей дає хороший короткочасний ефект і може бути перехідним етапом перед призначенням імуносупресивної терапії. Існують дані проведеного дослідження застосування 8-тижневого курсу комбінації азитроміцину та метронідазолу в дітей із загостренням ХК (азитроміцин призначався однократно на добу в дозі 7,5–10 мг/кг курсом по 5 днів перші 4 тижні лікування, а потім 3 рази на тиждень протягом наступних 4 тижнів), що продемонстрували досягнення повної клінічної ремісії в 66 % пацієнтів, проте більшість з них мали легку форму захворювання [29].
До препаратів, що рекомендовані як один із варіантів терапії для підтримки ремісії ХК у дітей, що мають негативний прогноз захворювання, на сьогодні відносяться тіопурини (азатіоприн або 6-меркаптопурин) (рівень доказовості 2 в педіатрії; 96 % згодних). Тіопурини призначені для підтримання ремісії ХК, яка була досягнута на фоні терапії глюкокортикоїдами. Зазвичай тіопурини призначають уже на фоні зниження дози преднізолону, адже для досягнення максимального ефекту лікування може знадобитися від 8 до 14 тижнів. У пацієнтів без порушення метаболізму тіопуринів рекомендоване призначення азатіоприну в дозі 2,0–2,5 мг/кг. Повна доза тіопуринів призначається стартово без її поступового збільшення. Зниження дози може знадобитися у пацієнтів, які мають знижену активність тіопуринметилтрансферази, також дана група лікарських засобів може бути протипоказана пацієнтам з надзвичайно низьким рівнем ферменту. Застосування тіопуринів має відбуватися під ретельним контролем загального аналізу крові, зниження рівня лейкоцитів крові до 3000/мм2 є показанням для зменшення дози вдвічі. Протягом всього курсу лікування тіопуринами необхідний періодичний контроль загального аналізу крові, показників печінкових ферментів і стану підшлункової залози у зв’язку з наявністю побічних ефектів даної групи препаратів. На сучасному етапі є результати проведених досліджень як у дорослих, так і в дитячій популяції, які наочно свідчать на користь ефективності застосування тіопуринів для тривалої підтримки ремісії при хворобі Крона. Існують дані проведеного РКД, які демонструють зниження рецидивів ХК у дітей на 6-меркаптопурині порівняно з плацебо (9 проти 47 %) [27]. Крім того, деякі дослідники повідомляють про зменшення частоти хірургічних втручань у пацієнтів з ХК, які отримували азатіоприн [30]. На думку більшості експертів, у клінічній практиці необхідно ретельно зважувати як переваги від ефективності даної групи препаратів, так і можливі побічні ефекти та довгострокові ризики їх використання.
До альтернативних препаратів, що рекомендовані як один із варіантів терапії для підтримки ремісії ХК у дітей, можна також віднести метотрексат. Згідно з рекомендаціями експертів, даний препарат може використовуватися у дітей з ХК як препарат першої лінії для підтримки ремісії або при непереносимості застосування тіопуринів (рівень доказовості 4; погодилися 92 %). Метотрексат може бути хорошою альтернативою для терапії дітей з ХК, які мають супутні позакишкові прояви у вигляді артриту. Проведені дослідження щодо вивчення ефективності метотрексату для лікування ХК в педіатричній практиці свідчили про наявність 50–80% клінічної відповіді в дітей, які не реагували на терапію або мали непереносимість тіопуринів [31]. Метотрексат призначається у дозі 15 мг/м2 (максимальна доза — 25 мг) раз на тиждень під контролем загального аналізу крові та печінкових ферментів. Препарат зазвичай вводиться підшкірно, хоча дані щодо його пероральної доступності на сьогодні обговорюються і є суперечливими, його доцільно поєднувати з прийомом фолієвої кислоти.
Одним із відносно нових терапевтичних напрямків для індукції та підтримання ремісії при хворобі Крона як у дорослих, так і в дітей на сьогодні є застосування біологічних препаратів — антитіл до фактора некрозу пухлини альфа (анти-ФНП) [32]. Згідно з думкою експертів ECCO та ESPGHAN, анти-ФНП-терапія (із застосуванням імфліксимабу та адалімумабу) показана пацієнтам з хворобою Крона, якщо в них зберігається активність запального процесу, незважаючи на попередню терапію імуносупресивними препаратами та за наявності гормонорезистентності (рівень доказовості 2 в педіатрії; погодилися 100 %). Також на сьогодні більшість експертів рекомендують антицитокінову терапію як стартове лікування для індукції та підтримки ремісії в дітей з ХК, які мають періанальні ураження (паралельно з проведенням хірургічного втручання) [2]. Варто також зазначити, що рішення щодо застосування біологічних препаратів як терапії першої лінії може бути прийнято для окремих пацієнтів дитячого віку при наявності факторів ризику несприятливого прогнозу захворювання та для категорії пацієнтів, які мають тяжкі позакишкові прояви патології. Дані проведених досліджень з вивчення ефективності біологічних препаратів при хворобі Крона в педіатричній практиці на сучасному етапі дають досить обнадійливі результати. За результатами РКД, застосування інфліксимабу при захворюваннях на хворобу Крона у дітей давало до 90 % клінічної відповіді на терапію та до 60 % частоти збереження ремісії через рік, інфліксимаб також виявив значну клінічну ефективність у пацієнтів дитячого віку з періанальними ураженнями ХК [33, 34]. Результати ретроспективного багатоцентрового дослідження, проведеного J.R. Rosh та співавторами у 115 пацієнтів дитячого віку з ХК, показали, що застосування як мінімум однієї дози адалімумабу сприяло розвитку безстероїдної ремісії захворювання практично у 42 % дітей [35]. Згідно з рекомендаціями, з метою індукції ремісії інфліксимаб вводиться в/в у дозі 5 мг/кг (три дози протягом 6 тижнів), після чого проводиться підтримуюча терапія з введенням препарату кожні 8 тижнів. Для індукції ремісії адалімумаб призначається в початковій навантажувальній дозі 2,4 мг/кг (максимальна доза — 160 мг) на першу п/ш ін’єкцію, а потім вводиться в менших дозуваннях згідно зі схемою раз на два тижні. Варто зазначити, що оцінка ефективності біологічної терапії проводиться після введення другої та третьої дози препарату, і за відсутності видимого ефекту до 12–14-го тижня лікування призначення препарату має бути припинено (у зв’язку з первинною неефективністю терапії). Згідно з проведеними дослідженнями, в педіатричній практиці є досить невеликою частка пацієнтів (близько 10–25 %), які не дають первинної відповіді на проведення індукційної терапії, однак існує ймовірність втрати вторинної відповіді на лікування внаслідок вироблення антитіл проти препарату [36]. Дану проблему на сучасному етапі вирішують з використанням комбінованої терапії біологічними препаратами та тіопуринами або метотрексатом. Однак дана терапевтична стратегія потребує більш детального вивчення в педіатричній практиці з огляду на підвищення ризику виникнення побічних ефектів.
Згідно з сучасною позицією експертів ESPGHAN, прийом препаратів 5-аміносаліцилової кислоти (5-АСК) для індукції ремісії хвороби Крона в педіатричній практиці не рекомендований, його можна розглядати лише в окремих пацієнтів з легким перебігом захворювання та локалізацією ураження в товстому кишечнику (рівень доказовості 2; погодилися 88 %). Доза для прийому препаратів 5-АСК при хворобі Крона в педіатрії становить 40–80 мг/кг/добу (максимум до 4 г/добу).
На сьогодні немає переконливої доказової бази щодо застосування в пацієнтів дитячого віку жодного штаму пробіотичних культур при хворобі Крона. Проведений метааналіз 7 досліджень ефективності використання пробіотиків у пацієнтів з ХК не виявив вірогідно значущої переваги їх застосування порівняно зі стандартною підтримуючою терапією [2].
Основними показаннями до хірургічного лікування хвороби Крона в дітей залишаються наявність гострих і хронічних кишкових ускладнень, а також неефективність консервативної терапії з затримкою фізичного розвитку.
Висновки
Таким чином, хвороба Крона на сучасному етапі розглядається як складний діагноз, який може маскуватися під перебіг інших патологій, наприклад синдром подразненого кишечника, дисахаридазна недостатність, гострі кишкові інфекції, гастроінтестинальна алергія та дисбіотичні порушення кишкової мікрофлори, що може відтерміновувати верифікацію захворювання та ускладнювати його подальший прогноз. Саме тому лише знання варіабельної клінічної картини ХК у дітей може дозволити зберегти час до своєчасної діагностики, призначити відповідну протокольну терапію та суттєво покращити якість життя пацієнта.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Benchimol E.I., Fortinsky K.J., Gozdyra P., Van den Heuvel M., Van Limbergen J., Griffiths A.M. Epidemiology of pediatric inflammatory bowel disease: a systematic review of international trend. Inflamm. Bowel Dis. 2011. № 171. Р. 423-39. doi: 10.1002/ibd.21349.
2. Ruemmele F.M., Veres G., Kolho K.L. et al. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease. J. Crohns Colitis. 2014. № 8(10). Р. 1179-1207. http://dx.doi.org/10.1016/j.crohns.2014.04.005
3. Kugathasan S., Judd R.H., Hoffmann R.G. et al. Epidemiologic and clinical characteristics of children with newly diagnosed inflammatory bowel disease in Wisconsin: a statewide population-based study. J. Pediatr. 2003. № 143(4). Р. 525-31. doi: 10.1067/s0022-3476(03)00444-x.
4. Duricova D. et al. The natural history of Crohn’s disease in children. European Journal of Gastroenterology & Hepatology. 2017. Vol. 29(2). P. 125-134. https://doi.org/10.1097/meg.0000000000000761
5. Корниенко Е.А. и др. Воспалительные заболевания кишечника с очень ранним началом. Альманах клинической медицины. 2016. Т. 44. № 6. С. 719-733. https://doi.org/10.18786/2072-0505-2016- 44-6-719-733
6. Шадрин О.Г. Болезнь Крона у детей: состояние проблемы и перспективы ее решения в Украине. Здоровье Украины. Медицинская газета. 2015. № 1. С. 3-5.
7. Levine A., Koletzko S., Turner D. et al. ESPGHAN revised porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents. J. Pediatr. Gastroenterol. Nutr. 2014. № 58. Р. 795-806. doi: 10.1097/MPG.0000000000000239.
8. Jose F.A., Garnett E.A., Vittinghoff E. et al. Development of extraintestinal manifestations in pediatric patients with inflammatory bowel disease. Inflamm. Bowel Dis. 2009. № 15. Р. 63-68. doi: 10.1002/ibd.20604.
9. Naramore S.K., Bennett W.E. Jr. et al. Serologic, but Not Genetic, Markers Are Associated With Impaired Anthropometrics at Diagnosis of Pediatric Crohn’s Disease. Journal of Pediatric Gastroenterology and Nutrition. 2019. Vol. 69(5). Р. e129-e134. doi: 10.1097/MPG.0000000000002462.
10. Walters T.D., Griffiths A.M. Mechanisms of growth impairment in pediatric Crohn’s disease. Nat. Rev. Gastroenterol. Hepatol. 2009. № 6(9). Р. 513-523. doi: 10.1038/nrgastro.2009.124.
11. Akshay Kapoor, Vidyut Bhatia, Anupam Sibal. Pediatric Inflammatory Bowel Disease. Indian Pediatr. 2016. № 53. Р. 993-1002. doi: 10.1007/s13312-016-0975-0.
12. Aloi M., Cucchiara S. Extradigestive manifestations of IBD in pediatrics. Eur. Rev. Med. Pharmacol. Sci. 2009. № 13. Р. 23-32. PMID: 19530508.
13. Крючко Т.О., Несіна І.М., Пода О.А., Коленко І.О. Алгоритм диференційної діагностики захворювань кишечника у дітей. Дитячий лікар. 2016. № 3(48). С. 21-24.
14. Henderson P., Anderson N.H., Wilson D.C. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease: a systematic review and meta-analysis. Am. J. Gastroenterol. 2014. № 109(5). Р. 637-45. doi: 10.1038/ajg.2013.131.
15. Chandrakumar A., Georgy M., Agarwal P. et al. Anti-Saccharomyces cerevisiae Antibodies as a Prognostic Biomarker in Children With Crohn Disease. Journal of Pediatric Gastroenterology and Nutrition. 2019. Vol. 69(1). Р. 82-87. doi: 10.1097/MPG.0000000000002311.
16. Weiss B., Turner D. et al.; on behalf of the ImageKids study group. NCT01881490. Simple Endoscopic Score of Crohn Disease and Magnetic Resonance Enterography in Children: Report From Image Kids Study. Journal of Pediatric Gastroenterology and Nutrition. 2019. Vol. 69(4). Р. 461-465. doi: 10.1097/MPG.0000000000002404.
17. Chiorean L., Schreiber-Dietrich D., Braden B. et al. Ultrasonographic imaging of inflammatory bowel disease in pediatric patients. World J. Gastroenterol. Vol. 21(17). P. 5231-5241. doi: 10.3748/wjg.v21.i17.5231.
18. Guilhon de Araujo, Sant’Anna A.M. et al. Wireless capsule endoscopy for obscure small-bowel disorders: final results of the first pediatric controlled trial. Clin. Gastroenterol. Hepatol. 2005. № 3(3). Р. 264-70. doi: 10.1016/S1542-3565 (04) 00715-3.
19. Hyams J., Markowitz J., Otley A. et al. Evaluation of the Pediatric Crohn’s Disease Activity Index: A Prospective Multicenter Experience. Journal of Pediatric Gastroenterology and Nutrition. 2005. № 41. Р. 416-421. doi: 10.1097/01.mpg.0000183350.46795.42.
20. Borrelli O., Cordischi L., Cirulli M. et al. Polymeric diet alone versus corticosteroids in the treatment of active pediatric Crohn’s disease: a randomized controlled open-label trial. Clin. Gastroenterol. Hepatol. 2006. №4. Р. 744-53. doi: 10.1016/j.cgh.2006.03.010.
21. Ludvigsson J.F., Krantz M., Bodin L. et al. Elemental versus polymeric enteral nutrition in paediatric Crohn’s disease: a multicentre randomized controlled trial. Acta Paediatrica. 2004. № 93. Р. 327-35. PMID: 15124834.
22. Rodrigues A.F., Johnson T., Davies P. et al. Does polymeric formula improve adherence to liquid diet therapy in children with active Crohn’s disease? Arch. Dis. Child. 2007. № 92. Р. 767-70. doi: 10.1136/adc.2006.103416.
23. Miele E., Shamir R., Aloi M. et al. Nutrition in Pediatric Inflammatory Bowel Disease: A Position Paper on Behalf of the Porto Inflammatory Bowel Disease Group of the European Society of Pediatric Gastroenterology, Hepatology and Nutrition. J. Pediatr. Gastroenterol. Nutr. 2018. № 66(4). Р. 687-708. doi: 10.1097/MPG.0000000000001896.
24. Grogan J.L., Casson D.H., Terry A., Burdge G.C., ElMatary W., Dalzell A.M. Enteral feeding therapy for newly diagnosed pediatric Crohn’s disease: a double-blind randomized controlled trial with two years follow-up. Inflamm. Bowel Dis. 2012. № 18(2). Р. 246-53. doi: 10.1002/ibd.21690.
25. Critch J., Day A.S., Otley A., King-Moore C., Teitelbaum J.E., Shashidhar H. Use of enteral nutrition for the control of intestinal inflammation in pediatric Crohn’s disease. J. Pediatr. Gastroenterol. Nutr. 2012. № 54(2). Р. 298-305. doi: 10.1097/MPG.0b013e318235b397.
26. Berni Canani R., Terrin G., Borrelli O., Romano M.T., Manguso F., Coruzzo A. Short- and long-term therapeutic efficacy of nutritional therapy and corticosteroids in paediatric Crohn’s disease. Dig. Liver. Dis. 2006. № 38(6). Р. 381-7. doi: 10.3748/wjg.15.2570.
27. Markowitz J., Grancher K., Kohn N., Lesser M., Daum F. A multicenter trial of 6-mercaptopurine and prednisone in children with newly diagnosed Crohn’s disease. Gastroenterology. 2000. № 119(4). Р. 895-902. doi: 10.1053/gast.2000.18144.
28. Levine A., Weizman Z., Broide E. et al. A comparison of budesonide and prednisone for the treatment of active pediatric Crohn’s disease. J. Pediatr. Gastroenterol. Nutr. 2003. № 36. Р. 248-52. doi: 10.1097/00005176-200302000-00017.
29. Levine A., Turner D. Combined azithromycin and metronidazole therapy is effective in inducing remission in pediatric Crohn’s disease. J. Crohns Colitis. 2011. № 5(3). Р. 222-6. doi: 10.1016/j.crohns.2011.01.006.
30. Сhatu S., Subramanian V., Saxena S. et al. The role of thiopurines in reducing the need for surgical resection in Crohn’s disease: a systematic review and meta-analysis. Am. J. Gastroenterol. 2014. № 109. Р. 23-34. doi: 10.1038/ajg.2013.402.
31. Willot S., Noble A., Deslandres C. Methotrexate in the treatment of inflammatory bowel disease: an 8-year retrospective study in a Canadian pediatric IBD center. Inflamm. Bowel Dis. 2011. № 17. Р. 2521-6. doi: 10.1002/ibd.21653.
32. Скрипник І.М. Запальні захворювання кишечника: 14-й конгрес Європейської організації з вивчення хвороби Крона і коліту (ЕССО). Сучасна гастроентерологія. 2019. № 3. С. 107-108. doi: http://doi.org/10.30978/MG-2019-3-107.
33. Ruemmele F.M., Lachaux A., Cézard J.P. et al. Efficacy of infliximab in pediatric Crohn’s disease: a randomized multicenter open-label trial comparing scheduled to on demand maintenance therapy. Inflamm. Bowel Dis. 2009. № 15. Р. 388-94. doi: 10.1002/ibd.20788.
34. Dupont-Lucas C., Dabadie A., Alberti C. et al. Predictors of response to infliximab in paediatric perianal Crohn's disease. Aliment Pharmacol. Ther. 2014. № 40. Р. 917-29. doi: 10.1111/apt.12928.
35. Rosh J.R., Lerer T., Markowitz J., Goli S.R., Mamula P., Noe J.D. et al. Retrospective Evaluation of the Safety and Effect of Adalimumab Therapy (RESEAT) in pediatric Crohn’s disease. Am. J. Gastroenterol. 2009. № 104(12). Р. 3042-9. doi: 10.1038/ajg.2009.493.
36. Cameron F.L., Wilson M.L., Basheer N. et al. Anti-TNF therapy for paediatric IBD: the Scottish national experience. Arch. Dis. Child. 2015. № 100. Р. 399-405. doi: 10.1136/archdischild-2013-305812.

/116.jpg)