Журнал «Здоровье ребенка» Том 16, №1, 2021
Вернуться к номеру
Медикаментозна алергія у дітей: що потрібно знати?
Авторы: Няньковський С.Л., Няньковська О.С., Яцула М.С., Городиловська М.І.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Реакції на лікарський засіб є причиною близько 6,5 % усіх госпіталізацій. Вони розвиваються в 15 % пацієнтів, які перебувають на стаціонарному лікуванні. Можливість їх розвитку слід враховувати при диференціальній діагностиці, коли будь-яка медична проблема виникає в людини, яка вживає ліки. У дітей основною складністю в діагностиці медикаментозної алергії є диференціація макулопапульозних висипань як реакції на лікарський засіб від вірусної екзантеми, що спостерігається доволі часто в цій віковій групі. При лікуванні алергічних реакцій першим кроком є негайне припинення дії причинного препарату. Уникнення застосування безрецептурних препаратів і вживання ліків всередину, якщо це можливо, важливе щодо профілактики медикаментозної алергії. При виборі альтернативного препарату слід враховувати перехресну реактивність між препаратами з подібною структурою. На амбулаторному етапі для профілактики й лікування реакцій на лікарський засіб можуть бути використані антигістамінні середники, зокрема диметиндену малеат — Едермік.
Реакции на лекарственные препараты являются причиной около 6,5 % всех госпитализаций. Они развиваются у 15 % пациентов, находящихся на стационарном лечении. Возможность их развития следует учитывать при дифференциальной диагностике, когда любая медицинская проблема возникает у человека, который принимает лекарства. У детей основной сложностью в диагностике лекарственной аллергии является дифференциация макулопапулезных высыпаний как реакции на лекарственное средство от вирусной экзантемы, которая часто наблюдается в этой возрастной группе. При лечении аллергических реакций первым шагом является немедленное прекращение действия причинного препарата. Избегание приема безрецептурных препаратов и употребления лекарств внутрь, если это возможно, важно с точки зрения профилактики лекарственной аллергии. При выборе альтернативного препарата следует учитывать перекрестную реактивность между препаратами с похожей структурой. На амбулаторном этапе для профилактики и лечения реакций на лекарственное средство могут быть использованы антигистаминные средства, в частности диметиндена малеат — Эдермик.
Drug reactions cause 6.5 % of all hospital admissions. They develop with a rate of 15 % in patients who are treated in hospitals. The risk of drug reactions should be considered in the differential diagnosis when any medical problem occurs in a person who uses medication. In children, the major difficulty in the diagnosis of drug allergy is differentiation of maculopapular drug eruptions from viral exanthem which is observed very commonly in this age group. In treatment of allergic reactions, the first step is to immediately discontinue the drug. Avoidance of using over-the-counter medicines and using drugs orally if possible are important in terms of prevention of drug allergies. Cross-reactivity between drugs with similar structure should be considered when choosing an alternative medication. Antihistamines, in particular dimetindene maleate — Edermik, can be used for the prevention and treatment of drug reactions at the outpatient stage.
медикаментозна алергія; діагностика; лікування; діти; діти раннього віку; алергічні реакції; диметиндену малеат; Едермік
медикаментозная аллергия; диагностика; лечение; дети; дети раннего возраста; аллергические реакции; диметиндена малеат; Эдермик
drug allergy; diagnosis; treatment; children; infants; allergic reactions; dimetindene maleate; Edermik
Основні визначення й термінологія
Епідеміологія
Клінічні прояви
β-лактамні антибіотики
Нестероїдні протизапальні препарати
Вакцини
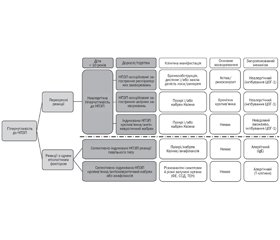
Діагностика
Лікування
- Impicciatore P., Choonara I., Clarkson A. et al. Incidence of adverse drug reactions in paediatric in/out-patients: a systematic review and meta-analysis of prospective studies. Br. J. Clin. Pharmacol. 2001. Vol. 52. P. 77-83.
- Vyles D., Chiu A., Simpson P. et al. Parent-reported penicillin allergy symptoms in the Pediatric Emergency Department. Acad. Pediatr. 2017. Vol. 17. P. 251-255.
- Smyth R.M., Gargon Е., Kirkham J. et al. Adverse drug reactions in children — a systematic review. PLoS One. 2012. Vol. 7. P. e24061.
- Lee S.I., Shin M.H., Lee H.B. et al. Prevalences of symptoms of asthma and other allergic diseases in korean children: a nationwide questionnaire survey. J. Korean Med. Sci. 2001. Vol. 16. P. 155-164.
- Rebelo Gomes E., Fonseca J., Araujo L., Demoly P. Drug allergy claims in children: from self-reporting to confirmed diagnosis. Clin. Exp. Allergy. 2008. Vol. 38. P. 191-198.
- Erkoçoğlu M., Kaya A., Civelek E. et al. Prevalence of confirmed immediate type drug hypersensitivity reactions among school children. Pediatr. Allergy. Immunol. 2013. Vol. 24. P. 160-167.
- Esposito S., Castellazzi L., Tagliabue C., Principi N. Allergy to antibiotics in children: an overestimated problem. Int. J. Antimicrob. Agents. 2016. Vol. 48. P. 361-366.
- International drug monitoring: the role of national centres. Report of a WHO meeting. World Health Organ Tech. Rep. Ser. 1972. Vol. 498. P. 1-25.
- Edwards I.R., Aronson J.K. Adverse drug reactions: definitions, diagnosis, and management. Lancet. 2000. Vol. 356. P. 1255-1259.
- Demoly P., Adkinson N.F., Brockow K. et al. International Consensus on drug allergy. Allergy. 2014. Vol. 69. P. 420-437.
- Khan D.A., Solensky R. Drug allergy. J. Allergy Clin. Immunol. 2010. Vol. 125 (2 Suppl 2). P. S126-137.
- Pichler W.J. Delayed drug hypersensitivity reactions. Ann. Intern. Med. 2003. Vol. 139. P. 683-693.
- Rawlins M.D., Thompson J.W. Mechanisms of adverse drug reactions. Textbook of adverse drug reactions. Davies D.M. (editor). Oxford: Oxford University Press, 1991. Р. 18-45.
- Doña I., Barrionuevo E., Blanca-Lopez N. et al. Trends in hypersensitivity drug reactions: more drugs, more response patterns, more heterogeneity. J. Investig. Allergol. Clin. Immunol. 2014. Vol. 24(3). P. 143-153.
- Cohen A.L., Budnitz D.S., Weidenbach K.N. et al. National surveillance of emergency department visits for outpatient adverse drug events in children and adolescents. J. Pediatr. 2008. Vol. 152. P. 416-421.
- Lange L., Koningsbruggen S.V., Rietschel E. Questionnaire-based survey of lifetime-prevalence and character of allergic drug reactions in German children. Pediatr. Allergy Immunol. 2008. Vol. 19. P. 634-638.
- Vezir E., Dibek Misirlioglu E., Civelek E. et al. Direct oral provocation tests in non-immediate mild cutaneous reactions related to beta-lactam antibiotics. Pediatr. Allergy Immunol. 2016. Vol. 27. P. 50-54.
- Gomes E.R., Brockow K., Kuyucu S. et al. Drug hypersensitivity in children: report from the pediatric task force of the EAACI Drug Allergy Interest Group. Allergy. 2016. Vol. 71. P. 149-161. http://dx.doi.org/10.1111/all.12774.
- Gamboa P.M. The epidemiology of drug allergy-related consultations in Spanish Allergology services: Alergológica-2005. J. Investig. Allergol. Clin. Immunol. 2009. Vol. 19. Suppl. 2. P. 45-50.
- Rukasin C.R.F., Norton A.E., Broyles A.D. Pediatric drug hypersensitivity. Curr. Allergy Asthma Rep. 2019. Vol. 19. P. 11.
- https://www.umj.com.ua/article/94307/medikamentozna-alergiya-specializovana-dopomoga.
- Hubiche T., Milpied B., Cazeau C. et al. Association of immunologically confirmed delayed drug reaction and human herpesvirus 6 viremia in a pediatric case of drug-induced hypersensitivity syndrome. Dermatology. 2011. Vol. 222(2). P. 140-141. http://dx.doi.org/10.1159/000324506.
- Shiohara T., Kano Y. A complex interaction between drug allergy and viral infection. Clin. Rev. Allergy Immunol. 2007. Vol. 33(1). P. 124-133. http://dx.doi.org/10.1007/s12016-007-8010-9.
- Chovel-Sella А., Ben Tov А., Lahav E. et al. Incidence of rash after amoxicillin treatment in children with infectious mononucleosis. Pediatrics. 2013. Vol. 131(5). P. e1424-e1427. http://dx.doi.org/10.1542/peds.2012-1575.
- Bergmann M., Caubet J.C. Specific aspects of drug hypersensitivity in children. Curr. Pharm. Des. 2016. Vol. 22. P. 6832-6851.
- Gomes E.R., Demoly P. Epidemiology of hypersensitivity drug reactions. Curr. Opin. Allergy Clin. Immunol. 2005. Vol. 5. P. 309-316.
- Kim B., Kim S.Z., Lee J. et al. Clinical profiles of adverse drug reactions spontaneously reported at a single Korean hospital dedicated to children with complex chronic conditions. PLoS One. 2017. Vol. 12. P. e0172425.
- Atanaskovic-Markovic М., Gomes Е., Cernadas J.R. et al. Diagnosis and management of drug-induced anaphylaxis in children: An EAACI position paper. Pediatr. Allergy Immunol. 2019. Vol. 30. P. 269-276.
- Lee S.Y., Ahn K., Kim J. et al. A multicenter retrospective case study of anaphylaxis triggers by age in Korean children. Allergy Asthma Immunol. Res. 2016. Vol. 8. P. 535-540.
- Motosue M.S., Bellolio M.F., Van Houten H.K. et al. Increasing Emergency Department visits for anaphylaxis, 2005–2014. J. Allergy Clin. Immunol. Pract. 2017. Vol. 5. P. 171-175.
- Ji Soo Park, Dong In Suh. Drug Allergy in Children: What Should We Know? Clin. Exp. Pediatr. 2020. Vol. 63(6). P. 203-210. doi: 10.3345/kjp.2019.00675.
- Dibek Misirlioglu E., Guvenir H., Bahceci S. et al. Severe cutaneous adverse drug reactions in pediatric patients: a multicenter study. J. Allergy Clin. Immunol. Pract. 2017. Vol. 5. P. 757-763.
- Duong T.A., Valeyrie-Allanore L., Wolkenstein P., Chosidow O. Severe cutaneous adverse reactions to drugs. Lancet. 2017. Vol. 390. P. 1996-2011.
- Oh H.L., Kang D.Y., Kang H.R. et al. Severe cutaneous adverse reactions in Korean pediatric patients: a study from the Korea SCAR Registry. Allergy Asthma Immunol. Res. 2019. Vol. 11. P. 241-253.
- Park G.M., Park J.H., Jung J.W. et al. Pediatric adverse drug reactions collected by an electronic reporting system in a single tertiary university hospital. Allergy Asthma Respir. Dis. 2016. Vol. 4. P. 354-359.
- Kim D.W., Choi Y.C., Lee Y.S., Nam Y.H, Jung J.A. Analysis of pediatric adverse drug reactions reported to regional pharmacovigilance center of a single university hospital. Allergy Asthma Respir. Dis. 2018. Vol. 6. P. 263-269.
- Romano A., Caubet J.C. Antibiotic allergies in children and adults: from clinical symptoms to skin testing diagnosis. J. Allergy Clin. Immunol. Pract. 2014. Vol. 2. P. 3-12.
- Norton A.E., Konvinse K., Phillips E.J., Broyles A.D. Antibiotic allergy in pediatrics. Pediatrics. 2018. Vol. 141. P. e20172497.
- Trubiano J.A., Stone C.A., Grayson M.L. et al. The 3 Cs of antibiotic allergy-classification, cross-reactivity, and collaboration. J. Allergy Clin. Immunol. Pract. 2017. Vol. 5. P. 1532-1542.
- Ibia E.O., Schwartz R.H., Wiedermann B.L. Antibiotic rashes in children: a survey in a private practice setting. Arch. Dermatol. 2000. Vol. 136. P. 849-854.
- Na H.R., Lee J.M., Jung J.W., Lee S.Y. Usefulness of drug provocation tests in children with a history of adverse drug reaction. Korean J. Pediatr. 2011. Vol. 54. P. 304-309.
- Noh S.R., Yoon J., Cho H.J. et al. Outcomes of drug provocation tests in Korean children with suspected drug hypersensitivity reaction . Allergy Asthma Respir. Dis. 2018. Vol. 6. P. 26-33.
- Zagursky R.J., Pichichero M.E. Cross-reactivity in β-lactam allergy. J. Allergy Clin. Immunol. Pract. 2018. Vol. 6. P. 72-81.
- Tonson la Tour A., Michelet M., Eigenmann P.A., Caubet J.C. Natural history of benign nonimmediate allergy to beta-lactams in children: a prospective study in retreated patients after a positive and a negative provocation test. J. Allergy Clin. Immunol. Pract. 2018. Vol. 6. P. 1321-1326.
- Neubert A., Verhamme K., Murray M.L. et al. The prescribing of analgesics and non-steroidal anti-inflammatory drugs in paediatric primary care in the UK, Italy and the Netherlands. Pharmacol. Res. 2010. Vol. 62. P. 243-248.
- Lesko S.M., Mitchell A.A. The safety of acetaminophen and ibuprofen among children younger than two years old. Pediatrics. 1999. Vol. 104. P. e39.
- Eustace N., O’Hare B. Use of nonsteroidal anti-inflammatory drugs in infants. A survey of members of the Association of Paediatric Anaesthetists of Great Britain and Ireland. Paediatr. Anaesth. 2007. Vol. 17. P. 464-469.
- Settipane R.A., Constantine H.P., Settipane G.A. Aspirin intolerance and recurrent urticaria in normal adults and children. Epidemiology and review. Allergy. 1980. Vol. 35. P. 149-154.
- Doña I., Blanca-López N., Torres M.J. et al. Drug hypersensitivity reactions: response patterns, drug involved, and temporal variations in a large series of patients. J. Investig Allergol. Clin. Immunol. 2012. Vol. 22. P. 363-371.
- Guvenir H., Dibek Misirlioglu E., Capanoglu M. et al. The frequency of nonsteroidal anti-inflammatory drug hypersensitivity in children with asthma. Int. Arch. Allergy Immunol. 2018. Vol. 176. P. 26-32.
- Liew W.K., Chiang W.C., Goh A.E. et al. Paediatric anaphylaxis in a Singaporean children cohort: changing food allergy triggers over time. Asia Pac. Allergy. 2013. Vol. 3. P. 29-34.
- Gabrielli S., Clarke A.E., Eisman H. et al. Disparities in rate, triggers, and management in pediatric and adult cases of suspected drug-induced anaphylaxis in Canada. Immun. Inflamm. Dis. 2018. Vol. 6. P. 3-12.
- Jares E.J., Baena-Cagnani C.E., Sánchez-Borges M. et al. Drug-induced anaphylaxis in latin american countries. J. Allergy Clin. Immunol. Pract. 2015. Vol. 3. P. 780-788.
- Choi J., Lee J.Y., Kim K.H. et al. Evaluation of drug provocation tests in Korean children: a single center experience. Asian Pac. J. Allergy Immunol. 2016. Vol. 34. P. 130-136.
- Stevenson D.D., Sanchez-Borges M., Szczeklik A. Classification of allergic and pseudoallergic reactions to drugs that inhibit cyclooxygenase enzymes. Ann. Allergy Asthma Immunol. 2001. Vol. 87. P. 177-80.
- Kowalski M.L., Asero R., Bavbek S. et al. Classification and practical approach to the diagnosis and management of hypersensitivity to nonsteroidal anti-inflammatory drugs. Allergy. 2013. Vol. 68. P. 1219-1232.
- Kidon M., Blanca-Lopez N., Gomes E. et al. EAACI/ENDA position paper: diagnosis and management of hypersensitivity reactions to non-steroidal anti-inflammatory drugs (NSAIDs) in children and adolescents. Pediatr. Allergy Immunol. 2018. Vol. 29. P. 469-480.
- Sánchez-Borges M., Capriles-Behrens E., Caballero-Fonseca F. Hypersensitivity to non-steroidal anti-inflammatory drugs in childhood. Pediatr. Allergy Immunol. 2004. Vol. 15. P. 376–380.
- Corzo J.L., Zambonino M.A., Muñoz C. et al. Tolerance to COX-2 inhibitors in children with hypersensitivity to nonsteroidal anti-inflammatory drugs. Br. J. Dermatol. 2014. Vol. 170. P. 725-729.
- Kelso J.M., Greenhawt M.J., Li J.T. et al. Adverse reactions to vaccines practice parameter 2012 update. J. Allergy Clin. Immunol. 2012. Vol. 130. P. 25-43.
- McNeil M.M., DeStefano F. Vaccine-associated hypersensitivity. J. Allergy Clin. Immunol. 2018. Vol. 141. P. 463-472.
- Caubet J.C., Ponvert C. Vaccine allergy. Immunol. Allergy Clin. North Am. 2014. Vol. 34. P. 597-613.
- McNeil M.M., Weintraub E.S., Duffy J. et al. Risk of anaphylaxis after vaccination in children and adults. J. Allergy Clin. Immunol. 2016. Vol. 137. P. 868-878.
- Grohskopf L.A., Sokolow L.Z., Broder K.R. et al. Prevention and control of seasonal influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices-United States, 2018–19 Influenza Season. MMWR Recomm. Rep. 2018. Vol. 67. P. 1-20.
- https://www.mayoclinic.org/diseases-conditions/drug-allergy/diagnosis-treatment/drc-20371839.

/80.jpg)
/81.jpg)
/82.jpg)
/83.jpg)