Журнал «» Том 13, №6, 2020
Вернуться к номеру
Симпатичний овердрайв як глобальна проблема серцево-судинних захворювань
Авторы: Тетяна Чистик
Рубрики: Кардиология
Разделы: Медицинские форумы
Версия для печати
22 вересня 2020 року відбувся сателітний симпозіум «Симпатичний овердрайв як глобальна проблема серцево-судинних захворювань» за підтримки компанії «Асіно Україна». В цьому заході взяли участь провідні спеціалісти-кардіологи — проф. Юрій Миколайович Сіренко (ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України»), проф. Лариса Миколаївна Яковлева (Харківська медична академія післядипломної освіти) та проф. Олег Сергійович Сичов (ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України»).
У своїй доповіді професор Ю.М. Сіренко відзначив, що симпатичні нервові фактори беруть участь в енергетичному балансі, а також у контролі артеріального тиску. Це створює передумови для гіпотези, що симпатичний овердрайв може бути причетним до розвитку та/або прогресування метаболічних порушень. Результати досліджень останнього десятиліття підтвердили цю гіпотезу, показавши появу адренергічної активації як на серцевому, так і на периферичному судинному рівні. Цілком ймовірно, що ця симпатична дисфункція спричинена рефлекторними механізмами (порушення тонусу барорецепторів), метаболічними факторами (резистентність до інсуліну) та гуморальними агентами (ангіотензин II, лептин). Хронічна активація симпатичної нервової системи з елементами її виснаження (симпатичний овердрайв) призводить до низки несприятливих наслідків для серцево-судинної системи, викликаючи гіпертрофію серця, гіпертрофію судин, ремоделювання артерій і дисфункцію ендотелію і тим самим посилюючи вже підвищений профіль серцево-судинного ризику пацієнта. Це має очевидні клінічні та терапевтичні наслідки, включаючи припущення, що гальмування симпатичної гіперактивності повинно бути включено до цілей як фармакологічних, так і нефармакологічних втручань, що застосовуються при лікуванні серцево-судинної патології.
Крім того, симпатична активація, що проявляється більш високою частотою серцевих скорочень (ЧСС) у стані спокою, викликає турбулентний кровоток у місцях біфуркацій, індукує розвиток атеросклеротичних бляшок і збільшує жорсткість великих судин. Впливаючи не лише на підвищення ЧСС у стані спокою, симпатичний овердрайв також пов’язаний зі структурною та функціональною модифікацією міокарда, такою як гіпертрофія лівого шлуночка або діастолічна дисфункція лівого шлуночка, що призводить до підвищеної захворюваності та смертності, якщо її не корегувати. Відомо, що симпатична гіперактивність є незалежним прогностичним фактором серцево-судинних захворювань або смертельних випадків у пацієнтів з серцевою недостатністю, нирковою недостатністю, основними серцевими аритміями, обструктивною хворобою легень, цирозом печінки або після гострого інсульту (рис. 1).
/48.jpg)
ЧСС у стані спокою зі звичайного клінічного показника перетворилася на значущий серцево-судинний (СС) маркер ризику. Вплив збільшення ЧСС у стані спокою на прогноз підтверджується у загальній популяції, у пацієнтів з артеріальною гіпертензією, ішемічною хворобою серця (ІХС) або серцевою недостатністю (СН) та існує незалежно від віку, СС факторів ризику або коморбідних станів. Континуум серцево-судинних захворювань включає фактори ризику, що ініціюють процес, який призводить до ушкодження тканин, і подальший ланцюг подій, що призводять до кінцевої стадії серцево-судинних захворювань (ССЗ) (рис. 2). ЧСС принципово впливає на всі стадії континууму ССЗ, від судинних факторів ризику до розвитку СС-подій та СН, і, отже, перетворюється на значущий маркер ризику і мету терапії при запобіганні ССЗ.
Серцево-судинний континуум є важливою причиною передчасної смерті та інвалідності, проте його прогресування не є неминучим. На сьогодні розроблені цільові заходи майже для кожної стадії континууму, при цьому бета-блокатори є ефективним і добре переносимим варіантом лікування у багатьох точках континууму. В рамках цього симпозіуму ми докладно розглядаємо використання бета-блокаторів пацієнтами з ССЗ, асоційованими з симпатичною гіперактивацією.
На сьогодні варіанти фармакотерапії при підвищеній ЧСС включають прийом недигідропіридинових блокаторів кальцієвих каналів, що знижують швидкість проведення по нервах і подовжують реполяризацію; бета-блокаторів без внутрішньої симпатоміметичної активності (ВСА), що спричиняють зниження ЧСС за рахунок гальмування активації симпатичної системи, і блокатора If-каналу івабрадину, що знижує ЧСС, інгібуючи If-осередок автоматизму серця, що контролює спонтанну діастолічну деполяризацію в синоатріальному вузлі (рис. 3).
На сьогодні результатами клінічних досліджень доведено, що серед запропонованих вище стратегій тільки бета-адреноблокатори (БАБ) без ВСА, що знижують ЧСС, безпосередньо діючи на симпатичну гіперактивацію, здатні вплинути на прогноз на будь-якому етапі серцево-судинного континууму.
Тему продовжила професор Л.М. Яковлева. Вона акцентувала увагу на тому, що численні епідеміологічні дослідження показали, що прискорене серцебиття у стані спокою є незалежним фактором ризику смертності у пацієнтів з ІХС та серцево-судинними факторами ризику.
У рекомендациях ESC/ESH (2018) частота серцевих скорочень більша за 80 уд/хв віднесена до факторів, що впливають на серцево-судинні ризики у пацієнтів з артеріальною гіпертензією. І хоча конт-роль ЧСС не є первинною метою лікування, при наявності специфічних показань, а саме ІХС, серцевої недостатності, фібриляції передсердь, вагітності, бета-адреноблокатори повинні бути розглянуті на будь-якому етапі антигіпертензивної терапії.
У дослідженні ADLIB вивчали ефективність монотерапії препаратами різних груп у молодих чоловіків і жінок з артеріальною гіпертензією 1-го ступеня. При виборі амлодипіну як медіани відповіді на лікування бісопролол продемонстрував статистично кращі результати (p = 0,004) щодо зниження САТ, ДАТ і ЧСС. Це дослідження підтвердило, що бісопролол може бути препаратом вибору для початкової терапії у молодих пацієнтів з артеріальною гіпертензією, що супроводжується симпатичною гіперактивацією (рис. 4).
Призначення БАБ пацієнтам з ІХС, які перенесли інфаркт міокарда, забезпечує зниження загальної та серцево-судинної смертності. Так, при їх використанні зниження ЧСС на 10 ударів/хв зменшує відносний ризик смерті від серцево-судинних захворювань на 30 %. А при стабільній ІХС, за результатами дослідження CORONOR, при використанні БАБ відносний ризик фатальних серцево-судинних подій є на 57 % нижчим.
У дослідженні TIBBS на тлі призначення Конкору (бісопрололу) знижувався ранковий пік епізодів ішемії, у кожного другого пацієнта повністю були усунуті епізоди ішемії та продемонстровано покращення довгострокового прогнозу (рис. 5).
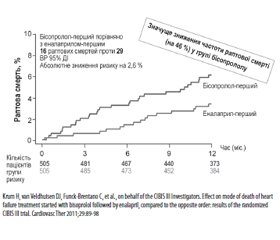
При серцевій недостатності активація через барорецептори симпатичної нервової системи є раннім компенсаторним механізмом, що забезпечує інотропну підтримку та збереження серцевого викиду. Проте хронічна симпатична активація призводить до згубних наслідків, спричинюючи подальше погіршення функції серця і збільшення смертності через прогресування серцевої недостатності. У трьох ключових дослідженнях — CIBIS II, COPERNICUS і MERIT-HF — призначення бисопрололу, карведилолу і метопрололу продемонструвало дуже схожий вплив на загальну смертність у пацієнтів з хронічною серцевою недостатністю (ХСН). Дуже важливо, що на ранній стадії становлення синдрому ХСН основною причиною смерті хворих є раптова смерть внаслідок гіперактивації симпатоадреналової системи. У дослідженні CIBIS IIІ було доведено, що призначення Конкору (бісопрололу), що передувало призначенню інгібітора ангіотензинперетворювального ферменту (іАПФ), забезпечувало зниження раптової смерті на 46 % (рис. 6).
/51.jpg) Професор О.Г. Сичов у своїй доповіді звернув увагу на те, що симпатична гіперактивація запускає низку патогенетичних процесів, які спричиняють розвиток серцево-судинних ускладнень — серцевої недостатності та раптової смерті. Так, тривала симпатикотонія викликає підвищення частоти серцевих скорочень, активацію ренін-ангіотензин-альдостеронової системи (РААС), зменшує резервні можливості міокарда, знижує скоротливість кардіоміоцитів і коронарний кровоток, спричиняє електролітні порушення, активацію цитокінів та прогресуюче ремоделювання міокарда. Вазоконстрикція, що з’являється при цьому, знижує адаптивні можливості до фізичних навантажень, збільшує ризик дисфункції міокарда та серцевої недостатності, ішемії й аритмій, зокрема раптової аритмічної смерті.
Професор О.Г. Сичов у своїй доповіді звернув увагу на те, що симпатична гіперактивація запускає низку патогенетичних процесів, які спричиняють розвиток серцево-судинних ускладнень — серцевої недостатності та раптової смерті. Так, тривала симпатикотонія викликає підвищення частоти серцевих скорочень, активацію ренін-ангіотензин-альдостеронової системи (РААС), зменшує резервні можливості міокарда, знижує скоротливість кардіоміоцитів і коронарний кровоток, спричиняє електролітні порушення, активацію цитокінів та прогресуюче ремоделювання міокарда. Вазоконстрикція, що з’являється при цьому, знижує адаптивні можливості до фізичних навантажень, збільшує ризик дисфункції міокарда та серцевої недостатності, ішемії й аритмій, зокрема раптової аритмічної смерті.
Про зв’язок зростання ЧСС із несприятливими серцево-судинними наслідками відомо досить давно. Так, у 1996 р. E. Копі зі співавт. довели, що середнє значення інтервалу RR менше за 700 мс (ЧСС > 85 уд/хв) є незалежним предиктором розвитку раптової серцевої смерті; при цьому діагностична цінність цього показника перевищувала такий критерій, як середнє значення фракції викиду лівого шлуночка (ФВ ЛШ).
Проспективне дослідження (Jouven X. et al., 2001) за участю 7079 чоловіків віком 42–53 роки, за якими спостерігали в середньому протягом 23 років, продемонструвало зростання ризику раптової смерті при зростанні середніх показників ЧСС у стані спокою. Так, у групі пацієнтів із ЧСС > 75 уд/хв ризик раптової смерті виявився у 3,8 раза вищим порівняно з квінтилем найменшої ЧСС. У групі осіб із ЧСС > 75 уд/хв спостерігалося також зростання показників загальної смертності, частоти інфаркту міокарда (ІМ) з летальними наслідками та смерті від серцево-судинних захворювань, однак це підвищення не було настільки вираженим (приблизно удвічі вище відповідних показників у групі осіб із ЧСС до 60 уд/хв).
Підвищення симпатичного тонусу призводить до ремоделювання лівого шлуночка. Надмірна симпатична активація призводить до змін у біології міоцитів, таких як гіпертрофія, експресія генів (фетальних) важких ланцюгів міозину, міоцитоліз, зміни білків цитоскелета, бета-адренергічна десенситизація, електромеханічне сполучення. Відбувається втрата міоцитів (некроз, апоптоз, автофагія), а також зміни у клітинному матриксі (деградація матриксу, фіброз міокарда). При активації РААС виникають зміни геометрії камери лівого шлуночка — зменшення розміру, збільшення сферичності, витончення стінки та недостатність міокарда.
Серцево-судинний континуум є важливою причиною передчасної смерті та інвалідності, проте його прогресування не є неминучим. Бета-адреноблокатори можуть чинити дію на чимало точок серцево-судинного континууму, тому вони є основними препаратами для лікування ІХС, зменшення гіпертрофії лівого шлуночка, запобігання ІМ, аритміям, дилатації та ремоделюванню лівого шлуночка, розвитку ХСН, серцево-судинної смертності, в тому числі раптової смерті.
Так, у рекомендаціях Європейської асоціації серцевого ритму бета-адреноблокатори є препаратами першої лінії у лікуванні безсимптомних аритмій.
Згідно з оновленими рекомендаціями Європейського товариства кардіологів (ESC, 2019), бета-адреноблокатори мають більш вагоме значення в лікуванні суправентрикулярних аритмій. Зокрема, вони показані як невідкладна терапія тахікардій з вузькими комплексами QRS (рівень доказовості — ІІа). Також бета-адреноблокатори є препаратами першого вибору в пацієнтів із суправентрикулярними тахікардіями, які відмовляються від проведення радіочастотної абляції (або в разі неефективності цієї процедури).
В європейських рекомендаціях із фібриляції передсердь 2020 року зазначено, що бета-адреноблокатори є препаратами першої лінії для всіх пацієнтів із фібриляцією передсердь незалежно від ФВ, при цьому селективні бета-адреноблокатори вперше показані як препарати першої лінії для контролю ритму у вагітних (клас рекомендацій — ІА).
Наразі немає альтернативи селективним бета-адреноблокаторам у пацієнтів з подовженим інтервалом QT; вони є золотим стандартом терапії для попередження раптової смерті в цієї категорії хворих.
На сьогодні бісопролол — єдиний селективний бета-адреноблокатор, з використанням якого був проведений окремий метааналіз. До нього увійшли два масштабні випробування — CIBIS I та CIBIS II з сумарною кількістю 3288 пацієнтів.
Для дослідження CIBIS I відібрали 641 пацієнта з ХСН з III–IV функціональним класом (ФК) за NYHA, яким протягом 4 років призначали бісопролол у малих і середніх дозах (1,25–5 мг) додатково до стандартної терапії комбінацією «діуретик + іАПФ». Випробування продемонструвало хорошу переносимість бісопрололу, вірогідне зниження смертності та госпіталізації з приводу ХСН порівняно з групою стандартної терапії.
До дослідження CIBIS II залучили 2647 пацієнтів із III–IV ФК і стабільною ХСН із ФВ ЛШ ≤ 35 %, які отримували діуретики й іАПФ. Бісопролол титрували до максимально переносимої дози. Цільова доза, якої досягли 43 % хворих, становила 10 мг/добу. Випробування було заплановано на 2 роки, але припинено раніше (через 1,3 року після другого проміжного аналізу), оскільки смертність від усіх причин у групі бісопрололу була значно нижчою, ніж у групі плацебо. Дослідження також довело хорошу переносимість бісопрололу.
Загалом у випробуванні CIBIS II в пацієнтів, які отримували бісопролол, виявлені статистично значущі:
— зниження смертності від усіх причин на 34 % (незалежно від етіології) (p < 0,0001);
— зниження раптової смерті на 44 % (p = 0,0011);
— зниження госпіталізації з усіх причин на 20 % (р = 0,0006);
— зниження госпіталізації у зв’язку з прогресуванням серцевої недостатності на 36 % (p < 0,0001).
За даними метааналізу двох досліджень, бісопролол статистично значуще знижував загальну смертність (відносний ризик (ВР) 0,71), смертність від ССЗ (ВР 0,72); показники раптової смерті (ВР 0,63), госпіталізації (ВР 0,85) (рис. 7).
Сьогодні в настановах ESC (2015) щодо лікування пацієнтів зі шлуночковими аритміями та попередження раптової серцевої смертності бета-адреноблокатори віднесені до препаратів першої лінії. Також бета-адреноблокатори рекомендовані пацієнтам із СН при систолічній дисфункції (ФВ ЛШ < 35–40 %) для зниження загальної смертності та частоти раптової серцевої смерті.
Для вторинної профілактики раптової серцевої смерті та шлуночкової тахікардії ESC рекомендує імплантацію кардіовертера-дефібрилятора (ІКД). Вона рекомендована пацієнтам з задокументованою ФШ або гемодінамічно непереносимою шлуночковою тахікардією при відсутності зворотної причини, які отримують постійну оптимальну медикаментозну терапію та мають очікувану тривалість життя з хорошим функціональним статусом більше ніж 1 рік (ІА).
Бета-адреноблокатори також рекомендовані як засоби вторинної профілактики раптової смерті. Їх призначення пацієнтам с ІХС, які мають систолічну дисфункцію лівого шлуночка і епізоди нестабільної шлуночкової тахікардії, вірогідно збільшує тривалість їх життя без залежності від ІКД.

/48_2.jpg)
/49.jpg)
/49_2.jpg)
/50.jpg)