Газета «Новости медицины и фармации» №10 (728), 2020
Вернуться к номеру
XXI Національний конгрес кардіологів України: нове у лікуванні та профілактиці серцево-судинних захворювань та пов’язаних з ними станів
Авторы: Тлустова Т.В., к.м.н.
Разделы: Медицинские форумы
Версия для печати
22–25 вересня 2020 року відбувся XXI Національний конгрес кардіологів України, який традиційно проводиться восени у Києві. Цього року вперше була створена оnlinе-платформа для можливості проведення конгресу в умовах пандемії COVID-19. Як і завжди, конгрес об’єднав провідних вчених і фахівців в галузі кардіології, кардіохірургії та суміжних спеціальностей. Програма конгресу була насиченою та включала всі аспекти сучасної кардіології й суміжних медико-соціальних проблем. Були розглянуті питання діагностики, лікування та профілактики артеріальної гіпертензії, ішемічної хвороби серця (ІХС), аритмій, серцевої недостатності, легеневої гіпертензії, тромбозів і тромбоемболії, васкулітів, невідкладних станів у кардіології тощо. Окрім того, деякі секції та доповіді були присвячені таким питанням: побічні реакції на лікарські засоби, тактика щодо первинної та вторинної профілактики кардіологічних захворювань, питання вироблення оптимальної лікарської тактики у складних клінічних випадках, питання мультидисциплінарного підходу до лікування пацієнтів із коморбідністю, а також основам кардіореабілітації, питанням кардіохірургічної допомоги та сучасним можливостям кардіохірургії, в тому числі інтервенційної кардіології.
Окрема секція була присвячена такій актуальній медико-соціальній проблемі сучасної України, як особливості надання кардіологічної допомоги учасникам збройного конфлікту. Вона включала розгляд стрес-асоційованих хвороб системи кровообігу, їх причини, наслідки, можливості корекції та профілактики.
В рамках конгресу були проведені спільні засідання представників вітчизняних і міжнародних асоціацій та були представлені школи для практикуючих («Школа практикуючого лікаря») та сімейних лікарів («Загальна практично-сімейна медицина»), що включали доповіді щодо діагностики, лікування та профілактики серцево-судинних захворювань на першому рівні надання медичної допомоги.
Слід відзначити, що особлива увага була приділена персоніфікованому підходу до ведення пацієнтів з серцево-судинними хворобами та супутніми станами. Проведено декілька майстер-класів з лікування серцево-судинних захворювань, на яких були надані практичні алгоритми впровадження нових рекомендацій та наведені конкретні клінічні випадки ведення хворих з різними серцево-судинними патологіями.
Найбільша увага була приділена таким поширеним захворюванням, як артеріальна гіпертензія, ІХС та серцева недостатність. Були представлені як доповіді щодо сучасних рекомендацій із ведення пацієнтів із даною патологією, так і досвід індивідуалізованого підходу до лікування з урахуванням функціонального стану хворого, наявності коморбідних станів, побічних реакцій кардіологічних препаратів тощо.
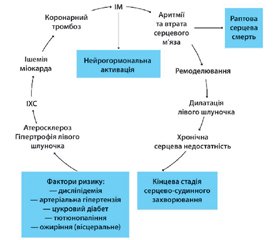
Перший сесійний день відкривав науково-практичний симпозіум на тему «Вибір антигіпертензивної терапії згідно з профілем пацієнта». Д.м.н., професор, завідувач відділення симптоматичних гіпертензій ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України Ю.М. Сіренко представив доповідь, що була присвячена ролі β-адреноблокаторів у сучасному лікуванні артеріальної гіпертензії (АГ). Професор нагадав слухачам основні етапи серцево-судинного континууму, в якому один із перших етапів розвитку та прогресування атеросклерозу, що призводить до необоротних змін в різних органах і системах, пов’язаний саме з АГ. Каскад розвитку АГ завжди включає гіперсимпатикотонію. Кардіопротекція у такому випадку забезпечується завдяки β1-адреноблокаторам, що уповільнюють процеси прогресування цього каскаду (рис. 1).
У дослідженні 2014 року (C. Bauters та ін.) доведено, що прийом β-адреноблокаторів у пацієнтів зі стабільною стенокардією після реваскуляризації знижує ризик серцево-судинної смерті на 57 %. У дослідженні 2004 року (Kernis S.J. та ін.) показано, що в пацієнтів з інфарктом міокарда після проведення реваскуляризації застосування β-адреноблокаторів значно зменшило ризик повторних інфарктів міокарда та частоту серцево-судинної смерті. Згідно з останніми європейськими рекомендаціями щодо лікування хворих на ІХС (2019), майже в усіх групах пацієнтів першим кроком контролю захворювання є призначення β-адреноблокаторів, особливо у хворих з частотою серцевих скорочень більше за 80. Навіть у пацієнтів з низьким артеріальним тиском рекомендована стартова терапія — низькі дози β-адреноблокаторів, а вже після цього можливе додавання інших груп препаратів.
Роль β-адреноблокаторів у регресі гіпертрофії лівого шлуночка вивчалась у дослідженні Fu Wei Hing та ін. (2017). Авторами доведено, що жиророзчинні та селективні блокатори β1-рецепторів потенційно можуть бути препаратами першої лінії лікування в пацієнтів з АГ та гіпертрофією лівого шлуночка, але ефективність жиророзчинних і селективних блокаторів β1-рецепторів щодо регресу гіпертрофії лівого шлуночка повинна бути підтверджена подальшими великими дослідженнями високої якості.
Ще одним аспектом терапевтичної дії β-адреноблокаторів є потенційний вплив на розвиток атеросклеротичної бляшки. У кількох дослідженнях було доведено, що застосування β-адреноблокаторів зменшує темпи прогресування або викликає регрес атеросклеротичної бляшки, що підтверджувалось внутрішньосудинним ультразвуковим дослідженням.
На сьогодні існує багато препаратів, що належать до групи β-адреноблокаторів, і вони суттєво відрізняються за такими критеріями: селективність, наявність α-адреноблокади, вплив на мембрани, розчинність у жирах, наявність внутрішньої симпатоміметичної активності, тривалість дії.
Небіволол — високоселективний препарат групи β-адреноблокаторів ІІІ покоління. Він поєднує дві фармакологічні властивості: завдяки D-енантіомеру небіволол є конкурентним і селективним блокатором β1-адренорецепторів, завдяки L-енантіомеру він має м’які вазодилататорні властивості внаслідок метаболічної взаємодії з L-аргініном/оксидом азоту. Фармакодинамічні ефекти небівололу: він зменшує частоту серцевих скорочень, не змінює ударний об’єм, не змінює серцевий викид і зменшує периферичний опір. Таким чином, небіволол працює ще й як периферичний вазодилататор.
Відмінність β-адреноблокаторів між собою добре показана у дослідженні Azra Mahmud, John Feely (2008): атенолол і небіволол не чинять суттєвого впливу на жорсткість крупних артерій, але небіволол, на відміну від атенололу, впливає на дрібні м’язові артерії, зменшуючи відбиття пульсових хвиль, можливо, через підвищений рівень оксиду азоту. Такі додаткові властивості можуть надавати важливі чіткі гемодинамічні ефекти, і тому β-адреноблокатори не можна розглядати як однорідну групу.
На сьогодні β-адреноблокатори мають стійку позицію в лікуванні АГ, а саме: вони показані при поєднанні АГ і ІХС, хронічній серцевій недостатності, після перенесеного інфаркту міокарда, при фібриляції передсердь, корекції артеріального тиску (АТ) у молодих жінок, які планують вагітність (у вагітних препаратом вибору є лабеталол).
У рекомендаціях 2018 року вказано, що β-адреноблокатори не є однорідним класом. Останнім часом збільшилось використання судинорозширювальних β-адреноблокаторів, таких як лабеталол, небіволол, целіпролол і карведилол. Дослідження небівололу показали, що він чинить більш сприятливий вплив на центральний АТ, аортальну жорсткість, дисфункцію ендотелію тощо. Він не чинить негативний вплив на ризик розвитку нових випадків цукрового діабету і має більш сприятливий профіль переносимості, ніж класичні β-блокатори, включаючи меншу побічну дію на сексуальну функцію.
На практиці більшість пацієнтів з АГ отримують не монотерапію, а комбінацію з 2, 3 або 4 препаратів, тому важливо вивчення поєднання ефектів комбінацій різних засобів. Класичною є комбінація небівололу з гідрохлортіазидом. Аналіз застосування такої комбінації в пацієнтів похилого віку показав ефективність у всіх групах на рівні майже 80 %.
У дослідженні 2017 року проф. Сіренка та співавт. вивчалась ефективність β-блокаторів у пацієнтів з інсулінорезистентністю та метаболічним синдромом протягом 6 місяців лікування. Було проведено порівняння чотирьох різних β-адреноблокаторів: атенололу, карведилолу, бісопрололу, небівололу та оцінено їх вплив на корекцію АГ. Це дослідження показало, що всі чотири β-адреноблокатори забезпечували подібне зниження АТ, але мали різні метаболічні ефекти. У пацієнтів, які отримували атенолол, спостерігалося значне погіршення інсулінорезистентності. Бісопролол може бути запропонований до застосування як метаболічно нейтральний препарат у пацієнтів з легкою та середньою гіпертензією, клінічними ознаками метаболічного синдрому та проявами інсулінорезистентності без діабету. Пацієнти, які отримували лікування небівололом та карведилолом, мали тенденцію до покращення чутливості до інсуліну та толерантності до глюкози. Терапія небівололом і карведилолом значно покращила глікемічний профіль, що може поліпшити прогноз. Небіволол і карведилол можуть бути рекомендовані як препарати вибору пацієнтам з гіпертонічною хворобою та метаболічним синдромом з ознаками порушення вуглеводного обміну.
Відомо, що призначення статинів може погіршувати вуглеводний обмін, але застосування разом із статинами комбінації «небіволол + гідрохлортіазид» не погіршувало, а іноді й покращувало вуглеводний обмін (Kei A. та співавт. Abstracts of EAS congress, 2015).
Відомим побічним ефектом β-адреноблокаторів є еректильна дисфункція. На фоні прийому небівололу цей побічний ефект не має високої частоти: при оцінці частоти виникнення цього побічного ефекту у США протягом 2009–2018 років встановлено, що із 12 126 пацієнтів, у яких були зареєстровані побічні ефекти небівололу, відзначалось лише 47 випадків еректильної дисфункції (0,39 %), і всі вони були зареєстровані на першому місяці прийому небівололу.
У кардіологічному портфелі Корпорації «Артеріум» молекула небівололу представлена препаратами виробництва АТ «Київмедпрепарат» Небіар® (чистий небіволол) та Небіар® Плюс (небіволол в комбінації з гідрохлортіазидом), що можуть за показаннями призначатися пацієнтам з АГ.
Д.м.н., професор ДУ «ННЦ «Інститут кардіології імені акад. М.Д. Стражеска» НАМН України Г.Д. Радченко представила доповідь «Базові аспекти лікування АГ при діабетичній нефропатії». Згідно зі статистичними даними США за 2017 рік, кожен третій пацієнт із цукровим діабетом має хронічне ураження нирок, 15 % пацієнтів з усієї популяції мають хронічну хворобу нирок, 48 % тих, хто має значне зниження швидкості клубочкової фільтрації (ШКФ), не знають про наявність у них хронічної хвороби нирок.
Хронічна хвороба нирок — це захворювання нирок тривалістю більше трьох місяців, що визначається структурними або функціональними порушеннями в нирках зі зниженням ШКФ або без нього, яке включає:
- патологічні зміни в нирках;
- ШКФ менше 60 мл/хв/1,73 м2 впродовж трьох місяців з іншими симптомами ураження нирок або без них (National Kidney Foundation. Clinical Practice Guidelines for Chronic Kidney Disease).
При діабетичному ураженні нирок найчастіше відзначається такий синдром, як протеїнурія. Для скринінгу застосовують спеціальні тест-смужки. Для кількісної оцінки необхідно оцінити концентрацію альбуміну, креатиніну сечі, співвідношення «альбумін/креатинін сечі».
Макроальбумінурія у хворих на цукровий діабет (ЦД) 2-го типу є проявом ХХН. Щодо мікропротеїнурії, нефрологи рекомендують оцінити, чи немає станів, що можуть вплинути на збільшення екскреції альбуміну:
- навантаження протягом останніх 24 годин;
- інфекції;
- лихоманка;
- застійна серцева недостатність;
- значна гіперглікемія;
- вагітність;
- значна АГ;
- інфекції сечовивідних шляхів;
- гематурія.
Протягом трьох місяців тричі повторюється аналіз сечі на протеїнурію, і якщо в як мінімум двох із трьох аналізів визначається мікроальбумінурія, це свідчить про наявність істинної мікроальбумінурії, що потребує медикаментозної корекції.
Скринінг на альбумінурію в пацієнтів із ЦД:
- при ЦД 1-го типу — через 5 років після встановлення діагнозу, потім щорічно;
- при ЦД 2-го типу — в момент встановлення діагнозу, потім щорічно (Clinical Practice Recommendations for Diabetes and Chronic Kidney Disease. Am. J. Kidney Dis. 2007. 49. S1-S180).
Макроальбумінурія при ЦД — це завжди маркер діабетичного ураження нирок (ДУН). Але при мікроальбумінурії критерії дещо інші — ДУН є можливим, при нормоальбумінурії ймовірність ДУН низька, а при ШКФ більше 60 встановлюється тільки ризик розвитку ДУН.
Під забезпеченням нефропротекції розуміють сповільнення швидкості зниження клубочкової фільтрації та попередження/зменшення прогресування протеїнурії або її регрес. Основною умовою нефропротекції є контроль артеріального тиску: досягнення цільового рівня АТ менше ніж 140/80 мм рт.ст.
Алгоритм лікування АГ при ураженні нирок згідно з європейськими рекомендаціями 2018 року включає:
1) початкове призначення інгібітора АПФ або блокатора ренін-ангіотензинової системи в комбінації з антагоністом кальцієвих каналів;
2) на другому етапі призначається інгібітор АПФ/блокатор ренін-ангіотензинової системи в комбінації з антагоністом кальцієвих каналів і діуретиком;
3) на третьому етапі — резистентна АГ — до схеми другого етапу додається спіронолактон або інший діуретик, α-/β-адреноблокатор.
При цьому β-адреноблокатори призначаються на будь-якому етапі при наявності серцевої недостатності, стенокардії, фібриляції передсердь, після інфаркту міокарда, у молодих жінок, які вагітні або планують вагітність.
У 2011 році проведено ASPIRANT — мультицентрове проспективне рандомізоване подвійне сліпе плацебо-контрольоване дослідження ефективності додавання спіронолактону при резистентній АГ. Доведено позитивний ефект додавання цього препарату до схеми лікування, але такі пацієнти потребують контролю рівня калію для попередження побічних ефектів, що пов’язані з гіперкаліємією.
Американські рекомендації суттєво відрізняються від європейських. Американські рекомендації пропонують призначення інгібіторів АПФ при альбумінурії вище за 300 мг/д, а при непереносимості цієї групи препаратів пропонують призначати блокатори ренін-ангіотензинової системи (сартани).
За даними метааналізів, на загальний рівень смертності у хворих з ЦД та ураженням нирок не впливають ніякі препарати, термінальній стадії ураження нирок запобігають сартани або комбінація інгібіторів АПФ і сартанів, гострому ураженню нирок, подвоєнню креатиніну запобігають сартани або інгібітори АПФ, регрес альбумінурії найкраще забезпечує комбінація сартанів з антагоністами кальцію.
При призначенні нефропротекторної терапії важливо досягти терапевтичної дози призначеного препарату, що буде забезпечувати нефропротекторний ефект. Для різних препаратів груп сартанів і інгібіторів АПФ встановлені різні цільові дози, але в цілому дози препаратів мають бути середніми або високими.
Кандесартан — це препарат групи сартанів, що забезпечує високу антигіпертензивну ефективність і тривалість дії (до 36 годин). Кандесартан забезпечує виражений ефект на діастолічний артеріальний тиск порівняно з іншими сартанами (лозартан, валсартан, ірбесартан), і досягається цей ефект при призначенні значно менших доз кандесартану, ніж інших препаратів.
Кандесартан має виражені ренопротективні ефекти. При порівнянні еналаприлу та кандесартану встановлено, що останній ефективно зменшує альбумінурію та попереджає гломерулосклероз за даними біопсії (Griffin K.A. et al., 2001).
K. Rossing et al. (2001) у своєму дослідженні показали, що кандесартан чинить дозозалежний ренопротективний вплив — чим більшою є доза, тим більший ренопротективний ефект.
У декількох дослідженнях була підтверджена ретинопротективна дія кандесартану: при ЦД 1-го типу він попереджав виникнення ретинопатії, а при ЦД 2-го типу зменшував темпи її прогресування. У рекомендаціях для офтальмологів щодо менеджементу діабетичної нефропатії вказано, що саме блокатори ренін-ангіотензинової системи (сартани) є препаратами вибору в цих пацієнтів (на основі досліджень DIRECT Protect 1 та Protect 2).
Переваги кандесартану:
- є блокатором ренін-ангіотензинової системи;
- призначається 1 раз на добу та діє впродовж 36 годин;
- показаний при серцевій недостатності, в тому числі при зниженій фракції викиду;
- чинить позитивний вплив на регресію/попередження прогресування діабетичної та недіабетичної нефропатії;
- має позитивний ефект при його застосуванні для попередження прогресування діабетичної ретинопатії.
Антигіпертензивна терапія при лікуванні АГ у пацієнтів, які знаходяться на гемодіалізі, включає п’ять рівнів:
1) β-адреноблокатор;
2) антагоніст кальцієвих каналів;
3) інгібітор АПФ або блокатор ренін-ангіотензинової системи (сартан);
4) блокатори мінералокортикоїдних рецепторів;
5) інші препарати.
Але при цьому треба враховувати, що інгібітори АПФ майже повністю виводяться при діалізі, тому рекомендовано в день діалізу збільшувати дозу цього препарату. Сартани, антагоністи кальцію та β-адреноблокатори (за виключенням атенололу) переважно виводяться печінкою, а отже, не потребують корекції дози в пацієнтів на гемодіалізі.
Наприкінці доповіді професор підсумувала, що ХХН досить часто зустрічається в пацієнтів з АГ і ЦД, контроль показників, що характеризують ураження нирок, має проводитись у всіх пацієнтів із АГ, контроль артеріального тиску — це основна умова збереження функції нирок, блокатори ренін-ангіотензинової системи мають використовуватися у складі комбінованої терапії АГ при ХХН. На ринку України представником молекули кандесартану є препарат Касарк®, таблетки Корпорації «Артеріум», представлений повною лінійкою: 8, 16 та 32 мг № 30 та комбінації з гідрохлортіазидом Касарк® Н 16 мг/12,5 мг № 30 та Касарк® НD 32 мг/25 мг № 30.
23 вересня відбувся майстер-клас «Оптимізація терапії хронічної ІХС: вибір антиішемічного кардіопротектора. Результати дослідження ЕПАСС» д.м.н., професора, головного наукового співробітника відділу некоронарних хвороб серця, ревматології та терапії ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України О.Г. Несукай. Не існує універсального визначення оптимального лікування пацієнтів з хронічною ІХС. Антиішемічна терапія повинна бути адаптована під кожного пацієнта відповідно до клінічних характеристик і переваг. Згідно з останніми європейськими рекомендаціями 2019 року з лікування хронічної ішемічної хвороби серця, першим кроком у лікуванні майже всіх груп пацієнтів є призначення β-адреноблокаторів. У цих рекомендаціях прописано, що метаболічні препарати ранолазин, нікорандил, івабрадин, триметазидин повинні бути розглянуті як препарати 2-ї лінії для зменшення нападів стенокардії, підвищення переносимості фізичних навантажень у пацієнтів, які не переносять або мають протипоказання або в яких симптоми недостатньо контролюються прийомом β-адреноблокаторів, блокаторів кальцієвих каналів та інших препаратів. Також у деяких пацієнтів комбінація β-блокатора або блокатора кальцієвих каналів з препаратами 2-ї лінії (ранолазин, нікорандил, івабрадин, триметазидин) може бути розглянута як терапія 1-ї лінії відповідно до частоти серцевих скорочень, артеріального тиску, толерантності до фізичних навантажень. Таким чином, метаболічна терапія є базисною для зменшення нападів стенокардії.
Ефективність та безпека триметазидину після черезшкірного коронарного втручання досліджена у рандомізованому подвійному сліпому плацебо-контрольованому дослідженні ATPCI. У пацієнтів, які нещодавно перенесли черезшкірне коронарне втручання, триметазидин не перевершував плацебо у зниженні несприятливих серцево-судинних подій. Потенційне пояснення цьому — більш низька, ніж очікувалось, частота клінічних подій та оптимальне лікування, при якому майже 100 % пацієнтів отримували подвійну антиагрегантну терапію і більше 95 % пацієнтів отримували статини. Таким чином, пацієнти не мали класичних проявів перебігу стенокардії, тому триметазидин у таких пацієнтів призначався не відповідно до показань до його застосування. Але в цьому дослідженні однозначно підтверджена безпека застосування триметазидину. Це дослідження ще раз підтвердило правило, що вчасно проведена реваскуляризація в пацієнтів з нещодавно встановленим діагнозом стенокардії (≤ 12 місяців), призначення адекватної медикаментозної терапії для вторинної профілактики значно зменшує ризик прогресування та/або несприятливих серцево-судинних подій (European Heart Journal. ESC Guidelines, 2019).
Фармакологічні шляхи лікування стенокардії включають зниження потреби у кисні та збільшення доставки кисню. Для цього застосовуються різні групи препаратів: β-адреноблокатори, антагоністи кальцію, нітрати, цитопротектори тощо.
Щодо енергетичного забезпечення, існує 2 шляхи забезпечення клітин енергією — з глюкози та з вільних жирних кислот. Якщо в умовах ішемії зменшується доставка кисню, то глюкозний шлях дозволяє збільшувати утворення аденозинтрифосфату (АТФ). Саме препарати тіазотної кислоти сприяють включенню цього механізму. Тіотриазолін® — оригінальний вітчизняний препарат тіазотної кислоти.
Основні ефекти препаратів тіазотної кислоти (Бєлєнічев І.Ф. із співавт., 2019):
- антиоксидантний: прямий механізм переходу вільних радикалів кисню і активних форм кисню у неактивний стан, непрямий — реактивує антиоксидантні ферменти і захищає від перевитрати ендогенні антиоксиданти (альфа-токоферол, глутатіон);
- протиішемічний та енерготропний — збільшує синтез АТФ, нормалізує дихальний ланцюжок мітохондрій;
- протизапальний — зменшує вміст циркулюючих імунних комплексів;
- мембраностабілізуючий — зберігає цілісність мембран клітин, нормалізує трансмембранні процеси;
- репаративний — стимулює регенерацію епітелію;
- антиапоптичний.
Тіотриазолін® має здатність підвищувати компенсаторну активацію анаеробного гліколізу, зменшувати пригнічення процесів окислення у циклі Кребса зі збереженням резерву АТФ, активувати антиоксидантну систему, поліпшувати реологічні якості крові за рахунок активації фібринолітичної системи, знижувати чутливість серцевого м’яза до катехоламінів. Все це поліпшує метаболізм серцевого м’яза, стабілізує зону некрозу та зменшує зону ішемії міокарда.
Тіольна група в структурі препаратів тіазотної кислоти є пасткою для активних форм кисню та вільних радикалів, регулює окислення/відновлення тіольних груп мітохондріальної пори і гальмує формування мітохондріальної дисфункції, енергодефіциту та апоптозу. Наявність в молекулі тіазотної кислоти тіольної групи дозволяє цьому препарату регулювати швидкість відкриття циклоспорин-
А-залежної мітохондріальної пори, зберігати заряд її мембрани, а також збільшувати внутрішньомітохондріальну концентрацію білка теплового шоку — HSP70, що виконує роль ендогенного цито- та органопротектора.
Ефективність Тіотриазоліну доведена у багатьох клінічних дослідженнях. Додавання Тіотриазоліну до базисної терапії стенокардії вірогідно поліпшує антиішемічний ефект лікування (Солобюкова, 2015). Застосування Тіотриазоліну дозволяє знизити частоту як передсердних, так і шлуночкових екстрасистол (Савченко М.А., 2013). Тіотриазолін® ефективніше за мельдоній збільшує тривалість фізичного навантаження та зменшує кількість епізодів ішемії (звіт клінічного дослідження «Відкрите порівняльне рандомізоване дослідження оцінки ефективності та переносимості лікарського препарату Тіотриазолін®»). Тіотриазолін® у добовій дозі 600 мг ефективно знижує тривалість епізодів ішемії у пацієнтів зі стабільною стенокардією навіть порівняно з оригінальним триметазидином (Нетяженко В.З., 2010).
На основі доведеної ефективності препаратів тіазотної кислоти був розроблений препарат Антарес® (діюча речовина — морфолінієва сіль тіазотної кислоти), що містить подвоєне дозування тіазотної кислоти. Ефективність препарату Антарес® при стабільній стенокардії була додатково підтверджена у відкритому нерандомізованому післямаркетинговому дослідженні ЕПАСС.
У дослідженні взяли участь 30 пацієнтів, середній вік яких становив 72,8 року (від 57 до 84 років), із них жінок — 37 %, чоловіків — 63 %.
Головний критерій ефективності при дослідженні — збільшення тривалості фізичного навантаження за результатами навантажувальних тестів:
- зменшення кількості нападів стенокардії/задишки на тиждень;
- зменшення потреби у нітратах;
- зменшення кількості аритмій за даними холтерівського моніторування;
- поліпшення варіабельності ритму серця.
Критерії включення пацієнтів у дослідження:
- діагноз: ІХС, стабільна стенокардія напруження ІІ–ІІІ функціонального класу;
- підписана інформована згода на участь у дослідженні;
- пацієнти, стан яких буде залишатись прогнозовано стабільним протягом всього періоду участі у дослідженні;
- готовність і здатність пацієнта виконувати умови протоколу дослідження.
Протокол дослідження включав:
1) підпис інформованої згоди на участь у дослідженні;
2) призначення препарату Антарес® внутрішньом’язово 2 рази на день по 4 мл протягом 14 діб;
3) на 15-й день — призначення препарату Антарес® у таблетках перорально по 200 мг 3 рази на день до 56-го дня;
4) на 56-й день дослідження проводився заключний візит.
Пацієнти суттєво не відрізнялись за клінічним профілем, віком тощо.
Всі пацієнти отримали зменшення нападів задишки, та лише у 10 % пацієнтів залишились класичні напади стенокардії. Було отримано збільшення переносимості фізичного навантаження при призначенні препарату Антарес® на 20 %, поліпшення варіабельності ритму серця при призначенні препарату Антарес® на 25 % у пацієнтів зі стабільною стенокардією.
Частка пацієнтів отримували Антарес® протягом не 8, а 12 тижнів (це пов’язано з карантинними обмеженнями в цьому році). Більш тривалий прийом препарату Антарес® збільшив переносимість фізичних навантажень не на 20 %, а на 32 %. Окремо був проведений аналіз збільшення толерантності до фізичного навантаження у різних вікових групах. У групі пацієнтів віком до 80 років відзначалось збільшення толерантності до фізичного навантаження на фоні прийому препарату Антарес® на 26 %, у групі пацієнтів віком 80 років і старше — на 14 %.
Висновки:
- підвищено статус препаратів, що чинять кардіометаболічну дію: метаболічна терапія є базовою складовою оптимальної медикаментозної терапії ІХС/стенокардії;
- Тіотриазолін® — оригінальний вітчизняний модулятор метаболізму кардіоміоцитів, що має додатковий антиоксидантний механізм дії, антиаритмічний ефект, є доведено ефективним антиішемічним засобом лікування;
- результати дослідження ефективності препарату Антарес® при стабільній стенокардії (ЕПАСС) довели його антиангінальну ефективність і збільшення тривалості фізичного навантаження в пацієнтів зі стабільною стенокардією в реальній клінічній практиці, в тому числі у хворих старше 80 років і при тривалості терапії 12 тижнів, при відсутності побічних ефектів та необхідності його відміни.
Д.м.н., професор, завідувач кафедри функціональної діагностики НМАПО імені П.Л. Шупика О.Й. Жарінов представив доповідь на тему «Роль блокаторів мінералокортикоїдних рецепторів у пацієнтів з різними варіантами серцевої недостатності». Професор коротко нагадав історію блокаторів мінералокортикоїдних рецепторів (МКР):
- 1955 р. — синтез альдостерону, описання первинного гіперальдостеронізму;
- 1960 р. — спіронолактон попереджує альдостерон-індукований некроз серця;
- 1960 р. — запуск спіронолактону як калійзберігаючого діуретика;
- 1987 р. — відкриття мінералокортикоїдних рецепторів і синтез еплеренону;
- 2003 р. — початок клінічного застосування еплеренону;
- 2010-ті рр. — вивчення нестероїдних блокаторів мінералокортикоїдних рецепторів.
Клінічні несприятливі ефекти альдостерону добре відомі: потенціація катехоламінів, затримка натрію, шлуночкові аритмії, дисфункція ендотелію, центральні пресорні ефекти, втрата калію та магнію, фіброз судин, тромбоз, фіброз міокарда. Все це призводить до пошкодження серця та судин. На початку застосування спіронолактон вважався антагоністом альдостерону, який ефективно блокував його негативні властивості. На сьогодні вже відомо, що спіронолактон — це блокатор мінералокортикоїдних рецепторів. Ці рецептори є в судинах, серці, нирках, і їх блокування дозволяє уникнути негативних наслідків їх активації (Cardiology in Review, 2005).
Професор надав огляд рекомендацій щодо застосування блокаторів МКР у пацієнтів із серцевою недостатністю в різних клінічних ситуаціях.
Серцева недостатність зі зниженою фракцією викиду лівого шлуночка. Блокатори МКР у європейських настановах з менеджменту серцевої недостатності пропонується призначати всім пацієнтам зі збереженням симптомів серцевої недостатності і фракцією викиду ≤ 35 %, незважаючи на терапію інгібіторами АПФ/блокаторами ренін-ангіотензинової системи і β-адреноблокаторами, для зниження ризику госпіталізації внаслідок серцевої недостатності і передчасної смерті (ESC HF, 2016).
Дослідження RALES (1999 р.) вивчало ефективність спіронолактону у хворих із серцевою недостатністю 3–4-го функціонального класу та фракцією викиду ≤ 35%. Отримано дані щодо 30% зниження ризику смерті на фоні прийому спіронолактону.
Дослідження EMPHASIS (2011 р.) вивчало ефективність еплеренону у хворих із серцевою недостатністю 2-го функціонального класу та фракцією викиду ≤ 35 та ≥ 30 %. В результаті отримані дані щодо 22% зниження ризику смерті при прийому еплеренону.
Дозування спіронолактону та еплеренону залежить від ШКФ (ACCF/AHA, 2013):
1) ШКФ більше 50 мл/хв/1,73 м2: еплеренон: початкова доза — 25 мг щодня, підтримуюча доза — 50 мг щодня; спіронолактон: початкова доза — 12,5–25 мг щодня, підтримуюча доза — 25 мг 1–2 р/д щодня;
2) ШКФ більше 30–49 мл/хв/1,73 м2: еплеренон: початкова доза — 25 мг через день, підтримуюча доза — 25 мг щодня; спіронолактон: початкова доза — 12,5–25 мг щодня або через день, підтримуюча доза — 12,5–25 мг щодня.
При цьому необхідний контроль рівня калію крові: при рівні калію більше 5 ммоль/л та/або погіршенні функції нирок прийом препарату групи блокаторів МКР слід зупинити до зниження рівня калію < 5 ммоль/л протягом як мінімум 72 годин, далі — відновити прийом у більш низькій дозі. Але слід пам’ятати, що ефективність цих препаратів є найвищою при досягненні цільової терапевтичної дози.
У дослідженні EMPHASIS також був продемонстрований рівень безпеки еплеренону. Ефективність і безпека даного препарату не залежать від фонових доз інгібіторів АПФ та β-блокаторів (Circ. Heart Fail., 2013).
Застосування блокаторів МКР при серцевій недостатності зі значно зниженою фракцією викиду лівого шлуночка та низьким артеріальним тиском не викликає подальшого зниження артеріального тиску (Serenelli M. et al. JACC Heart Fail., 2020).
У дослідженні 2003 року EPHESUS показано, що застосування еплеренону в дозі 25–50 мг у пацієнтів в ранньому періоді після перенесеного інфаркту міокарда позитивно впливало на виживання за рахунок зниження ризику раптової кардіальної смерті (Pitt B. et al. New Engl. J. Med., 2003).
У 2014 році опубліковано результати дослідження REMINDER, в якому отримано дані, що еплеренон попереджує розвиток ускладнень при інфаркті міокарда з елевацією сегмента ST без серцевої недостатності (Montalescot G. et al. Eur. Heart J. 2014. 35. 2295-302). А дослідження ефективності спіронолактону (ALBATROSS) у тій самій клінічній ситуації дало нейтральний результат (Montalescot G. et al. JACC. 2016. 67. 1917-27).
За результатами досліджень, опублікованих Європейським товариством кардіологів у 2017 році, було прописано, що всім пацієнтам з фракцією викиду ≤ 40 % і серцевою недостатністю або цукровим діабетом, які вже отримують інгібітори АПФ і β-адреноблокатори, мають бути призначені блокатори МКР, якщо немає ниркової недостатності та/або гіперкаліємії (ESC STEMI guidelines, 2017).
Вплив еплеренону на фібриляцію передсердь у хворих з нетяжкою серцевою недостатністю оцінювався у дослідженні EMPHASIS-HF (Swedberg et al. J. Am. Coll. Cardiol. 2012 May. 59 (18). 1598-1603). У пацієнтів із систолічною серцевою недостатністю еплеренон зменшив частоту повторного виникнення фібриляції або тріпотіння передсердь.
Вибір блокатора МКР (спіронолактон або еплеренон) залежить від ефектів, які хоче отримати лікар. Еплеренон — це вже активна діюча речовина, і дія препарату починається одразу, а блокування рецепторів до альдостерону є більш м’яким і стійким. Спіронолактон — це проліки, і тому його ефект починається через 8 годин від початку прийому препарату, а блокування рецепторів до альдостерону є більш вираженим, але зі значними коливаннями. Таким чином, еплеренон чинить більш селективну дію, що суттєво знижує частоту небажаних побічних ефектів (наприклад, гірсутизму). На вітчизняному фармацевтичному ринку еплеренон представлений препаратом Реніаль® таблетки, вкриті плівковою оболонкою, виробництва АТ «Київмедпрепарат», Корпорація «Артеріум», в дозуваннях 25 та 50 мг.
Серцева недостатність зі збереженою і помірно зниженою фракцією викиду лівого шлуночка. У сучасних європейських рекомендаціях (ESC HF Guidelines, 2016) вказано, що діуретики рекомендовано призначати пацієнтам з ознаками застою для полегшення симптомів і зменшення ознак серцевої недостатності. Доказова база є досить обмеженою. У американському дослідженні TOPCAT встановлено, що спіронолактон не покращує прогноз при серцевій недостатності зі збереженою фракцією викиду лівого шлуночка (TOPCAT: Pfeffer et al., AHA, 2013). Але у цьому дослідженні було показано, що в пацієнтів із проміжною фракцією викиду (45–49 %) ретроспективно виявлявся позитивний ефект спіронолактону.
Призначення блокаторів МКР обґрунтовано при серцевій недостатності зі збереженою фракцією викиду лівого шлуночка та резистентною АГ для зменшення негативних ефектів альдостерону, оскільки у цих пацієнтів часто спостерігається гіперальдостеронізм (Acelajado M.C., Calhoun D.A. Aldosteronism and resistant hypertension. Int. J. of Hypertension. 2011).
Наприкінці доповіді професор зауважив, що при корекції серцевої недостатності за допомогою комбінації нейрогуморальних препаратів важливо не поспішати відміняти препарати, що дозволили стабілізувати клінічну ситуацію та/або забезпечили регресію симптомів серцевої недостатності.
Таким чином, із проведенням нових клінічних досліджень поступово розширюється перелік показань для призначення блокаторів МКР. Вони обов’язково призначаються при серцевій недостатності зі зниженою фракцією викиду лівого шлуночка та при інфаркті міокарда з елевацією сегмента ST. Блокатори МКР мають сприятливий профіль при серцевій недостатності з помірно зниженою фракцією викиду лівого шлуночка. Також призначення блокаторів МКР обґрунтовано при серцевій недостатності зі збереженою фракцією викиду лівого шлуночка та резистентною АГ, оскільки у цих пацієнтів часто спостерігається гіперальдостеронізм. На сьогодні доведена перевага еплеренону перед спіронолактоном, особливо щодо ефективності та переносимості.

/3_u.jpg)
/4_u.jpg)