Журнал "Гастроэнтерология" Том 54, №3, 2020
Вернуться к номеру
Особливості цитокінового балансуу хворих із передраковими станами шлунка залежно від змін у структурі щитоподібної залози
Авторы: Мосійчук Л.М., Кушніренко І.В., Татарчук О.М., Коненко І.С., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
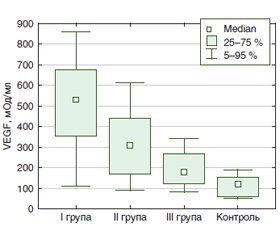
Актуальність. Пошук загальних ланок патогенезу коморбідності при передракових станах шлунка і захворюваннях щитоподібної залози не втрачає актуальності. Саме в цьому аспекті важливим є дослідження цитокінової ланки імунної системи організму при поєднанні цих захворювань. Мета дослідження: визначити особливості цитокінового балансу за рівнем васкулоендотеліального фактора росту (VEGF), туморнекротизуючого фактора (TNF) α, інтерлейкінів (ІЛ) 8 та 18 у хворих із передраковими станами шлунка залежно від змін у структурі щитоподібної залози. Матеріали та методи. Обстежено 45 хворих із передраковими станами шлунка. Критерії включення до обстеження: кишкова метаплазія в тілі та/або антральному відділі шлунка, атрофія в тілі шлунка. За результатами ультразвукового дослідження щитоподібної залози (ЩЗ) пацієнти розподілені на групи: І група — 19 осіб із вузловими змінами, ІІ група — 18 осіб із дифузними змінами, ІІІ — 8 осіб без змін у ЩЗ. Контрольну групу становили 10 здорових осіб. У сироватці крові визначали рівень ІЛ-8, ІЛ-18, TNF-α, VEGF імуноферментним методом з використанням наборів реактивів фірми «Вектор-БЕСТ», м. Новосибірськ. Результати. У 82,2 % пацієнтів із передраковими станами шлунка виявили зміни в структурі ЩЗ (n = 37), вузлові зміни — у 42,2 % хворих (n = 19). Концентрація ІЛ-8 у хворих І групи була вищою порівняно з ІІ, ІІІ та контрольною групами — у 2,0 раза (р < 0,05), у 2,7 (р < 0,05) та в 3,1 раза (р < 0,05) відповідно. Концентрація TNF-α у І групі була вірогідно вищою порівняно з ІІ, ІІІ та контрольною групами у 2,3 раза (р < 0,05), у 3,5 раза (р < 0,05) та в 1,4 раза (р < 0,05) відповідно. Установлено кореляційний зв’язок рівня TNF-α із ІЛ-8 (r = 0,487, р = 0,001). Рівень VEGF був вірогідно підвищений у І групі в 4,3 раза (р < 0,05) та у ІІ групі у 2,5 раза (р < 0,05) порівняно з контролем. Також у хворих І групи його вміст був вірогідно вищий в 1,7 та 2,9 раза порівняно з ІІ та ІІІ групами (р < 0,01 і р < 0,001 з урахуванням поправки Бонферроні відповідно). За результатами Kruskal — Wallis test різниця рівня VEGF між групами становила 0,002. Експресія VEGF корелює з рівнем TNF-α (r = 0,442, р = 0,004) та ІЛ-8 (r = 0,319, р = 0,042). Установлено пряму асоціацію між рівнем VEGF та виявленням одночасно кишкової метаплазії в тілі та антрумі (r = 0,443, р = 0,008), кишкової метаплазії в тілі, антрумі та куті шлунка (r = 0,404, р = 0,024), кишкової метаплазії в тілі шлунка (r = 0,340, р = 0,039). Висновки. У пацієнтів із передраковими станами шлунка у 82,2 % випадків виявлено зміни в структурі ЩЗ, що супроводжуються підвищенням рівня VEFG, який прямо корелює з наявністю кишкової метаплазії в шлунку. У 42,2 % хворих виявлено вузлові зміни в ЩЗ, що супроводжуються також і підвищенням рівнів ІЛ-8 та TNF-α. Такі дані свідчать про важливість подальшого вивчення ролі цитокінів у розвитку коморбідності при передракових станах шлунка.
Актуальность. Поиск общих звеньев патогенеза коморбидности при предраковых состояниях желудка и заболеваниях щитовидной железы не теряет актуальности. Именно в этом аспекте важным является изучение цитокинового звена имунной системы организма при сочетании таких заболеваний. Цель исследования: изучить особенности цитокинового баланса по уровню васкулоэндотелиального фактора роста (VEGF), туморнекротизирующего фактора (TNF) α, интелейкинов (ИЛ) 8 и 18 у пациентов с предраковыми состояниями желудка в зависимости от изменений структуры щитовидной железы. Материалы и методы. Обследовано 45 пациентов с предраковыми состояниями желудка. Критерии включения в обследование: кишечная метаплазия в теле и/или антральном отделе желудка, атрофия в теле желудка. По результатам ультразвукового обследования щитовидной железы (ЩЖ) пациенты разделены на группы: І группа — 19 пациентов с узловыми изменениями, ІІ группа — 18 пациентов с диффузными изменениями, ІІІ — 8 пациентов без изменений в ЩЖ. Контрольную группу составили 10 здоровых лиц. В сыворотке крови определяли уровень ІЛ-8, ІЛ-18, TNF-α, VEGF иммуноферментным методом с использованием наборов реактивов фирмы «Вектор-БЕСТ», г. Новосибирск. Результаты. У 82,2 % пациентов с предраковыми состояниями желудка выявили изменения в структуре ЩЖ (n = 37), узловые изменения — у 42,2 % больных (n = 19). Концентрация ИЛ-8 у пациентов І группы была выше по сравнению со ІІ, ІІІ и контрольной группами — в 2,0 раза (р < 0,05), в 2,7 (р < 0,05) и в 3,1 раза (р < 0,05) соответственно. Концентрация TNF-α в І группе была достоверно выше по сравнению со ІІ, ІІІ и контрольной группами в 2,3 раза (р < 0,05), в 3,5 раза (р < 0,05) и в 1,4 раза (р < 0,05) соответственно. Установлена корреляционная связь уровня TNF-α с ИЛ-8 (r = 0,487, р = 0,001). Уровень VEGF был достоверно повышен в І группе в 4,3 раза (р < 0,05) и во ІІ группе в 2,5 раза (р < 0,05) по сравнению с контролем. Также у пациентов І группы его содержание было достоверно выше в 1,7 и в 2,9 раза по сравнению со ІІ и ІІІ группами (р < 0,01 і р < 0,001 с учетом поправки Бонферрони соответственно). По результатам Kruskal — Wallis test, разница уровня VEGF между групами составила 0,002. Экспрессия VEGF коррелирует с уровнем TNF-α (r = 0,442, р = 0,004) и ИЛ-8 (r = 0,319, р = 0,042). Установлена прямая ассоциация между уровнем VEGF и выявлением одновременно кишечной метаплазии в теле и антруме (r = 0,443, р = 0,008), кишечной метаплазии в теле, антруме и углу желудка (r = 0,404, р = 0,024), кишечной метаплазии в теле желудка (r = 0,340, р = 0,039). Выводы. У пациентов с предраковыми состояниями желудка в 82,2 % случаев выявлены изменения в структуре ЩЖ, которые сопровождаются повышением уровня VEFG, который прямо коррелирует с кишечной метаплазией в желудке. У 42,2 % пациентов выявлены узловые изменения в ЩЖ, которые сопровождаются также и повышением уровней ИЛ-8 и TNF-α. Такие данные свидетельствуют о важности дальнейшего изучения роли цитокинов в развитии коморбидности при предраковых состояних желудка.
Background. The study of the cytokine balance is important due to searching the general links of the pathogenesis of comorbidity in precancerous gastric lesions and thyroid diseases. The purpose was to determine the peculiarities of the cytokine balance in terms of the level of vascular endothelial growth factor (VEGF), tumor necrotizing factor (TNF) α, interleukins (IL) 8 and IL-18 in patients with precancerous gastric lesions depending on the changes in the structure of the thyroid gland. Materials and methods. Forty-five patients with precancerous gastric lesions were examined. Inclusion criteria were as follows: intestinal metaplasia in the body and/or antrum, atrophy in the body of the stomach. According to the results of an ultrasound examination of the thyroid gland, patients are divided into the groups: group I — 19 patients with nodular changes, group II — 18 patients with diffuse changes, and group III — 8 patients without changes. The control group included 10 healthy individuals. The level of IL-8, IL-18, TNF-α, VEGF was determined in the blood serum by the enzyme immunoassay using reagent kits of the Vector-BEST company, Novosibirsk, Russia. Results. 82.2 % patients with precancerous gastric lesions developed the changes in the structure of the thyroid gland (n = 37), 42.2 % (n = 19) had nodular changes in. The concentration of IL-8 in patients of group I was higher compared with group II, III and control group by 2.0 (p < 0.05), 2.7 (p < 0.05), and 3.1 times (p < 0.05), respectively. The concentration of TNF-α in group I was significantly higher compared with the II, III and control groups by 2.3 (p < 0.05), 3.5 (p < 0.05), and 1.4 times (p < 0.05), respectively. A correlation between the level of TNF-α and IL-8 (r = 0.487, p = 0.001) was established. The level of VEGF was significantly increased in group I by 4.3 times (p < 0.05) and in group II by 2.5 times (p < 0.05) compared with the control. Also, in patients of group I, its content was significantly higher — 1.7 and 2.9 times compared with groups II and III (p < 0.01 and p < 0.001, taking into account the Bonferroni correction, respectively). According to the results of the Kruskal-Wallis test, the difference in VEGF level between groups was 0.002. VEGF expression correlates with the level of TNF-α (r = 0.442, p = 0.004) and with the level of IL-8 (r = 0.319, p = 0.042). A direct association was found between the level of VEGF and the simultaneous detection of intestinal metaplasia in the body and antrum (r = 0.443, p = 0.008), intestinal metaplasia in the body, antrum and angle of the stomach (r = 0.404, p = 0.024), intestinal metaplasia in the stomach body (r = 0.340, p = 0.039). Conclusions. 82.2 % patients with precancerous gastric lesions were found to have the changes in the structure of the thyroid gland, which is accompanied by an increase in the VEFG level, which directly correlates with the intestinal metaplasia in the stomach. 42.2 % of patients showed nodular changes in the thyroid gland, which is also accompanied by an increase in the levels of IL-8 and TNF-α. Such data indicate the importance of further studying of the role of cytokines in the development of comorbidity in precancerous gastric lesions.
атрофія; метаплазія; дисплазія; щитоподібна залоза; цитокіни; васкулоендотеліальний фактор росту
атрофия; метаплазия; дисплазия; щитовидная железа; цитокины; васкулоэндотелиальный фактор роста
atrophy; metaplasia; dysplasia; thyroid gland; cytokines; vascular endothelial growth factor
Вступ
Матеріали та методи
/16.jpg)
Результати
Обговорення
Висновки
- Brown A.R., Simmen R.C., Simmen F.A. The role of thyroid hormone signaling in the prevention of digestive system cancers. Int. J. Mol. Sci. 2013. № 14(8). P. 16240-16257. DOI: 10.3390/ijms140816240.
- Kandemir E.G., Yonem A., Narin Y. Gastric Carcinoma and Thyroid Status. The Journal of International Medical Research. 2005. № 33. Р. 222-227. DOI: 10.1177/147323000503300210.
- Abnet C.C., Fan J.H., Kamangar F. et al. Self-reported goiter is associated with a significantly increased risk of gastric noncardia adenocarcinoma in a large population-based Chinese cohort. Int. J. Cancer. 2006. № 119(6). Р. 1508-1510. DOI: 10.1002/ijc.21993.
- Shen Z., Qin Y., Liu Y. et al. Helicobacter pylori Infection Is Associated with the Presence of Thyroid Nodules in the Euthyroid Population. PLoS ONE. 2013. № 8(11). P. e80042. DOI: 10.1371/journal.pone.0080042.
- Behrouzian R., Aghdami N. Urinary iodine/creatinine ratio in patients with stomach cancer in Urmia, Islamic Republic of Iran. East Mediterr. Health J. 2004. № 10(6). P. 921-924. PMID: 16335780.
- Gołkowski F., Szybiński Z., Rachtan J. et al. Iodine prophylaxis — the protective factor against stomach cancer in iodine deficient areas. European Journal of Nutrition. 2007. № 46. P. 251-256. DOI: 10.1007/s00394-007-0657-8.
- Майкова Т.В., Кушніренко І.В., Залюбовська О.І., Пушкіна М.І. Поєднана патологія гастродуоденальної зони і щитовидної залози: механізми формування, підходи до багатофакторної діагностики і патогенетичного лікування: Посібник для лікарів. Київ: KVIZ, 2012. 128 с.
- Portela-Gomes G.M., Albuquerque J.P., Ferra M.A. Serotonin and gastrin cells in rat gastrointestinal tract after thyroparathyroidectomy and induced hyperthyroidism. Dig. Dis. Sci. 2000. № 45(4). P. 730-735. DOI: 10.3748/wjg.v18.i33.4570.
- Rafsanjani F.N., Asl S.Z.., Naseri M.K., Vahedian J. Effects of thyroid hormones on basal and stimulated gastric acid secretion due to histamine, carbachol and pentagastrin in rats. Saudi Med. J. 2003. № 24(4). P. 341-346. PMID: 12754530.
- Lee J.H., Kwon O.D., Ahn S.H. Reduction of gastrointestinal motility by unilateral thyroparathyroidectomy plus subdiaphragmatic vagotomy in rats. World J. Gastroenterol. 2012. № 18(33). P. 4570-4577. DOI: 10.3748/wjg.v18.i33.4570.
- Kahraman H., Kaya N., Demirçali A. et al. Gastric emptying time in patients with primary hypothyroidism. Eur. J. Gastroenterol. Hepatol. 1997. № 9(9). P. 901-904. DOI: 10.1097/00042737-199709000-00014.
- Santi A., Duarte M.M., Moresco R.N. et al. Association between thyroid hormones, lipids and oxidative stress biomarkers in overt hypothyroidism. Clin. Chem. Lab. Med. 2010. № 48(11). P. 1635-1639. DOI: 10.1515/CCLM.2010.309.
- Stenken J.A., Poschenrieder A.J. Bioanalytical chemistry of cytokines — a review. Anal. Chim. Acta. 2015. № 853. P. 95-115. DOI: 10.1016/j.aca.2014.10.009.
- Simbircev А.S, Totoljan A.A. Cytokines in laboratory diagnostics. Infectious diseases: news, opinions, education. 2015. № 2. P. 82-98.
- Rajendra S.A., Chen D.S., Ferrara N. VEGF in Signaling and Disease: Beyond Discovery and Development. Cell. 2019. № 176(6). P. 1248-1264. DOI: 10.1016/j.cell.2019.01.021.
- Ferrara N. Vascular endothelial growth factor: basic science and clinical progress. Endocr. Rev. 2004. № 25(4). P. 581-611. DOI: 10.1210/er.2003-0027.
- Carmeliet P. VEGF as a key mediator of angiogenesis in cancer. Oncology. 2005. № 69(3). P. 4-10. DOI: 10.1159/000088478.
- Matsumoto K., Ema M. Roles of VEGF-A signalling in development, regeneration, and tumours. The Journal of Biochemistry. 2014. № 156(1). P. 1-10. DOI: org/10.1093/jb/mvu031.
- Costache M.I., Ioana M., Iordache S. et al. VEGF Expression in Pancreatic Cancer and Other Malignancies: A Review of the Literature. Rom. J. Intern. Med. 2015. № 53(3). P. 199-208. DOI: 10.1515/rjim-2015-0027.
- Siveen K.S., Prabhu K., Krishnankutty R. et al. Vascular Endothelial Growth Factor (VEGF) Signaling in Tumour Vascularization: Potential and Challenges. Curr. Vasc. Pharmacol. 2017. № 15(4). P. 339-351. DOI: 10.2174/1570161115666170105124038.
- Melincovici C.S., Boşca A.B., Şuşman S. et al. Vascular endothelial growth factor (VEGF) — key factor in normal and pathological angiogenesis. Rom. J. Morphol. Embryol. 2018. № 59(2). P. 455-467. PMID: 30173249.
- Moehler M., Gepfner-Tuma I., Maderer A. et al. Sunitinib added to FOLFIRI versus FOLFIRI in patients with chemorefractory advanced adenocarcinoma of the stomach or lower esophagus: a randomized, placebo-controlled phase II AIO trial with serum biomarker program. BMC Cancer. 2016. № 16. P. 699. DOI: 10.1186/s12885-016-2736-9.
- Ferrara N., Hillan K.J., Novotny W. Bevacizumab (Avastin), a humanized anti-VEGF monoclonal antibody for cancer therapy. Biochem. Biophys. Res. Commun. 2005. № 333(2). P. 328-335. DOI: 10.1016/j.bbrc.2005.05.132.
- Ferrari S.M., Centanni M., Virili C. et al. Sunitinib in the Treatment of Thyroid Cancer. Curr. Med. Chem. 2019. № 26(6). P. 963-972. DOI: 10.2174/0929867324666171006165942.
- hang X., Zhou Y., Wu X. et al. Cytoreductive surgery for metastatic gastrointestinal stromal tumors followed by sunitinib compared to followed by imatinib-a multi-center cohort study. Eur. J. Surg. Oncol. 2019. № 45(3). P. 318-323. DOI: 10.1016/j.ejso.2018.08.001.
- Ferrara N., Adamis A. P. Ten years of anti-vascular endothelial growth factor therapy. Nat. Rev. Drug. Discov. 2016. № 15(6). P. 385-403. DOI: 10.1038/nrd.2015.17.
- Frezzetti D., Gallo M., Maiello M.R. et al. VEGF as a potential target in lung cancer. Expert Opin Ther Targets. 2017. № 21(10). P. 959-966. DOI: 10.1080/14728222.2017.1371137.
- Wang X.Y., Wang L.L., Zheng X. et al. Expression of p-STAT3 and vascular endothelial growth factor in MNNG-induced precancerous lesions and gastric tumors in rats. World J. Gastrointest Oncol. 2016. № 8(3). P. 305-313. DOI: 10.4251/wjgo.v8.i3.305.
- Raica M., Mogoantă L., Cîmpean A.M. et al. Immunohistochemical expression of vascular endothelial growth factor (VEGF) in intestinal type gastric carcinoma. Rom. J. Morphol. Embryol. 2008. № 49(1). P. 37-42. PMID: 18273500.
- Liu D., He Q., Liu C. Correlations among Helicobacter pylori infection and the expression of cyclooxygenase-2 and vascular endothelial growth factor in gastric mucosa with intestinal metaplasia or dysplasia. J. Gastroenterol. Hepatol. 2010. № 25(4). P. 795-799. DOI: 10.1111/j.1440-1746.2009.06168.x.
- Kim J.Y., Jeon T.J., Bae B.N. et al. The prognostic significance of growth factors and growth factor receptors in gastric adenocarcinoma. APMIS. 2013. № 121(2). P. 95-104. DOI: 10.1111/j.1600-0463.2012.02942.x.
- Siregar G.A., Halim S., Sitepu V.R. Serum TNF-a, IL-8, VEGF levels in Helicobacter pylori infection and their association with degree of gastritis. Acta Med. Indones. 2015. № 47(2). P. 120-126. PMID: 26260554.
- Siregar G., Sari D., Sungkar T. Serum VEGF Levels in Helicobacter pylori Infection and Correlation with Helicobacter pylori cagA and vacA Genes. Maced J. Med. Sci. 2017. № 5(2). P. 137-141. DOI: 10.3889/oamjms.2017.031.
- Aksoy E.K., Akpınar M.Y., Doğan Ö. et al. Clinical Significance of Serum Vascular Endothelial Growth Factor, Pigment Epithelium-Derived Factor, Tumor Necrosis Factor Alpha, and Progranulin Levels in Patients with Gastric Cancer and Gastric Precancerous Lesions. J. Gastrointest. Cancer. 2019. № 50(3). P. 537-542. DOI: 10.1007/s12029-019-00251-8.
- Klein M., Catargi B. VEGF in physiological process and thyroid disease. Ann. Endocrinol (Paris). 2007. № 68(6). P. 438-448. DOI: 10.1016/j.ando.2007.09.004.
- Su J.J., Hui L.Z., Xi C.J., Su G.Q. Correlation analysis of ultrasonic characteristics, pathological type, and molecular markers of thyroid nodules. Genet. Mol. Res. 2015. № 14(1). P. 9-20. DOI: 10.4238/2015.
- Bilgici B., Ecemis G.C., Tuncel O.K. et al. VEGF and GM-CSF levels in nodular thyroid diseases. Endocrine. 2014. № 45(1). P. 61-66. DOI: 10.1007/s12020-013-9945-7.
- Haytaoglu G., Kuzu F., Arpaci D. et al. Correlation of vascular endothelial growth factor and vascular endothelial growth factor receptor-1 levels in serum and thyroid nodules with histopathological and radiological variables. J. Lab. Physicians. 2019. № 11(1). P. 51-57. DOI: 10.4103/JLP.JLP_41_18.
- Kilic I., Guldiken S., Sipahi T. et al. Investigation of VEGF and IL-8 Gene Polymorphisms in Patients with Differentiated Thyroid Cancer. Clin. Lab. 2016. № 62(12). P. 2319-2325. DOI: 10.7754/Clin. Lab.2016.160403.
- Coperchini F., Pignatti P., Carbone A. et al. TNF-α increases the membrane expression of the chemokine receptor CCR6 in thyroid tumor cells, but not in normal thyrocytes: potential role in the metastatic spread of thyroid cancer. Tumour Biol. 2016. № 37(4). P. 5569-5575. DOI: 10.1007/s13277-015-4418-7.
- Li Z.W., Wu Y., Sun Y. et al. Inflammatory cytokine gene polymorphisms increase the risk of atrophic gastritis and intestinal metaplasia. World J. Gastroenterol. 2010. № 16(14). P. 1788-1794. DOI: 10.3748/wjg.v16.i14.1788.
- Wang Y.M., Li Z.X., Tang F.B. et al. Association of genetic polymorphisms of interleukins with gastric cancer and precancerous gastric lesions in a high-risk Chinese population. Tumour Biol. 2016. № 37(2). P. 2233-2242. DOI: 10.1007/s13277-015-4022-x.

/16_2.jpg)
/17.jpg)