Журнал «Почки» Том 9, №2, 2020
Вернуться к номеру
Нирки та вегетативна дисфункція у дітей і підлітків (частина I)
Авторы: Вакуленко Л.І.
ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
У статті обговорюються механізми взаємодії, розвитку і прогресування серцево-судинних ускладнень у дітей та підлітків із хронічною хворобою нирок. Підкреслюється провідна роль вегетативних порушень у розвитку серцево-судинних порушень. Розглядаються механізми, за допомогою яких підвищення активності симпатичної частини вегетативної нервової системи призводить до ураження нирок. Взаємодія симпатичної нервової та ренін-ангіотензинової систем при формуванні порушень з боку серцево-судинної системи та нирок розглядається як складова адаптаційно-пристосувального процесу організму. Універсальним патогенетичним фактором, який неодмінно супроводжує розвиток вегетативних дисфункцій та хронічної хвороби нирок у дітей і підлітків, є активація ренін-ангіотензинової системи. Спільні механізми розвитку кардіоренальних порушень визначають подальший односпрямований підхід до діагностики та лікування.
В статье обсуждаются механизмы взаимодействия, развития и прогрессирования сердечно-сосудистых осложнений у детей и подростков с хронической болезнью почек. Подчеркивается главенствующая роль вегетативных нарушений в развитии сердечно-сосудистых нарушений. Рассматриваются механизмы, с помощью которых повышение активности симпатической части вегетативной нервной системы приводит к поражению почек. Взаимодействие симпатической нервной и ренин-ангиотензиновой систем при формировании нарушений со стороны сердечно-сосудистой системы и почек рассматривается как составляющая адаптационно-приспособительного процесса организма. Универсальным патогенетическим фактором, который непременно сопровождает развитие вегетативных дисфункций и хронической болезни почек у детей и подростков, является активация ренин-ангиотензиновой системы. Общие механизмы развития кардиоренальных нарушений определяют дальнейший однонаправленный подход к диагностике и лечению.
The article discusses the mechanisms of interaction, development and progress of cardiovascular complications in children and adolescents with chronic kidney disease. The dominant role of autonomic dysfunction in the development of cardiovascular disorders is emphasized. The mechanisms are described by which an increase in the activity of sympathetic part of autonomic nervous system leads to kidney damage. Interaction of sympathetic nervous system and renin-angiotensin system during the formation of cardiovascular and kidney diseases is considered as a component of adaptive process of the body. The universal pathogenetic factor that accompanies the development of autonomic dysfunction and chronic kidney disease in children and adolescents is activation of renin-angiotensin system. The general mechanisms for the development of cardio-renal disorders determine further unidirectional approaches to the diagnosis and treatment.
діти; хронічна хвороба нирок; вегетативна дисфункція; артеріальна гіпертензія
дети; хроническая болезнь почек; вегетативная дисфункция; артериальная гипертензия
children; chronic kidney disease; autonomic dysfunction; arterial hypertension
Вступ
Вегетативні порушення у дітей та підлітків із хронічною хворобою нирок
Вегетативні дисфункції у дітей та підлітків
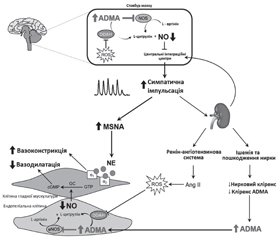
Патогенез гіперсимпатикотонії
Гіперсимпатикотонія та ендотеліальна дисфункція
Наступний компонент РААС — альдостерон
Підвищена ниркова аферентна імпульсація
Наслідки гіперсимпатикотонії
Висновки
- Raina R., Nair N., Chakraborty R., Nemer L., Dasgupta R., Varian K. An Update on the Pathophysiology and Treatment of Cardiorenal Syndrome. Cardiol. Res. 2020. 11(2). 76-88. doi: 10.14740/cr955.
- Иванов Д.Д., Курята А.В., Гармиш И.П. Блокаторы ренин-ангиотензин-альдостероновой системы: хроническая болезнь почек и сердечно-сосудистый риск. Почки. 2018. 7(2). 81-90. doi: 10.22141/2307-1257.7.2.2018.127393.
- Rangaswami J., Bhalla V., Blair J.E.A. et al. Cardiorenal Syndrome: Classification, Pathophysiology, Diagnosis, and Treatment Strategies: A Scientific Statement From the American Heart Association. Circulation. 2019. 139(16). e840–e878. doi: 10.1161/CIR.0000000000000664.
- Ronco C., Bellasi A., Di Lullo L. Cardiorenal Syndrome: An Overview. Adv. Chronic. Kidney Dis. 2018. 25(5). 382-390. doi: 10.1053/j.ackd.2018.08.004.
- Olowu W.A. Epidemiology, pathophysiology, clinical characteristics and management of childhood cardiorenal syndrome. World J. Nephrol. 2012. 1(1). 16-24. doi: 10.5527/wjn.v1.i1.16.
- Tian J., Niu L., An X. Cardiovascular risks in chronic kidney disease pediatric patients. Exp. Ther. Med. 2017. 14(5). 4615-4619. doi: 10.3892/etm.2017.5117.
- Mitsnefes M.M. Cardiovascular disease in children with chronic kidney disease. J. Am. Soc. Nephrol. 2012. 23. 578-585. doi: 10.1681/ASN.2011111115.
- Hsu C.N., Lu P.C., Lo M.H., Lin I.C., Tain Y.L. The Association between Nitric Oxide Pathway, Blood Pressure Abnormalities, and Cardiovascular Risk Profile in Pediatric Chronic Kidney Disease. Int. J. Mol. Sci. 2019. 20(21). 5301. doi: 10.3390/ijms20215301.
- Skrzypczyk P., Okarska-Napierała M., Stelmaszczyk-Emmel A., Górska E., Pańczyk-Tomaszewska M. Renalase in children with chronic kidney disease. Biomarkers. 2019. 24(7). 638-644. doi: 10.1080/1354750X.2019.1642957.
- Wilson A.C., Schneider M.F., Cox C. et al. Prevalence and correlates of multiple cardiovascular risk factors in children with chronic kidney disease. Clin. J. Am. Soc. Nephrol. 2011. 6. 2759-2765. doi: 10.2215/CJN.03010311.
- Vidi SR. Role of hypertension in progression of chronic kidney disease in children. Curr. Opin. Pediatr. 2018. 30(2). 247-251. doi: 10.1097/MOP.0000000000000595.
- Barletta G.M., Flynn J., Mitsnefes M. et al. Heart rate and blood pressure variability in children with chronic kidney disease: a report from the CKiD study. Pediatr. Nephrol. 2014. 29(6). 1059-1065. doi: 10.1007/s00467-013-2737-8.
- Suessenbach F.K., Burckhardt B.B. Levels of angiotensin peptides in healthy and cardiovascular/renal-diseased paediatric population — an investigative review. Heart Failure Reviews. 2019. 24. 709-723. https://doi.org/10.1007/s10741-019-09797-y.
- Іванов Д.Д. Нефрологія «під мікроскопом»: міждисциплінарні аспекти. Нирки і артеріальна гіпертензія. Український медичний часопис. 2019. Т. VII/VIII. 4(132).
- Vakulenko L.I. 24-hour blood pressure profile in children with chronic pyelonephritis and chronic kidney disease stages I–III. Kidneys. 2019. 8(3). 66-72.
- Flynn J.T., Kaelber D.C., Baker-Smith C.M. et al. Clinical Practice Guideline for Screening and Management of High Blood Pressure in Children and Adolescents. Pediatrics. 2017. 140. 1-72. e20171904. doi: 10.1542/peds.2017-1904.
- Wühl E., Schaefer F. Treatment of Hypertension in Chronic Kidney Disease. In: Lurbe E., Wühl E. (eds). Hypertension in Children and Adolescents. 2019. Updates in Hypertension and Cardiovascular Protection. Springer, Cham. Р. 239-255.
- Halbach S., Flynn J. Treatment of hypertension in children with chronic kidney disease. Curr. Hypertension Rep. 2015. 17(1). 503. doi: 10.1007/s11906-014-0503-3.
- Kamath N., Iyengar A., George N., Luyckx V.A. Risk Factors and Rate of Progression of CKD in Children. Kidney Int. Rep. 2019. 4(10). 1472-1477. DOI: 10.1016/j.ekir.2019.06.004.
- Becker B.K., Zhang D., Soliman R., Pollock D.M. Autonomic nerves and circadian control of renal function. Auton. Neurosci. 2019. 217. 58-65. doi: 10.1016/j.autneu.2019.01.003.
- Вейн А.М., Вознесенская Т.Г., Воробьева О.В. Вегетативные расстройства: клиника, диагностика, лечение: рук-во для врачей. М.: МИА, 2010. 637 с.
- Неудахин Е.В. Обоснование энерготропной терапии вегетативных расстройств у детей. РМЖ. 2018. 2(ІІ). 107-112.
- Чутко Л.С., Сурушкина С.Ю., Яковенко Е.А., Корнишина Т.Л. Вегетососудистая дистония у детей и подростков. Клинико-психофизиологические проявления и терапия (обзор). Практика педиатра. 2019. 3. 17-21.
- Майданник В.Г. [та ін.]. Вегетативні дисфункції у дітей. Пароксизмальна вегетативна недостатність. Київ: Логос, 2017. 300 с.: табл., іл.
- Борисова Т.П., Абатуров А.Е. Клинические проявления и коррекция вегетативной дисфункции у детей и подростков. Здоровье ребенка. 2018. 13(6). 588-594. doi: 10.22141/2224-0551.13.5.2018.143165.
- Міхєєва Т.М., Нечитайло Д.Ю., Понюк В.В., Фоміна Т.П. Особливості вегетативного стану та рівня артеріального тиску в дітей із хронічною гастродуоденальною патологією. Запорожский медицинский журнал. 2018. Т. 20. 5(110). 651-654. DOI: 10.14739/2310-1.
- Беляева Л.М., Колупаева Е.А., Король С.М., Микульчик Н.В. Синдром вегетативной дисфункции у детей: мифы и реальность. Медицинские новости. 2013. 5. 5-15.
- Захарова И.Н., Творогова Т.М., Пшеничникова И.И. Современные рекомендации по лечению и диагностике вегетативной дистонии у детей и подростков. Медицинский совет. 2016. 16. 116-123.
- Остроумова О. Д., Кочетков А. И., Гусева Т. Ф., Зыкова А. А. Гиперсимпатикотония в патогенезе развития артериальной гипертонии и поражения сердца у лиц молодого и среднего возраста: возможности бисопролола в кардиопротекции. Кардиология. 2018. 58(3). 63-72. https://doi.org/10.18087/cardio.2018.3.10100.
- Агапитов Л.И., Черепнина И.В. Диагностика и лечение артериальной гипертензии у детей и подростков в свете новых клинических рекомендаций Американской академии педиатрии. Российский вестник перинатологии и педиатрии. 2019. 64(4). 114-127. DOI: 10.21508/1027-4065-2019-64-4-114-127.
- Writing Group Members, Mozaffarian D., Benjamin E.J. et al. Executive Summary: Heart Disease and Stroke Statistics – 2016 Update: A Report From the American Heart Association. Circulation. 2016. 133(4). 447-454. doi: 10.1161/CIR.0000000000000366.
- Parati G., Esler M. The human sympathetic nervous system: its relevance in hypertension and heart failure. European Heart Journal. 2012. 33(9). 1058-66. https://doi.org/10.1093/eurheartj/ehs041.
- Kaur J., Young E.B., Fadel J.P. Sympathetic Overactivity in Chronic Kidney Disease: Consequences and Mechanisms. Int. J. Mol. Sci. 2017. 18(8). 1682. https://doi.org/10.3390/ijms18081682.
- Макарова Т.П., Мельникова Ю.С. Эндотелиальная дисфункция и элементный статус при хронической болезни почек у детей. Российский вестник перинатологии и педиатрии. 2018. 63(2). 48-52. DOI: 10.21508/1027-4065-2018-63-2-48-52.
- Carlstrom M., Montenegro M.F. Therapeutic value of stimulating the nitrate-nitrite-nitric oxide pathway to attenuate oxidative stress and restore nitric oxide bioavailability in cardiorenal disease. J. Intern. Med. 2019. 285(1). 2-18. doi: 10.1111/joim.12818.
- Протопопов А.А., Нестеренко О.В., Бородулин В.Б., Шевченко О.В. Гипергомоцистеинемия как предиктор прогрессирования хронического пиелонефрита. Клиническая нефрология. 2013. 6. 33-36.
- Martens C.R., Kirkman D.L., Edwards D.G. The Vascular Endothelium in Chronic Kidney Disease: A Novel Target for Aerobic Exercis. Exerc Sport Sci Rev. 2016. 44(1). 12-9. doi: 10.1249/JES.0000000000000065.
- Reddy Y.S., Kiranmayi V.S., Bitla A.R., Krishna G.S., Rao P.V., Sivakumar V. Nitric oxide status in patients with chronic kidney disease. Indian J. Nephrol. 2015. 25(5). 287-91. doi: 10.4103/0971-4065.147376.
- Chen J., Hamm L.L., Mohler E.R. et al. Interrelationship of Multiple Endothelial Dysfunction Biomarkers with Chronic Kidney Disease. PLoS One. 2015. 10(7). e0132047. doi: 10.1371/journal.pone.0132047.
- Drozdz D., Łątka M., Drozdz T., Sztefko K., Kwinta P. Thrombomodulin as a New Marker of Endothelial Dysfunction in Chronic Kidney Disease in Children. Oxid. Med. Cell. Longev. 2018. 1619293. DOI: 10.1155/2018/1619293.
- Brooks E.R., Haymond S., Rademaker A. et al. Contribution of symmetric dimethylarginine to GFR decline in pediatric chronic kidney disease. Pediatr. Nephrol. 2018. 33(4). 697-704. doi: 10.1007/s00467-017-3842-x.
- Chien S.J., Lin I.C., Hsu C.N., Lo M.H., Tain Y.L. Homocysteine and Arginine-to-Asymmetric Dimethylarginine Ratio Associated with Blood Pressure Abnormalities in Children with Early Chronic Kidney Disease. Circ. J. 2015. 79(9). 2031-7. doi: 10.1253/circj.CJ-15-0412.
- Иноземцева Н.Д., Захарова Н.Б., Россоловский А.Н. Значение молекулярных маркеров в изучении эндотелиальной дисфункции у больных МКБ (обзор литературы). Бюллетень медицинских Интернет-конференций. 2015. 5(6). 902-905.
- Noh M.R., Jang H.S., Kim J., Padanilam B.J. Renal Sympathetic Nerve-Derived Signaling in Acute and Chronic Kidney Diseases. Int. J. Mol. Sci. 2020. 21(5). pii: E1647. doi: 10.3390/ijms21051647.
- Sata Y., Head G.A., Denton K., May C.N., Schlaich M.P. Role of the Sympathetic Nervous System and Its Modulation in Renal Hypertension. Front Med. (Lausanne). 2018. 5. 82. doi: 10.3389/fmed.2018.00082.
- Конради А.О. Взаимодействие между симпатической нервной системой и ренин-ангиотензиновой системой. Роль в повышении артериального давления. Артериальная гипертензия. 2012. 18(6). 577-583.

/17.jpg)