Журнал «Боль. Суставы. Позвоночник» Том 8, №4, 2018
Вернуться к номеру
Алгоритми лікування системної склеродермії за умов переважного ураження шкіри та суглобів, при синдромі Рейно та дигітальних виразках згідно з сучасними рекомендаціями
Авторы: Головач І.Ю.(1), Єгудіна Є.Д.(2)
1 - Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
2 - ДЗ «Дніпропетровська державна медична академія» МОЗ України, м. Дніпро, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
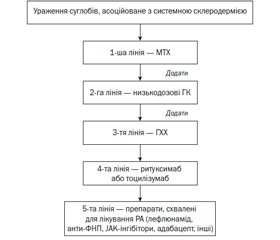
Системна склеродермія (ССД) (cистемний склероз) є унікальним захворюванням серед ревматичних недуг, оскільки становить проблему менеджменту хронічної мультисистемної автоімунної патології з розлогою облітеруючою васкулопатією малих артерій, пов’язаною з різним ступенем фіброзу тканин. У патологічний процес можуть залучатися всі органи, так чи інакше пов’язані зі сполучною тканиною, та ті, що мають кровоносні сосуди. Прогресуючий перебіг ССД призводить до розвитку необоротних фіброзних змін, внаслідок чого відбувається порушення функції уражених органів. Відмінною рисою ССД є клінічна неоднорідність підгруп хворих, що різниться залежно від ступеня тяжкості захворювання, залучення тих чи інших органів і систем та прогнозу. Лікар повинен ретельно обстежити кожного пацієнта із ССД, щоб зрозуміти конкретні прояви і рівень активності захворювання для призначення адекватного лікування. У даний час використання алгоритмів лікування є сучасною стратегією ведення пацієнтів, особливо після невдалого використання препаратів першої лінії. При ранній активній дифузній склеродермії з переважним ураженням шкіри слід надати перевагу метотрексату (МТХ) як препарату першої лінії, а за його неефективності або непереносимості — мофетилу мікофенолату (ММФ), за неефективності останнього препаратом третьої лінії є циклофосфамід. Слід зауважити, що при тяжкому ураженні шкіри препаратом першої лінії є ММФ, а МТХ — другої, при неефективності ММФ. На сьогодні блокатори кальцієвих каналів (БКК), головним чином ніфедипін, є препаратами першої лінії для терапії синдрому Рейно при ССД. За неефективності цих лікарських засобів до лікування слід додати інгібітори фосфодіестерази-5 (іФДЕ-5), наступним кроком терапії є призначення інгібіторів ангіотензинперетворюючого ферменту або блокаторів рецепторів ангіотензину. У разі неефективності комбінованої терапії БКК та іФДЕ-5, при тяжкому перебігу синдрому Рейно слід використовувати простаноїди. Препаратом першої лінії для лікування артриту, як і для ураження шкіри, є МТХ; за умов його неефективності або високої запальної активності слід додати глюкокортикоїди та нестероїдні протизапальні препарати. Гідроксихінолон є препаратом третьої лінії, його додають до терапії при неефективності вищеперерахованих агентів. Біологічні агенти (ритуксимаб і тоцилізумаб) є препаратами четвертої лінії терапії артриту, асоційованого із ССД.
Системная склеродермия (ССД) (системный склероз) является уникальным заболеванием среди ревматических болезней, поскольку представляет проблему менеджмента хронической мультисистемной аутоиммунной патологии с широко распространенной облитерирующей васкулопатией малых артерий, связанной с разной степенью фиброза тканей. В патологический процесс могут вовлекаться все органы, так или иначе связанные с соединительной тканью и имеющие кровеносные сосуды. Прогрессирующее течение ССД приводит к развитию необратимых фиброзных изменений, в результате которых происходит нарушение функции пораженных органов. Отличительной чертой ССД является клиническая неоднородность подгрупп больных, которые различаются в зависимости от степени тяжести заболевания, вовлечения тех или иных органов и систем и дальнейшего прогноза. Врач должен тщательно обследовать каждого пациента с ССД для определения конкретных проявлений и уровня активности заболевания для назначения соответствующего лечения. В настоящее время использование алгоритмов лечения является современной стратегией ведения пациентов, особенно после неудачного использования препаратов первой линии. При ранней активной диффузной склеродермии с преимущественным поражением кожи следует отдать предпочтение метотрексату (МТХ) в качестве препарата первой линии, а при его неэффективности или непереносимости препаратом второй линии является мофетила микофенолат (ММФ), при неэффективности последнего препаратом третьей линии является внутривенный циклофосфамид. Следует заметить, что при тяжелом поражении кожи препаратом первой линии является ММФ, а МТХ — вторым, при неэффективности ММФ. На сегодняшний день блокаторы кальциевых каналов (БКК), главным образом нифедипин, остаются препаратами первой линии для терапии синдрома Рейно при ССД. При неэффективности этих лекарственных средств следует добавить ингибиторы фосфодиэстеразы-5 (иФДЕ-5), следующим шагом терапии является назначение ингибиторов ангиотензинпревращающего фермента или блокаторов рецепторов ангиотензина. При неэффективности комбинированной терапии БКК и иФДЕ-5, при тяжелом течении синдрома Рейно следует использовать простаноиды. Препаратом первой линии для лечения артрита, как и для поражения кожи, является МТХ, при его неэффективности или высокой воспалительной активности следует добавить глюкокортикоиды и нестероидные противовоспалительные препараты. Гидроксихинолон является препаратом третьей линии, его добавляют к терапии при неэффективности вышеперечисленных агентов. Биологические агенты (ритуксимаб и тоцилизумаб) являются препаратами четвертой линии лечения артрита, ассоциированного с ССД.
Systemic scleroderma (SSD) (systemic sclerosis) is a unique rheumatic disease because it presents the challenge of managing a chronic multisystem autoimmune disease with a widespread obliterative vasculopathy of small arteries associated with varying degrees of tissue fibrosis. All organs having connective tissue and blood vessels can be involved in the pathological process. The progressive clinical course of SSD leads to the development of irreversible fibrotic changes, resulting in dysfunction of the affected organs. A distinctive feature of SSD is the clinical heterogeneity of subgroups of patients, which varies depending on the severity of the disease, the involvement of various organs and systems and the prognosis. The physician should carefully examine each SSD patient to understand the specific manifestations and the level of disease activity to prescribe appropriate therapy. At present, the use of treatment algorithms is a modern strategy for patients’ management, especially after unsuccessful use of the first line drugs. In early active diffuse scleroderma with predominant skin lesion, methotrexate (MTХ) should be preferred as the first line drug, and with its ineffectiveness or intolerance, the second line drug is mofetil mycophenolate (MMF), if it’s ineffective, the third line drug is intravenous cyclophosphamide. It should be noted that with severe skin lesions, the first line drug is MMF, and MTХ — the second one, if MMF if ineffective. To date, calcium channel blockers (CCBs), mainly nifedipine, are the first line drugs for the treatment of SSD-associated Raynaud’s syndrome. If these drugs are ineffective, phosphodiesterase-5 inhibitors (iFDE-5) should be added, the next step in therapy is to prescribe angiotensin-converting enzyme inhibitors or angiotensin receptor blockers. In case of combination therapy by CCBs and iFDE-5 ineffectiveness in Raynaud’s syndrome, prostanoids should be added. The first line drug for the arthritis treatment, as well as for skin lesions, is MTX; when it is ineffective or the process has high inflammatory activity, glucocorticoids and nonsteroidal anti-inflammatory drugs should be added. Hydroxychloroquine is the third line drug and is added to the therapy if the above agents were ineffective. Biological agents (rituximab and tocilizumab) are the fourth line drugs in musculoskeletal involvement.
системна склеродермія; шкірний фіброз; синдром Рейно; дигітальні виразки; алгоритм; лікування
системная склеродермия; фиброз кожи; синдром Рейно; дигитальные язвы; алгоритм; лечение
systemic sclerosis; skin fibrosis; Raynaud’s syndrome; digital ulcers; algorithm; treatment
Вступ
Синдром Рейно та дигітальні виразки
Ураження суглобів, асоційоване з ССД
- Kovalenko VM, Shuba NM. Nomenklatura, klasyfikacija, kryterii' diagnostyky ta programy likuvannja revmatychnyh hvorob [Nomenclature, classification, criterias, diagnostics, and programs for rheumatic diseases]. Kyiv; 2004. 156 p. (in Ukrainian).
- Pattanaik D, Brown M, Postlethwaite B, Postlethwaite AE. Pathogenesis of Systemic Sclerosis. Front Immunol. 2015 Jun 8;6:272. doi: 10.3389/fimmu.2015.00272.
- Jimenez SA, Piera-Velazquez S. Endothelial to mesenchymal transition (EndoMT) in the pathogenesis of Systemic Sclerosis-associated pulmonary fibrosis and pulmonary arterial hypertension. Myth or reality? Matrix Biol. 2016 Apr;51:26-36. doi: 10.1016/j.matbio.2016.01.012.
- Hochberg MC, Silman AJ, Smolen JS, et al, editors. Rheumatology. 5th ed. Philadelphia, PA: Mosby; 2010. 2228 p.
- Horimoto AMC, Matos ENN, Costa MRD, et al. Incidence and prevalence of systemic sclerosis in Campo Grande, State of Mato Grosso do Sul, Brazil. Rev Bras Reumatol Engl Ed. 2017 Mar - Apr;57(2):107-114. doi: 10.1016/j.rbre.2016.09.005.
- Barnes J, Mayes MD. Epidemiology of systemic sclerosis: incidence, prevalence, survival, risk factors, malignancy, and environmental triggers. Curr Opin Rheumatol. 2012;24(2):165-170. doi: 10.1097/BOR.0b013e32834ff2e8.
- Denton CP, Hughes M, Gak N, et al. BSR and BHPR guideline for the treatment of systemic sclerosis. Rheumatology (Oxford). 2016 Oct;55(10):1906-10. doi: 10.1093/rheumatology/kew224.
- Kowal-Bielecka O, Fransen J, Avouac J, et al. Update of EULAR recommendations for the treatment of systemic sclerosis. Ann Rheum Dis. 2017 Aug;76(8):1327-1339. doi: 10.1136/annrheumdis-2016-209909.
- Asano Y, Jinnin M, Kawaguchi Y, et al. Diagnostic criteria, severity classification and guidelines of systemic sclerosis. J Dermatol. 2018 Jun;45(6):633-691. doi: 10.1111/1346-8138.14162.
- Johnson SR. New ACR EULAR guidelines for systemic sclerosis classification. Curr Rheumatol Rep. 2015 May;17(5):32. doi: 10.1007/s11926-015-0506-3.
- Kumánovics G, Péntek M, Bae S, et al. Assessment of skin involvement in systemic sclerosis. Rheumatology (Oxford). 2017 Sep 1;56(suppl_5):v53-v66. doi: 10.1093/rheumatology/kex202.
- Czirják L, Foeldvari I, Müller-Ladner U. Skin involvement in systemic sclerosis. Rheumatology (Oxford). 2008;47 Suppl 5:v44-45. doi: 10.1093/rheumatology/ken309.
- Müller-Ladner U, Tyndall A, Czirjak L, Denton C, Matucci-Cerinic M; EUSTAR centres. Ten years EULAR Scleroderma Research and Trials (EUSTAR): what has been achieved? Ann Rheum Dis. 2014 Feb;73(2):324-7. doi: 10.1136/annrheumdis-2013-203997.
- Asano Y. Recent advances in the treatment of skin involvement in systemic sclerosis. Inflamm Regen. 2017 Jun 12;37:12. doi: 10.1186/s41232-017-0047-4.
- Lafyatis R. Transforming growth factor β-at the centre of systemic sclerosis. Nat Rev Rheumatol. 2014 Dec;10(12):706-19. doi: 10.1038/nrrheum.2014.137.
- Iwamoto N, Distler JH, Distler O. Tyrosine Kinase Inhibitors in the Treatment of Systemic Sclerosis: from animal models to clinical trials. Curr Rheumatol Rep. 2011 Feb;13(1):21-27. doi: 10.1007/s11926-010-0142-x.
- Gordon JK, Martyanov V, Magro C, et al. Nilotinib (Tasigna™) in the treatment of early diffuse systemic sclerosis: an open-label, pilot clinical trial. Arthritis Res Ther. 2015 Aug 18;17:213. doi: 10.1186/s13075-015-0721-3.
- Shouval R, Furie N, Raanani P, Nagler A, Gafter-Gvili A. Autologous Hematopoietic Stem Cell Transplantation for Systemic Sclerosis: A Systematic Review and Meta-Analysis. Biol Blood Marrow Transplant. 2018;24(5):937-944. doi: 10.1016/j.bbmt.2018.01.020.
- Denton CP. Advances in pathogenesis and treatment of systemic sclerosis. Clin Med (Lond).2015;15(Suppl 6):s58–63. doi:10.7861/clinmedicine.15-6-s58.
- Fernandez-Codina AA, Walker KM, Pope JE. Treatment Algorithms for Systemic Sclerosis According to Experts. Arthritis Rheumatol. 2018 Nov;70(11):1820-1828. doi: 10.1002/art.40560.
- Meier FM, Frommer KW, Dinser R, et al. Update on the profile of the EUSTAR cohort: an analysis of the EULAR Scleroderma Trials and Research group database. Ann Rheum Dis. 2012 Aug;71(8):1355-60. doi: 10.1136/annrheumdis-2011-200742.
- Herrick AL. Management of Raynaud's phenomenon and digital ischemia. Curr Rheumatol Rep. 2013 Jan;15(1):303. doi: 10.1007/s11926-012-0303-1.
- Golovach IYu, Chipko TM, Korbut NN. Raynaud’s phenomenon and digital ulcers in systemic sclerosis: pathophysiology questions and management at the present stage. Ukrainian rheumatology journal. 2017;(70):15-23. (in Russian).
- Bailey SR, Mitra S, Flavahan S, Flavahan NA. Reactive oxygen species from smooth muscle mitochondria initiate cold induced constriction of cutaneous arteries. Am J Physiol Heart Circ Physiol. 2005 Jul;289(1):H243-50. doi: 10.1152/ajpheart.01305.2004.
- Garcia-Carrasco M, Jimenez-Hernandez M, Escarcega RO, et al. Treatment of Raynaud’s phenomenon. Autoimmun Rev. 2008 Oct;8(1):62-8. doi: 10.1016/j.autrev.2008.07.002.
- Werner C, Baumhakel M, Teo KK, et al. RAS blockade with ARB and ACE inhibitors: current perspective on rationale and patient selection. Clin Res Cardiol. 2008 Jul;97(7):418-31. doi: 10.1007/s00392-008-0668-3.
- Baumhäkel M, Böhm M. Recent achievements in the management of Raynaud’s phenomenon. Vasc Health Risk Manag. 2010 Apr 15;6:207-14. doi: 10.2147/VHRM.S5255.
- Abraham S, Steen V. Optimal management of digital ulcers in systemic sclerosis. Ther Clin Risk Manag. 2015 Jun 15;11:939-47. doi: 10.2147/TCRM.S82561.
- Nitsche A. Raynaud, digital ulcers and calcinosis in scleroderma. Reumatol Clin. 2012 Sep-Oct;8(5):270-7. doi: 10.1016/j.reuma.2012.02.006.
- Korn JH, Mayes M, Matucci Cerinic M, et al. Digital ulcers in systemic sclerosis: prevention by treatment with bosentan, an oral endothelin receptor antagonist. Arthritis Rheum. 2004 Dec;50(12):3985-93. doi: 10.1002/art.20676.
- Avouac J, Walker UA, Hachulla E, et al. Joint and tendon involvement predict disease progression in systemic sclerosis: a EUSTAR prospective study. Ann Rheum Dis. 2016 Jan;75(1):103-9. doi: 10.1136/annrheumdis-2014-205295.
- Desbois AC, Cacoub P. Systemic sclerosis: An update in 2016. Autoimmun Rev. 2016 May;15(5):417-26. doi: 10.1016/j.autrev.2016.01.007.
- La Montagna G, Sodano A, Capurro V, Malesci D, Valentini G. The arthropathy of systemic sclerosis: a 12 month prospective clinical and imaging study. Skeletal Radiol. 2005 Jan;34(1):35-41. doi: 10.1007/s00256-004-0830-6.
- Avouac J, Clements PJ, Khanna D, Furst DE, Allanore Y. Articular involvement in systemic sclerosis. Rheumatology (Oxford). 2012 Aug;51(8):1347-56. doi: 10.1093/rheumatology/kes041.
- Lóránd V, Czirják L, Minier T. Musculoskeletal involvement in systemic sclerosis. Presse Med. 2014 Oct;43(10 Pt 2):e315-28. doi: 10.1016/j.lpm.2014.03.027.
- Smith V, Van Praet JT, Vandooren B, et al. Rituximab in diffuse cutaneous systemic sclerosis: an open-label clinical and histopathological study. Ann Rheum Dis. 2010 Jan;69(1):193-7. doi: 10.1136/ard.2008.095463.

/153-1.jpg)
/154-1.jpg)
/154-2.jpg)
/155-1.jpg)