Епідеміологія
Загальновідомо, що частота розвитку й особливості перебігу інсульту залежать від доінсультного (фонового) стану церебральної гемодинаміки й метаболізму головного мозку, його енергетичних потреб і реактивності нейроімуноендокринної системи організму. До головних модифікованих чинників ризику гострих порушень мозкового кровообігу відносять артеріальну гіпертензію (АГ), цукровий діабет (ЦД), куріння й дисліпідемію.
ЦД на сьогодні набув ознак неінфекційної епідемії, що охопила 425 мільйонів дорослого населення нашої планети з прогнозованим зростанням цієї цифри в 1,5 раза до 2045 року [5].
За результатами епідеміологічних досліджень ЦД визнаний незалежним і водночас модифікованим чинником ризику як ішемічного, так і геморагічного інсульту. Так, за даними численних спостережень, наявність ЦД підвищує ризик ГПМК серед чоловіків у 1,5–4 рази, серед жінок — у 2–6 разів, причому ці показники є особливо високими в пацієнтів молодого працездатного віку [6, 7]. У свою чергу кожен третій-п’ятий пацієнт із ГПМК має ЦД.
Складність проблеми полягає в тому, що на кожний діагностований випадок ЦД припадає принаймні один недіагностований, отже, щонайменше половина хворих через несвоєчасне встановлення діагнозу не отримує адекватних заходів, спрямованих як на лікування ЦД, так і на усунення пов’язаних з ним додаткових чинників ризику ГПМК, таких як ожиріння, АГ, дисліпідемія тощо [8]. Так, Копенгагенським дослідженням інсульту показано, що тільки в 75 % пацієнтів із ГПМК ЦД був діагностований до цереброваскулярної події, на той час як у решти захворювання не було своєчасно –виявлено [9].
Наявність ЦД не тільки підвищує ризик, а й значно обтяжує перебіг ГПМК, підвищує ризик смертності й погіршує подальший прогноз захворювання. За даними Фремінгеймського дослідження, частота повторних випадків інсультів у цих хворих зростає майже вдвічі порівняно з показником в основній популяції [10].
Чинники ризику й механізми розвитку
ГПМК при ЦД є багатофакторним патологічним станом, а механізм його розвитку є складним і багатоланцюговим. Висунуті теорії патогенезу уражень головного мозку за ЦД можна умовно об’єднати в ішемічну (мікро- та макроангіопатії) й метаболічну. Водночас беззаперечним вважається той факт, що ішемія головного мозку внаслідок мікро- та макросудинних уражень має метаболічне підґрунтя розвитку.
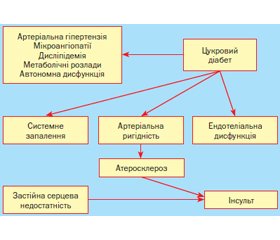
Основні можливі механізми розвитку ГПМК у хворих на ЦД наведені на рис. 1.
Численні дослідження показали, що в патогенезі діабетичних церебральних порушень, зокрема за ЦД типу 2, провідну роль відіграє хронічна гіперглікемія. Спричинені нею патогенетичні ланцюги ведуть як до метаболічних, так і до зумовлених ними судинних змін головного мозку при ЦД [12].
Індукована гіперглікемією гіперпродукція активних форм кисню (АФК) спричиняє «оксидативний стрес», інгібує дію гліцеральдегід-3-фосфатдегідрогенази (GAPDH) — ключового ферменту гліколізу. Вільні радикали індукують розрив ДНК, у свою чергу АФК активують фермент репарації ДНК полі(АДФ-рібоза)-полімеразу (PARP). Активована PARP змінює GAPDH і пригнічує її активність. Це призводить до накопичення проміжних продуктів гліколізу, які реалізують основні патогенетичні механізми розвитку ендотеліальної дисфункції, серед яких активація поліолового шляху, збільшення утворення кінцевих продуктів глікації (AGEs), підвищення експресії рецепторів для AGEs, активація ізоформ протеїнкінази C і гесманінового шляху. Зазначені процеси є особливо небезпечними для головного мозку, у якому інтенсивність вільнорадикальних процесів є значно вищою. Багато в чому це визначається високим вмістом у мозку поліненасичених жирних кислот — субстратів вільнорадикального окиснення. Так, уміст фосфоліпідів у мозку в 1,5 раза більший, ніж у печінці, і в 3–4 рази більший, ніж у серці. Ось чому порушення функціонування системи про- й антиоксидантного захисту є особливо небезпечним для мозкової тканини. Крім того, головний мозок характеризується низьким рівнем антиоксидантного захисту. Становлячи близько 2 % від загальної маси тіла, він утилізує 20–25 % усього кисню, що отримує організм. Тому перехід до вільнорадикальної форми навіть 0,1 % кисню, що метаболізується нейронами, є токсичним для мозкової тканини [12, 13].
Важливим механізмом розвитку церебральних уражень при ЦД є неферментативне глікозилювання білків, що полягає в здатності глюкози, фруктози й галактози вступати в реакції глікозилювання з аміногрупами, які входять до структури білків, ліпідів і нуклеїнових кислот [14], що призводить до різкої зміни властивостей останніх. За неможливості повністю метаболізуватися гліколітичним шляхом надлишок глюкози перетворюється на N-ацетил-глюкозамін, який у поєднанні із серином і тріоніном може спричиняти різноманітні внутрішньоклітинні пошкодження, у тому числі й на генетичному рівні, призводить до розвитку ішемії й стимулює утворення факторів росту з посиленням гемокоагуляції й розвитком судинних уражень головного мозку. Окрім участі у формуванні ангіопатій, кінцеві продукти глікозилювання спричиняють порушення морфофункціональних властивостей нейроцитів.
Гіперглікемія також призводить до посиленої активації поліолового шляху окиснення глюкози зі зростанням швидкості продукції сорбітолу й фруктози. Останні погано проникають через плазмолему й накопичуються в клітинах, підвищуючи осмолярність, що спричиняє розвиток дегенерації клітин через «гіпер–осмолярні «вибухи» [15]. Крім того, накопичення сорбітолу в нейронах пригнічує синтез найважливішого компоненту мієліну — міоінозитолу, що є субстратом для синтезу мембранного фосфатидилінозитолу (ендогенного регулювальника мікросомальної Na+K+АТФази), а також для численних різноманітних сигнальних молекул-кіназ, які можуть приєднати до інозитолу фосфатну групу.
Важлива роль у патогенезі церебральних порушень при ЦД також належить порушенню вироблення й метаболізму нейромедіаторів центральної нервової системи (ЦНС), нейротрофічних факторів, хоча й визнають, що ці процеси є вторинними щодо інших патогенетичних ланок [16].
Зумовлене вищезазначеними чинниками пошкодження судинного ендотелію є ключовою ланкою у патогенезі як мікро-, так і макросудинних діабетичних цереброваскулярних змін. Неферментативне глікозилювання білків та інших сполук, що містять аміногрупи, автоокиснення глюкози з підвищенням утворення вільних радикалів, пряма глюкозотоксичність запускають каскад реакцій з боку імунної, згортальної, фібринолітичної й інших систем. Це супроводжується системним запаленням із посиленням експресії прозапальних цитокінів і адгезивних молекул. Посилення вільнорадикальних процесів є одним з тригерних механізмів, що призводять до дефіциту NO при ЦД. Виснаження ендотеліальної продукції NO відбувається паралельно зі збільшенням утворення супероксиду в судинах на різних стадіях захворювання. Це призводить до зменшення ендо–телійзалежного розслаблення судин, збільшення вазоконстрикції, гіперплазії клітин гладеньких м’язів, ремоделювання судин і розвитку атеросклерозу. При цьому ендотеліальна дисфункція супроводжується гіперпродукцією ендотелінів, які мають потужну судинозвужувальну дію [17].
У свою чергу, ураження судинного ендотелію спричиняє гемореологічні зміни внаслідок порушення синтезу й секреції чинників, що регулюють систему гомео–стазу, до яких, окрім NO, належать анти–тромбін ІII, простациклін, протеїн С, активатори плазміногену тощо. На цьому тлі відбувається гіперпродукція речовин, які сприяють тромбо–утворенню, серед яких найбільше значення мають фібриноген, V, IX, X, XI і XII фактори згортання крові, калікреїн, інгібітори фібринолізу, блокатори рецепторів плазміногену, тромбоксан А2 та ендотелін-1. Порушення гемостазу при ЦД мають комплексний характер. Посилюються агрегаційна активність тромбоцитів і еритроцитів, антиагрегаційний потенціал ендотелію, знижується антикоагулянтна й фібринолітична активність крові. Концентрація вазоактивних і тромбогенних похідних арахідонової кислоти — простагландинів і тромбоксанів — у крові підвищується на тлі зниження вмісту речовин, що чинять антиагрегаційну й антитромбогенну дію [18].
Важливу роль у формуванні макро–судинних церебральних порушень відіграють ожиріння, інсулінорезистентність і зумовлені ними метаболічні порушення, що спричиняють АГ, а також сприяють розвитку дисліпідемії внаслідок посиленого надходження в кров вільних жирних кислот. Надмірна кількість останніх призводить до посилення продукції в печінці ліпопротеїнів дуже низької щільності (ЛПДНЩ) з подальшим підвищенням концентрації в плазмі крові тригліцеридів, аполіпопротеїну В і зниженням вмісту антиатерогенних ліпопротеїнів високої щільності (ЛПВЩ). Суттєвим і незалежним чинником ризику розвитку запалення судинної стінки й атеросклерозу є α-ліпопротеїни, або «малі щільні» ЛПНЩ. Як антагоністи плазміногену, вони відзначаються підвищеною здатністю до тромбо–утворення й окиснення порівняно із ЛПНЩ, мають імуногенні й антигенні властивості й тому захоплюються макрофагами, сприяють подальшій їх трансформації в пінисті клітини. Останні, як відомо, є основою утворення атероматозної бляшки, або атероми. Унаслідок цього відбувається захоплення збагачених аполіпопротеїном E ЛПДНЩ макрофагами з перетворенням останніх на пінисті клітини, утворення ліпідних плям з подальшим моделюванням атеросклеротичної бляшки. У цьому процесі бере участь ядерний рецептор PPAR-γ, який регулює ліпідний обмін і гомеостаз глюкози [19].
Реалізація зазначених вище механізмів спричиняє генералізоване ураження всіх ланок системи кровообігу, що проявляється дегенеративними змінами артеріол, вен, капілярів (мікроангіопатією), а також ушкодженням великих і середніх артеріальних судин (макроангіопатією). Порушення вуглеводного обміну призводить до зміни комплексу інтима-медіа: прогресування захворювання характеризується зростаючим витонченням м’язового шару поряд зі збільшенням товщини інтими. Надалі можливе формування гемодинамічно значущого стенозу великих артерій з підвищеним ризиком пристінкового тромбо–утворення й загрозою повної оклюзії судини. У випадку фрагментації тромба виникає загроза емболізації дистального судинного русла. Небезпека розвитку інсультів при ЦД зростає при недостатньому функціонуванні анастомозів, зокрема неповноцінності судин віллізієва кола. Поширене ураження артеріальної системи мозку супроводжується зниженням реактивності й еластичності і, відповідно, зростанням жорсткості судинної стінки, що також несприятливо позначається на стані мозкового кровообігу. Більшість авторів зазначають, що наявність мікроангіопатій та автономної нейропатії з порушенням регуляції судинного тонусу в пацієнтів із ЦД обмежує можливості авторегуляції мозкового кровотоку. Коливання системного артеріального тиску (АТ) за цих умов можуть виявитися вирішальними у виникненні як гострої, так і хронічної церебральної ішемії [16, 18, 20].
Артеріальна гіпертензія, яка трапляється при ЦД приблизно вдвічі частіше, ніж у загальній популяції, визнана потужним чинником розвитку ГПМК у пацієнтів із ЦД. За результатами багатьох досліджень, контроль АТ є надзвичайно важливим для запобігання розвитку гострих цереброваскулярних подій. Зокрема, у дослідженні UKPDS у групі пацієнтів із ЦД типу 2 з більш жорстким контролем АТ (144/82 мм рт.ст.) частота інсульту виявилася на 44 % нижчою порівняно з хворими стандартної контрольної групи (154/87 мм рт.ст.) [21].
До вагомих чинників ризику ГПМК при ЦД також відносять фібриляцію передсердь, яка, за даними метааналізу, реєструється приблизно у 25 % пацієнтів із ЦД [22]. У свою чергу, фібриляція передсердь асоціюється з ризиком підвищення ішемічного інсульту в 4–5 разів [23]. Серцева недостатність також асоціюється з підвищеним ризиком ішемічного інсульту, навіть без миготливої аритмії. Показано, що у хворих на ЦД за наявності СН відносний ризик ішемічного інсульту зростає на 27 % [24]. Також важливими факторами розвитку ГПМК у хворих на ЦД є куріння, зловживання алкоголем, малорухливий спосіб життя, психоемоційні навантаження.
Клінічно-діагностичні особливості
Клінічна картина
Перебіг ГПМК у хворих на ЦД і осіб без діабету відрізняється [6]. Як вже зазначалося, ЦД асоціюється з вищою захворюваністю і смертністю у пацієнтів з ішемічним і геморагічним інсультом [25].
У хворих на ЦД частіше, ніж у популяції, трапляється ішемічний інсульт, на той час як частота геморагічного інсульту в цієї категорії пацієнтів є навіть дещо нижчою. За даними масштабного епідеміологічного дослідження, співвідношення ішемічний/геморагічний інсульт у хворих на ЦД становило 11 : 1 (у загальній популяції — 5 : 1). Результати інших досліджень показали, що захворюваність на ішемічний інсульт серед пацієнтів з ЦД вдвічі вища, ніж у загальній популяції, тоді як частота геморагічного інсульту практично не відрізняється [9, 26].
У хворих на ЦД часто розвивається –лакунарний інсульт, тобто інфаркт головного мозку розміром менше від 15 мм у діаметрі. Саме ЦД і АГ — основні чинники ризику розвитку лакунарних інфарктів [27].
Важливо відзначити, що подібні інфаркти мозку часто перебігають клінічно безсимптомно (так звані німі інфаркти). Водночас повторні лакунарні інсульти можуть призводити до виражених порушень когнітивних функцій, аж до формування деменції, ризик розвитку якої в пацієнтів із ЦД значно підвищений [28].
За результатами наших досліджень, у структурі ГПМК хворих на ЦД переважає ішемічний інсульт. Його частка у хворих на ЦД обох типів приблизно однакова й дорівнює 90 %. Водночас частота геморагічних інсультів у хворих на ЦД типу 1 перевищує відповідний показник у хворих на ЦД типу 2, що вказує на менше значення церебрального атеросклерозу в розвитку ГПМК для цієї категорії пацієнтів. Заслуговує на увагу той факт, що ГПМК є повторним для більше ніж третини пацієнтів. При ЦД типу 1 більшість випадків ГПМК припадає на осінньо-зимовий період, типу 2 — на осінньо-весняний. Найбільша частота епізодів ГПМК у хворих на ЦД типу 2 припадає на нічні й ранкові години, що в цілому відповідає загальним літературним даним щодо їх хроноритмологічних особливостей і пов’язується з особливостями функціонування симпатоадреналової системи й іншими чинниками. Водночас при ЦД типу 1 такої чіткої тенденції не спостерігається, що можна пояснити не тільки десинхронозом функціонування регулювальних систем організму при ЦД, зумовленим основним захворюванням, а й ритмом проведення інсулінотерапії [29, 30].
У клінічній картині інфаркту мозку при ЦД обох типів на перший план виступають вогнищеві симптоми, характер яких визначається локалізацією пошкодження. Вивчення ступеня рухових порушень в осіб з ішемічним інсультом показало, що найбільш часто вони проявляються геміпарезом (близько 80 %), рідше — геміплегією. Слід зауважити, що частка геміплегій дещо більша у хворих на ЦД типу 2. Афазія частіше виникає в пацієнтів, які страждають від ЦД типу 2, переважають її кіркова сенсорна й мотор–на форми. Порушення свідомості різного ступеня прояву розвивається у хворих на ЦД обох типів приблизно з однаковою частотою, водночас вони більш глибокі у випадках ЦД типу 2 [29, 30].
Клінічна картина геморагічного інсульту при первинному огляді практично не залежить від локалізації крововиливів і проявляється майже однаково в усіх пацієнтів поєднанням загальномозкових і вогнищевих симптомів. При крововиливах у мозок при ЦД відзначаються дуже висока смертність, помітна декомпенсація діабетичних порушень, у половини хворих спостерігаються тривалі коматозні стани. Водночас нерідко паренхіматозні крововиливи розвиваються поступово; при субарахноїдальному крововиливі початок негострий, супроводжується слабко вираженими менінгеальними симптомами і помірним психомоторним збудженням [31]. Привертає увагу той факт, що частота летальних випадків внаслідок ГПМК у хворих на ЦД типу 1 є майже втричі вищою порівняно з пацієнтами з ЦД типу 2. Це, на нашу думку, пояснюється більш тяжким і лабільним перебігом основного захворювання й вищою часткою геморагічних інсультів при ЦД типу 1 [30, 31].
У більшості пацієнтів на тлі ГПМК відзначається погіршення компенсації ЦД, що насамперед пояснюється масивною секрецією стресових гормонів, які чинять контрінсулярну дію. При цьому гіперглікемія часто реєструється в пацієнтів з гострим інсультом незалежно від діагнозу ЦД і асоціюється з тяжчим перебігом захворювання й вищою летальністю [32].
Численні дослідження показали, що гостра гіперглікемія при інсульті (як за наявності попереднього ЦД, так і без нього) пов’язана з більшими обсягами інфаркту, більш тривалим перебуванням у стаціонарі, поганим функціональним відновленням і збільшенням смертності [32, 33].
Діагностика
Діагностика ГПМК у хворих на ЦД не має особливої специфіки порівняно з такою в пацієнтів без ЦД і полягає, окрім стандартного фізичного й неврологічного обстеження, у проведенні нейровізуалізації (комп’ютерна/магнітно-резонансна томографія (КТ/МРТ)), ангіографії, соно–графії екстра- й інтракраніальних артерій шиї й голови, електрокардіографії (ЕКГ). Постійному контролю підлягають показники АТ і діурезу [34, 35].
Обов’язковим є здійснення моніторингу глікемії, глюкозурії, ацетонурії. Окрім загальноклінічних аналізів крові й сечі, визначають показники коагуляційного гемостазу, іонограму, рівень азотистих шлаків, печінкові проби, ліпідограму.
Диференціальна діагностика
ГПМК у хворих на ЦД часто маскуються під епізоди гіпоглікемій (реакція організму на швидке зниження глікемії й зменшення утилізації глюкози мозковою тканиною), і навпаки, симптоми останньої (адренергічні, що пов’язані з активацією симпатоадреналової системи, і нейроглікопенічні, що викликані енергетичним голодуванням мозкових клітин) у літніх хворих нерідко розцінюються як стигми МІ. До адренергічних симптомів відносять серцебиття, розширення зіниць, підвищення АТ. Прояви ней–роглікопенічних симптомів — від легких порушень емоційно-психічної сфери до необоротних розладів регуляції серцево-судинної й дихальної систем. Кора й діенцефальні структури більш чутливі до гіпоглікемії, тому вже при рівні глікемії в крові нижче від 3 ммоль/л виникають дратівливість, порушення пам’яті, сон–ливість, апатія, неадекватні мовлення й вчинки. Нейропатологічні симптоми виникають внаслідок збільшення концентрації нейро–токсину аспартату, який утворюється з аміно–кислот, коли ті використовуються клітинами мозку як джерело енергії за відсутності глюкози. При глибокій гіпоглікемії виникають патологічні рефлекси, тонічні й клонічні судоми, у подальшому — кома, що може ускладнитися інсультом, інфарктом міокарда, набряком мозку [36].
Гіпоглікемічна кома, як і ГПМК, зазвичай розвивається раптово, часто їй передує гіпоглікемічний стан, що проявляється відчуттям голоду, онімінням язика, губ, двоїнням в очах, пітливістю, емоційним збудженням, тремтінням кінцівок. Найпоширенішою причиною гіпоглікемії є передозування інсуліну або таблетованих цукрознижувальних препаратів на тлі недостатнього споживання вуглеводів із їжею. Сприяють розвитку коми інтенсивна м’язова робота, вживання алкогольних напоїв, прийом саліцилатів, ниркова, печінкова й серцева недостатність. Якщо у хворого на ЦД підозрюють МІ, симптоми якого проявилися рано-вранці, неодмінно треба мати на увазі можливість наявності в пацієнта гіпоглікемії, що потребує адекватної корекції [29].
Також слід пам’ятати, що гіпоглікемічна кома сама по собі є чинником виникнення ГПМК. Так, за деякими даними, у пацієнтів віком до 40 років у випадку нетривалого перебігу ЦД при гіпоглікемічній комі частіше розвивається крововилив у мозок, а при тривалому перебігу (понад 15–20 років) — інфаркт мозку [10, 37].
Гіперглікемічні (кетоацидотична, гіперосмолярна, лактацидотична) коми також часто супроводжуються специфічними неврологічними симптомами й синдромами [38, 39]. Зокрема, гіпер–осмолярна кома, яка трапляється переважно в літніх хворих на ЦД типу 2, у 10–20 % супроводжується поліморфною неврологічною симптоматикою (судомами, дизартрією, ністагмом, парезами, паралічами, геміанопсією, вестибулярними порушеннями). Зазначена картина зумовлена тим, що гіперосмолярність при гіперглікемії здатна викликати зменшення мозкового кровотоку, фокальний неврологічний дефіцит, тобто симптоми, що імітують МІ.
Клінічні й лабораторні критерії диференціальної діагностики ком при ЦД та ішемічному інсульті наведені в табл. 1.
Слід зауважити, що церебральні зміни, які виникають внаслідок метаболічних або токсичних порушень, зазвичай викликають підгострий розвиток порушень свідомості, з системними розладами або без них і з мінімальною вогнищевою симптоматикою [40]. У нетипових випадках вирішальними в діагностиці є результати нейровізуалізаційних досліджень (КТ/МРТ).
Також слід пам’ятати, що як гіпоглікемічна, так і гіперглікемічні коми нерідко поєднуються з ГПМК, що може становити певні діагностичні труднощі й потребує комплексного підходу до надання медичної допомоги із залученням фахівців різного профілю.
Лікування
Лікування ГПМК у хворих на ЦД відповідає комплексу загальноприйнятих терапевтичних заходів щодо лікування ГПМК і спрямоване на максимальну оптимізацію як вуглеводного обміну, так і усунення зумовлених ЦД змін із боку різних органів і систем.
Згідно з європейськими та американськими рекомендаціями щодо інсультів, невідкладна допомога при МІ повинна бути спрямована на стабілізацію життєво важливих функцій, реканалізацію закупорених судин, запобігання ранньому повторному інфаркту, запобігання виникненню або зменшення вторинного ураження нейронів [34, 41].
Загальні заходи включають контроль АТ, температури тіла, насичення киснем, нормалізацію водно-електролітного балансу, ЕКГ-моніторинг.
Застосовують реканалізаційну (тромболізис) терапію, механічну тромбектомію й інгібітори агрегації тромбоцитів. Як показали дослідження останніх років, ризик ускладнень тромболізису в пацієнтів із ЦД практично не перевищує такий у хворих без порушень вуглеводного обміну. Крім того, необхідно здійснювати заходи щодо лікування або запобігання розвитку гострих ускладнень і ранньої нейрореабілітації (рухової, логопедичної тощо) [34, 41, 42].
Специфічне лікування у першу чергу включає контроль глікемії. Як вже зазначалося, встановлено негативний вплив підвищення рівня глюкози крові на процес ішемізації ділянки головного мозку. Крім того, гіперглікемія в поєднанні з інсулінорезистентністю чинить додаткову несприятливу дію, призводячи до збільшення органної дисфункції шляхом зниження транспорту кисню й порушення водно-електролітного гомеостазу (посилення діурезу й додаткових втрат рідини), стимуляції катаболізму структурних білків через недостатнє надходження глюкози до клітини, глікозилювання білкових молекул і зниження їх функціональної активності [43].
Згідно з настановою Європейської організації інсульту (ESO) 2017 року з управління глікемією, при гострому інсульті необхідно досягти рівня глюкози в крові в діапазоні 140–180 мг/дл (7,8–10,0 ммоль/л) упродовж перших 24 годин ГПМК, уникаючи при цьому більш інтенсивного зниження глікемії [44].
На доцільності утримання глікемії в зазначених вище цільових межах також наголошується в спільних рекомендаціях Американської асоціації з проблем серця (American Heart Association, AHA) і Американської асоціації з лікування інсульту (American Stroke Association, ASA) 2018 року [45]. Показаннями до ініціації інсулінотерапії є рівень глюкози в крові 180 мг/дл (10 ммоль/л) або вище.
Традиційно гіперглікемія при гострому інсульті регулюється підшкірним введенням інсуліну короткої (ультракороткої) дії під контролем глікемії методом ковзної шкали. Водночас на сьогодні активно обговорюється питання доцільності інфузійної терапії інсуліном для інтенсивного контролю рівня глюкози крові в пацієнтів з гострим ішемічним інсультом, переваги й безпека якої були продемонстровані в деяких рандомізованих клінічних дослідженнях [46].
Водночас докази того, що активне зменшення глікемії шляхом внутрішньовенного введення інсуліну покращує наслідки ГПМК, є недостатніми [47, 48].
На сьогодні жоден метааналіз не продемонстрував суттєвої користі від внутрішньовенного введення інсуліну з метою корекції глікемії в межах певного діапазону в пацієнтів з гострим ішемічним або геморагічним інсультом в аспекті покращання функціональних наслідків і зменшення показників смертності. –Водночас доведено, що інфузійна інсулінотерапія значно збільшує частоту небез–печних при ГПМК епізодів гіпо–глікемії [49].
Тому застосування режиму внутрішньовенного введення інсуліну в пацієнтів з легкою й середньою гіперглікемією на сьогодні не рекомендується.
У разі ж задовільного глікемічного контролю, ясної свідомості, відсутності перешкод до прийому пероральних препаратів пацієнти можуть отримувати протидіабетичну терапію за звичайними схемами [50].
У хворих на ГПМК нерідкою є й гіпо–глікемія, що зумовлена зниженням споживання їжі пацієнтами, які продовжують отримувати протидіабетичні засоби. Компенсаторна активація симпатоадреналової системи на тлі гіпоглікемії є надзвичайно небезпечним чинником прогресування інфаркту й набряку мозку. За літературними даними, наявність гіпо–глікемії сприяє зростанню площі мозкового інфаркту, може погіршити функціо–нальні наслідки й значно обтяжує прогноз захворювання [40].
Тому пацієнтам з МІ, які отримують гіпоглікемізуючу терапію, обов’язково слід провести корекцію доз препаратів. Зниження глікемії нижче від 60 мг/дл (3,3 ммоль/л) є вкрай небезпечним і потребує негайного введення розчину глюкози [51].
Як вже зазначалося, прогноз щодо життя й відновлення функцій після ГПМК у хворих на ЦД є гіршим, ніж у пацієнтів без цього захворювання. Перебіг МІ характеризується вищим ризиком розвитку ускладнень, більшим ступенем прояву неврологічного дефіциту, тривалішими термінами госпіталізації. Неналежний контроль глікемії збільшує негайну й довгострокову захворюваність і смертність, пов’язану з інсультом, і значно підвищує ризик повторних ГПМК [52]. З іншого боку, зменшення рухливості пацієнтів після інсульту створює передумови до набору маси тіла, зниження утилізації глюкози, що обмежує можливості задовільної компенсації ЦД.
Окрім незадовільного глікемічного контролю, за результатами дослідження UKPDS, чинниками ризику смертності після перенесеного інсульту у хворих на ЦД також є жіноча стать, підвищення систолічного артеріального тиску, повторний інсульт й лейкоцитоз [53].
Контроль глікемії відіграє важливе значення в подальшій реабілітації хворих. Також важливими є нормалізація артеріального тиску, ліпідного обміну й коагуляційного гемостазу. Варто також зазначити, що проведення рухової реабілітації у хворих на ЦД може бути обтяжене через наявність діабетичних уражень периферичної нервової системи, трофічних виразок [29], що вказує на необхідність застосування спеціальних реабілітаційних схем.
Профілактика
Первинна й вторинна профілактика ГПМК у хворих на ЦД полягає в комплексі заходів, спрямованих на корекцію глікемії, дисліпідемії, оптимізацію реологічних властивостей крові, у тому числі тромбоцитарного гемостазу, АТ, нормалізацію маси тіла, покращання мозкового кровообігу й метаболізму, лікування коморбідних станів тощо [54].
Основу терапії будь-якого хронічного ускладнення ЦД становить корекція всіх видів обміну, у першу чергу вуглеводного. На сьогодні доведена і є безсумнівною необхідність досягнення й підтримання жорстких цільових рівнів глікемії і HbA1c для запобігання розвитку мікросудинних ускладнень ЦД через вплив на метаболічну пам’ять [55]. Водночас дискусійним залишається питання, наскільки вигідним є вплив довготривалого глікемічного контролю на серцево-судинні наслідки, включно з інсультом [56, 57].
Ефективність проведення гіпоглікемізуючої терапії в профілактиці цереброваскулярних захворювань при ЦД продемонстрована в багатьох клінічних та експериментальних роботах. Основні результати отримані в рамках двох досліджень, що стали важливими віхами в діабетології: UKPDS і DCCT. Багатоцентрове дослідження DCCT продемонструвало, що інтенсифікована інсулінотерапія і близька до нормальної глікемія дозволяють запобігти розвитку макросудинних ускладнень або загальмувати його на 41 % [58]. Результати дослідження UKPDS показали, що зниження HbA1c на 1 % асоційоване зі зменшенням ризику інсульту на 12 %. Водночас більш інтенсивна гіпоглікемізуюча терапія збільшувала ризик ГПМК на 11 % [53].
Подальші дослідження поставили перед собою мету з’ясувати, чи отримають пацієнти будь-які додаткові переваги, у першу чергу щодо макросудинних ускладнень, при інтенсивному контролі за глікемією. Результати трьох з них — ADVANCE, ACCORD і VADT — свідчать про те, що інтенсивна терапія забезпечує досягнення цільових рівнів HbA1c, але в жодному дослідженні не виявлено вірогідного зменшення ризику серцево-судинних подій, включно з інсультами [40]. Інтенсивна терапія була пов’язана з відсутністю впливу на ризик нефатальних інсультів у ADVANCE (HR = 0,97; 95% ДІ: 0,81–1,16) при цільових рівнях HbA1c ≤ 6,5 % і навіть асоціювалася з незначним підвищенням ризику при більш жорсткому глікемічному конт–ролі (HbA1c ≤ 6,5 %) в ACCORD (HR = 1,06; 95% ДІ: 0,75–1,50; p = 0,74). У дослідженні VADT частота розвитку серцево-судинних ускладнень у групі інтенсивної терапії виявилася більшою. Зрештою, метааналіз, який містив дані 33 040 учасників, які брали участь у UKPDS, ACCORD, ADVANCE, VADT та PROactiv, встановив, що інтенсивний контроль глікемії, при якому середній рівень HbA1c порівняно зі стандартною терапією був нижчим на 0,9 %, призводив до зниження випадків коронарних подій, водночас не мав суттєвого впливу на частоту інсульту (0,93, 0,81–1,06) або смертність від усіх причин (1,02, 0,87–1,19). Отже, жорсткий контроль глікемії не тільки не запобігає розвитку ГМПК, а й може призвести до зростання їх частоти [59].
На сьогодні цільовий рівень HbA1c для хворих на ЦД згідно з рекомендаціями провідних лікарських товариств, зокрема оновленими Стандартами медичної допомоги хворим на ЦД Американської діабетичної асоціації (ADA) 2018 року, для більшості дорослих (окрім вагітних) становить до 7 %, водночас експертами підкреслюється необхідність індивідуалізації лікування ЦД 2-го типу зі збереженням балансу між перевагами контролю глікемії та його потенційними ризиками. Згідно із стандартами ADA-2018, менш жорсткі цілі HbA1c (наприклад, < 8 %) можуть бути доцільними для пацієнтів з анамнезом тяжкої гіпоглікемії, обмеженою тривалістю життя, мікро- або макросудинними ускладненнями, супутніми захворюваннями або тривалим ЦД, при яких неможливо досягти мети, незважаючи на самоконтроль, належний моніторинг глікемії й ефективні дози антидіабетичних препаратів, включно з інсуліном. Особливо це стосується літніх осіб (старших від 65 років) із ЦД, у яких потрібно прагнути максимального спрощення схеми лікування й зниження ризику гіпо–глікемії. Вибір цільового рівня HbA1c (< 7,5 %; < 8,0 % або < 8,5 %), глюкози крові, АТ і ліпідів у цієї категорії хворих визначається функціональним станом, наявністю супутніх захворювань і очікуваною тривалістю життя [60].
На сьогодні єдиним антигіперглікемічним препаратом, для якого доведена ефективність щодо зменшення ризику смертності від інсульту, є метформін (у дослідженні UKPDS — зниження на 41 %). Цей препарат залишається засобом першого вибору при лікуванні ЦД типу 2 згідно з рекомендаціями всіх авторитетних лікарських організацій.
У стандартах ADA-2018 підкреслюється, що в пацієнтів з ЦД типу 2 і встановленим атеросклеротичним серцево-судинним захворюванням (АССЗ), які не досягли глікемічних цілей за допомогою модифікації способу життя й метформіну, слід розглянути призначення препарату, для якого доведено зниження ризику розвитку серйозних серцево-судинних подій і кардіоваскулярної смертності (агоніст рецепторів глюкагоноподібного пептиду 1 та інгібітор натрійзалежного котранспортера глюкози 2-го типу). Водночас питання щодо впливу антидіабетичних препаратів другої лінії на гострі цереброваскулярні події на сьогодні залишається відкритим.
Корекція вуглеводного обміну, особливо у хворих на ЦД типу 2, що мають додаткові чинники ризику серцево-судинних захворювань, сама по собі не здатна запобігти розвитку церебральних патологічних змін. Так, висока вірогідність виникнення повторних епізодів ГПМК зберігається у хворих, які перенесли ішемічний інсульт, навіть на тлі задовільного глікемічного контролю [61]. Дослідження STENO-2.57 и STENO-2 довели необхідність комплексного підходу до профілактики цереброваскулярних захворювань при ЦД, що полягає у цільовій довготривалій інтенсифікованій терапії відносно декількох чинників ризику (гіперглікемія, АГ, дисліпідемія, індекс маси тіла > 25 кг/м2, куріння).
Обов’язковою передумовою профілактики й лікування цереброваскулярних ускладнень при ЦД вважається корекція артеріального тиску. У дослідженні UKPDS зниження систолічного АТ на 10 мм рт.ст. або діастолічного — на 5 мм рт.ст. зменшувало ризик серцево-судинних ускладнень на 51 %, а інсульту — на 44 %. У дослідженні ACCORD-BP за участю 4733 пацієнтів з ЦД типу 2 інтенсивний контроль АТ (цільовий рівень систолічного АТ < 120 мм рт.ст.) був пов’язаний зі значним зниженням частоти загального інсульту (HR = 0,59; 95% ДІ: 0,39–0,89; р = 0,01) і нефатального інсульту (HR = 0,63; 95% ДІ: 0,41–0,96; P = 0,03) [62].
Метааналіз 13 рандомізованих клінічних випробувань, у яких брало участь 37 736 хворих на ЦД типу 2, показав, що досягнення навіть більш скромних, ніж в ACCORD, цільових рівнів АТ (САТ ≤ 135 мм рт.ст.) знижує ризик інсульту на 17 %. Подальший метарегресійний аналіз показав тривале зменшення ризику інсульту при САТ < 120 мм рт.ст., але навіть при рівнях < 130 мм рт.ст. на 40 % збільшились серйозні побічні ефекти без будь-яких інших кардіоваскулярних переваг, окрім інсульту [63].
На відміну від кардіологічних товариств, які встановили більш жорсткий цільовий рівень САТ (< 130/80 мм рт.ст.), ADA, як і раніше, рекомендує пацієнтам з ЦД підтримувати показник на рівні < 140/90 мм рт.ст. Експерти асоціації аргументують таку рекомендацію результатами клінічних випробувань, що не показали переваг жорсткого конт–ролю АТ у хворих на ЦД в аспекті впливу на комбіновану первинну серцево-судинну кінцеву точку (нефатальний інфаркт міокарда, нефатальний інсульт або смерть від серцево-судинних причин) порівняно зі стандартним контролем АТ. Проте стандарти ADA не виключають, а навіть рекомендують індивідуальний підхід до антигіпертензивної терапії в пацієнтів з ЦД типу 2. Відзначено, що більш жорсткий цільовий рівень АТ (наприклад, < 130/80 мм рт.ст. або < 120/80 мм рт.ст.) може бути корисний у окремих пацієнтів із ЦД [60].
У рекомендаціях ADA-2018 зазначається, що пацієнти з більш високим ризиком розвитку кардіоваскулярної патології (особливо інсульту) або альбумінурії, які можуть досягти цільових рівнів АТ відносно легко і без значних побічних ефектів, є оптимальною когортою для інтенсифікації антигіпертензивної терапії.
Слід зазначити, що різке зниження АТ при церебральному атеросклерозі здатне спровокувати ішемічний інсульт. Обережності потребує проведення анти–гіпертензивної терапії у хворих із гемодинамічно значущим (понад 70 %) двобічним стенозом внутрішніх сонних артерій, у яких надмірно агресивна анти–гіпертензивна терапія сприяє збільшенню ризику ГПМК. Тому найбільш обґрунтованим вважається визначення цільового рівня АТ у цієї групи хворих у межах 130–140/80 мм рт.ст., водночас досягнення його слід здійснювати дуже повільно, протягом декількох місяців. Крім того, швидкість такого зниження АТ повинна відрізнятися у різних груп немолодих хворих (залежно від поширеності церебрального атеросклерозу або перенесення зниження АТ пацієнтом) [64].
Антигіпертензивна терапія включає антагоністи ренін-ангіотензинової системи (за відсутності протипоказань), як інгібітори АПФ, так і блокатори рецепторів ангіотензину, проте не обидва одночасно [60]. Також призначають антагоністи кальцієвих каналів, бета-блокатори й діуретики. У нових настановах ADA-2018 також додана рекомендація щодо можливості застосування антагоністів мінералокортикоїдних рецепторів пацієнтами з резистентною АГ.
Ще одним важливим компонентом профілактики й лікування цереброваскулярних захворювань при ЦД є корекція порушень ліпідного обміну. Для покращання ліпідного профілю пацієнтам із ЦД необхідна модифікація способу життя, сфокусована на нормалізації маси тіла, зменшенні споживання насичених жирів, трансжирів і холестерину (ХС), збільшенні споживання омега-3 жирних кислот, клітковини й рослинних станолів/стеролів, а також підвищенні фізичної активності.
Відповідно до рекомендацій ADA-2018 слід інтенсифікувати модифікацію способу життя й оптимізувати глікемічний контроль пацієнтам із підвищеним рівнем тригліцеридів (≥ 1,7 ммоль/л) і/або зниженим рівнем холестерину ЛПВЩ (< 1,0 ммоль/л для чоловіків і < 1,3 ммоль/л для жінок).
Препаратами першого ряду в лікуванні дисліпідемій при ЦД є статини, що не лише мають виражені холестеринознижувальні властивості, але й чинять додаткову протизапальну й антитромботичну дію. Блокуючи 3-гідрокси-3-метилглютарил-коензим А-редуктазу, ці препарати зменшують експресію адгезивних молекул (Р-селектин, VCAM, ICAM), пригнічують при цьому адгезію й агрегацію тромбоцитів, зменшують утворення прозапальних цитокінів, модулюють продукцію останніх у ЦНС, покращують функціональні властивості ендотелію, зменшують окиснення ЛПНЩ, стабілізують фіброзну капсулу атеросклеротичної бляшки й ліпідного ядра [65].
Вивченню ефективності корекції дисліпопротеїнемії статинами присвячено багато досліджень. У дослідженні 4S лікування симвастатином хворих на ЦД протягом 5,4 року знизило ризик ГПМК на 62 %, загальну смертність — на 43 % [66]. Дослідження CARE показало, що лікування правастатином знижує ризик ГПМК на 32 %, а у випробуванні LIPID терапія цим препаратом зменшила частоту ішемічного інсульту на 23 % [67]. Результати цих рандомізованих плацебо-контрольованих досліджень дозволили дійти висновку про необхідність застосування статинів у хворих на ЦД з метою профілактики цереброваскулярних захворювань, зокрема ГПМК. Призначення аторвастатину в осіб, старших від 40 років, сприяло скороченню серцево-судинних подій, у тому числі інсультів, у дослідженні ASCOT-LLA на 23 % і в дослідженні CARDS — на 37 %. Багатьма дослідженнями (COMETS, LUNAR, MERCURY-I, SOLAR, STELLAR та ін.) продемонстрована більш суттєва гіпо–ліпідемічна ефективність розувастатину порівняно з іншими препаратами цієї групи. Доведено, що тільки аторвастатин у максимальному дозуванні й розувастатин у середньотерапевтичних і максимальних дозах можуть забезпечити деклароване багатьма рекомендаціями зниження ЛПНЩ на 40–50 % від початкового рівня. Важливою особливістю розувастатину є його здатність більшою мірою, ніж інші статини, знижувати тригліцериди й підвищувати ЛПВЩ [68].
За результатами метааналізу (14 досліджень, близько 18 тис. пацієнтів) рандомізованих досліджень терапії статинами встановлено пропорційне зниження смертності від усіх причин на 9 % і смертності від судинних захворювань — на 13 % на 1 ммоль/л (39 мг/дл) зниження рівня ХС ЛПНЩ у крові. Показано, що у хворих навіть із невисоким рівнем ХС ЛПНЩ (нижче від 3,06 ммоль/л) аторвастатин у дозі 10 мг/добу є безпечним і високоефективним щодо зниження ризику ГПМК. Отримані результати дозволили дійти висновку, що використання якогось цільового рівня ХС ЛПНЩ як єдиного критерію при призначенні хворим на ЦД статинів є невиправданим. Принциповим визначальним чинником слід вважати загальний високий серцево-судинний ризик у досліджуваної категорії пацієнтів [69].
Згідно з рекомендаціями ADA-2018 статинова терапія повинна розглядатися як постійна для всіх хворих на ЦД, старших від 40 років, і раніше у групах високого ризику незалежно від початкових показників ліпідного обміну. Пацієнтам будь-якого віку з ЦД і АССЗ слід призначати високоінтенсивну терапію статинами, хворим, старшим від 40 років з ЦД без АССЗ, — статинотерапію помірної інтенсивності. Також рекомендовано розглянути доцільність додавання езетимібу або PCSK9 (інгібітору пропротеїну конвертази субтилізину/кексину 9-го типу) для пацієнтів з ЦД і АССЗ, у яких рівень ХС ЛПНЩ ≥ 70 мг/дл (1,8 ммоль/л), незважаючи на максимальну дозу статинів.
Слід зазначити, що додавання езетимібу до терапії статинами може забезпечити додаткові переваги серцево-судинної системи, оскільки знижує рівень холестерину ЛПНЩ ще на 24 % [70]. Застосування фібрату не показало значного покращення серцево-судинних результатів, але його призначення можна розглянути в пацієнтів із ЦД типу 2 зі змішаною дисліпідемією [71].
Ефективним напрямком профілактики судинних ускладнень при ЦД є застосування антиагрегантів. Антитромбоцитарна терапія суттєво знижує кількість рецидивів серцево-судинних подій серед хворих на ЦД. За результатами дослідження CAPRIE, клопідогрель перевершує аспірин у зниженні серцево-судинних подій і є набагато безпечнішим в аспекті можливих кровотеч у хворих на ЦД з АССЗ [72]. На жаль, ці клінічні переваги не поширюються на первинну профілактику. Короткочасна подвійна терапія аспірином і клопідогрелем покращує результат інсульту в пацієнтів із транзиторною ішемічною атакою або нетяжким інсультом [73]. Питання використання довгострокової подвійної терапії залишається відкритим, оскільки на тлі відносного ризику зменшення інсульту може зрости геморагічний ризик [74].
Серед важливих профілактичних заходів також слід зазначити нормалізацію маси тіла. Пацієнтам з ЦД типу 2 й ожирінням показані дієта, фізична активність і модифікація способу життя, спрямовані на досягнення зменшення маси тіла на 5 % і більше від початкового показника. При виборі антидіабетичних засобів слід надавати перевагу препаратам, які сприяють зменшенню або є нейтральними щодо зменшення маси тіла [75]. Метаболічна хірургія при лікуванні ожиріння в осіб з ЦД типу 2 показала переваги з боку серцево-судинної системи і є ефективним методом лікування осіб з ожирінням (ІМТ > 40 кг/м2) [76].
Важливим є лікування інших коморбідних станів у хворих на ЦД, зокрема фібриляції передсердь, що підвищує ризик ішемічного інсульту [22, 23] і серцевої недостатності.
Серед заходів профілактики ГМПК у хворих на ЦД також слід відзначити корекцію шкідливих звичок і способу життя, що насамперед включає відмову від куріння, зловживання алкоголем, дотримання режиму дозованих фізичних навантажень. У разі гемодинамічно значущого стенозу сонних артерій необхідне проведення каротидної ендатеректомії.
☼ Отже, сучасна доказова база щодо профілактики церебральних уражень при ЦД містить достатньо відомостей щодо необхідної корекції чинників ризику, що дозволяє сподіватися на суттєве зменшення найближчим часом напруженості проблеми ГПМК у хворих на ЦД.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список літератури
знаходиться в редакції

/u/12-1.jpg)
/u/14-1.jpg)