Вступ
Системний остеопороз та його ускладнення залишаються важливою медико-соціальною проблемою, пов’язаною зі збільшенням показників інвалідності, летальності та значними економічними затратами суспільства [1–4]. Визначення мінеральної щільності кісткової тканини (МЩКТ) за допомогою методики двохенергетичної рентгенівської абсорбціометрії (ДРА) на сьогодні є золотим стандартом для встановлення діагнозу захворювання й оцінки ризику вертебальних та невертебральних переломів [1, 5–7]. Проте дослідження останніх років довели, що МЩКТ є важливим, але не єдиним параметром міцності кісткової тканини й ризику переломів. Важливу роль у їх розвитку відіграють різні клінічні фактори ризику (вік, стать, паління, вживання алкоголю, супутні захворювання та стани, прийом деяких лікарських засобів), які, зокрема, включені до інструменту FRAX (Fracture Risk Assessment Tool), що дозволяє оцінити 10-річний ризик основних остеопоротичних переломів (променева, плечова та стегнова кістки, клінічно значущі переломи тіл хребців) та переломів стегнової кістки зокрема [8, 9]. Крім того, у численних клінічних дослідженнях та метааналізах доведено, що важливе значення у прогнозуванні ризику переломів має показник TBS (Trabecular Bone Score) [10, 11], який відображає більшою мірою якісні характеристики кісткової тканини та особливості її мікроархітектоніки. Обидві ці методики (FRAX та TBS) на сьогодні включені в програмне устаткування сучасних рентгенівських денситометрів, що дозволяє разом із визначенням показників МЩКТ комплексно оцінити стан кісткової тканини та ризик остеопоротичних переломів.
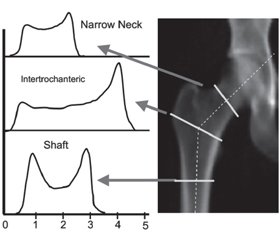
Слід зазначити, що крім вищезазначених методик рентгенівські денситометри містять ще одну важливу методику, яка визначає геометричні параметри стегнової кістки та її міцнісні характеристики — структурний аналіз стегнової кістки (Hip Structural Analysis, HSA) [12–15]. Дана програма аналізує параметри, які в подальшому використовуються не тільки для розрахунку показника МЩКТ, але й для оцінки структурної геометрії перетинів, що проходять через проксимальні відділи стегнової кістки в певних місцях. Зображення кісткової маси використовується безпосередньо при проведенні ДРА, де піксельні значення виражаються в г/см2. Метод використовує принцип, що лінія значень пікселів на осі кістки відповідає площині зрізу, який проходить через кістку в даному місці, і містить певну інформацію про перетин кістки. Програма аналізує проксимальний відділ стегнової кістки в трьох її ділянках (рис. 1), а саме: 1) у найвужчій ділянці шийки стегнової кістки (Narrow Neck, NN); 2) міжтрохантерній ділянці стегнової кістки (Intertrochanteric, ІТ) уздовж бісектриси кута шийки стегнової кістки та 3) валі стегнової кістки (Shaft, S), на 2 см дистальніше до середньої точки малого вертлюга. У подальшому за допомогою комп’ютерної програми для кожного регіону розподіл кісткової маси через кістку вираховує її геометричні властивості, отримані за певними формулами, що імплементовані в програмне забезпечення ДРА [12]. Зображення денситометра Hologic, який показує регіони стегнової кістки, що використовуються для аналізу (на шийці стегнової кістки (NN-ділянка), між трохантерами (Іntertrochanteric) і валі (Shaft)), наведено на рис. 1. Зліва зображені типові профілі маси кістки, які використовують при вимірюванні геометричних властивостей.
/17-1.jpg)
Програма HSA автоматично оцінює структурні показники, такі як момент інерції поперечного перетину шийки стегнової кістки (CMSI), площа поперечного перетину (CSA), кут шийки стегнової кістки, довжина її осі (HAL) та ін. [13–15].
Сross sectional moment of inertia (CSMI, мм4), момент інерції мінімального поперечного перетину стегнової кістки. Показник CSMI в ділянці регіону інтересу (region of interest, ROI) шийки стегнової кістки описує геометричні її особливості, щільність та стійкість до вигину з біомеханічної точки зору й теоретично відображає міцність шийки стегнової кістки (рис. 2).
Сross sectional area (CSA, мм2), площа поперечного перетину мінімального CSMI в ділянці регіону інте–ресу шийки стегнової кістки (рис. 2).
Показник d1 (мм), відстань від центру головки до центру шийки (мінімального CSMI) стегнової кістки (рис. 2).
Показник d2 (мм), відстань від центру головки стегнової кістки до міжвертлюгової лінії стегнової кістки (рис. 2).
Показник d3 (мм), середній діаметр шийки стегнової кістки.
Показник y (мм), відстань від центроїду (центр маси) шийки стегнової кістки до верхнього її краю на рівні мінімального CSMI. Верхня ділянка шийки стегнової кістки становить особливий інтерес через вищу втрату кісткової маси з віком порівняно з усією шийкою стегнової кістки (рис. 2).
Показник θ (градуси), кут шийки стегнової кістки.
Нip axis length (HAL, мм), довжина осі стегнової кістки; відстань, виміряна вздовж осі шийки стегнової кістки від основи великого вертлюга до внутрішньої поверхні таза.
Вищезазначені показники використовуються, зокрема, й для вирахування програмою показника індексу міцності стегнової кістки (Femur Strength Index, FSI), який поєднує структурні параметри програми HSA з віком, зростом і масою тіла та відображає здатність стегнової кістки витримувати навантаження при падінні на великий вертлюг.
На сьогодні згідно з оновленими рекомендаціями Міжнародного товариства з клінічної денситометрії (International Society for Clinical Densitometry, 2015) показник довжини осі стегнової кістки (HAL), отриманий при вимірюванні за допомогою ДРА, є незалежним предиктором переломів стегнової кістки в постменопаузальних жінок [5], а методика HSА, інтегрована в рентгенівські денситометри, розширює можливості клініциста в комплексній оцінці ризику остеопоротичних переломів. Проте дані щодо показників даної методики в осіб української популяції поки відсутні.
Мета дослідження — вивчити вікові особливості параметрів структурного аналізу стегнової кістки в жінок української популяції та запропонувати їх референтні показники для використання в практичній охороні здоров’я.
Матеріали та методи
Нами на базі Українського науково-медичного центру проблем остеопорозу, ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» за допомогою методики ДРА обстежено 1127 жінок віком 20–89 років. У подальшому для визначення референтних значень для показників структурного аналізу стегнової кістки були виключені результати жінок з індексом маси тіла менше 15 й більше 40 кг/м2, постменопаузальним остеопорозом згідно з рекомендаціями Все–світньої організації охорони здоров’я (ВООЗ, 1994) (показник Т на рівні стегнової кістки і/або поперекового відділу хребта і/або всього скелета ≤ –2,5 SD), показником Z ≤ –2,0 SD на рівні стегнової кістки та/чи поперекового відділу хребта і/або всього скелета в молодих жінок (до настання менопаузи), клінічно значущими супутніми захворюваннями та станами, які можуть впливати на метаболізм кісткової тканини, з патологією кульшового суглоба (коксартроз 2–4-го ст., асептичний некроз головки стегнової кістки, дисплазія кульшового суглоба та ін.). Таким чином, аналіз проведений з використанням результатів 690 жінок. Клініко-анамнестична характеристика обстежених наведена в табл. 1.
Структурний аналіз показників стегнової кістки проводили методом ДРА за допомогою рентгенівського денситометра Prodigy (GE Lunar, Madison, 2005, США).
Статистичну обробку результатів дослідження здійснювали за допомогою пакета програм Statistica 7.0. Використовували однофакторний дисперсійний аналіз Anova, кореляційний та регресійний аналізи. Результати подані у вигляді M ± SD. Критичним рівнем значущості вважали р < 0,05.
Результати
Аналіз отриманих результатів засвідчив вірогідний вплив віку на варіабельність показників HSA: FSI (F = 5,8; р = 0,000007); CSMI (F = 3,3; р = 0,003); CSA (F = 11,2; р = 0,0000001); d1 (F = 14,1; р = 0,0000001); d2 (F = 5,0; р = 0,00004); d3 (F = 9,8; р = 0,0000001); y (F = 20,1; р = 0,0000001); α (F = 7,8; р = 0,0000001) та HAL (F = 4,7; р = 0,0001). Проте нами не встановлено подібного впливу віку на показник величини кута шийки стегнової кістки (параметр θ: F = 0,7; р = 0,67). Середні показники обстежених жінок залежно від віку наведено в табл. 2.
/18-1.jpg)
Так, нами встановлено вірогідне зменшення показника міцності стегнової кістки з 1,5 ± 0,3 до 1,3 ± 0,4 од. на тлі вірогідного зростання параметрів моменту інерції мінімального поперечного перетину стегнової кістки (з 9204,7 ± 2587,9 у віці 20–29 років до 10020,0 ± 3175,3 мм4 у віці 80–89 років відповідно), площі поперечного перетину мінімального CSMI в ділянці регіону інтересу шийки стегнової кістки (з 137,3 ± 25,9 до 120,0 ± 20,7 мм2) та довжини осі стегнової кістки (з 101,8 ± 8,2 віком 20–29 років до 107,0 ± 5,4 мм віком 80–89 років відповідно).
За даними регресійного аналізу, в обстежених жінок вік вірогідно був пов’язаний з показниками FSI, CSA, HAL, d1, d2, d3. α та y. Проте нами не встановлено вірогідного зв’язку між віком і показниками θ (кут шийки стегнової кістки) і CSMI (момент інерції мінімального поперечного перетину стегнової кістки). Найбільш вираженими, хоча й слабкими, проте вірогідними були зв’язки між віком та відстанню від центра головки стегнової кістки до міжвертлюгової лінії стегнової кістки (показник d1; r = –0,32; p = 0,00001) та відстанню від центроїду шийки стегнової кістки до верхнього її краю на рівні мінімального CSMI (показник у; r = 0,37; p = 0,00001) (табл. 3).
При аналізі кореляційних зв’язків між параметрами геометрії стегнової кістки та основними антропометричними показниками нами було встановлено вірогідний зв’язок між показниками як зросту, так і маси тіла й параметрами CSMI, CSA, HAL, d1, d2, d3 та y.
Показник зросту був найбільш виражено, хоч і помірно пов’язаний з параметром HAL (r = 0,45; p = 0,00001), меншою мірою з показниками CSMI (r = 0,39; p = 0,00001) та CSA (r = 0,38; p = 0,00001). На відміну від вищезазначеного показник маси тіла був вірогідно пов’язаний з показниками CSMI (r = 0,42; p = 0,00001) та CSA (r = 0,42; p = 0,00001),тоді як цей зв’язок з параметром HAL (r = 0,25; p = 0,00001) був вірогідним, хоча й слабким (табл. 3).
Показник міцності стегнової кістки (FSI) був вірогідно пов’язаний з масою тіла (p = 0,00001), проте не зі зростом (p = 0,23). Крім того, кут шийки стегнової кістки згідно з показником θ не був вірогідно пов’язаний з показниками зросту та маси тіла в обстежених жінок (рис. 3).
При аналізі кореляційних зв’язків між показниками МЩКТ різних ділянок скелета та параметрами HSA найбільш виражені зв’язки встановлені щодо показників CSMI і CSA на всіх досліджуваних рівнях.
Параметр міцності стегнової кістки найбільшою мірою корелював з показником МЩКТ, виміряним на рівні шийки стегнової кістки (r = 0,30; р = 0,0001), меншою мірою на рівні всієї стегнової кістки (r = 0,18; р = 0,02) та поперекового відділу хребта (r = 0,09; р = 0,03) й зовсім не корелював на рівні всього скелета (r = 0,06; р = 0,09) (табл. 4).
Показник довжини осі стегнової кістки (HAL) вірогідно не корелював з жодним вимірюваним показником МЩКТ, що підтверджує його незалежну роль у прогнозуванні ризику остеопоротичних переломів стегнової кістки (табл. 4).
Обговорення
На сьогодні продемонстровано, що показник МЩКТ не є універсальним параметром міцності кісткової тканини й ризику переломів. Комплексна оцінка стану кісткової тканини поєднує його використання з такими показниками, як FRAX та TBS.
Останнім часом усе більше уваги приділяється аналізу показників геометрії стегнової кістки, які є також незалежними предикторами ризику остеопоротичних переломів. На даний час у численних дослідженнях продемонстровано зв’язок між показником HAL та ризиком переломів стегнової кістки [13, 17].
Так, у дослідженні, проведеному K.G. Faulkner [13], при обстеженні 2506 жінок віком 50 років і старше (365 — з переломом проксимального відділу стегнової кістки та 2141 — контроль) за допомогою ДРА продемонстровано, що показник МЩКТ був вірогідно нижчим, а параметр HAL вірогідно вищим у групі пацієнток з переломами порівняно з контролем. Показник CSMI вірогідно не відрізнявся в групах залежно від наявності переломів після його корекції щодо параметрів МЩКТ та HAL. Індекс міцності стегнової кістки після корекції шодо показників T і HAL був вірогідно нижчим у групі жінок з переломами, у зв’язку з чим авторами зроблено висновок про те, що показники МЩКТ, HAL та FSI є вірогідними незалежними предикторами перелому стегнової кістки.
При вивченні коефіцієнта шансів (OR) для параметрів МЩКТ та HSА авторами встановлено, що він відповідно для показника T (зміна на одне SD) становив 2,0 (95% довірчий інтервал (ДІ) 1,8–2,4; р < 0,001); для довжини сегнової кістки (HAL) (зміна на одне SD) — 1,3 (95% ДІ 1,2–1,5; р < 0,001); індексу міцності стегнової кістки (FSI), скоригованого до показників Т та HAL (зміна на одне SD), — 1,5 (95% ДІ 1,3–1,6; р < 0,001); віку (на декаду) — 1,1 (95% ДІ 0,9–1,2; р = 0,31) [13]. Проведений авторами ROC-аналіз для оцінки дискримінаційної можливості у показника T та моделі ймовірності логістичної регресії з включенням параметрів HAL and FSI продемонстрував, що площа під ROC-кривою була вірогідно більшою при комплекному врахуванні показників МЩКТ та HSA. Вона становила відповідно 0,74 проти 0,71 (р < 0,001), що свідчить про покращення дискримінаційних властивостей для виявлення переломів при включенні вищезазначених параметрів геометрії стегнової кістки, які були об’єднані з вимірами МЩКТ.
Вивченню вікових і статевих особливостей геометрії стегнової кістки присвячені численні дослідження, проведені останніми роками [18–21].
Так, G. Alwis, C. Karlsson, S. Stenevi-Lundgren та співавт. проаналізовано показники геометрії стегнової кістки у жителів Швеції [18] віком 6–90 років з використанням ДРА (599 дівчат і 642 хлопчики віком 6–19 років та 270 жінок і 249 чоловіків віком 20–90 років). При вивченні показників геометрії стегнової кістки в дітей і підлітків авторами встановлено їх вірогідне збільшення до віку 17 років у дівчаток та 19 років у хлопчиків. Після деякої стабілізації показники періостального та ендостального діаметра стегнової кістки далі збільшувалися з віком, проте зростання показника ендостального діаметра стегнової кістки було виражено більшою мірою порівняно з показником її періостального діаметра. На відміну від вищезазначеного, товщина кортикального шару кістки та МЩКТ вірогідно зменшувались з віком. Зниження МЩКТ відбувалось при збільшенні розміру кістки, що призводило до статистично невірогідного зниження міцності кістки, оціненого за показниками модуля перетину Z та CSMI, від моменту стабілізації показників у віці 17–19 років до 90 років. Часткове збереження міцності кістки було більш очевидним у чоловіків, ніж у жінок, оскільки зменшення показника МЩКТ було більшим у жінок, ніж у чоловіків, тоді як збільшення показника періостального діаметра в чоловіків було більш вираженим, ніж у жінок. Як зазначають автори, статеві відмінності нормативних показників міцності кісткової тканини можуть бути пов’язані як зі статевими особливостями формування піку кісткової маси, так і з геометричними параметрами стегнової кістки під час росту та репродуктивного віку.
При проведенні Third National Health and Nutrition Examination Survey (NHANES III) у США за допомогою ДРА [19] були проаналізовані показники HSA та МЩКТ у дорослих осіб віком 20–99 років. Аналіз включав дані білошкірих американців неіспанського походження (2719 чоловіків і 2904 жінки). Проводили дослідження кортикальної ділянки стегнової кістки (Shaft, на 2 см дистальніше до середньої точки малого вертлюга) та змішаної кортикально-требекулярної ділянки (Narrow Neck, найбільш вузька частина шийки стегнової кістки). Авторами проаналізовано показники МЩКТ та модуля перетину (section modulus) після їх корекції за масою тіла. Зниження параметрів МЩКТ з віком у ділянці найбільш вузької ділянки шийки стегнової кістки було подібним до того, яке спостерігалось у ділянці валу стегнової кістки. Останній показник також зменшувався, хоча і більш повільно. Динаміка показника модуля перетину мала деякі особливості залежно від регіону вимірювання та статі. Зокрема, на рівні найбільш вузької частини стегнової кістки та в ділянці валу він залишався майже сталим аж до п’ятого десятиліття в жінок, а потім зменшувався повільніше, ніж показник МЩКТ. На відміну від вищезазначеного, у чоловіків модуль перетину в найбільш вузькій частині стегнової кістки помірно зменшувався до п’ятого десятиліття, а потім залишався майже сталим, тоді як відповідний показник на рівні валу стегнової кістки був сталим до п’ятого десятиліття, а потім прогресивно збільшувався. На думку авторів, очевидним механізмом протилежно направлених змін показників МЩКТ та модуля перетину є лінійне розширення субперіостального діаметра кістки незалежно від статі та регіону вимірювання, що відіграє певну роль у механічній компенсації втрати медулярної кісткової маси.
На думку авторів, отримані результати дозволяють припустити, що втрата кісткової маси в стегновій кістці при старінні не обов’язково означає зменшення її механічної міцності. Модуль перетину в осіб літнього віку в середньому змінюється на 14 % від відповідних показників у молодих жінок та на 6 % у чоловіків.
У дослідженні, проведенному J. Gong, M. Tang, B. Guo у населення Китаю [20], вивчено вікові та статеві особливості міцності кісткової тканини та структури стегнової кістки в 3855 здорових осіб (2713 жінок та 1142 чоловіки) віком від 25 до 91 року з використанням ДРА. Відмінності показників HSA між віковими та статевими групами були скориговані залежно від маси тіла, зросту обстежених та показників МЩКТ стегнової кістки. Зв’язок з віком оцінювали з використанням лінійного регресійного аналізу. Авторами не встановлено вірогідного зв’язку між показниками HSA у молодих осіб. Деякі параметри HSA (CSMI, CSA, модуль перетину, товщина кортикального шару) вірогідно зменшувались з віком, тоді як величини періостального та ендокортикального діаметрів стегнової кістки вірогідно зростали. Особи старших вікових груп мали менші показники міцності стегнової кістки та ширини кортикального її шару, а також збільшені параметри періостального та ендокортикального діаметрів стегнової кістки (p < 0,05), ніж молоді особи. У чоловіків спостерігали більш виражене зростання показників періостального та ендокортикального діаметрів стегнової кістки, ніж у жінок у різних вікових групах. Показник міцності стегнової кістки вірогідно зменшувався з віком у осіб обох статей, що було пов’язано з погіршенням параметра CSMI. Автори зазначають менш виражений зв’язок показників HAS з віком у обстежених чоловіків Китаю порівняно з даними при обстеженні осіб європеоїдної раси та подібний зв’язок у жінок. У чоловіків-китайців встановлено більш виражені структурні порушення геометрії стегнової кістки з віком, ніж у чоловіків європеоїдної раси, що, за думкою авторів, може впливати на ризик переломів стегнової кістки [20].
В іншому дослідженні, проведенному Н. Zhang, Y.Q. Hu, Z.L. Zhang [21] у населення Китаю, вивчено особливості показників МЩКТ та HSA у 18 502 здорових осіб (14 435 жінок та 4077 чоловіків), 254 пацієнтів (216 жінок і 38 чоловіків) з переломами шийки стегнової кістки та 254 осіб відповідного віку та статі (конт–роль). Авторами встановлено вірогідний негативний зв’язок показників МЩКТ, CSMI, CSA та індексу міцності стегнової кістки з віком, проте після корекції показників щодо зросту та маси тіла лише параметр HAL вірогідно збільшувався з віком, а вірогідної кореляції між CSMI та віком як у чоловіків, так і в жінок не виявлено. В осіб обох груп (чоловіки та жінки) з переломами стегнової кістки параметри МЩКТ та CSA стегнової кістки були вірогідно нижчими порівняно з контролем. Після корекції показників щодо МЩКТ у жінок лише менший показник міцності стегнової кістки (FSI) був вірогідним у прогнозі переломів стегної кістки (OR 1,53; 95% ДІ 1,04–2,26). У чоловіків не виявлено жодного показника геометрії стегнової кістки, який би вірогідно впливав на ризик її переломів.
У дослідженні, проведеному М. Iki, N. DongMei, J. Tamaki та співавт., проведено аналіз показників HSA в японській популяції з використанням ДРА [22]. Обстежено 2197 японських жінок віком 15–79 років без супутніх захворювань, пов’язаних з метаболізмом кісткової тканини. Авторами встановлені зміни показників HSA з віком, що були вірогідними у віковій групі 50–54 роки на рівні найвужчої частини шийки стегнової кістки (Narrow neck) та міжвертлюгової ділянки (Intertrochanteric), які були подібні до динаміки змін МЩКТ. У жінок у віковій групі 55–59 років подібні зміни виявлялись і на рівні валу стегнової кістки (Shaft).
Вік-асоційовані зміни показників CSA й ширини кортикальної кістки (CT) були ідентичними до змін показника МЩКТ. Крім того, динаміка показників МЩКТ та СТ у японських жінок була подібна до такої у білошкірих жінок неіспанського походження, які мешкають у США, проте їх значення були дещо меншими. Параметри CSA і CT виявляли високі кореляційні зв’язки з показником МЩКТ на відміну від показників ендостального діаметра (ED), періостального діаметра (PD) й модуля перетину (SM), зв’язок між якими й параметром МЩКТ був значно меншим.
Як зазначалось вище, згідно з оновленими рекомендаціями Міжнародного товариства з клінічної денситометрії (International Society for Clinical Densitometry, 2015), на даний час показник довжини стегнової кістки (HAL), отриманий при вимірюванні за допомогою ДРА, вірогідно пов’язаний з ризиком переломів стегнової кістки в постменопаузальних жінок [5]. На відміну від вищезазначеного наступні параметри геометрії стегнової кістки, отримані за допомогою ДРА (CSA, зовнішній діаметр стегнової кістки (outer diameter, OD), модуль перетину (section modulus, SM), коефіцієнт вигину (buckling ratio, BR), CSMI та NSA)), не повинні використовуватися для оцінки ризику її переломів. Крім того, параметри CSA, OD, SM, BR, CSMI, HAL та NSA не повинні використовуватись для ініціації лікування та моніторингу за ефективністю терапії [5].
На сьогодні комплексна оцінка стану кісткової тканини та ризику остеопоротичних переломів поєднує використання показників МЩКТ, FRAX, TBS та HSA. Останніми роками створено референтні дані щодо трьох вищезазначених методик для осіб української популяції, проте дані щодо останньої методики відсутні. Тому метою даного дослідження було визначення вікових особливостей параметрів HSA в жінок української популяції та запропонувати їх референтні показники для використання в практичній охороні здоров’я.
Результати дослідження продемонстрували вірогідний вплив віку на показники FSI, CSMI, CSA, d1, d2, d3, y, α і HAL, проте не на показник θ. Встановлено вірогідне зменшення з віком показника FSI на тлі вірогідного зростання параметрів CSMI, CSA та HAL. Показники зросту та маси тіла були вірогідно пов’язані з параметрами CSMI, CSA і HAL. Показник міцності стегнової кістки (FSI) був вірогідно пов’язаний з масою тіла, проте не зі зростом. Крім того, він вірогідно корелював з показником МЩКТ, виміряним на рівні шийки стегнової кістки, меншою мірою на рівні всієї стегнової кістки та хребта. Показник довжини осі стегнової кістки (HAL) вірогідно не корелював ні з одним з вимірюваних показників МЩКТ, що підтверджує його незалежну роль у прогнозуванні ризику переломів стегнової кістки.
Висновки
Отримані показники структурного аналізу стегнової кістки в здорових жінок української популяції можуть бути використані для комплексної оцінки стану кісткової тканини та ризику переломів стегнової кістки.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Povoroznjuk VV, Grigor’eva NV, Orlik TV, Nishku–maj OI, Dzerovich NI, Balackaja NI. Osteoporoz v praktike vracha-internista [Osteoporosis in the practice of an internist doctor]. Kiїv: Ekspres; 2014. 198 р. (in Russian).
2. Dhanwal DK, Dennison EM, Harvey NC, Cooper C. Epidemiology of hip fracture: worldwide geographic variation. Indian J Orthop Jan. 2011;45(1):15-22. doi:10.4103/0019-5413.7365.
3. Filipov O. Epidemiology and social burden of the fe–moral neck fractures. Journal of IMAB. Annual Proceeding (Scientific Papers). 2014;20(4):516-518.
4. Tucker A, Donnelly KJ, McDonald S et al. The changing face of fractures of the hip in Northern Ireland:
a 15-year review. Bone Joint J. 2017 Sep;99-B(9):1223-1231. doi: 10.1302/0301-620X.99B9.BJJ-2016-1284.R1.
5. 2015 — ISCD Official Posotions — Adult. Електронний ресурс: https://www.iscd.org/official-positions/2015-iscd-official-positions-adult.
6. Punda M, Grazio S. Bone densitometry — the gold standard for diagnosis of osteoporosis. Reumatizam. 2014;61(2):70-4.
7. Blake GM, Fogelman I. Role of dual-energy X-ray absorptiometry in the diagnosis and treatment of osteoporosis. J Clin Densitom. 2007 Jan-Mar;10(1):102-10.
8. FRAX®. Інструмент оцінки ризику переломів. Available from: https://www.sheffield.ac.uk/FRAX/tool.jsp?lang=uk
9. Povoroznjuk V.V., Grigor’eva N.V. Rol’ FRAX v prognozirovanii riska perelomov. Problemi osteologії. 2012;(1):3-15 (In Ukrainian).
10. Hans D, Goertzen AL, Krieg MA, Leslie WD. Bone microarchitecture assessed by TBS predicts osteoporotic fractures independent of bone density: the Manitoba study. J Bone Miner Res. 2011 Nov;26(11):2762-9. doi: 10.1002/jbmr.499.
11. Shevroja E, Lamy O, Kohlmeier L et al. Use of Trabecular Bone Score (TBS) as a Complementary Approach to Dual-energy X-ray Absorptiometry (DXA) for Fracture Risk Assessment in Clinical Practice. 2017;20(3):334-345. doi: 10.1016/j.jocd.2017.06.019.
12. Beck TJ. Hip Structural Analysis (HSA) Program (BMD and Structural Geometry Methodology) As Used to Create NHANES III Dataset. Octobert 29, 2002. Available from: https://wwwn.cdc.gov/nchs/data/nhanes3/17a/hip_methods.pdf
13. Faulkner KG, Wacker WK, Barden HS et al. Femur strength index predicts hip fracture independent of bone density and hip axis length Osteoporos Int. 2006;(17):593-599. doi: 10.1007/s00198-005-0019-4.
14. Boudreaux RD, Sibonga JD. Advanced Hip Analysis: Simple Geometric Measurements Predict Hip Fracture Beyond Bone Mineral Density TOJ.2015;1(2):109-122. doi: 10.18600/toj.010212.
15. Muschitz Ch, Milassin L, Patsch J et al. DXA and QCT Geometric Structural Measurements of Proximal Femoral Strength. Available from: http://www.muschitz.info/muschitz/files/DXA%20QCT%20Hip%20Review%20final%20C%20Muschitz.pdf
16. Beck TJ, Looker AC, Ruff CB, Sievanen H, Wah–ner HW. Structural trends in the aging femoral neck and proximal shaft: analysis of the Third National Health and Nutrition Examination Survey dual-energy X-ray absorptiometry data. J Bone Miner Res. 2000 Dec;15(12):2297-304.
17. Grygorieva NV, Povoroznyuk VV, Zubach OB, Povoroznyuk VasV. Proximal Femoral Geometry and the Risk of Fractures: Literature Review. Bol’, Sustavy, Pozvonochnik. 2016;(21):21-28.
18. Alwis G, Karlsson C, Stenevi-Lundgren S, Rosengren BE, Karlsson MK. Femoral neck bone strength estimated by hip structural analysis (HSA) in Swedish Caucasians aged 6-90 years. Calcif Tissue Int. 2012 Mar;90(3):174-85. doi: 10.1007/s00223-011-9566-1. Epub 2012 Jan 22.
19. Kaptoge S, Dalzell N, Loveridge N et al. Effects of gender, anthropometric variables, and aging on the evolution of hip strength in men and women aged over 65. Bone. 2003 May;32(5):561-70.
20. Gong J, Tang M, Guo B et al. Sex- and age-related differences in femoral neck cross-sectional structural changes in mainland Chinese men and women measured using dual-energy X-ray absorptiometry. Bone. 2016 Feb;83:58-64. doi: 10.1016/j.bone.2015.09.017. Epub 2015 Oct 22.
21. Zhang H, Hu YQ, Zhang ZL. Age trends for hip geometry in Chinese men and women and the association with femoral neck fracture. Osteoporos Int. 2011 Sep;22(9):2513-22. doi: 10.1007/s00198-010-1479-8.
22. Iki M, DongMei N, Tamaki J, Sato Y, Kagamimori S, Kagawa Y, Yoneshima H; Japanese Population-based Osteoporosis Study Group. Age-specific reference values of hip geometric indices from a representative sample of the Japanese female population: Japanese Population-based Osteoporosis (JPOS) Study. Osteoporos Int. 2011 Jun;22(6):1987-96. doi: 10.1007/s00198-010-1406-z.

/17-1.jpg)
/17-2.jpg)
/18-1.jpg)
/19-1.jpg)
/20-1.jpg)
/20-2.jpg)