Статья опубликована на с. 40-45
Введение
Перелом дистального метаэпифиза лучевой кости (перелом луча в типичном месте) встречается достаточно часто, особенно у пожилых людей [1–3]. Среди всех переломов они составляют от 11 до 30 % [4, 5]. Обычно переломы костей этой локализации при хорошем сопоставлении срастаются в течение 4–6 недель, и больные возвращаются к активной трудовой жизни. Высокий удельный вес среди этой группы пострадавших имеют женщины в пре- и постменопаузальном возрасте, с пониженной минеральной плотностью костей [6, 7]. Неудовлетворительные результаты лечения у пациентов старше 70 лет встречаются в 44 % случаев (не удается получить удовлетворительного сопоставления отломков после первичной репозиции или наступает вторичное смещение) [8–10].
Подавляющее большинство пациентов старше 60 лет лечится консервативно по ряду объективных причин [11–13]. Результаты лечения таких больных остаются неудовлетворительными в 30 % случаев [14–17]. Обусловлено это рядом причин.
Применяемая стандартная методика ручной репозиции с последующей фиксацией отломков гипсовой лонгетой не исключает возможность вторичного смещения отломков [18–21]. Увеличение сроков иммобилизации приводит к развитию контрактур в лучезапястном суставе и суставах пальцев кисти [22–24].
Одним из грозных осложнений при переломе лучевой кости в типичном месте является развитие посттравматического нейродистрофического синдрома. Факторами риска его развития являются пол, возраст, сопутствующие заболевания — остеопороз, шейный остеохондроз или иная спондилопатия, гипертоническая болезнь, ожирение, ишемическая болезнь [15, 26]. Значительную роль в развитии посттравматического нейродистрофического синдрома играет наличие сахарного диабета. Такие больные на длительное время становятся нетрудоспособными [28, 27].
Высокий удельный вес неудовлетворительных результатов обусловливает поиск оптимальных методик ведения больных как в остром периоде, так и в процессе восстановительного лечения. Единства мнений по данному вопросу не существует, отсутствует алгоритм консервативного лечения этих больных, особенно на ранних стадиях.
Целью работы является улучшение результатов лечения пострадавших с переломами дистального метаэпифиза лучевой кости на основе ранней диагностики и проведения патогенетически обоснованной профилактики и лечения посттравматического нейродистрофического синдрома в группе больных с сахарным диабетом.
Задачи:
1. Определить вероятность развития посттравматического нейродистрофического синдрома (характер перелома, возраст, пол, сопутствующие заболевания, характер и выраженность болевого синдрома, неврологические нарушения) у больных сахарным диабетом.
2. Обосновать и провести индивидуальный комплекс восстановительного лечения с использованием рациональной фиксации отломков, медикаментозной терапии, физиолечения и лечебной физкультуры.
3. Определить эффективность предложенного комплексного лечения.
Материалы и методы
Под нашим наблюдением находились 63 больных, у которых перелом дистального метаэпифиза лучевой кости сочетался с сахарным диабетом. Большинство из них были женщины (43 — 68,3 %). 38 пострадавших были старше 55 лет (60,4 %). В этой группе больных перелом по типу Колеса встречался в 49 случаях, Смита — в 14 (77,8 и 22,2 % соответственно). Женщин было подавляющее большинство (52 — 82,5 %). Переломы по типу трещины нами не анализировались. Во всех случаях проводилась коррекция смещения, фиксация пластиковой повязкой.
Для определения силы боли использовалась визуально-аналоговая шкала (ВАШ), характера боли — опросник DN4 (опросник для диагностики нейропатической боли).
Альгезиометрия (измерение боли) являлась характеристикой происходящих изменений в организме, а динамика показателей — объективным критерием эффективности проводимой терапии.
Интегральный показатель боли — это ее субъективная оценка больным. Имеется много аспектов и способов учета ее интенсивности. Наиболее полно и удобно в клинической практике у больных с переломами луча в типичном месте характеризует боль визуальная аналоговая шкала (ВАШ) — от полного отсутствия до невозможности переносить ее.
Больному давалась инструкция оценить свои ощущения по следующим принципам. На шкале длиной 10 см (100 мм) точкой отмечается уровень силы боли. Начальная точка обозначает отсутствие боли — 0, затем идет слабая боль, умеренная, сильная боль и конечная точка — невыносимая боль — 10.
При кажущейся примитивности ВАШ имеет широкое применение в клинической практике и всеобщее признание клиницистов.
DN4 — опросник для диагностики нейропатической боли. Во время беседы выясняли следующие вопросы:
1. Соответствует ли боль, которую испытывает пациент, одному или нескольким из следующих определений:
— ощущение жжения (да, нет);
— болезненное ощущение холода (да, нет);
— ощущение, как от удара током (да, нет).
2. Сопровождается ли боль одним или несколькими из следующих симптомов в области ее локализации:
— пощипывание, ощущение ползания мурашек (да, нет);
— покалывание (да, нет);
— онемение (да, нет);
— зуд (да, нет).
3. Локализована ли боль в той же области, где осмотр выявляет один или оба следующих симптома:
— пониженная чувствительность к прикосновению (да, нет);
— пониженная чувствительность к покалыванию (да, нет).
4. Можно ли вызвать или усилить боль в области ее локализации:
— проведя в этой области кисточкой (да, нет).
При ответе «да» на четыре и более вопроса диагноз нейропатической боли вероятен более чем в 86 % случаев.
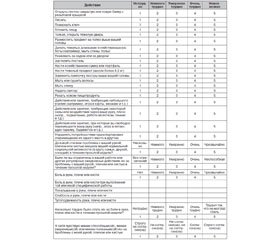
Для субъективной унифицированной оценки функции кисти в отдаленные сроки после травмы пальцев и кисти чаще всего используют специфический опросник DASH — Disability of the Arm, Shoulder and Hand Outcome Measure — Опросник исходов и неспособности руки и кисти. В 2005 году он прошел процесс межкультурной адаптации на русском языке (Ягджян Г.В. и соавт., 2005), и русскоязычная версия доступна на интернет-странице Института труда и здоровья (Канада) — http://www.dash.iwh.on.ca. Основной раздел опросника DASH (шкала неспособностей/симптомов) состоит из 30 пунктов-вопросов, связанных с состоянием функции кисти за последнюю неделю. При этом 21 из них выявляет степень трудности выполнения различных физических действий по причине ограничения функции плеча или кисти; 6 пунктов касаются выраженности некоторых симптомов и 3 — социально-ролевых функций. Каждый пункт имеет 5 вариантов ответов, оцениваемых в баллах от 1 до 5. Сумму баллов по всем пунктам затем преобразуют на 100-балльную шкалу (табл. 1).
/42.jpg)
Больному предлагается оценить способность совершать определенные действия в течение последней недели, обводя кружком номер соответствующего ответа.
Таким образом, DASH оценивает неспособность верхней конечности от 0 — отсутствие неспособностей (хорошая функциональность) до 100 — чрезмерная неспособность. Интерактивная шкала находится по электронному адресу https://sites.google.com/site/71microsurgery/vopros-vracu/dash
Во всех наблюдениях в течение первых трех суток у больных с сахарным диабетом и переломами лучевой кости в типичном месте болевой синдром имел характер нейропатического. Это было обусловлено несколькими причинами, одна из которых — анатомическая предрасположенность. Карпальный канал — это узкий туннель, который формируется костями запястья и поперечной связкой запястья. Через него проходят сухожилия сгибателей кисти и срединный нерв. От последнего отходят чувствительные веточки к большому, указательному, среднему и половине безымянного пальца. Кроме того, он иннервирует мышцы большого пальца. Нейропатия срединного нерва при переломах луча в типичном месте заключается в травматизации и сдавлении срединного нерва в полости канала.
Общепринятым является мнение, что в развитии посттравматического нейродистрофического синдрома предрасполагающими факторами являются сосудистые заболевания, преморбидные дегенеративные изменения в мышечно-сухожильно-периартикулярных тканях, остеохондроз шейного отдела позвоночника, сахарный диабет. У всех пострадавших имелась эта патология.
Очень важным в профилактике развития посттравматического нейродистрофического синдрома на начальных этапах являлось полноценное мультимодальное обезболивание. Достигалось это следующими приемами.
Проводилась разъяснительная беседа с пациентом. Использовались нестероидные противовоспалительные препараты (внутримышечная инъекция дексалгина за 15–20 минут до вправления). В гематому перелома вводился 2% раствор лидокаина, не ранее чем через 5 минут проводилась репозиция. Производилась длительная, с нарастающим усилием тракция отломков лучевой кости. Грубые манипуляции не производились. После сопоставления отломков в положении легкого растяжения и небольшого сгибания или разгибания кисти отломки фиксировались гипсовой или пластиковой лонгетой. Через 2 недели при необходимости проводилось этапное выведение кисти в среднефизиологическое положение. Через 4–5 недель лонгета снималась, проводилось восстановительное лечение.
На 2-й день после травмы больные начинали ЛФК пальцев по 1 периоду, проводили физиопроцедуры — УВЧ и магнитотерапию.
Медикаментозная терапия включала применение препаратов Са и витамина D3 (кальций-Д3 Никомед), витамины группы В (нейробион, дуовит), альфа-липоевую кислоту (берлитион), миорелаксант мидокалм. Обязательным компонентом консервативной профилактики и лечения было применение полипептида келтикана. Препарат, содержащий цитидинмонофосфат и уридинмонофосфат, показан для лечения нейропатической боли при поражении периферической нервной системы. Он улучшает аксональную и нейрональную регенерацию. С целью снижения мышечного тонуса использовался миорелаксант мидокалм, который оказывает и местноанестезирующее воздействие.
Результаты и обсуждение
У всех 63 больных при поступлении определялся нейропатический компонент болевого синдрома различной степени выраженности. Проведение профилактических мероприятий (психогенная подготовка пострадавших, мультимодальное обезболивание, щадящая репозиция с фиксацией современными пластиковыми повязками, коферменты с полипептидами, миорелаксанты, препараты Са и витамина D3), раннее физиолечение и ЛФК привели к достоверному снижению болевого синдрома. Уже к 4-м суткам после поступления пострадавшие отмечали снижение интенсивности боли с 7,42 ± 0,31 балла до 2,40 ± 0,12 балла на 7-е и 14-е сутки по данным ВАШ (удовлетворительная переносимость ощущения боли — уже 2,1 ± 0,1 балла и 2,2 ± 0,3 балла), что является свидетельством хорошей переносимости ощущения боли. Такие же показатели сохранились и к концу иммобилизации.
Результаты лечения 63 больных были оценены к 90-м суткам после травмы. После проведения восстановительного лечения болевые ощущения оценены 52 больными как незначительные и терпимые (2,40 ± 0,24 балла). У 9 пострадавших имела место хронизация болевого синдрома (5,2 ± 0,6 балла). Имелись контрактуры пальцев и лучезапястного сустава. Сохранялся нейропатический выраженный болевой синдром. У 2 имели место выраженные нейротрофические и функциональные нарушения, которые в дальнейшем потребовали длительного консервативного лечения
При опросе больных по шкале DASH функцию поврежденной руки определили как удовлетворительную функциональность — 33,2 ± 0,4 балла.
Полученные нами результаты свидетельствуют о следующем. Переломы лучевой кости в типичном месте у больных с сахарным диабетом во всех случаях сопровождаются нейропатическим компонентом боли. Сочетание психогенной подготовки пострадавших, мультимодальное обезболивание, щадящая репозиция с фиксацией современными пластиковыми повязками, медикаментозная терапия, раннее физиолечение и ЛФК позволили купировать болевой синдром уже к 7-м суткам у подавляющего большинства пострадавших (92,6 %). К 90-м суткам после окончания лечения 52 пациента (82,5 %) оценили болевые ощущения как терпимые, а функцию поврежденной руки определили как удовлетворительную функциональность — 33,2 ± 0,4 балла.
У 9 пострадавших имела место хронизация болевого синдрома. Функцию поврежденной руки определили как удовлетворительную. У 2 имели место выраженные нейротрофические и функциональные нарушения — результат был неудовлетворительным.
Выводы
1. Во всех наблюдениях в течение первых трех суток у больных с сахарным диабетом и переломами лучевой кости в типичном месте болевой синдром имел характер нейропатического.
2. Обоснован и проведен лечебно-профилактический комплекс — психогенная подготовка пострадавших, мультимодальное обезболивание, щадящая репозиция с фиксацией современными повязками, медикаментозная терапия, раннее физиолечение и ЛФК.
3. 52 пациента (82,5 %) высоко оценили результаты лечения — болевые ощущения как терпимые, а функцию поврежденной руки определили как удовлетворительную функциональность — 33,2 ± 0,4 балла по шкале DASH.
Список литературы
1. Акимова Т.Н., Савченко В.В., Гладкова Е.В., Колмыкова А.С., Чибриков А.Г. Средние сроки временной нетрудоспособности у больных с переломами длинных костей // Травма. — 2009. — Т. 10, № 1. — С. 44-47.
2. Епанов В.В. Клинико-эпидемиологическая характеристика переломов дистального отдела лучевой кости на почве остеопороза в условиях Крайнего Севера (на примере города Якутска: Дис… канд. мед. наук. — Якутск. — 2006. — 22 с.
3. Ангарская Е.Г. Переломы лучевой кости в типичном месте // Сибирский медицинский журнал. — 2005. — № 1. — С. 106-109.
4. Ролік О.В. Післятравматичний нейродистрофічний синдром при переломах дистального метаепіфізу кісток передпліччя / Ролік О.В., Ганич Т.С., Колісник Г.І., Марченкова Н.О., Тугаров Ю.Р. // Ортопедия, травматология и протезирование. — 2004. — № 1. — С. 127-132.
5. Palshin G.А., Yepanov V.V. Neurodystrophic syndrome in the presence of distal part radial fracture, treatment and prophylaxis // The XII International Symposium of the Japan-Russia Medical Exchange. — Krasnoyarsk, 2005. — P. 144-145.
6. Корж Н.А. Патогенез посттравматических болевых синдромов конечностей / Корж Н.А., Котульский И.В. // Международный медицинский журнал. — 2002. — № 1-2. — С. 134-137.
7. Аль-Замиль М.Х. Карпальный синдром // Клиническая неврология. — 2008. — № 1. — С. 41-45.
8. Гаркави А.В. Обезболивающая и противовоспалительная терапия при консервативном лечении острого периода травмы конечностей / Гаркави А.В., Силин Л.Л., Терновой К.С. // Международный медицинский журнал. — 2004. — № 12. — С. 94-97.
9. Голубев В.Л. Туннельные синдромы руки / Голубев В.Л., Данилов А.Б., Меркулова Д.М., Орлова О.Р. // Русский медицинский журнал. — 2009. — Т. 17 (Специальный выпуск. Болевой синдром). — С. 22-26.
10. Данилов А.Б. Диагностические шкалы для оценки нейропатической боли / Данилов А.Б., Давыдов О.С. // Боль. — 2007. — № 3(16). — С. 11-15.
11. Taha R. Update on the pathogenesis of complex regional pain syndrome: role of oxidative stress / Taha R., Blaise G.A. // Can. J. Anaesth. — 2012. — 59. — 875-881.
12. Parkitny L. Inflammation in complex regional pain syndrome: a systematic reviewand meta-analysis / Parkitny L., McAuley J.H., Di Pietro F., Stanton T.R., O’Connell N.E., Marinus J. // Neurology. — 2013. — 80. — Р. 106-117.
13. Баховудинов А.Х. Прогнозирование формирования синдрома Зудека при дистальных переломах лучевой кости: Автореф. дис... канд. мед. наук. — Новосибирск, 2011. — С. 27.
14. Tran de Q.H. Treatment of complex regional pain syndrome: a review of the evidence / Tran de Q.H., Duong S., Bertini P., Finlayson R.J. // Can. J. Anaesth. — 2010. — V. 57, № 2. — P. 149-166.
15. Perez R. Prognostic factors in treatment of distal radius fracture: volar plate versus external fixation / Perez R., Vicent-vera J. // Rev. Esp. Cir. Orthop. traumtol. — 2008. — 52. — Р. 300-3005.
16. Schilder J.C. Psychological and behavioral aspects of complex regional pain syndrome management / Schilder J.C., Schouten A.C., Perez R.S., Huygen F.J., Bruehl S., Chung O.Y. // Clin. J. Pain. — 2006. — 22. — Р. 430-437.
17. Tran de Q.H. Treatment of complex regional pain syndrome: a review of the evidence / Tran de Q.H., Duong S., Bertini P., Finlayson R.J. // Can. J. Anaesth. — 2010. — V. 57, № 2. — P. 149-166.
18. Zečević Luković T. Complex regional painsyndrome type I in the upper extremity — how efficient physical therapy and rehabilitation are / Zečević Luković T., Ristić B., Jovanović Z., Rančić N., Ignjatović Ristić D., Cuković S. // Med. Glas. (Zenica). — 2012. — 9. — Р. 334-340.
19. O’Connel N.E. Interventions for treating pain anddisability in adults with complex regional pain syndrome / O’Connel N.E., Wand B.M., McAuley J., Marston L., Moseley G.L. // Cochrane Database Syst. Rev. — 2013. — 4. — CD009416.
20. Demir S.E., Ozaras N., Karamehmetoğlu S.S., Karacan I., Aytekin E. Risk factors for complex regional painsyndrome in patients with traumatic extremity injury // Ulus Travma Acil. Cerrahi Derg. — 2010. — 16. — Р. 144-148.
21. Золотушкин М.Л. Лечение посттравматического комплексного регионарного болевого синдрома с применением криогенных технологий и медикаментозной коррекции: Автореф. дис... канд. мед. наук. — Пермь, 2012. — 18 с.
22. Кириллов В.И. Опыт оперативного лечения переломов дистального метаэпифиза лучевой кости у пожилых пациентов / Кириллов В.И., Аюпов O.H., Нагога А.Г., Быховцев В.И. // VI Всероссийский съезд общества кистевых хирургов (2–3 июня 2016 г., г. Нижний Новгород). Материалы съезда: ФГБУ «ПФМИЦ» Минздрава России, 2016. — 63 с.
23. Райсян Р.М. Лечение переломов дистального метаэпифиза лучевой кости в амбулаторных условиях / Райсян Р.М., Обухов И.А. // VI Всероссийский съезд общества кистевых хирургов (2–3 июня 2016 г., г. Нижний Новгород). Материалы съезда: ФГБУ «ПФМИЦ» Минздрава России, 2016. — 93 с.
24. Harden R.N., Oaklander A.L., Burton A.W., Perez R.S., Richardson K., Swan M. et al. Complex regional pain syndrome: practical diagnostic and treatment guidelines // Pain Med. — 2013. — 14. — 180-229.
25. Бурьянов А.А. Посттравматическая дистрофия конечностей (синдром Зудека). Вопросы патогенеза, диагностики и лечения: Автореф. дис... канд. мед. наук. — Харьков, 1990. — 24 с.
26. Zhongguo GuShang. Quantitative evaluation of Colles' fracture by Multislice CT multiplanner reconstruction: a feasibility study // China journal of orthopedic and traumato-logy. — 2016. — 29 (1). — 13-7.
27. Способ прогнозирования вероятности формирования посттравматического нейродистрофического синдрома при переломе лучевой кости в типичном месте: пат. 2398505 Рос. Федерация / А.Х. Баховудинов, В.А. Ланшаков, А.А. Панов, М.Ю. Баранов, Р.М. Мартынов.
28. Мотовилов Д.Л. Научное обоснование организации специализированной помощи при переломах дистального метаэпифиза лучевой кости: Автореф. дис... канд. мед. наук. — СПб., 2010. — С. 26.

/42.jpg)