Статья опубликована на с. 16-22
Введение
Понятие «риносинусит» (РС) подчеркивает, что воспаление возникает одновременно в слизистой оболочке носа и околоносовых пазухах. Как правило, при риносинусите в процесс вовлечена одна или несколько околоносовых пазух. Это может быть подтверждено с помощью ультрасонографии (УЗИ) или рентгенографии (характерно затенение пазух).
В соответствии с EPOS 2012 острый риносинусит, помимо воспаления, характеризуется двумя или более субъективными симптомами: заложенностью носа или выделениями из носа в сочетании с болью или давлением в области околоносовых пазух либо утратой/снижением обоняния [1]. Могут иметь место и дополнительные симптомы, такие как лихорадка, усталость или головная боль.
Острый ринит является первой стадией развития риносинусита. Грань между острым и хроническим риносинуситом в основном определяется продолжительностью заболевания, а не специфическими симптомами. В соответствии с определениями EPOS 2012, острый риносинусит полностью вылечивается, без остаточных симптомов, через 12 недель, тогда как при хроническом риносинусите после этого периода один или несколько симптомов остаются. Острый вирусный риносинусит длится менее 10 дней, а в случае острого поствирусного риносинусита через 10 дней симптомы сохраняются. В последнем случае часто можно видеть картину двухфазного течения с сохранением или ухудшением симптомов к концу 10-дневного периода.
Основной причиной острого РС являются главным образом вирусы (риновирусы, вирусы парагриппа 1 и 2, коронавирус и вирусы гриппа), все они повышают концентрацию провоспалительных цитокинов и нейтрофилов [2]. Подобный тип реакции встречается при бактериальной инфекции. Таким образом, острый РС без труда можно ошибочно диагностировать как бактериальную инфекцию и, следовательно, лечить антибиотиками, которые на этой стадии болезни не способствуют излечиванию.
Острый РС является самым распространенным инфекционным заболеванием и обусловливает огромное социально-экономическое бремя для общества, помимо индивидуального дискомфорта с пониженным качеством жизни [3]. Стратегией лечения является снижение тяжести симптомов, минимизация продолжительности заболевания и предотвращение осложнений, а также дальнейшего развития в хроническую болезнь.
В последние годы предложен новый способ лечения острого РС — фитотерапевтические препараты [4–6]. BNO 1016 («Бионорика SE», Ноймаркт, Германия) является новым препаратом на основе сухого экстракта фиксированной комбинации пяти растительных экстрактов, содержащей корень горечавки (Gentianae radix), цветки первоцвета (Primula flos), траву щавеля (Rumicis herba), цветки бузины черной (Sambuci Flos) и траву вербены (Verbenae herba) в соотношении 1 : 3 : 3 : 3 : 3. Препарат является стандартизированным высокодозированным средством для лечения острого РС. Фармакологические исследования показали in vitro и на животных моделях, что BNO 1016 обладает противомикробным и противовирусным эффектом, включая секретолитическую и противовоспалительную активность [6]. Предыдущая фаза исследования — 2b/3 документально зафиксировала эффективность и безопасность BNO 1016 при суточной дозе 160 мг (прием трижды в день) в течение 15 дней [7]. Это было подтверждено в последующей фазе 3 исследования [8].
Чтобы подтвердить наблюдаемый эффект лечения для бόльшей популяции пациентов, в ходе настоящей оценки были объединены данные фазы 2b/3 (код ARhiSi-1) и фазы 3 (код ARhiSi-2). Для анализа использовали 589 пациентов, у которых сравнивали эффективность 480 мг BNO 1016 в день (3 × 160 мг) с плацебо при лечении острого РС.
Материалы и методы
Пациенты
Критериями включения в исследования были критерии ARhiSi-2. Для участия в исследованиях отбирали взрослых амбулаторных пациентов обоих полов в возрасте ≥ 18 и ≤ 75 лет с клиническим диагнозом «острый РС» (МКБ-10: J01.9), подтвержденным УЗИ верхнечелюстных пазух. Острый РС диагностировался в случае развития по крайней мере трех основных симптомов (насморк/выделения из передних отделов носа, стекание слизи по задней стенке глотки, заложенность носа, головная боль, лицевая боль/ощущение тяжести). Симптомы должны были длиться в течение 3 дней или менее. Все отобранные пациенты должны были иметь проверенное исследователем значение MSS ≥ 8 и ≤ 12 баллов (из максимальных 15 баллов). Кроме того, должна была присутствовать заложенность носа и легкая/умеренная лицевая боль/ощущение тяжести (≥ 1 и ≤ 2 баллов). Ориентировались именно на такую выраженность лицевой боли, чтобы отобрать для исследования только пациентов с неосложненным острым РС.
Были исключены пациенты, которых лечили кортикостероидами или антибиотиками (местно или системно) в течение 4 недель перед первым визитом к исследователю («визит включения»). Кроме того, не включали людей, принимавших лекарства от обычных симптомов простуды, иммуномодулирующие препараты (за 7 дней до включения), беременных или кормящих грудью женщин и людей с тяжелыми заболеваниями почек или печени, тяжелыми соматическими или неврологическими и/или психическими заболеваниями.
Дизайн анализа
Анализ базируется на двух одинаковых проспективных рандомизированных двойных слепых плацебо-контролируемых мультицентровых исследованиях с параллельными группами, проведенных в 2009–2010 гг. в 37 центрах (16 специалистов по оториноларингологии, 21 специалист по внутренним болезням и врачи общего профиля) по всей Германии. При 1-м визите в день 0 в исследование включили амбулаторных пациентов, страдающих острым РС, рандомизировали на группы и взяли письменное согласие. Лечение проводили путем назначения 160 мг BNO 1016 три раза в день перорально или плацебо три раза в день перорально в течение 15 дней. Распределение лечения в обеих группах провели в соотношении 1 : 1. Ни участники, ни исследователь не знали, какой препарат им дают, проводя лечение двойным слепым способом.
В ходе лечения пациенты ежедневно фиксировали свои симптомы. При каждом визите в центр исследования (дни 3, 7, 10 и 14; визиты 2, 3, 4 и 5 соответственно) исследователь оценивал пять симптомов MSS и ответ на лечение. Кроме того, во время визитов пациенты заполняли анкету шкалы качества жизни, обусловленного состоянием здоровья (SNOT-20 GAV) [9].
УЗИ околоносовых пазух проводили в ходе обоих исследований при первом визите, чтобы подтвердить диагноз. УЗИ в конце лечения (визит 5) проводили лишь при втором исследовании.
Исследования были одобрены немецким регуляторным органом и получили положительное заключение от Комитета по этике; структура исследований соответствует Хельсинкской декларации и согласованному трехстороннему руководству по надлежащей клинической практике (CPMP/ICH/135/95).
Измерения эффективности
Критерии эффективности. Все анализы эффективности базируются на объединенных данных испытаний ARhiSi-1 и ARhiSi-2 (см. раздел «Статистический анализ»).
Первичной конечной точкой анализируемой совокупности было среднее значение MSS при визите 5 (день 14, популяция для полного анализа — FAS и протокольная популяция — PP). Кроме того, анализировали одиночные симптомы по шкале MSS при визите 5, день 14 (FAS и PP). Более того, для FAS и PP провели анализ по анкете SNOT-20 как общей суммы показателей при визите 3 (день 7) и при визите 5 (день 14). Дополнительно исследователь классифицировал (FAS и PP) пациентов с лечебным эффектом по 4-балль-
ной оценочной шкале при визите 2 (день 3), визите 3 (день 7), визите 4 (день 10) и визите 5 (день 14).
Оценка тяжести симптомов. Исследователи оценивали тяжесть каждого из пяти симптомов по MSS при каждом визите, используя 4-балльную оценочную шкалу повышающейся тяжести (0 — нет/не присутствует, 1 — незначительный, 2 — умеренный, 3 — тяжелый). Параметры боли и наличие стекания слизи по задней стенке глотки оценивали в соответствии с описаниями пациентов.
Шкала выраженности основного симптома (MSS). MSS объединяет пять наиболее важных симптомов риносинусита, основанных на экспертных клинических рекомендациях (насморк/выделения из передних отделов носа, стекание слизи по задней стенке глотки, заложенность носа, головная боль, лицевая боль/ощущение тяжести). Эту шкалу использовали в качестве основного критерия эффективности в нескольких клинических исследованиях [10–12]. Значения MSS рассчитывали как сумму пяти оценок каждого из симптомов.
Оценка пациентов с лечебным эффектом и без лечебного эффекта. Исследователь оценивал общий ответ на лечение при каждом визите, используя 4-балльную оценочную шкалу (0 — симптомы исчезли/излечены; 1 — симптомы облегчены по сравнению с визитом 1; 2 — симптомы не изменились по сравнению с визитом 1, 3 — симптомы ухудшились по сравнению с визитом 1). Пациентов, которых излечили или которые сообщили, что их симптомы облегчены (оценка 0 баллов и 1 балл), классифицировали как пациентов с лечебным эффектом, тогда как больных с неизменившимися или ухудшенными симптомами (оценка 2 и 3 балла) считали пациентами без лечебного эффекта.
Статистические анализы
Общее определение популяции. В комбинированный анализ были включены лишь группы лечения плацебо и BNO 1016 480 мг из испытания ARhiSi-1: когда для такого анализа применили критерии включения и исключения в ARhiSi-2, пациенты, включенные в ARhiSi-1 с лицевой болью/тяжестью > 2 или значением MSS > 12 или MSS < 8, были исключены из подлежащих анализу совокупностей, поскольку это было нарушением критерия включения в ARhiSi-2. Распределение пациентов по различным совокупностям проведено в соответствии с правилами встреч для рассмотрения данных слепого метода соответствующих испытаний ARhiSi-1 и ARhiSi-2.
Совокупности данных, подлежащие анализу, и обращение с пропущенными данными. Анализ эффективности проводили в основном на FAS, которая включает данные для всех рандомизированных пациентов с острым риносинуситом, получивших как минимум одну дозу препарата (используемого в исследовании) и как минимум одну оценку эффективности. PP включает всех рандомизированных пациентов из FAS, за исключением тех, у кого были нарушения протокола исследования. Для оценки безопасности объединение данных не проводили. Вместо этого для описания результатов по безопасности использовали выборку каждого исследования, подлежащую оценке безопасности (SEP). Исходные данные были использованы для подстановки отсутствующих значений в случае раннего отсева пациентов из-за недостаточной эффективности анализа на FAS. Как правило, при отсутствии значений в случае выздоровления пациентов и прекращения их участия в исследовании последнее документированное значение каждой конечной точки эффективности использовали для подстановки соответствующих пропавших значений по всем следующим визитам, которые не были выполнены (метод переноса данных последнего наблюдения вперед, LOCF).
Если пациент выбыл из исследования по причинам, связанным с применением исследуемого препарата, например таким как неожиданное ухудшение симптомов заболевания/состояния во время исследования или недостаточная эффективность, исследователь использовал худшую категорию для глобальной оценки эффективности.
В случае отсутствия значения для расчета симптома по шкале SNOT-20 использовали худшую категорию, если пропущено не более двух значений, в противном случае значение не учитывалось.
Статистические методы
Все данные анализировали с помощью компьютерной программы «Система статистического анализа» (SAS), версия 9. Поскольку большинство статистических тестов были односторонними, значения p ≤ 0,025 указывают на статистический уровень значимости.
Если не указано иное, отклонения обозначены как стандартная ошибка среднего значения (SEM).
Все анализы эффективности проведены с совокупностью объединенных данных (см. раздел «Статистические анализы»). При анализе объединенных данных первичную конечную точку исследования ARhiSi-2 оценивали с помощью ковариационного анализа (ANCOVA).
Разница в один балл значения MSS между группами лечения считалась (по аналогии с ARhiSi-2) клинически значимой.
Все вторичные конечные точки были проанализированы в режиме эксперимента. Категориальные переменные тестировали с помощью теста хи-квадрат. Непрерывные данные анализировали с помощью теста ANCOVA аналогично первичной конечной точке либо с помощью критерия Кохрана — Мантеля — Гензеля. Исходные значения сравнивали между группами лечения и проверяли с помощью теста Манна — Уитни — Вилкоксона (непрерывные переменные) или теста
хи-квадрат (категориальный тест).
Результаты
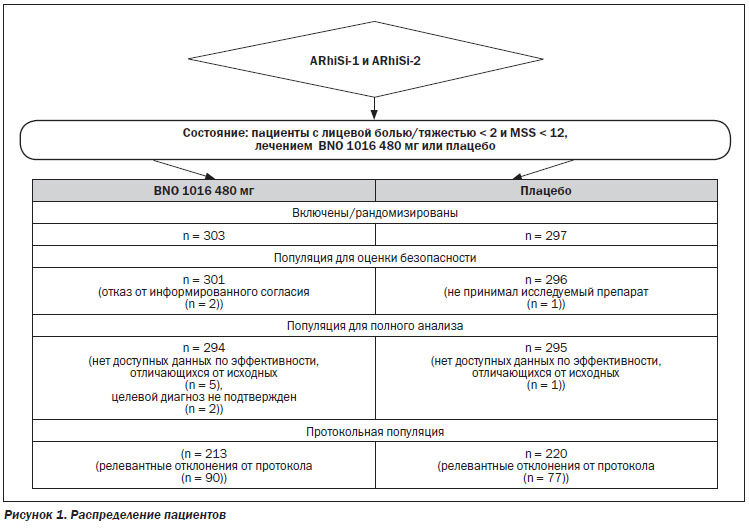
Распределение пациентов
Распределение пациентов показано на рис. 1. В общей сложности 303 пациента составили группу лечения BNO 1016, для группы плацебо выделено 297 пациентов (в совокупности объединенных данных). Кроме того, 589 из этих 600 рандомизированных пациентов были рассмотрены в пределах FAS, 294 пациента в группе BNO 1016 (97 %) и 295 пациентов в группе плацебо (98,2 %).
Критериям для включения в PP соответствовали 213 (70,3 %) пациентов в группе BNO 1016 и 220 (74,1 %) пациентов в группе плацебо.
Результаты изучения эффективности
Продолжительность исследования и соблюдение режима лечения. Средняя продолжительность участия в исследовании составила 29 дней для обеих групп с диапазоном 3–57 дней для группы BNO 1016 и 3–86 дней для группы плацебо. Процент соблюдения режима лечения, судя по подсчету таблеток, составил 99,7 % в группе BNO 1016 и 100,2 % в группе плацебо.
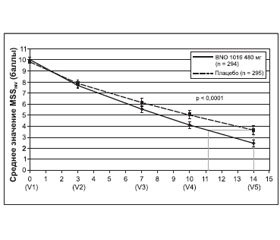
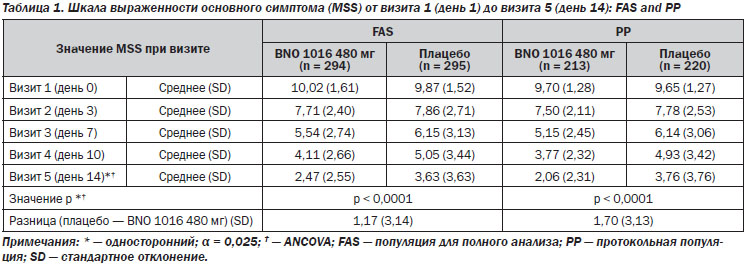
Шкала выраженности основного симптома (MSS). Исходные данные (среднее значение MSS) при включении не имели статистических различий между двумя группами лечения (табл. 1). Значение MSS постепенно улучшалось в обеих группах в течение 15-дневного периода лечения в среднем от 10,02 ± 1,61 до 2,47 ± 2,55 для BNO 1016 и от 9,87 ± ± 1,52 до 3,63 ± 3,63 в группе плацебо (табл. 1, рис. 2). Разница между группами лечения при визите 5 была статистически значимой в пользу продукта BNO 1016 (FAS, p < 0,0001).
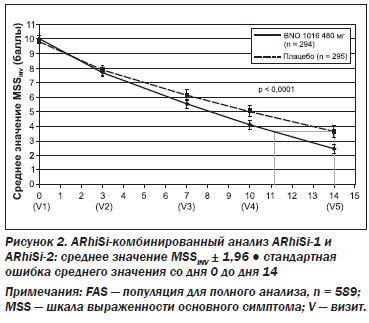
Очевидная разница в значениях MSS между двумя группами уже была явной при визите 4 (день 10), что указывает на более быстрое восстановление в группе BNO 1016, показывая разницу в 0,94 балла, со средним значением 4,11 против 5,05. При визите 5 (день 14) значения были 2,47 ± 2,55 (BNO 1016) и 3,63 ± 3,63 (плацебо), соответственно, разница в 1,16 ± 3,14 балла. Переводя эти цифры в состояние испытуемых, получаем почти 3-дневное ускорение их восстановления с BNO 1016 (11-й и 14-й день соответственно). Разница между группами лечения в конце терапии при анализе PP составила 1,70 ± 3,13 балла (р < 0,0001). Это означает ускоренную на 4 дня нормализацию состояния пациентов, получавших BNO 1016, в конце терапии (день 10 и 14 соответственно).
В табл. 2 показаны одиночные симптомы MSS при визите 5 (день 14). В FAS каждый индивидуальный симптом демонстрирует статистический уровень значимости в пользу BNO 1016 (p < 0,0001).
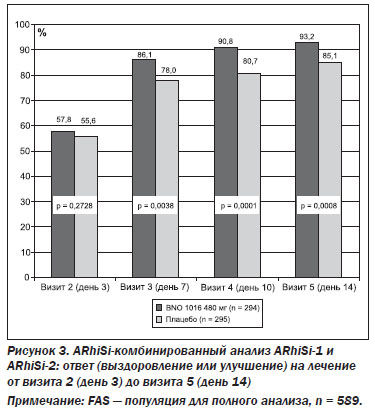
Ответ на лечение. Абсолютные и относительные результаты лечения приведены в табл. 3. Статистически значимое улучшение (и для FAS, и для PP) в пользу BNO 1016 было видно уже в день 7 (визит 3). На рис. 3 приведен комбинированный анализ ARhiSi-1 и ARhiSi-2: ответ (выздоровление или улучшение) на лечение от визита 2 (день 3) до визита 5 (день 14).
Оценка качества жизни. Общее число баллов по SNOT-20 приведено в табл. 4. В конце лечения была очевидной высокозначимая разница в пользу BNO 1016 (р = 0,0015).
Результаты по безопасности. Не сообщалось о серьезных нежелательных явлениях (SAEs) в ходе исследований ARhiSi-1 или ARhiSi-2. В ходе ARhiSi-1 было всего 42 нежелательных явления (AEs) у 33 пациентов из популяции для оценки безопасности (SEP, n = 450): 33 AEs у 26 из 300 пациентов (8,7 %) при лечении BNO 1016 (2 группы лечения BNO 1016 в суточной дозе 240 мг или 480 мг) и 9 AEs у 7 из 150 пациентов (4,7 %) при лечении плацебо.
При исследовании ARhiSi-2 было всего 53 AEs у 46 пациентов из SEP (n = 385): 21 AEs у 19 из 194 пациентов (9,8 %) при лечении BNO 1016 480 мг и 32 AEs у 27 из 191 пациента (14,1 %) при лечении плацебо. Сообщалось, что большинство AEs у пациентов, которых лечили BNO 1016, были небольшой/умеренной интенсивности.
Обсуждение
Данный анализ свидетельствует об эффективности перорального приема 480 мг (160 мг 3 раза в день) растительного препарата BNO 1016. Эта новая концепция лечения болезни, которая протекает и заканчивается в определенный срок, ускоряет устранение симптомов по сравнению с плацебо и улучшает качество жизни пациентов. Анализ PP превосходил результаты по FAS на протяжении всего исследования.
До сих пор наши знания о полезных эффектах растительных лекарственных средств при лечении острого РС были ограниченными. Фармакологические исследования BNO 1011 показали его противовирусную активность [13], а также способность стимулировать частоту биения ресничек респираторного эпителия in vitro путем активации форсколинстимулируемой секреции хлорида [14]. BNO 1011 — это сухой экстракт без вспомогательных веществ, тогда как в BNO 1016 эти вспомогательные вещества добавляют по техническим причинам, например чтобы из этого сухого экстракта можно было прессовать таблетки.
Недавно опубликован обзор клинических свойств BNO 101 (Синупрет®) (препарат с теми же компонентами, что и BNO 1016, но в более низкой дозе), который при лечении демонстрирует благоприятный эффект [15]. Это растительное лекарственное средство оказывает существенный противовоспалительный эффект, снижая экспрессию циклооксигеназы (COX) 2 и образование простагландина (PG) E (2) [16]. Таким образом, механизм действия препарата оправдывает его терапевтическое применение при лечении синусита и других вирусных/микробных носовых инфекций, связанных с воспалением*. Экспериментальные исследования Синупрета® показывают снижение роста бактерий после 4-дневного приема [6]. Другие растительные препараты, химический состав которых менее известен, по-видимому, также обладают некоторым противовоспалительным эффектом, например при хроническом синусите [17].
Хотя интраназальные кортикостероиды (применяемые отдельно или в комбинации с антибиотиками), в общем, рекомендованы для лечения острого РС, необходимо дальнейшее документальное обоснование их клинического применения [18]. Недавний метаанализ эффективности кортикостероида мометазона для лечения острого РС показал облегчение или устранение симптомов [19]. Для BNO 1016 было рассчитано (для объединенного набора данных) количество препарата, необходимое для лечения 10 пациентов. Таким образом, растительный препарат BNO 1016, по-видимому, столь же эффективен или даже более эффективен, чем некоторые кортикостероиды, локально применяемые для лечения острого РС.
Использование MSS в нашем анализе проведено в соответствии с рекомендациями EPOS 2012, которые объединяют пять наиболее релевантных признаков острого РС и часто используются в качестве стандарта для первичных критериев эффективности в клинических исследованиях [1]. Кроме того, УЗИ околоносовых пазух подтвердило лечебный эффект [8]. Наш анализ и исследование ARhiSi-2 по клинической эффективности BNO 1016 [8] были первыми строго контролируемыми исследованиями (для оценки эффекта комбинированного растительного препарата с фиксированной дозой), отвечающими всем современным стандартам качества для проспективного двойного слепого рандомизированного плацебо-контролируемого исследования.
Золотого стандарта лечения острого РС не существует. Для лечения неосложненного острого РС антибиотики не показаны. Из-за большого количества различных вирусов, вызывающих острый РС, производство эффективной вакцины затруднено. Социально-экономические издержки этого заболевания чрезвычайно высоки, требуются значительные ресурсы здравоохранения, и все это приводит к потере производительности [3]. В среднем каждый взрослый подвержен заболеваниям верхних дыхательных путей от двух до пяти раз в год. С учетом этого каждый способ лечения, который сокращает длительность болезни и улучшает качество жизни отдельных пациентов, выгоден как для общества, так и для каждого человека.
Поскольку количество SAEs при лечении BNO 1016, а также частота и интенсивность нежелательных явлений одинаковы для BNO 1016 и плацебо, можно сделать вывод, что BNO 1016 имеет аналогичный с плацебо профиль безопасности. Соответственно, BNO 1016 имеет благоприятное соотношение польза/риск.
В заключение отметим, что данный анализ подтверждает результаты фазы 3 исследования с препаратом BNO 1016. Анализ показал, что ежедневный прием 480 мг BNO 1016 в течение 2 недель является безопасным и эффективным методом лечения неосложненного РС. Препарат обеспечивает быструю и клинически значимую ремиссию симптомов и улучшает качество жизни по сравнению с плацебо.
Благодарности. Авторы выражают благодарность фирме «Бионорика SE» (Ноймаркт, Германия) за финансовую поддержку и исследователям из центров исследования за помощь в наборе и мониторинге пациентов согласно протоколу исследования и требованиям надлежащей клинической практики. Авторы также признательны пациентам за их участие и соблюдение протокола исследования. Управление проектом осуществлено независимой контрактной исследовательской организацией «Pharmalog Institute for Clinical Research» (Мюнхен, Германия).
Конфликт интересов. M. Mондиглер является сотрудником компании «Бионорика SE». П. Стиерна и К. Бахерт являются научными консультантами компании «Бионорика SE». Х. Штаммер является управляющим директором КИО по клиническим испытаниям. Р. Юнд — исследователь-координатор мультицентровых клинических исследований, согласно § 40 Закона о лекарственных препаратах (Германия).
Впервые опубликовано в журнале
«Acta Oto-Laryngologica».
2015; 135: 42-50
Список литературы
1. Fokkens W.J., Lund V.J., Mullol J., Bachert C., Alobid I., Baroody F. et al. EPOS 2012. European position paper on rhinosinusitis and nasal polyps 2012 // Rhinology. — 2012. — 1-229.
2. Masood A., Maoumoulidis I., Panesar J. Acute rhinosinusitis in adults: an update on current management // Postgrad. Med. — 2007. — 83. — 402-408.
3. Hellgren J., Cervin A., Nordling S., Bergman A., Cardell L.-O. Allergic rhinitis and the common cold: high costs to society // Allergy. — 2010. — 65. — 776-83.
4. Guo R., Canter P.H., Ernst E. Herbal medicines for the treatment of rhinosinusitis: a systematic review // Otolaryngol. Head Neck Surg. — 2006. — 135. — 496-506.
5. Reden J., El-Hifnawi D., Zahnert T., Hummel T. The effect of herbal combination of primrose, gentian root, vervain, elder flowers, and sorrel on olfactory function in patients with a 13. sinonasal olfactory dysfunction // Rhino-logy. — 2011. — 49. — 342-346.
6. Ismail C. Pharmacology of Sinupret. Recent results on the rational for the Sinupret compound // HNO. — 2005. — 53. — S38-542.
7. Bachert C., Mondigler M., Steindl H., Stammer H., Stierna P., Eskotter H. et al. Multicentre, randomised, double-blind, placebo-controlled, parallel-group dose-finding study of herbal medicine (dry extract) BNO 1016 in acute rhinosinu-sitis (ARhiSi-1). 84th Annual Meeting ofthe German Society of Oto-Rhino-Laryngology, Head and Neck Surgery, 2013.
8. Jund R., Mondigler M., Steindl H., Stammer H., Stierna P., Bachert C. Clinical efficacy of a dry extract of five herbal drugs in acute viral rhinosinusitis // Rhinology. — 2012. — 50. — 417-426.
9. Baumann I., Blumenstock G., De Maddalena H., Piccirillo J.F., Plinkert P.K. Quality of life in patients with chro-nic sinusitis: validation of the Sino-Nasal Outcome Test-20 German Applied Version // HNO. — 2007. — 55. — 42-47.
10. Bachert C., Schapowal A., Funk P., Kieser M. Treatment of acute rhinosinusitis with the preparation from Pe-largonium sidoides EPs 7630: a randomized, double-blind, placebo-controlled trial // Rhinology. — 2009. — 47. — 51-58.
11. Meltzer E.O., Bachert C., Staudinger H. Treating acute rhinosinusitis: comparing efficacy and safety of mometasone furoate nasal spray, amoxicillin, and placebo // J. Allergy Clin. Immunol. — 2005. — 116. — 1289-1295.
12. Revicki D.A., Margolis M.K., Thompson C.L., Meltzer E.O., Sandor D.W., Shaw J.W. Major symptom score utility index for patients with acute rhinosinusitis // Am. J. Rhinol. Allergy. — 2011. — 25. — 99-106.
13. Glatthar-Saalmuller B., Tauchhaus U., Rode S., Haunschild J., Saalmuller A. Antiviral activity of two preparations of the herbal medicinal product Sinupret™ against viruses causing respiratory infections // Phytomedicine. — 2011. — 19. — 1-7.
14. Kreindler J.L., Chen B., Kreitman Y., Kofonow J., Adams K.M., Cohen N.A. et al. 1011 stimulates chloride transport and ciliary beat frequency in human respiratory epithelial cultures // Am. J. Rhinol. Allergy. — 2012. — 26. — 439-443.
15. Meltzer J., Saller R., Schapowal A., Brignoli R., Systematic review of clinical data with BNO-101 (Sinupret) in the treatment of sinusitis // Forsch Komplementmed. — 2006. — 13. — 78-87.
16. Rossi A., Dehm F., Kiesselbach C., Haunschild J., Sautebin L., Werz O. The novel Sinupret dry extracts exhibit anti-inflammatory effectiveness in vivo // Fitoterapia. — 2012. — 83. — 715-720.
17. Lee J.S., Kim I.S., Kim J.H., Kim D.H., Yun C.Y. Suppressive effects of Houttuynia cordata Thunb (Saururaceae) extract on Th2 immune response // J. Ethnopharmacol. — 2008. — 117. — 34-40.
18. Meltzer E.O., Bachert C., Staudinger H. Treating acute rhinosinusitis: comparing efficacy and safety of mometasone furoate nasal spray, amoxicillin, and placebo // J. Allergy Clin. Immunol. — 2005. — 116. — 1289-1295.
19. Zalmanovici Trestioreanu A., Yaphe J. Intranasal steroids for acute sinusitis (review) // The Cochrane Library. — 2010. — Issue 7.