Статья опубликована на с. 113-120
Введение
Коррекция гемодинамики в периоперационном периоде является важнейшей задачей анестезиолога. Нарушения гемодинамики встречаются как при расширенных, так и при малых оперативных вмешательствах и могут быть обусловлены множеством факторов, усугубляющих друг друга. Наиболее значимыми факторами могут быть прямое вазоплегическое и кардиодепрессивное действие анестетиков, острая кровопотеря, фармакологическая симпатэктомия (при спинальной и эпидуральной анестезии), анафилактические реакции, раздражение рефлексогенных зон (корня брыжейки, легкого и др.), попадание в кровь токсинов и т.д. Реакция гемодинамики у разных пациентов на один и тот же фактор может быть различна и труднопредсказуема в зависимости от пола, возраста, исходного уровня волемии, наличия сопутствующих заболеваний и других причин.
Группой исследователей под руководством M. Walsh (2013) установлено, что даже кратковременное снижение уровня интраоперационного среднего артериального давления (САД) ниже 55 мм рт.ст. приводит к значительному повышению риска послеоперационных осложнений, в первую очередь кардиальных и почечных [1]. Поэтому тщательный мониторинг гемодинамики жизненно важен для своевременной коррекции возникших нарушений. Стратегии интраоперационной коррекции гемодинамики включают волемическую и вазопрессорную поддержку, однако сегодня продолжаются дебаты относительно режимов инфузионной терапии (либеральный или рестриктивный), сроков подключения симпатомиметиков, выбора растворов и препаратов инотропной поддержки.
Цель работы: определение современных тенденций в принципах периоперационной гемодинамической коррекции. Оценка состояния проблемы с учетом результатов метаанализов многоцентровых рандомизированных клинических исследований.
Инфузионная терапия
Центральное место в лечении больных с кровотечениями принадлежит инфузионно-трансфузионной терапии, направленной на быстрое восстановление объема циркулирующей крови, сердечного выброса, доставки и потребления кислорода тканями всех органов и систем организма [2]. В ситуации, когда используется стандартный мониторинг гемодинамики, основным критерием для назначения и выбора дозы симпатомиметиков обычно является уровень артериального давления. В то же время в современном представлении о мониторинге системы кровообращения центральным показателем гемодинамики является сердечный выброс, являющийся одним из основных факторов (вместе с уровнем гемоглобина и насыщением крови кислородом), определяющих доставку кислорода к тканям. Поскольку возможность коррекции гемодинамики под контролем сердечного выброса зачастую отсутствует, а для повышения артериального давления можно использовать различные симпатомиметики, возникает вопрос о том, какой препарат обеспечивает более благоприятный гемодинамический профиль при подборе его дозы по уровню артериального давления [3]. Вазопрессоры в терапии геморрагического шока не имеют повсеместного применения. Они широко используются в Европе, кроме Великобритании, но при этом нет данных об их использовании в североамериканских рекомендациях [4]. Целью интраоперационной инфузионной терапии является поддержание адекватного объема циркулирующей крови (ОЦК) для обеспечения должной перфузии органов-мишеней, а также адекватной доставки к ним кислорода. Традиционно это достигалось путем инфузии больших объемов кристаллоидов, что основано на устаревшей предпосылке: предоперационный пациент изначально считался гиповолемичным из-за длительного голодания, а порой и применения слабительных для подготовки кишечника. Также широко распространено мнение, что проведение хирургических вмешательств требует агрессивного возмещения жидкостью, хотя водная нагрузка часто не имеет никакого влияния на связанную с анестезией гипотензию [5]. Другим путем поддержания достаточного уровня органной перфузии является коррекция гемодинамики вазопрессорами [6].
В Веллингтоне кардиохирургические пациенты были разделены на две группы: одна группа в периоперационном периоде получала только инфузию, вторая — инфузионную терапию с введением норадреналина. При сравнении в первой группе число реинтубаций было выше [7]. При проведении радикальной цистэктомии сочетание ограничительной инфузионной гидратации с норадреналином способствовало снижению интраоперационной кровопотери, потребности в дальнейших гемотрансфузиях, а также было сопряжено со снижением количества осложнений. В колоректальной хирургии есть убедительные доказательства того, что интраоперационная инфузия жидкости должна сводиться к нулевому балансу, что способствует более раннему восстановлению функции кишечника [8].
Основная стратегия для определения наилучших результатов основана на фактических данных: нормотермию необходимо сохранять периоперационно, в периоперационном периоде объем инфузии необходимо поддерживать в пределах из расчета от 3,5 до 6,0 мл/кг в час, использование вазопрессоров, а именно норадреналина по сравнению с другими симпатомиметиками, способствует улучшению результатов, декстранов следует избегать [9].
В ранней фазе кровотечений происходит активация симпатической системы, в результате чего создается компенсаторная артериальная и венозная вазоконстрикция, направленная на нормализацию артериального давления [10]. На данном этапе поддержка вазопрессорами не нужна [11]. При продолжающемся кровотечении происходит снижение сосудистого тонуса и сопротивления, и вазопрессоры посредством увеличения венозного возврата, препятствуя тахикардии и тем самым обеспечивая снабжение самого миокарда кровью, способствуют восстановлению гемодинамических показателей, уменьшая потребность в непрерывной инфузии жидкости.
Создание гипергидратации при высоких темпах инфузии приводит к развитию целого ряда осложнений, таких как отечный синдром, абдоминальный компартмент-синдром, респираторный дистресс-синдром (РДС), возникновение системного воспалительного ответа. Респираторный дистресс-синдром является основной причиной летальности на 3-й день после операции у травматологических больных [12]. Исследование 102 больных показало, что риск развития у больных РДС при коррекции ОЦК в период кровотечений кристаллоидными растворами повышается в первые 24 часа [13]. Преимуществом же вазопрессорной поддержки является профилактика развития отека мозга за счет поддержания достаточного уровня церебрального перфузионного давления в условиях отсутствия избытка свободной воды. Именно в первые 24 часа после травмы летальность от вторичных повреждений центральной нервной системы является значительной [14].
Проведение малообъемной жидкостной ресусцитации возможно с применением гипертонического раствора натрия хлорида. Исследования показали, что небольшой объем введенного гипертонического раствора 5 мл/кг с добавлением декстранов или без них является весьма эффективным: он улучшает капиллярный кровоток, стабилизирует артериальное давление и сердечный выброс при малых объемах инфузии, без патологического воздействия на иммунную систему [15]. Однако имеются данные, что введение гипертонических растворов способствует развитию коагулопатии, а также уменьшает активацию нейтрофилов [16, 17].
Для восстановления и поддержания ОЦК используются коллоидные и кристаллоидные растворы, однако коллоидно-кристаллоидная дилемма остается краеугольным камнем современной анестезиологии. Актуальным остается вопрос безопасности инфузии коллоидных растворов: развитие ятрогенной острой почечной недостаточности и метаболического ацидоза, коагулопатии, анафилактических реакций остаются проблемой для синтетических коллоидов [18–20]. Из кристаллоидов более предпочтительным является Рингера лактат, так как он не создает риска развития гиперхлоремического ацидоза [21].
С 2003 по 2012 г. проведено многоцентровое рандомизированное клиническое исследование, целью которого было сравнить влияние кристаллоидов и коллоидов на выживаемость больных, находящихся в отделении интенсивной терапии в состоянии гиповолемического шока. Было исследовано 2857 больных. Первая группа получала коллоиды (n = 1414; желатин, декстраны, гидро–ксиэтилкрахмалы (ГЭК) или 20% альбумин), вторая группа — кристаллоиды (n = 1443; изотонический или гипертонический раствор натрия хлорида, раствор Рингера лактат). Результаты оказались противоречивыми: в течение первых 28 дней летальность в группах не отличалась; 90-дневная летальность была выше в группе пациентов, получавших кристаллоиды. Не было разницы между группами в необходимости заместительной почечной терапии. Более того, пациенты 1-й группы (коллоиды) дольше не нуждались в искусственной вентиляции легких [22]. Специалисты же из Австралии при проведении исследования аналогичного дизайна у 7000 пациентов не выявили разницы в летальности ни на 28-й, ни на 90-й день, однако пациенты, получавшие коллоиды, чаще требовали проведения заместительной почечной терапии [23].
В исследовании на крысах было показано, что при гиповолемическом шоке повреждение легких наблюдалось реже у животных, которые получали гипертонический раствор хлорида натрия и раствор гидроксиэтилкрахмала в сравнении с раствором Рингера [24]. В исследовании на кроликах было показано, что гиперволемия кристаллоидами во время операции на толстой кишке чаще приводит к отеку и несостоятельности анастомоза [25].
На сегодняшний день нет достаточной доказательной базы для утверждения, что ГЭК 130/0,4 является более безопасным, чем его предшественники [26].
В 2010 г. Finfer et al. провели международное многоцентровое исследование, в котором выявили значительную гетерогенность назначения инфузионных сред в разных странах. Так, например, в Великобритании, Китае и Австралии врачи отдают предпочтение коллоидам при лечении гиповолемии, а в США ими пользуются лишь 13 % врачей [27].
Метаанализ 9 рандомизированных клинических исследований показал преимущества рестриктивного режима инфузионной терапии по сравнению с массивным использованием плазмозаменителей. Отмечено уменьшение количества ранних послеоперационных осложнений [28].
Существует все больше и больше доказательств того, что интраоперационный объем вводимой жидкости влияет на количество ранних постоперационных осложнений. В прошлом пациентам, перенесшим расширенные оперативные вмешательства, вводились большие количества кристаллоидов. Было установлено, что при этом значительный положительный периоперационный водный баланс способствует развитию ранних послеоперационных осложнений. Среди них: коагулопатия, отеки, РДС, абдоминальный компартмент-синдром, увеличение потребности в гемодиализе. Ограничительный (рестриктивный) интраоперационный режим инфузионной терапии предполагает отсутствие гиповолемии, но инфузия при этом ограничивается до нулевого баланса. Это снижает риск развития ранних послеоперационных осложнений после проведения расширенных оперативных вмешательств [29]. Продленное предоперационное голодание сегодня неактуально. Исследования показали, что безопасным является сокращение безводного периода до 2 часов [30].
В сравнительном исследовании либерального и рестриктивного режимов у 141 пациента с расширенными оперативными вмешательствами (ограничительная группа получала средний объем 2,7 литра, группа либерального режима — 5,4 литра) число пациентов с осложнениями в основном со стороны сердечно-сосудистой и легочной системы было больше в группе с либеральным режимом. У них же отмечалась большая частота раневой инфекции и почечной дисфункции. В группе с ограничительным режимом почечных осложнений не выявлено [31].
В 2009 г. провели сравнительный обзор: ограничительный режим против либерального режима инфузионной терапии, а также их влияния на постоперационный период [32]. Было идентифицировано 7 рандомизированных исследований; из них 6 с участием расширенных оперативных вмешательств. Диапазон вводимой в либеральных группах жидкости был от 2750 до 5388 мл, а в ограничительных группах — от 998 до 2740 мл. В целом необходимо отметить, что общего определения «либеральных» или «ограничительных» протоколов не существует в клинической практике. Ограничительный режим, использующийся в одном центре, может быть, на самом деле, либеральным в другом. Исследования различались с точки зрения темпа инфузии, показаний для применения дополнительной инфузии, а также течения раннего постоперационного периода. Таким образом, существует трудность интерпретации результатов. Три исследования показали лучший исход на фоне ограничительного режима, два не показали никакой разницы в результатах, и два показали различия только в некоторых выбранных результатах. При ограничительном режиме в раннем послеоперационном периоде наблюдалось скорейшее восстановление функции желудочно-кишечного тракта, снижение продолжительности пребывания в стационаре. У пациентов с либеральным режимом инфузии на 1–2-е сутки была выражена гипокоагуляция, хотя проявлений тошноты и рвоты было гораздо меньше. Инфузионная терапия в расчете 20–30 мл/кг в интраоперационном периоде снижает риск развития тошноты, рвоты, головокружения, сонливости [33].
В целом большинство авторов считают, что у пациентов высокого риска при расширенных оперативных вмешательствах необходимо придерживаться целенаправленной рестриктивной инфузионной терапии; у пациентов невысокого риска при малых оперативных вмешательствах допустимо увеличение объема интраоперационной инфузионной терапии до 20–30 мл/кг с целью уменьшения риска послеоперационной тошноты и рвоты [34, 35].
Мониторинг гемодинамики
Традиционный мониторинг (артериальное давление и частота сердечных сокращений) не позволяет своевременно корригировать инфузионную терапию [36]. Здоровый пациент, находясь в горизонтальном положении, может потерять до 25 % объема крови, прежде чем происходит снижение артериального давления или увеличение частоты сердечных сокращений, в то время как чувствительные мониторы могут показать изменения в слизистой оболочке желудка, рН, указывая на ишемию и нарушения перфузии [37]. Поддержание эффективного объема циркулирующей крови и артериального давления является ключевым компонентом обеспечения адекватного кровоснабжения органов, избегая рисков, связанных с любой гипо- или гиперперфузией. Однозначно большинство авторов указывают на вред как гипо-,
так и гиперволемии [38]. Периоперационная гиперволемия и гиповолемия напрямую связаны с ранними постоперационными осложнениями [39–41]. Многочисленные исследования показали: цель инфузионной терапии — стабилизация гемодинамики, что предотвращает развитие послеоперационных осложнений при проведении расширенных оперативных вмешательств [42, 43]. Однако «слепая» коррекция гемодинамики путем увеличения скорости инфузии или использования вазопрессоров без гемодинамического мониторинга является недопустимой. Необходимо дифференцировать следующие периоперационные аспекты: инфузионная терапия для коррекции дефицита объема, вазопрессоры для коррекции артериального давления и сосудистого тонуса и инотропная поддержка, если сердечный выброс остается недостаточным, несмотря на оптимизацию объема [44]. Важно понимать, что гипотония не должна служить в качестве автоматического триггера для увеличения объема инфузионной терапии, поскольку не любая гипотензия обусловлена истинной гиповолемией.
Целенаправленная инфузионная терапия имеет решающее значение в улучшении послеоперационных результатов [45]. Функциональные показатели гемодинамики иллюстрируют уникальную информацию об ответе на инфузионную терапию, что дает возможность обнаружить потребность в инфузии и избежать ненужной перегрузки жидкостью. Несмотря на ограничения и сопутствующие факторы, эта информация должна быть основополагающей для проведения инфузионной терапии у хирургических больных [46]. Универсальная формула для расчета объема инфузии очень дискутабельна, поскольку ответ на инфузионную терапию у пациентов разный [47].
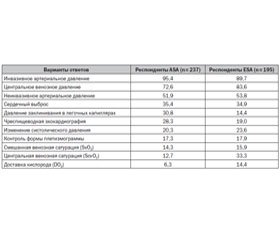
При опросе 2500 активных членов Американской (ASA) и Европейской ассоциаций хирургов (ESA) о предпочтении гемодинамического мониторинга необходимость присутствия отдельных его компонентов оценена следующим образом (табл. 1) [48].
Вазоактивные препараты
Вазоактивные препараты классифицируются на основании их непосредственного эффекта на сосудистый тонус (вазоконстрикторы и вазодилататоры) и на сердце (наличие или отсутствие положительного инотропного эффекта). Вазопрессоры включают чистые вазоконстрикторы (фенилэфрин и вазопрессин) и иноконстрикторы (допамин, норадреналин и адреналин). Каждый из этих препаратов действует как вазопрессор для повышения среднего артериального давления путем поддержания сосудистого тонуса. Инотропы включают инодилататоры (добутамин и милринон) и вышеназванные иноконстрикторы. Эти препараты повышают минутный объем кровообращения (МОК) путем повышения сократимости миокарда. Инодилататоры также уменьшают постнагрузку. Гемодинамический эффект вазоактивных препаратов зависит от дозы, что наиболее заметно у допамина [49]. Применяемые интраоперационно вазопрессоры не ухудшают перфузию периферических органов и тканей, что было показано на результатах приживаемости свободных кожных трансплантатов [50].
Фенилэфрин стимулирует только альфа-рецепторы, вызывая артериальную и венозную вазоконстрикцию, что клинически проявляется повышением периферического сосудистого сопротивления, САД, венозного возврата и рефлекторной брадикардией. Его нужно крайне осторожно использовать у пациентов с миокардиальной дисфункцией. Периоперационно фенилэфрин используется для коррекции гипотензии и уменьшения тахикардии при некоторых видах кардиальной патологии (аортальный стеноз и гипертрофическая кардиомиопатия), при нейроаксиальных блокадах, гипердинамическом режиме кровообращения в условиях шока, а также для коррекции гипотензии на фоне тахиаритмии, или если тахиаритмия вызвана другими вазоактивными препаратами [51, 52]. При сравнительном исследовании влияния вазопрессоров (фенилэфрин) и инотропов (допамин) во время операций трансплантации печени у пациентов с циррозом было выявлено, что применение фенилэфрина приводило к меньшему уровню интраоперационной кровопотери и метаболического ацидоза по сравнению с допамином [53].
Адреналин в малых дозах увеличивает МОК через стимуляцию бета1-рецепторов сердца, обеспечивая положительный инотропный и хронотропный эффекты, в то время как альфа1-вазоконстрикция перекрывается бета2-вазодилатацией. В результате повышается МОК, снижается периферическое сосудистое сопротивление, а действие на САД может быть различным [54]. При больших дозах альфа1-вазоконстрикторный эффект преобладает, что вызывает повышение МОК, периферического сосудистого сопротивления и САД. Адреналин используется во время сердечно-легочно-мозговой реанимации, а также при атропин-нечувствительной брадикардии [55]. Важной особенностью адреналина является его самое сильное вазоконстрикторное действие на спланхнический кровоток, что, с одной стороны, вызывает активное вовлечение в ОЦК спланхнического резерва (около 800 мл), а с другой — вызывает опасения клиницистов относительно безопасности такого эффекта. Однако недавнее исследование действия норадреналина и адреналина у критических пациентов (целевой показатель — САД) не выявило достоверной разницы в 28- и 90-дневной летальности [56].
Норадреналин имеет мощный альфа1-адреностимулирующий эффект, умеренный бета1- и минимальный бета2-эффекты [51]. Таким образом, норадреналин оказывает мощное вазоконстрикторное действие, повышая периферическое сосудистое сопротивление и САД, и в меньшей степени влияет на МОК. Влияние на частоту сокращений сердца минимально, поскольку рефлекторная брадикардия перекрывается умеренным бета1-хронотропным эффектом. Как и для фенилэфрина, особая осторожность необходима при его применении на фоне сниженной сократимости миокарда. Норадреналин остается препаратом первой линии для коррекции гемодинамики при септическом шоке, особенно при наличии гипердинамического режима кровообращения [56].
Допамин является промежуточным предшественником норадреналина и характеризуется хорошо известным дозозависимым эффектом. Гемодинамический эффект начинается с 5 мкг/кг/мин, когда допамин слабо стимулирует бета1-рецепторы, обеспечивает выброс норадреналина и подавляет его обратный захват в пресинаптических терминалях симпатических нервов, а также проявляет слабую альфа1-адреностимуляцию. В больших дозах превалирует альфа1-адреностимуляция, что обеспечивает вазоконстрикцию [51]. Допамин может использоваться для купирования симптомной брадикардии, не чувствительной к атропину. Во многом клиническое использование допамина продолжает снижаться из-за его непрямых эффектов, значительных вариаций эффективной концентрации препарата у пациентов, получающих одинаковые дозы, а также из-за недавних исследований, демонстрирующих более высокий уровень летальности по сравнению с норадреналином в лечении кардиогенного и септического шока [57, 58]. Допамин остается препаратом резерва при лечении септического шока с гиподинамическим режимом кровообращения и для устранения брадикардии [52]. При сравнении допамина и фенилэфрина во время торакальных операций, когда особенно важно придерживаться рестриктивного режима инфузионной терапии, было выявлено, что допамин обеспечивает больший МОК при более низком САД по сравнению с фенилэфрином. Кроме того, при однолегочной вентиляции допамин обеспечивает более высокий уровень церебральной оксигенации [59].
Добутамин преимущественно стимулирует бета1- и бета2-адренорецепторы, вызывая положительный хронотропный и инотропный эффекты, системную и легочную вазодилатацию. Клинически имеет место увеличение частоты сердечных сокращений, МОК и снижение периферического сосудистого сопротивления. Возможно некоторое снижение САД [60]. Добутамин часто используют после оперативных вмешательств на сердце благодаря инотропному и вазодилатирующему действию [61]. Вопрос о его применении при кардиогенном шоке сегодня остается дискутабельным. В последней редакции рекомендаций Американской ассоциации сердца по лечению пациентов с инфарктом миокарда и кардиогенным шоком детальный алгоритм заменен фразой: «Вазоактивные препараты должны быть индивидуализированы и вводиться под контролем инвазивного гемодинамического мониторинга» [62].
В недавно опубликованном метаанализе 23 рандомизированных клинических исследований проводилось сравнение всех основных вазоактивных препаратов для лечения и шока и не было выявлено достоверных различий в летальности [63].
S. Morozowich в своем обзоре современных тенденций фармакологической коррекции гемодинамики в интраоперационном периоде делает следующие выводы:
1. Выбор вазоактивного препарата должен базироваться на необходимости коррекции конкретного физиологического дефицита, и конкретный препарат не столь важен, если достигается гемодинамическая цель.
2. Достижение супрафизиологических целей по МОК нецелесообразно и может нанести вред, но если максимальная доза одного препарата не в состоянии достичь цели, должен быть добавлен второй вазоактивный препарат с другим механизмом действия.
3. Пациентам, получающим вазоактивные препараты, необходимо проводить тщательный мониторинг для поддержания минимальной эффективной дозы [54].
Выводы из аналитического обзора
В настоящее время активно обсуждаются недостатки и преимущества двух путей периоперационной гемодинамической коррекции: объемной инфузионной терапии и использования симпатомиметиков. Результаты последних рандомизированных исследований указывают на целесообразность использования рестриктивного режима жидкостной ресусцитации с подключением адреномиметических препаратов для коррекции сердечного выброса и сосудистого тонуса при недостаточных эффектах инфузии. Как гиповолемия, так и гиперволемия вредны для организма пациента. В период увлечения большими объемами инфузионной терапии специалисты накопили значительный опыт наблюдения негативных последствий такого пути коррекции. Они проявляются отечным синдромом, накоплением жидкости в интерстиции легких с ухудшением оксигенации и формированием РДС, абдоминальным компартмент-синдромом, дилюционной коагулопатией, увеличением потребности в проведении заместительной почечной терапии. Современная концепция инфузионной терапии строится на принципе достижения нулевого результирующего водного баланса. Адреномиметики применяются при необходимости корригировать инотропную функцию миокарда и сосудистый тонус. Однако эффект от применяемых одинаковых доз адреномиметиков в организме разных больных может значительно отличаться и быть непредсказуем. Следовательно, коррекция гемодинамики на современном этапе должна проводиться с использованием эффективных мероприятий гемодинамического мониторинга.
Список литературы
1. Relationship between intraoperative mean arterial pressure and clinical outcomes after noncardiac surgery: toward an empirical definition of hypotension / M. Walsh, P.J. Devereaux, A.X. Garg [et al.] // Anesthesiology. — 2013. — Vol. 119(3). — P. 507-515.
2. Стуканов М.М. Сравнительная оценка вариантов инфузионной терапии у больных с геморрагическим шоком / М.М. Стуканов, В.Н. Лукач, П.В. Горин // Анестезиология и реаниматология. — 2011. — № 2. — С. 27-34.
3. Kirov M.Y. Perioperative haemodynamic therapy / M.Y. Kirov, V. Kuzkov, Z. Molnar // Curr. Opin. Crit. Care. — 2010. — Vol. 16(4). — P. 384-392.
4. Rose B. Treatment of severe hypovolemia and hypovolemic shock in adults / B. Rose, S. Mandell / UpToDate [електронний ресурс] last updated: квітень 13, 2016. — Режим доступу: http://www.uptodate.com/contents/treatment-of-severe-hypovolemia-or-hypovolemic-shock-in-adults.
5. Population volume kinetics predicts retention of 0.9% saline infused in awake and isoflurane-anesthetized volunteers / A. Norberg, R.G. Hahn, H. Li [et al.] // Anesthesiology. — 2007. — Vol. 107. — P. 24-32.
6. Blood volume is normal after pre-operative overnight fasting / M. Jacob, D. Chappell, P. Conzen [et al.] // Acta Anaesthesiol. Scand. — 2008. — Vol. 52. — P. 522-529.
7. Walker L.J. Fluid administration, vasopressor use and patient outcomes in a group of high-risk cardiac surgical patients receiving postoperative goal-directed haemodynamic therapy: a pilot study / L.J. Walker, P.J. Young // Anaesth. Intensive Care. — 2015. — Vol. 43(5). — P. 617-627.
8. Wuethrich P.Y. New perioperative fluid and pharmacologic management protocol results in reduced blood loss, faster return of bowel function, and overall recovery / P.Y. Wuethrich, F.C. Burkhard // Curr. Urol. Res. — 2015. — Vol. 16(4). — P. 17.
9. Emerging paradigms in perioperative management for microsurgical free tissue transfer: review of the literature and evidence-based guidelines / S. Motakef, P.M. Mountziaris, I.K. Ismail [et al.] // Plastic and Reconstructive Surgery. — 2015. — Vol. 135(1). — P. 290-299.
10. Schadt J.C. Hemodynamic and neurohumoral responses to acute hypovolemia in conscious mammals / J.C. Schadt, J. Ludbrook // Amer. J. Physiol. — 1991. — № 3. — Н305-H318.
11. Walley K. Shock / K. Walley, L. Wood / Principles of critical care; editor. — New York: McGraw-Hill, 1998. — Р. 277-302.
12. Initial severity of metabolic acidosis predicts the development of acute lung injury in severely traumatized patients / L.W. Eberhard, D.J. Morabito, M.A. Matthay [et al.] // Crit. Care Med. — 2000. — Vol. 28. — P. 125-131.
13. Left ventricular function after severe trauma / N. Smail, A. Descorps Declere, J. Duranteau [et al.] // Intensive Care Med. — 1996. — Vol. 22. — P. 439-442.
14. Lethal injuries and time to death in a level I trauma center / J.A. Acosta, J.C. Yang, R.J. Winchell [et al.] // J. Amer. Coll. Surg. — 1998. — № 3. — P. 528-533.
15. Hypertonic saline resuscitation diminished lung injury by suppressing neutrophil activation after hemorrhagic shock / N. Angle, D.B. Hoyt, R. Coimbra [et al.] // Shock. — 1988. — № 9. — P. 164-170.
16. Pre-Hospital Resuscitation of Traumatic Hemorrhagic Shock with Hypertonic Solutions Worsen Hypo-Coagulation and Hyper-Fibrinolysis / M.J. Delano, S.B. Rizoli, S.G. Rhind [et al.] // Shock [електронний ресурс]. — 2015. Mar 17. — Режим доступу: doi: 10.1097/SHK.0000000000000368.
17. Hypertonic HBOC‑201 decreases neutrophil activation after hemorrhagic shock / F.A. Rivera-Chevez, A. Lu, M.M. Liu // Crit. Care Med. — 2014. — Vol. 27. — P. 14-20.
18. Colloids for fluid resuscitation: what is their role in patients with shock? / D. Orbegozo Cortes, C. Santacruz, K. Donadello [et al.] // Minerva Anestesiol. — 2014. — Vol. 80(8). — P. 963-969.
19. Crystalloids vs. colloids in fluid resuscitation: a systematic review / P.T. Choi, G. Yip, L.G. Quinonez [et al.] // Crit. Care Med. — 1999. — Vol. 27(1). — P. 200-210.
20. Hemodynamic support of the trauma patient / M.J. van den Elsen, L.P. Leenen, J. Kesecioglu [et al.] // Curr. Opin. Anaesthesiol. — 2010. — Vol. 23(2). — P. 269-275.
21. Vincent J.L. Fluid resuscitation: colloidsvscrystalloids / J.L. Vincent // Acta Clin. Belg. — 2007. — № 2. — P. 408-411.
22. Effects of fluid resuscitation with colloidsvscrystalloids on mortality in critically ill patients presenting with hypovolemic shock: the CRISTAL randomized trial / D. Annane, S. Siami, S. Jaber [et al.] // JAMA. — 2013. — Vol. 310(17). — P. 1809-1817.
23. Сrystalloids vs. colloids: KO at the twelfth round? / D.P. Phillips, A.M. Kaynar, J.A. Kellum [et al.] // Crit. Care. — 2013. — Vol. 17(3). — Р. 319.
24. Effects of different resuscitation fluids on pulmonary expression of aquaporin1 and aquaporin5 in a rat model of uncontrolled hemorrhagic shock and infection / J. Gao, L. Zhou, Y. Ge [et al.] / PLoSOne [електронний ресурс]. — 2013 May 31. — Режим доступу: http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0064390.
25. The effect of fluid overload in the presence of an epidural on the strength of colonic anastomoses / С. Nessim, L. Sidris, S. Turcotte [et al.] // Surg. Res. — 2013. — Vol. 183(2). — P. 567-573.
26. Systematic review of third-generation hydroxyethyl starch (HES130/0.4) in resuscitation: safety not adequately addressed / C.S. Hartog, M. Kohl, K. Reinhart [et al.] // Anesth. Analg. — 2011. — Vol. 112. — P. 635-645.
27. Estrada C.A. Hydroxyethyl starch in severe sepsis: end of starch era? / C.A. Estrada, R. Murugan // Crit. Care. — 2013. — Vol. 17. — P. 310.
28. Meta-analysis of standard, restrictive and supplemental fluid administration in colorectal surgery / N.N. Rahbari, J.B. Zimmermann, T. Schmidt [et al.] // Brit. J. Surg. — 2009. — Vol. 96. — P. 331-341.
29. Chloride-liberal fluids are associated with acute kidney injury after liver transplantation / A. Nadeem, N. Salahuddin, A. El Hazmi [et al.] // Crit. Care. — 2014. — Vol. 18(6). — Р. 625.
30. How perioperative fluid balance influences postoperative outcomes / D.N. Lobo, D.A. MacAfee, S.P. Allison [et al.] // Res. Clin. Anaesthesiol. — 2006. — Vol. 20. — P. 439-455.
31. Effects of intravenous fluid restriction on postoperative complications: comparison of two perioperative fluid regimens: a randomized assessor-blinded multicenter trial / B. Brandstrup, H. Tonnesen, R. Beier-Holgersen [et al.] // Ann. Surg. — 2003. — Vol. 238. — P. 641-648.
32. ‘Liberal’ vs. ‘restrictive’ perioperative fluid therapy — a critical assessment of the evidence / M. Bundgaard-Nielsen, N.H. Secher, H. Kehlet [et al.] // Acta Anaesthesiol. Scand. — 2009. — Vol. 53. — P. 843-851.
33. Preoperative fluid bolus and reduction of postoperative nausea and vomiting in patients undergoing laparoscopic gynecologic surgery / K.G. Lambert, J.H. Wakim, N.E. Lambert [et al.] // AANAJ. — 2009. — Vol. 77. — P. 110-114.
34. Hamilton M.A. Perioperative fluid management: progress despite lingering controversies / M.A. Hamilton // Clevel. Clin. J. Med. — 2009. — Vol. 76. — S28-31.
35. Doherty D. Intraoperative fluids: how much is too much? / D. Doherty, J. Buggy // Brit. J. Anaesth. — 2012. — Vol. 109(1). — P. 69-79.
36. Hypovolemia after traditional preoperative care in patients undergoing colonic surgery is underrepresented in conventional hemodynamic monitoring / T. Junghans, H. Neuss, M. Strohauer [et al.] // International J. Colorectal. Dis. — 2006. — Vol. 21. — Р. 693-697.
37. Identification and resuscitation of the trauma patient in shock / M.N. Cocchi, E. Kimlin, M. Walsh [et al.] // Emerg. Med. Clin. North Amer. — 2007. — Vol. 25. — P. 623-642.
38. Perioperative fluid therapy: a statement from the international Fluid Optimization Group / Lais Helena Camacho Navarro, Joshua A. Bloomstone, Jose Otavio Costa Auler Jr [et al.] // BioMed [електронний ресурс] Central Published online 2015 Apr. 10. — Режим доступу: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4403901/
39. Bellamy M.C. Wet, dry or something else? / M.C. Bellamy // Brit. J. Anaesth. — 2006. — Vol. 97. — P. 755-757.
40. Functional intravascular volume deficit in patients before surgery / M. Bundgaard-Nielsen, C.C. Jorgensen, N.H. Secher [et al.] // Acta Anaesthesiol. Scand. — 2010. — Vol. 54. — P. 464-469.
41. Knott L. Fluid Overload / L. Knott / Patient [електронний ресурс] Last Checked: 23/07/2014. — Режим доступу: http://patient.info/doctor/fluid-overload.
42. Intraoperative crystalloid overload leads to substantial inflammatory infiltration of intestinal anastomoses — a histomorphological analysis / B. Kulemann, S. Timme, G. Seifert [et al.] // Surgery. — 2013. — Vol. 154. — P. 596-603.
43. Hamilton M.A. A systematic review and meta-analysis on the use of preemptive hemodynamic intervention to improve postoperative outcomes in moderate and high-risk surgical patients / M.A. Hamilton, M. Cecconi // Anesth. Analg. — 2011. — Vol. 112. — P. 1392-1402.
44. Vascular content, tone, integrity, and haemodynamics for guiding fluid therapy: a conceptual approach / L.S. Chawla, C. Ince, D. Chappell [et al.] // Brit. J. Anaesth. — First published online: September 17, 2014. — Режим доступу: http://bja.oxfordjournals.org/content/early/2014/09/17/bja.aeu298.full.
45. Perioperative fluid management strategies in major surgery: a stratified meta-analysis / T. Corcoran, J.E. Rhodes, S. Clarke [et al.] // Anesth. Analg. — 2012. — Vol. 114. — P. 640-651.
46. Perel A. Bench-to-bedside review: functional hemodynamics during surgery — should it be used for all high-risk cases? / A. Perel, M. Habicher, M. Sander // Crit. Care. — 2013. — Vol. 17. — Р. 203.
47. Yeager M.P. Perioperative fluid management: current consensus and controversies / M.P. Yeager, B.C. Spence // Semin. Dial. — 2006. — Vol. 19. — P. 472-479.
48. Hemodynamic monitoring and management in patients undergoing high risk surgery: a survey among North American and European anesthesiologists / M. Cannesson, G. Pestel, C. Ricks [et al.] // Crit. Care. — 2011. — Vol. 15. — Р. 197.
49. Pharmacotherapy update on the use of vasopressors and inotropes in the intensive care unit / J.C. Jentzer, J.C. Coons, C.B. Link [et al.] // J. Cardiovasc. Pharmacol. Ther. — 2015. — Vol. 20(3). — P. 249-260.
50. Impact of vasopressors on outcomes in head and neck free tissue transfer / L. Harris, D. Goldstein, S. Hofer [et al.] // Microsurgery. — 2012. — Vol. 32(1). — P. 15-19.
51. Overgaard C.B. Inotropes and vasopressors: Review of physiology and clinical use in cardiovascular disease / C.B. Overgaard, V. Dzavik // Circulation. — 2008. — Vol. 118. — P. 1047-1056.
52. Surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock: 2012 / R.P. Dellinger, M.M. Levy, A. Rhodes [et al.] // Crit. Care Med. — 2013. — Vol. 41. — P. 580-637.
53. A comparison of intra-operative blood loss and acid-base balance between vasopressor and inotrope strategy during living donor liver transplantation: a randomised, controlled study / S.H. Hong, C.S. Park, H.S. Jung [et al.] // Anaesthesia. — 2012. — Vol. 67. — P. 1091-1100.
54. Morozowich S.T. Pharmacologic agents for acute hemodynamic instability: Recent advances in the management of perioperative shock — A systematic review / S.T. Morozowich, Harish Ramakrishna // Annals of Сardiac Anesthesia. — 2015. — Vol. 18(4). — P. 543-554.
55. American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Part 1: Executive summary: 2010 / J.M. Field, M.F. Hazinski, M.R. Sayre [et al.] // Circulation. — 2010. — Vol. 122(18), Suppl. 3. — S640-656.
56. A comparison of epinephrine and norepinephrine in critically ill patients / J.A. Myburgh, A. Higgins, A. Jovanovska [et al.] // Intensive Care Med. — 2008. — Vol. 34. — P. 2226-2234.
57. Comparison of dopamine and norepinephrine in the treatment of shock / D. De Backer, P. Biston, J. Devriendt [et al.] // Engl. J. Med. — 2010. — Vol. 362. — P. 779-789.
58. Dopamine versus norepinephrine in the treatment of septic shock: A meta-analysis / D. De Backer, C. Aldecoa, H. Njimi [et al.] // Crit. Care Med. — 2012. — Vol. 40. — P. 725-730.
59. Comparison Between Phenylephrine and Dopamine in Maintaining Cerebral Oxygen Saturation in Thoracic Surgery: A Randomized Controlled Trial / J.W. Choi, H. Joo Ahn, M. Yang [et al.] // Medicine (Baltimore). — 2015. — Vol. 94. — P. 49.
60. Vincent J.L. De Backer D. Circulatory shock / J.L. Vincent, D. De Backer // New Engl. J. Med. — 2013. — Vol. 369. — P. 1726-1734.
61. Bench-to-bedside review: Inotropic drug therapy after adult cardiac surgery — A systematic literature review / M. Gillies, R. Bellomo, L. Doolan [et al.] // Crit. Care. — 2005. — Vol. 9(3). — P. 266-279.
62. ACCF/AHA guideline for the management of ST-elevation myocardial infarction: A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines / P.T. O’Gara, F.G. Kushner, D.D. Ascheim [et al.] // Circulation. — 2013. — Vol. 127(4). — P. 362-425.
63. Vasopressors for hypotensive shock / C. Havel, J. Arrich, H. Losert [et al.] // Cochrane Database Systematic Review [електронний ресурс]. — 2011 May 11(5). — CD003709. — doi: 10.1002/14651858.CD003709.pub.3/ — Режим доступу: http://www.ncbi.nlm.nih.gov/pubmed/21563137.

/113.jpg)