Статтю опубліковано на с. 56-62
Вступ
Захворювання дихальних шляхів у дітей залишаються протягом останніх десятиріч однією з найбільш актуальних медичних та соціальних проблем педіатрії. Це пов’язано з незмінно високою питомою вагою даної патології в структурі дитячої захворюваності та високим рівнем дитячої смертності внаслідок гострих захворювань органів дихання (третє місце в структурі дитячої смертності). За останні десять років кількість захворювань бронхолегеневої системи в дітей зросла майже в 3,6 раза, переважно за рахунок гострих та рецидивуючих запальних процесів верхніх і нижніх дихальних шляхів [1, 6]. Кожне друге звернення до педіатра або сімейного лікаря відбувається з приводу респіраторних захворювань.
Серед захворювань дихальних шляхів 85 % випадків припадає на гострі респіраторні захворювання, з яких майже 80 % становлять гострі респіраторні вірусні інфекції (ГРВІ), а 15–20 % гострих респіраторних захворювань спричиняються бактеріальними збудниками (пневмокок, гемофільна паличка, мораксела катараліс, стрептокок) та представниками атипової мікрофлори (мікоплазма, хламідії). Щорічно реєструється до 65–70 тисяч випадків ГРВІ на 100 тисяч дитячого населення, що у 2,7–3,2 раза перевищує значення аналогічних показників у дорослих [8, 11].
Причиною розвитку ГРВІ можуть стати понад 200 різноманітних вірусів, що схожі за механізмом передачі збудника (переважно повітряно-крапельний) та розвитком патологічного процесу в дихальних шляхах. Протягом останніх десяти років фахівцями ідентифіковано 6 нових респіраторних вірусів: метапневмовірус, коронавірус — збудник SARS (тяжкого гострого респіраторного синдрому), коронавіруси NL63 і HKU1, вірус парагрипу 4 і бокавірус [11]. Переважна більшість збудників ГРВІ — це РНК-віруси, за винятком аденовірусу, який містить ДНК.
Виділяють шість родин збудників вірусних інфекцій: ортоміксовіруси — вірус грипу; параміксовіруси — вірус парагрипу, респіраторно-синцитіальний вірус; пікорнавіруси — риновіруси, ентеровіруси; реовіруси — ортореовіруси; аденовіруси містять лише аденовіруси; коронавіруси — респіраторні коронавіруси.
Різні збудники визначаються відповідною тропністю до певних відділів дихальних шляхів: коронавіруси вражають переважно слизову оболонку носа, реовіруси — слизову оболонку носа та глотки, парагрипозні віруси — слизову оболонку гортані, вірус грипу — трахеї, РС-вірус — слизову оболонку бронхів та бронхіол, аденовіруси переважно вражають лімфоїдну тканину глотки та кон’юнктиви. Результатом інфікування є розвиток гострого запалення в клітинах епітелію респіраторного тракту [1, 2]. Особливості ураження різних відділів респіраторного тракту обумовлюють різноманітні прояви катарального синдрому при ГРВІ, що може проявлятися ознаками гострого риніту, риносинуситу, трахеїту, фарингіту, тонзиліту, ларингіту або перебігати у вигляді бронхіту.
Найбільшу увагу клініцистів зазвичай привертають прояви гострого тонзиліту та гострого фарингіту в дітей як найчастіші прояви гострих респіраторних вірусних та бактеріальних інфекцій.
Гострий фарингіт — інфекційне захворювання, що проявляється запаленням слизової оболонки задньої стінки глотки, фолікулів та бокових лімфоїдних стовпців.
Гострий тонзиліт — захворювання, що характеризується гострим запаленням одного чи кількох лімфоїдних утворень глоткового кільця (частіше піднебінних мигдаликів).
Вітчизняні фахівці в клінічній практиці вже звикли використовувати термін «гострий тонзилофарингіт» з огляду на високу частоту зустрічальності поєднаного ураження слизової оболонки глотки та піднебінних мигдаликів інфекційного генезу. В англомовній літературі з аналогічною метою використовується поняття sore throat, що є не визначенням конкретної нозологічної форми, а, швидше, збірним терміном для декількох захворювань [15, 21].
За даними вітчизняних та світових наукових джерел, у дітей віком від 5 до 15 років майже 30 % гострих фарингітів та 20–30 % гострих тонзилітів викликається β-гемолітичним стрептококом групи А [3, 6, 7, 15, 23]. Серед інших бактеріальних збудників гострих тонзилітів та фарингітів — стрептококи групи G, С, дуже рідко запальний процес спричиняють Arcanobacterium haemolyticum, Neisseria gonorrhoeae, Corynebacterium diphtheriae, мікоплазми та хламідії [4, 5, 10, 11].
У дітей перших 3–5 років життя переважають гострі тонзиліти та фарингіти, спричинені вірусними агентами (70–90 % випадків). Найбільш типовим збудником гострого фарингіту є риновіруси. Дослідження останніх років показують, що їх значення невтримно зростає, і тепер риновіруси відповідальні більше ніж за 80 % випадків ГРВІ в період осінніх епідемій [1, 11]. Серед інших етіологічних чинників гострого тонзилофарингіту доцільно визначити аденовіруси, коронавірус, віруси грипу й парагрипу, вірус Епштейна — Барр, вірус Коксакі А.
Обґрунтування необхідності місцевої терапії
Гострі тонзиліти розвиваються переважно в дітей, старших від 1–1,5 року, що обумовлюється формуванням лимфоїдної тканини глоткового кільця в цьому віці. Клінічна картина гострого тонзиліту характеризується болем у горлі, утрудненим та болісним ковтанням, збільшенням та болючістю регіонарних лімфатичних вузлів. При об’єктивному огляді визначається набряк слизової оболонки мигдаликів з яскравою гіперемію, інколи з гнійними нашаруваннями на їх поверхні. Морфологічні зміни характеризуються запальним набряком та інфільтрацією клітинних елементів слизової оболонки, десквамацією епітелію, значною судинною реакцією у вигляді розширення поверхневих та глибоких судин [3, 7, 16].
Проявами гострого фарингіту в дитини зазвичай є різка печія, першіння та сухість у горлі, біль при ковтанні, характерний болісний поверхневий кашель, регіонарний лімфаденіт. У дітей перших років життя визначається дисфагія, підвищена салівація. Клінічні прояви супроводжуються характерною картиною при прямій фарингоскопії: гіперемія та набряк слизової оболонки задньої стінки глотки, глоткових дужок та м’якого піднебіння, значна зернистість поверхні слизової оболонки, інколи з проявами дрібних крововиливів.
Як бактеріальні, так і вірусні тонзиліти та фарингіти супроводжуються проявами загального інтоксикаційного синдрому у вигляді підвищення температури тіла (при бактеріальних процесах переважно до фебрильних цифр), зниженням апетиту, дратівливістю або млявістю дитини. Зазвичай прояви гострого тонзилофарингіту, спричиненого вірусними збудниками, супроводжуються іншими різноманітними проявами катарального синдрому: риніт, риносинусит, кон’юнктивіт, ларингіт.
Для гострих фарингітів та тонзилітів будь-якої етіології характерний виражений больовий синдром. Найчастіше саме больові відчуття дитини змушують батьків звернутися до лікаря [5, 7]. Постійний та інтенсивний больовий синдром значно порушує самопочуття дитини, пояснює відмову дитини від прийняття їжі та рідини, ускладнює –пероральний прийом лікарських засобів.
Значна вираженість больового синдрому при ураженні глотки пов’язана з подразненням чутливих нервів глоткового сплетіння внаслідок запального процесу слизової оболонки. Для слизової оболонки глотки характерна висока та чутлива іннервація, особливо в задніх та бокових відділах. При цьому нерідко визначається іррадіація болю в альвеолярні ясна, нижню та верхню щелепу, вухо.
Найважливішою терапевтичною проблемою при лікуванні гострих захворювань дихальної системи в дітей є вирішення питання про необхідність призначення антибактеріальної терапії. Широкий спектр етіологічних факторів гострих респіраторних інфекцій, обмежені можливості вірогідної верифікації збудників ускладнюють проблему діагностики та лікування гострих захворювань респіраторного тракту в дітей. Діагноз встановлюється переважно на підставі епідеміологічних та клінічних даних.
Слід зазначити, що саме бактеріальні гострі тонзиліти та фарингіти становлять величезну загрозу імовірним розвитком ускладнень, таких як гостра ревматична лихоманка, паратонзилярний абсцес, лімфаденіти шийних лімфатичних вузлів, мастоїдити [7, 9, 16, 19]. Це також обумовлює необхідність своєчасного призначення антибактеріальних препаратів.
Препаратами вибору при захворюваннях верхніх дихальних шляхів, асоційованих з β-гемолітичним стрептококом групи А, згідно з національними рекомендаціями та консенсусами практично всіх країн світу протягом останніх десятиріч залишаються препарати пеніциліну — пеніцилін V або амоксицилін [3, 7, 16, 19, 21].
При вірусних ураженнях верхніх дихальних шляхів антибактеріальна терапія призначається за окремими показаннями з урахуванням вікових, соціальних чинників, стану імунної системи дитини, наявності та характеру супутньої патології.
З огляду на складність вибору препарату для призначення етіотропної терапії при лікуванні гострих респіраторних захворювань верхніх дихальних шляхів у дітей особливого значення набувають препарати, здатні чинити місцевий протизапальний та саногенетичний вплив.
Враховуючи інтенсивність больових проявів, якими супроводжується перебіг гострого тонзиліту та фарингіту в дітей, доцільно застосування препаратів, що мають місцевий знеболюючий ефект. Головною метою використання препаратів цієї групи стає зниження активності запального процесу слизової оболонки верхніх дихальних шляхів, запобігання розвитку ускладнень внаслідок поширення запального процесу на інші відділи респіраторного тракту, профілактика вторинного інфікування пошкодженої слизової оболонки та необхідність якомога швидшого уникнення больових відчуттів у дитини [4, 8, 10, 13].
Вибір препарату для місцевої терапії
З метою зменшення проявів гострого запального процесу слизової оболонки верхніх дихальних шляхів застосовуються різноманітні лікарські препарати у вигляді дезінфікуючих розчинів, спреїв, таблеток, пігулок для розсмоктування. Препарати, що мають використовуватись для місцевого впливу на слизову оболонку дихальних шляхів, повинні відповідати ряду вимог:
— широкий спектр антимікробної та противірусної дії;
— відсутність токсичного ефекту;
— низька та повільна швидкість абсорбції зі слизових оболонок;
— мінімальна ймовірність розвитку алергічної реакції на тлі застосування препарату;
— відсутність подразнюючого впливу на слизову оболонку ротової порожнини та інших відділів шлунково-кишкового тракту;
— добрі органолептичні властивості;
— зручність застосування, особливо в педіатричній практиці.
На сьогодні фармацевтичний ринок пропонує великий арсенал лікарських засобів, що чинять антисептичну дію при нанесенні на слизові оболонки ротової порожнини та верхніх дихальних шляхів. Ці препарати застосовуються у вигляді пігулок для розсмоктування, спреїв для зрошення слизових оболонок, розчинів для полоскання ротової порожнини, розчинів для інгаляцій. Більшість препаратів для місцевого впливу на уражені слизові оболонки містять у своєму складі хімічні сполуки: тимол, хлорбензол, фенол, метакрезол, хлоргексидин та ін. Деякі препарати включають комбінації активних антисептичних речовин з нестероїдними протизапальними препаратами та місцевими антибактеріальними засобами [10, 13, 16, 19, 21].
Препарати для місцевого застосування, на жаль, не позбавлені побічних ефектів, до яких можна віднести: алергічні реакції, порушення місцевого біоценозу, подразнюючий вплив на слизову оболонку ротоглотки та інших відділів шлунково-кишкового тракту, специфічний смак та запах [13, 16]. Саме це є причиною їх обмеженого використання в педіатрії.
Бензидаміну гідрохлорид.
Механізм дії
Одним з лікарських засобів, що здатен чинити потужну місцеву саногенетичну, протизапальну та анестезуючу дію на слизову оболонку верхніх дихальних шляхів, є бензидаміну гідрохлорид (C19H24ClN3O — 1-бензил-3-[3-(диметиламіно) пропокси]-1H-індазол) — діюча речовина препарату Тантум Верде®.
Бензидаміну гідрохлорид чинить значний протизапальний вплив, який за окремими напрямками перевищує дію таких нестероїдних протизапальних препаратів, як ібупрофен та напроксен. Реалізація протизапальної дії обумовлена інгібуванням синтезу прозапальних цитокінів TNF-α та IL-1β. При цьому дія препарату не поширюється на продукцію цитокінів IL-6, IL-8 та синтез протизапальних цитокінів (IL-10) і рецепторів (IL-1Ra) [1, 8, 13, 18]. Комбінований вплив препарату на продукцію цитокінів здатний пригнічувати запальний процес на слизових оболонках дихальних шляхів на найбільш ранніх етапах розвитку за рахунок зниження вироблення та вивільнення ферментів (циклооксигенази) та зниження синтезу простагландинів. Протизапальній активності препарату також сприяє індукція гальмування відповідної міграції моноцитів людини у відповідь на вплив хемоатрактантів CCL2 (MCP-1), мікробного продукту FMLP та компонента каскаду комплементу С5а.
Бензидаміну гідрохлорид здатен гальмувати вивільнення ферментів із лізосом нейтрофільних гранулоцитів, пригнічує міграцію лейкоцитів та їх агрегацію, блокує вивільнення вазоактивних амінів та агрегацію тромбоцитів. Препарат сприяє стабілізації мембран клітин, пригнічує генерацію активованих кисневмісних метаболітів макрофагами та нейтралізує високотоксичні вільні радикали [18, 20, 22]. Протизапальний ефект препарату посилюється опосередкованою ендотелій-протекторною дією. Бензидаміну гідрохлорид обмежує пошкодження ендотелію продуктами фагоцитів, пригнічує активність фагоцитів та інактивує серотонін і гістамін [20, 21]. Результатом протизапальної дії препарату є зниження й усунення набряку та гіперемії слизової оболонки дихальних шляхів, зменшення запальної гіпертрофії регіонарних лімфатичних вузлів та профілактика небажаних ускладнень.
/56-62/59-1.jpg)
/56-62/59-2.jpg)
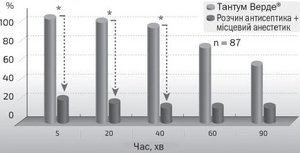
Препарат Тантум Верде® має потужний знеболювальний ефект за рахунок структурної схожості молекули бензидаміну гідрохлориду з тетракаїном. На відміну від інших нестероїдних протизапальних засобів знеболювальна дія препарату має виключно місцевий характер, а її активність досягає 50 % від дії тетракаїну. Реалізація знеболювального ефекту обумовлена стабілізуючим впливом препарату на чутливі сенсорні рецептори слизової оболонки дихальних шляхів, зниженням концентрації біогенних амінів, що мають альгогенні властивості, та підвищенням рівню больової чутливості рецепторного апарату. Крім того, препарат значно впливає на таламічні центри больової чутливості, викликаючи локальну блокаду синтезу простагландинів (PgE1, PgE2 и PgF2-α) [18, 21]. Після топічного використання препарату Тантум Верде® у вигляді розчину для місцевого застосування або у вигляді спрея місцевоанестезуюча дія препарату настає через 2–3 хвилини після використання й триває півтори години.
Бензидамін за хімічною структурою є слабкою основою на відміну від інших нестероїдних протизапальних засобів, що являють собою слабкі кислоти. Це забезпечує бензидаміну високу ліпофільність, що дозволяє швидко проникати у вогнище запалення, де рН значно нижче, та створювати там терапевтичну концентрацію. Численні дослідження дозволили стверджувати, що бензидамін має високу бактерицидну активність щодо понад 110 штамів бактерій, зокрема щодо пневмококу, золотистого стафілококу, клебсієли пневмонії, стрептококу тощо. Бактерицидна активність препарату реалізується за рахунок здатності до коагуляції протеїнів клітинних стінок інфекційних агентів. У високих концентраціях препарат має також фунгіцидний ефект відносно штамів Candida albicans та Aspergillus niger у результаті прямого впливу та пошкодження цитоплазматичної мембрани міцетів, що перешкоджає їх репродукції [18, 20, 22]. Концентрація бензидаміну в препараті Тантум Верде® становить 1500 мкг/мл, що значно більше, ніж мінімальна інгібуюча концентрація для більшості вивчених мікроорганізмів.
Результати клінічних досліджень ефективності бензидаміну гідрохлориду
У дослідженні C. Cingi та співавторів [16] вивчались особливості дії бензидаміну у формі спрея при спільному використанні з антибактеріальними препаратами для лікування гострих тонзилофарингітів, викликаних β-гемолітичним стрептококом групи А, у дітей. Проведений аналіз отриманих результатів показав статистично вірогідне зниження вираженості основних клінічних проявів захворювання на тлі комплексного лікування. Дослідження показало, що застосування бензидаміну може поєднуватися з проведенням антибактеріальної терапії.
Вітчизняні дослідники на підставі власних результатів довели, що бензидаміну гідрохлорид може застосовуватися для усунення больового синдрому при лікуванні гострих тонзилофарингітів у дітей [12].
Проведені численні клінічні дослідження вітчизняних та світових фахівців показали високу ефективність та безпеку бензидаміну для корекції стану дитини після проведення тонзилектомії, при лікуванні фарингітів, що розвиваються внаслідок інтубації трахеї під час проведення загальної анестезії. Найчастіше пацієнтів після проведення інтубації трахеї турбує біль у горлі, що посилюється при ковтанні, дисфагія, що пов’язано з подразненням та травмуванням слизової оболонки ротової порожнини та гортані. У проведеному клінічному дослідженні встановлено значне зниження больового синдрому внаслідок інтубації трахеї після застосування спрея або розчину для полоскання Тантум Верде®. Доведено тривалий ефект дії препарату, що зберігається протягом 20–24 годин (Istituto per l’Infanzia Burlo Garofalo, Італія, 2012 р.).
Продемонстровано, що препарат Тантум Верде® має високу ефективність при лікуванні дітей, які перенесли оперативне втручання з приводу паратонзилярного абсцесу [8]. Застосування препарату Тантум Верде® дозволило полегшити перебіг післяопераційного періоду в дітей, скоротити тривалість використання протизапальних препаратів системної дії та анальгетиків. Бензидамін у складі препарату значно прискорює зворотний розвиток проявів реактивного запалення (набряк та гіперемія слизової оболонки, реакція лімфатичних вузлів).
Протягом останніх років доведена ефективність бензидаміну при комплексному лікуванні запальних захворювань пародонту в дітей.
У 1998 році бензидамін був доданий до списку препаратів, що рекомендовані FDA для профілактики та лікування мукозиту, який розвивається в пацієнтів унаслідок променевої терапії злоякісних пухлин голови та шиї. Оральний мукозит є одним з найтяжчих побічних ефектів променевої терапії. Ураження слизової оболонки ротової порожнини та глотки може також розвиватися після операцій із трансплантації кісткового мозку. Розвиток запалення та виразкового ураження слизової оболонки ротової порожнини на тлі променевої терапії пов’язаний із продукцією прозапальних цитокінів IL-1, IL-6 и TNF-α. Проведене у 2001 році багатоцентрове подвійне сліпе рандомізоване дослідження показало, що бензидамін пригнічує цей процес, сприяє загоєнню слизової оболонки та прискорює процеси репарації [14, 18]. У 2004 році цей препарат було включено до протоколів Американської онкологічної асоціації як препарат з доказовою ефективністю.
Тантум Верде® — препарат бензидаміну гідрохлориду
Сукупність місцевого знеболюючого, протизапального ефекту в поєднанні з потужною бактерицидною та фунгіцидною активністю препарату Тантум Верде® сприяє покращенню самопочуття дитини вже на другу добу від початку лікування. Істотно зменшуються больові відчуття в спокої та при ковтанні, нівелюються відчуття сухості та першіння глотки, оталгії, нав’язливий сухий кашель. Дитина стає більш активною, покращується апетит, нормалізується сон. Позитивна клінічна картина корелює зі змінами, що виявляються при об’єктивному огляді: істотно зменшується вираженість запального набряку та гіперемії слизової оболонки, стає меншою судинна реакція.
Безсумнівною перевагою препарату Тантум Верде® є відсутність побічних ефектів, які доволі часто розвиваються при застосуванні нестероїдних протизапальних препаратів системної дії.
Препарат Тантум Верде® відрізняється від інших засобів місцевої дії високою переносимістю, особливо порівняно з фенолом та гексетидину хлорбутанолом. При застосуванні препарату Тантум Верде® для лікування гострих тонзилітів та гострих фарингітів тільки у 2 % дітей визначались алергічні реакції, у той час як при використанні препаратів фенолу та гексетидину цей показник дорівнював 10 та 15 % відповідно [10, 18]. Препарат Тантум Верде® не має системних побічних ефектів, відсутність яких пояснюється мінімальною концентрацією в плазмі крові, що не здатна чинити терапевтичну дію. Низька концентрація препарату в крові поряд з фармакологічно активною концентрацією в тканинах при локальному застосуванні дозволяє уникнути побічних системних впливів при високій терапевтичній ефективності.
Форми випуску препарату Тантум Верде®. Режим застосування
Препарат Тантум Верде® випускається у формі дозованого спрея для місцевого застосування та розчину для місцевого застосування (розчин для полоскання ротової порожнини).
Спрей Тантум Верде® містить 30 мл (176 доз) — 255 мкг/дозу. Одна доза становить 0,17 мл, що відповідає 0,255 мкг бензидаміну гідрохлориду. Спрей призначається дітям віком понад 4 роки. Препарат застосовується шляхом розпилювання розчину в ротовій порожнині. Дітям 6–12 років — по 4 дози, дітям 4–6 років — по 1 дозі на кожні 4 кг маси тіла (максимально 4 дози) кожні 1,5–3 години (від 2 до 6 разів на добу).
Тантум Верде® у формі розчину для місцевого застосування призначається дітям від 12 років. Флакон містить 120 мл розчину (1,5 мг/мл). 100 мл розчину містять 0,15 г бензидаміну гідрохлориду. Рекомендована доза — 15 мл розчину. При використанні необхідно нерозведеним або розведеним (15 мл розчину, що були відміряні, можуть бути розведені 15 мл води) препаратом прополоскати ротову порожнину. Полоскання слід проводити 2–3 рази на добу.
Показання для призначення препарату Тантум Верде®
Отже, подана інформація свідчить про різноспрямований спектр терапевтичних ефектів препарату Тантум Верде®: протизапальних, знеболюючих, протинабрякових, бактерицидних, фунгіцидних.
Показаннями для призначення препарату як місцевої патогенетичної терапії є запальні захворювання ротової порожнини та верхніх дихальних шляхів інфекційного генезу, а саме: гострі фарингіти, тонзиліти, стоматити, гінгівіти, глосити тощо. При лікуванні гострих захворювань дихальної системи, спричинених бактеріальними збудниками, препарат Тантум Верде® може застосовуватись у комбінації з антибактеріальними препаратами.
Доцільно рекомендувати використовувати препарат після проведення оперативних втручань у порожнині рота та глотки, аденотомії та тонзилектомії, оперативних втручань на верхній та нижній щелепі, захворюваннях пародонту, при пошкодженнях слизової оболонки рота та глотки травматичного генезу, після проведення інтубації трахеї з метою загальної анестезії.
Доказовий високий профіль безпеки препарату та виключно місцева дія дозволяють рекомендувати препарат Тантум Верде® для застосування в педіатричній практиці.
Список литературы
1. Абатуров А.Е. Молекулярные механизмы неспецифической защиты респираторного тракта: распознавание патоген-ассоциированных молекулярных структур // Здоровье ребенка. — 2006. — № 2(2). — С. 87-92.
2. Абатуров А.Е., Волосовец А.П., Юлиш Е.И. Инициация воспалительного процесса при вирусных и бактериальных заболеваниях, возможности и перспективы медикаментозного управления. — Харьков: С.А.М., 2011. — 392 с.
3. Бредун А.Ю. Хронический тонзиллит у детей: новое решение старой проблемы // Здоровье Украины. — 2007. — № 18/1. — С. 37.
4. Великорецкая М.Д., Старостина Л.С. Эффективность местной терапии заболеваний полости рта и глотки у детей с соматической патологией // Педиатрия. — 2010. — № 4.
5. Зайцева О.В. Острый ринофарингит в педиатрической практике // Лечащий врач. — 2012. — № 10.
6. Крючко Т.Ф. Проблема тонзиллита в педиатрической практике / Т.Ф. Крючко, О.Я. Ткаченко, Т.В. Шпехт // Здоровье ребенка. — 2010. — № 1. — С. 79-82.
7. Полунина Т.А., Вишнева Е.А. Фарингиты у детей // Педиатрическая фармакология. — 2011. — Т. 8, № 5. — С. 106-108.
8. Радучич О. Возможности применения препарата «Тантум Верде» в практике врача-отоларинголога // Совр. педиатрия. — 2013. — № 5. — С. 51-55.
9. Рязанцев С.В. Топическая противовоспалительная терапия заболеваний глотки // Доктор.Ру. — 2010. — Т. 57, № 6. — С. 22-26.
10. Солдатский Ю.Л. Симптоматическое лечение инфекционно-воспалительных заболеваний глотки // Лечащий врач. —2014. — № 10.
11. Сміян О.І. Сучасні етіопатогенетичні та клініко-діагностичні особливості перебігу гострих респіраторних вірусних інфекцій у дітей / О.І. Сміян, Т.П. Бинда, Є.В. Дмітрова, В.А. Сухарєва // Журнал клінічних та експериментальних медичних досліджень. — 2013. — № 3. — С. 328-335.
12. Шахтель Б.П., Падджарино Д.А. Рандомизированная двойная слепая плацебо-контролируемая модель, демонстрирующая местный эффект бензидамина у детей с тонзиллофарингитом // Здоровье ребенка. — 2012. — № 8(43). — С. 73-76.
13. Юлиш Е.И. Патогенетическая терапия при воспалительных заболеваниях глотки у детей / Е.И. Юлиш, О.Е. Чернышева, Б.И. Кривущев, Е.В. Глинская, А.А. Левченко // Здоровье ребенка. — 2013. — № 1(44). — С. 97-101.
14. Ahmed K.M. The effect of olive leaf extract in decreasing the expression of two pro-inflammatory cytokines in patients receiving chemotherapy for cancer. A randomized clinical trial // Saudi Dent. J. — 2013 Oct. — 25(4). — 141-7. doi: 10.1016/j.sdentj.2013.09.001.
15. Ba-Saddik I.A. Prevalence of Group A beta-haemolytic Streptococcus isolated from children with acute pharyngotonsillitis in Aden, Yemen / I.A. Ba-Saddik, A.A. Munibari, A.M. Alhilali, S.M. Ismail, F.M. Murshed, J.B. Coulter, L.E. Cuevas, C.A. Hart, B.J. Brabin, C.M. Parry // Trop. Med. Int. Health. — 2014 Jan 10. — doi: 10.1111/tmi.12264.
16. Cingi C. Effect of chlorhexidine gluconate and benzydaminehydrochloride mouth spray on clinical signs and quality of life of patients with streptococcal tonsillopharyngitis: multicentre, prospective, randomised, double-blinded, placebo-controlled study / C. Cingi, M. Songu, A. Ural, N. Erdogmus, M. Yildirim, H. Cakli, C. Bal // J. Laryngol. Otol. — 2011 Jun. — 125(6). — 620-5. doi: 10.1017/ S0022215111000065.
17. Pilloni A.P. Antimicrobial action of Nitens mouthwash (ce–tyltrimethylammonium naproxenate) on multiple isolates of pharyngeal microbes: a controlled study against chlorhexidine, zydamine, hexetidine, amoxicillin, amoxicillin-clavulanate, clarithromycin, and cefaclor / A.P. Pilloni, G. Buttini, D. Giannarelli, B. Giordano, R. Iovene, F. Montella, R. di Salvo, R. Colantuono, G. Lalli, M.A. Tufano // Chemotherapy. — 2002 Sep. — 48(4). — 168-73. doi: 10.1159/000063868.
18. Quane P.A., Graham G.G., Ziegler J.B. Pharmacology of benzydamine // Inflammopharmacology. — 1998. — 6(2). — 95-107.
19. Regoli M. Update on the management of acute pharyngitis in children / M. Regoli, E. Chiappini, F. Bonsignori, L. Galli, M. de Martino // Ital. J. Pediatr. — 2011 Jan. 31. — 37. — 10. doi: 10.1186/1824-7288-37-10.
20. Turnbul R.S. Benzydamine Hydrochloride (Tantum) in the management of oral inflammatory conditions // Journal Can. Den. Assoc. — 1995. — 61(2). — 127-34.
21. Shulman S.T. Clinical practice guideline for the diagnosis and management of group A streptococcal pharyngitis: 2012 update by the Infectious Diseases Society of America / S.T. Shulman, A.L. Bisno, H.W. Clegg, M.A. Gerber, E.L. Kaplan, G. Lee, J.M. Martin, C. Van Beneden // Clin. Infect. Dis. — 2012, Nov. 15. — 55(10). — 1279-82. doi: 10.1093/cid/cis847.
22. Sironi M. Differential effect of benzydamine on pro- versus anti-inflammatory cytokine production: lack of inhibition of interleukin‑10 and interleukin‑1 receptor antagonist / M. Sironi, L. Massimiliano, P. Transidico, M. Pinza, S. Sozzani, A. Mantovani, A. Vecchi // Int. J. Clin. Lab. Res. — 2000. — 30(1). — 17-9.
23. Van Driel M.L. Different antibiotic treatments for group A streptococcal pharyngitis / M.L. van Driel, A.I. De Sutter, N. Keber, H. Habraken, T. Christiaens // Cochrane Database Syst. Rev. — 2013 Apr. 30. — 4. — CD004406. doi: 10.1002/14651858. CD004406.pub3

/56-62/59-1.jpg)
/56-62/59-2.jpg)
/56-62/60-1.jpg)
/56-62/60-2.jpg)