Газета «Новости медицины и фармации» Гастроэнтерология (573) 2016 (тематический номер)
Вернуться к номеру
Залізодефіцитна анемія. Адаптована клінічна настанова, заснована на доказах. 2015 рік
Рубрики: Гастроэнтерология
Разделы: Официальная информация
Версия для печати
Статтю опубліковано на с. 27-60
Державний експертний центр Міністерства охорони здоров’я України
Національна медична академія післядипломної освіти ім. П.Л. Шупика
Українська асоціація сімейної медицини
Всеукраїнська асоціація гастроентерологів
Асоціація дієтологів України
Асоціація акушерів-гінекологів України
Склад мультидисциплінарної робочої групи з опрацювання клінічної настанови
Матюха Лариса Федорівна завідувач кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Загальна практика — сімейна медицина» (згідно з наказом МОЗ України від 10.12.2012 № 526-к);
Ліщишина Олена Михайлівна директор Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний центр МОЗ України», к.мед.н., ст.н.с.;
Бекетова Галина Володимирівна завідувач кафедри дитячих і підліткових захворювань Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Педіатрія» (згідно з наказом МОЗ України від № 622-к);
Веселова Тетяна Володимирівна асистент кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.мед.н.;
Видиборець Станіслав Володимирович завідувач кафедри гематології та трансфузіології Національної медичної академії післядипломної освіти імені П.Л. Шупика, професор, д.мед.н.;
Давидова Юлія Володимирівна завідувач відділення акушерських проблем екстрагенітальної патології Державної установи «Інститут педіатрії, акушерства і гінекології НАМН України», д.мед.н., професор;
Ісламова Ганна Олегівна науковий співробітник відділення ендокринної гінекології Державної установи «Інститут педіатрії, акушерства і гінекології НАМН України», к.мед.н.;
Камінський В’ячеслав Володимирович завідувач кафедри акушерства, гінекології та репродуктології Національної медичної академії післядипломної освіти імені П.Л. Шупика, член-кореспондент НАМН України, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Акушерство і гінекологія» (згідно з наказом МОЗ України від 10.12.2012 № 526-к);
Кліменко Сергій Вікторович завідувач відділення медичної генетики Державної установи «Національний центр радіаційної медицини» НАМН України, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Гематологія» (згідно з наказом МОЗ України від 29.05.2014 № 196-к);
Луньова Ганна Геннадіївна завідувач кафедри клінічної лабораторної діагностики Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Клінічна лабораторна діагностика» (згідно з наказом МОЗ України від 10.12.2012 № 526-к);
Мостовенко Раїса Василівна завідувач дитячого інфекційного відділення Національної дитячої спеціалізованої лікарні «ОХМАТДИТ», к.мед.н., головний позаштатний спеціаліст МОЗ України зі спеціальності «Педіатрія» (згідно з наказом МОЗ України від 10.12.2012 № 526-к);
Нетяженко Василь Захарович завідувач кафедри пропедевтики внутрішніх хвороб № 1 Національного медичного університету імені О.О. Богомольця, академік НАМН України, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Терапія» (згідно з наказом МОЗ України від 10.12.2012 № 526-к);
Огородник Артем Олександрович молодший науковий співробітник відділення акушерських проблем екстрагенітальної патології Державної установи «Інститут педіатрії, акушерства і гінекології НАМН України», к.мед.н.;
Погоріла Оксана Іванівна асистент кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика;
Сергієнко Олександр Володимирович асистент кафедри гематології та трансфузіології Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.мед.н.;
Сергієнко Людмила Іванівна доцент кафедри клінічної лабораторної діагностики Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.мед.н.;
Татарчук Тетяна Феофанівна заступник директора з наукової роботи, завідувач відділення ендокринної гінекології Державної установи «Інститут педіатрії, акушерства і гінекології НАМН України», член-кореспондент НАМН України, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Дитяча гінекологія» (згідно з наказом МОЗ України від 10.12.2012 № 526-к);
Харченко Наталія В’ячеславівна завідувач кафедри гастроентерології і дієтології, декан терапевтичного факультету Національної медичної академії післядипломної освіти імені П.Л. Шупика, член-кореспондент НАМН України, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Гастроентерологія» (згідно з наказом МОЗ України від 17.11.2014 № 622-к);
Швець Олег Віталійович доцент кафедри факультетської терапії № 1 Національного медичного університету імені О.О. Богомольця, к.мед.н., доцент, головний позаштатний спеціаліст МОЗ України зі спеціальності «Дієтологія» (згідно з наказом МОЗ України від 10.12.2012 № 526-к);
Шалько Мирослава Назарівна асистент кафедри акушерства, гінекології та репродуктології Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.мед.н.;
Яновська Вікторія Григорівна завідувач Українського референс-центру з клінічної лабораторної діагностики та метрології Національної дитячої спеціалізованої лікарні «ОХМАТДИТ»;
Ященко Юрій Борисович завідувач наукового відділу організації медичної допомоги Державної наукової установи «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами, професор кафедри неонатології Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Педіатрія» (згідно з наказом МОЗ України від 29.05.2014 № 196-к).
Методичний супровід та інформаційне забезпечення
Горох Євгеній Леонідович начальник відділу якості медичної допомоги та інформаційних технологій Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний центр МОЗ України», к.т.н.;
Мельник Євгенія Олександрівна начальник відділу доказової медицини Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України»;
Мігель Олександр Володимирович завідувач сектора економічної оцінки медичних технологій Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний центр МОЗ України»;
Шилкіна Олена Олександрівна начальник відділу методичного забезпечення новітніх технологій у сфері охорони здоров’я Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний цент МОЗ України».
Державний експертний центр МОЗ України є членом Guidelines International Network (Міжнародна мережа настанов) ADAPTE (Франція) (Міжнародний проект з адаптації клінічних настанов)
Рецензенти
Тимченко Анатолій Сергійович директор Державної установи «Інститут гематології та трансфузіології НАМН України», д.мед.н., професор;
Хіміон Людмила Вікторівна завідувач кафедри сімейної медицини Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.мед.н., професор.
Зміст
Список скорочень
Синтез настанови
Стан проблеми
Анотація
Метаболізм заліза: короткий огляд
Причини та наслідки дефіциту заліза
Епідеміологія залізодефіцитної анемії
Діагностика та оцінка тяжкості ЗДА
Ведення пацієнтів із залізодефіцитною анемією
Дієтотерапія
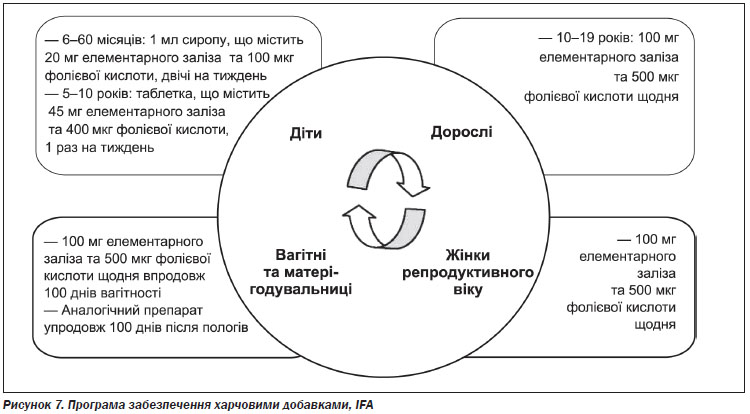
Забезпечення дієтичними добавками впродовж життя
Терапія із застосуванням препаратів для перорального прийому
Терапія із парентеральним введенням препаратів заліза
Переливання еритроцитів
Висновки
Конфлікти інтересів
Інформація про авторів [«Diagnosis and management of iron deficiency anaemia: a clinical update» (2010)]
Бібліографія
Список скорочень
DALY Роки втраченого життя, скоригованого за інвалідністю (непрацездатністю)
ВООЗ Всесвітня організація охорони здоров’я
ЗДА Залізодефіцитна анемія
Синтез настанови
У світі з метою надання якісної та ефективної медичної допомоги в якості джерела даних з доказової медицини використовуються клінічні настанови, на підставі яких розробляються клінічні протоколи та/або медичні стандарти.
Клінічна настанова — документ, що містить систематизовані положення стосовно медичної допомоги при певній нозології чи при певному клінічному питанні. Клінічна настанова розробляється з дотриманням певної методології і має на меті максимально допомогти лікарю та пацієнту в прийнятті рішення в певних клінічних ситуаціях. В основу створення настанови покладено інформацію, що відповідає критеріям доказової медицини.
В Україні створення клінічних настанов здійснюється шляхом адаптації вже існуючих клінічних настанов, які розроблені на засадах доказової медицини та представлені на таких сайтах, як GIN (міжнародний ресурс), SING (Шотландія), NICE (Англія), NZGG (Нова Зеландія), AHRQ (США) тощо.
Настанови, засновані на доказах, використані при розробці уніфікованого клінічного протоколу медичної допомоги пацієнтам із залізодефіцитною анемією, можуть бути застосовані закладами охорони здоров’я, що надають первинну та вторинну медичну допомогу. Інформація, представлена в цих настановах, може бути використана при створенні інших нормативних документів.
У настанові розглянуто групи ризику, алгоритми діагностики й сучасні підходи до лікування залізодефіцитної анемії. Дана настанова має на меті регламентувати порядок діагностики залізодефіцитної анемії та стандартизувати підхід до ведення пацієнтів з даною медичною проблемою.
Інформаційний пошук за темою «Залізодефіцитна анемія» проводився за такими пошуковими словами: «iron-deficiency anemia», «iron-deficiency anaemia», «iron deficiency», «anaemia» та «anemia». Було знайдено наступні документи: Guideline for the laboratory diagnosis of functional iron deficiency (2013); Guidelines for Control of Iron Deficiency Anaemia (2013); Anaemia management in people with chronic kidney disease. CG 114 (2011); Guidelines for the management of iron deficiency anaemia (2011); UK guidelines on the management of iron deficiency in pregnancy (2011); Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and young children (0–3 years of age). American Academy of Pediatrics (2010); Guidelines for the management of iron deficiency anaemia (2010); Knowledge update on screening for Iron deficiency anaemia (2010); Diagnosis and management of iron deficiency anaemia: a clinical update (2010); Iron Deficiency — Investigation and Management (2010); Priorities in the Assessment of Vitamin A and Iron Status in Populations (2010); Iron deficiency anemia: diagnosis and managemen (2010); Worldwide prevalence of anaemia, WHO Vitamin and Mineral Nutrition Information System, 1993–2005 (2008); Worldwide prevalence of anaemia 1993–2005 (2008); Indicators and Methods for Cross-Sectional Surveys of Vitamin and Mineral Status of Populations (2007); Nutritional Anemia. Book (2007); Nutritional anemia. Guidebook (2007); Iron Deficiency Anemia (2007); Assessing of Iron Status in Populations (2007); Guidelines on food fortification with micronutrients (2006); Guidelines for the management of iron deficiency anaemia (2005); Clinical practice guideline on screening, prevention and treatment of iron-deficiency anemia (2005); Iron Deficiency Anemia. Chapter 9. Guidelines for Adolescent Nutrition Services (2005); Focusing on anaemia. Towards an integrated approach for effective anaemia control (2004); Iron Deficiency Anaemia Assessment, Prevention and Control. A guide for programme managers (2001); Guidelines for the Use of Iron Supplements to Prevent and Treat Iron Deficiency Anemia (1998); Preventing Iron Deficiency in Women and Children: Background and Consensus on Key Technical Issues and Resources for Advocacy, Planning and Implementing National Programmes (1998); Recommendations to Prevent and Control Iron Deficiency in the United States (1998); Guidelines for the Use of Iron Supplements to Prevent and Treat Iron Deficiency Anemia (1998); Trace elements in human nutrition and health (1996); Preventing and controlling iron deficiency anaemia through primary health care (1989).
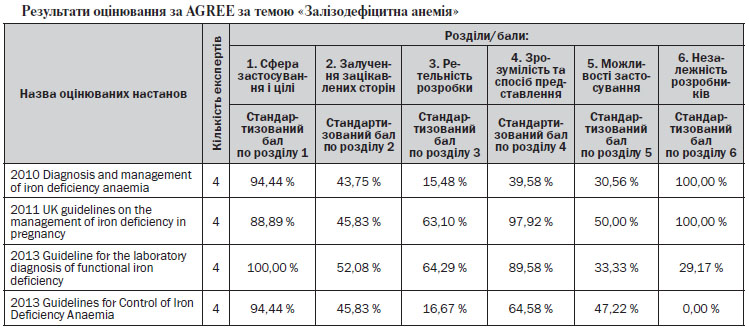
В результаті первинного скринінгу мультидисциплінарною робочою групою було відібрано наступні документи: Guideline for the laboratory diagnosis of functional iron deficiency (2013); Guidelines for Control of Iron Deficiency Anaemia (2013); UK guidelines on the management of iron deficiency in pregnancy (2011); Diagnosis and management of iron deficiency anaemia: a clinical update (2010). У листопаді — грудні 2013 року дані документи були оцінені за AGREE. Результати оцінювання за AGREE наведені в таблиці.
З урахуванням оцінки за AGREE, з огляду на викладення матеріалу, його структуру, сучасність, релевантність темі та інші вимоги наказу МОЗ України від 29.11.2012 № 751 «Про створення та впровадження медико-технологічних документів зі стандартизації медичної допомоги в системі Міністерства охорони здоров’я України», зареєстрованого в Міністерстві юстиції України за № 2001/22313, мультидисциплінарна робоча група відібрала прототип, який ліг в основу адаптованої клінічної настанови, — Diagnosis and management of iron deficiency anaemia: a clinical update (2010) http://www.ncbi.nlm.nih.gov/pubmed/21034387. Також з урахуванням того, що в даному документі висвітлено частину актуальних для системи охорони здоров’я України питань, було прийнято рішення щодо проведення синтезу настанов із включенням фрагментів інших настанов. Додатково було включено фрагменти таких документів:
1. UNICEF «National Iron Plus Initiative Guidelines for Control of IDA» (2013), http://www.pbnrhm.org/docs/iron_plus_guidelines.pdf. Цей документ є національною програмою Індії щодо подолання проблеми залізодефіцитної анемії в країні. Фрагменти цієї програми разом з даними ВООЗ дають уявлення про стан проблеми в світі та показують, в який спосіб долається залізодефіцитна анемія в Індії.
2. WHO Global Database on Anaemia «Worldwide prevalence of anaemia 1993–2005», http://whqlibdoc.who.int/publications/2008/9789241596657 eng.pdf?ua=1. З цього джерела були використані дані з метою висвітлення глобальної статистики щодо поширеності анемії.
3. British society of Gastroenterology «Guidelines for the management of iron deficiency anaemia» (2005), http://www.bsg.org.uk/pdf word docs/iron def.pdf, створена Британською асоціацією гастроентерологів шляхом консенсусу на підставі сучасних на той час доказових даних. Процес розробки настанов даної асоціації відповідає критеріям NICE; асоціація акредитована NICE, про що зазначено на сайті асоціації http://www.bsg.org.uk/clinical/general/guidelines.html.
4. British society of Gastroenterology «Guidelines for the management of iron deficiency anaemia» (2011), створена Британською асоціацією гастроентерологів (зазначена вище) http://www.bsg.org.uk/images/stories/docs/clinical/guidelines/sbn/bsg ida 2011.pdf.
5. British Committee for Standards in Haematology «UK guidelines on the management of iron Deficiency in Pregnancy» (2011) http://www.bcshguidelines.com/documents/UK Guidelines iron deficiency in pregnancy.pdf, створена робочою групою гематологів та акушерів-гематологів Великої Британії. Методологія створення настанови та градація рівнів доведеності даних та сили рекомендацій представлені на сайті Британського комітету зі стандартизації в гематології http://www.bcshguidelines.com.
6. Клінічна настанова лікарні Короля Едуарда (м. Перт, Західна Австралія) http://www.kemh.health.wa.gov.au/development/manuals/OfeG guidelines/sectionb/2/b2.23.pdf в частині акушерства та гінекології розроблена відділенням акушерства та гінекології цієї лікарні. На сайті лікарні Короля Едуарда http://www.kemh.health.wa.gov.au) зазначено, що при розробці настанов співробітники лікарні дотримуються методології. При цьому робоча група бере до уваги сучасні наукові докази, положення найкращої клінічної практики; рішення формується шляхом консенсусу. Проекти настанов перед виданням проходять етап обговорення. В настановах зазначаються дати планового перегляду. Процедура оцінки рівня доказовості первинних рекомендацій на сайті лікарні не оприлюднена; сила рекомендацій не зазначається.
7. WHO. Haemoglobin concentrations for the diagnosis of anaemia and assessment of severity. Vitamin and Mineral Nutrition Information System.
Geneva, World Health Organization, 2011 (WHO/NMH/NHD/MNM/11.1) http://www.who .int/vmnis/indicators/haemo globin.pdf.
Окрім цього, учасники мультидисциплінарної робочої групи користувалися узагальненими даними щодо діагностики та ведення залізодефіцитної анемії (ЗДА), які представлені світовим ресурсом DynaMed (https://dynamed.ebscohost.com).
Стан проблеми
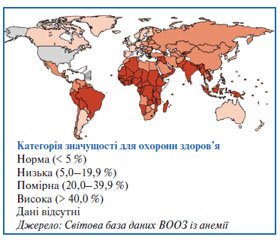
Глобальна база даних ВООЗ є єдиним джерелом оцінки поширеності анемії з можливістю отримати інформацію на рівні країн, регіонів та світу в цілому. В якості індикатору використовується концентрація гемоглобіну в крові, порогові значення норми якого для різних груп населення (дітей, підлітків, дорослих та вагітних жінок) були визначені експертами ВООЗ в Женеві у 1992 році.
Дані щодо поширення анемії збиралися з регіонів для всіх груп населення з 1993 по 2005 роки. Ці дані були отримані від дітей дошкільного віку (76,1 %), вагітних (69 %) та невагітних жінок (73,5 %). Охоплення інших груп населення значно нижче: 33 % дітей шкільного віку, 40,2 % чоловіків и 39,1 % людей похилого віку. В цілому охоплення населення становило близько 48,8 %.
Поширеність анемії серед населення Землі становить близько 24,8 %. В абсолютних цифрах це близько 1 620 000 000 людей, які страждають від анемії.
У дітей дошкільного віку, поширеність анемії становить 47,4 % (293 000 000 дітей у всьому світі). Найбільш поширена анемія в Африці (67,6 %) та Південно-Східній Азії (65,5 %). В східній частині Середземномор’я поширеність становить 46 %, в інших регіонах ВООЗ близько 20 % (Північна та Південна Америка, Європа та Західна частина Тихого океану).
Серед вагітних жінок поширеність трохи менша; однак поширення анемії в регіонах має таку ж тенденцію, яка відмічається серед дітей дошкільного віку. Найбільша поширеність в Африці (57,1 %) та Південно-Східній Азіі (48,2 %), потім у Східному Середземномор’ї (44,2 %), Західній частині Тихого океану (30,7 %), в регіонах Європи та Південної Америки 25 % та 24,1 % відповідно. У цілому 56 400 000 вагітних жінок страждають від анемії (поширеність в світі 41,8 %).
Серед невагітних жінок поширеність анемії трохи менша, ніж у вагітних. У цілому це близько 468 400 000 невагітних жінок, які страждають від анемії (поширеність в світі 30,2 %). Найбільш поширена в Африці (47,5 %) та Південно-Східній Азії (35,7 %). В регіоні Східного Середземномор’я поширеність анемії становить 32,4 %, у Західній частині Тихого океану — 20,5 %, в Європейському регіоні — 19 % та 17,8 % у Північній та Південній Америці.
Окрім того, глобальна поширеність анемії серед дітей шкільного віку становить 25,4 %, серед чоловіків — 12,7 %, а серед людей літнього віку — 23,9 %.
«Diagnosis and management of iron deficiency anaemia: a clinical update» (2010)
Анотація
— Залізодефіцитна анемія (ЗДА) і дотепер широко поширена в Австралії та світі, особливо в групах високого ризику.
— В більшості випадків можна ефективно діагностувати ЗДА шляхом проведення загального аналізу крові та визначення рівня феритину в сироватці крові. Вміст заліза в сироватці крові не є діагностичним критерієм дефіциту заліза.
— Хоча дефіцит заліза може бути обумовленим фізіологічними потребами організму дітей та підлітків в період росту та жінок в період вагітності, слід шукати його причину(-и).
— За відсутності фізіологічних причин дефіциту заліза (особливо у чоловіків та жінок в період постменопаузи) слід проводити обстеження пацієнта (гастроскопія/колоноскопія) для виключення наявності джерела кровотечі в шлунково-кишковому тракті, зокрема, обумовленого злоякісною пухлиною.
— Слід проводити обстеження пацієнтів із ЗДА для виявлення целіакії.
— Для більшості пацієнтів ефективною терапією першої лінії є прийом пероральних препаратів заліза з відповідною дозою та відповідною тривалістю.
— Для окремих категорій пацієнтів, яким показана терапія із внутрішньовенним введенням заліза, сучасні препарати можуть безпечно вводитись в спеціалізованих амбулаторних центрах. Така терапія є відносно недорогою.
— Переливання еритроцитів є неприйнятною терапією у випадку ЗДА, за винятком потреби в негайному збільшенні постачання кисню, як, наприклад, при функціональній недостатності органу-мішені (при стенокардії або серцевій недостатності) або при ЗДА, ускладненій серйозною, гострою кровотечею, яку не вдається припинити.
— Необхідні узгоджені методи застосування препаратів заліза для внутрішньовенного введення для удосконалення використання таких препаратів в Австралії та зменшення кількості зайвих переливань крові.
— Продукти нового покоління (IV) для внутрішньовенного введення, застосування яких ґрунтується на високоякісних доказах безпеки та ефективності, сприятимуть швидкому введенню заліза більшою дозою та включенню внутрішньовенного введення препаратів заліза в стандартну практику надання медичної допомоги.
Діагностика для лікування ЗДА залишається складним завданням. Ця патологія становить істотну проблему для системи охорони здоров’я Австралії. Відповідно до оцінки Всесвітньої організації охорони здоров’я (ВООЗ), від анемії, головною причиною якої є ЗДА, в Австралії страждає 8 % дітей дошкільного віку, 12 % жінок в період вагітності та 15 % жінок дітородного віку.
Метаболізм заліза: короткий огляд
Більшість заліза в організмі (тобто 2,6 г з 3–4 г) транспортується в складі гемоглобіну та зазнає повторної утилізації, коли еритроцити старіють. Один грам заліза депонується в печінці та 0,47 — в міоглобіні та цитохромах. Невелика кількість (3 мг) транспортується в плазмі крові в зв’язаній із трансферином формі. З організму чоловіків та жінок (не в період менструації) виводиться приблизно 1 мг заліза на добу; організм жінок в період менструації додатково втрачає в середньому ще 1 мг заліза на добу. В організмі доношеної дитини міститься 180 мг заліза, і маса еритроцитів повинна подвоїтись протягом 12 місяців життя (у дітей, народжених із низькою масою тіла, кількість еритроцитів повинна збільшитись більше ніж вдвічі). Потреба швидко зростає в підлітковому віці, коли збільшується об’єм крові та суха маса тіла, що у дівчат ускладнюється початком менструації, а у жінок в період вагітності — збільшенням маси еритроцитів в організмі матері та процесом еритропоезу плода.
Залізо з продуктів харчування надходить до організму в гемовій (продукти тваринного походження) та негемовій (зернові та овочі) формі. Залізо в гемовій формі (депоноване в гемоглобіні та міоглобіні) абсорбується краще, ніж залізо в негемовій формі. Залізо в негемовій формі абсорбується клітинами з просвіту кишечника за участю специфічних транспортерів (транспортери двовалентних металів розташовані на апікальних мембранах ентероцитів кишечника) та потрапляє в циркулюючу кров, де зв’язується із трансферином. Рецептори трансферину еритробластів поглинають комплекси залізо-трансферин; внаслідок процесу ендоцитозу залізо включається в склад гемоглобіну. Хоча специфічний механізм абсорбції заліза в гемовій формі залишається остаточно не з’ясованим, були ідентифіковані імовірні його транспортери1.
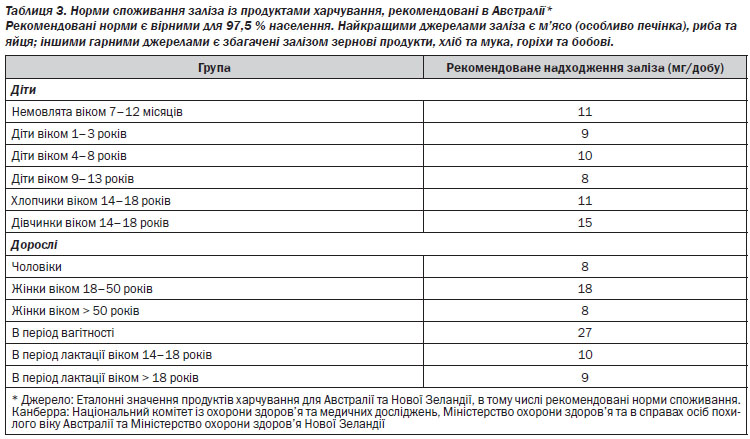
Абсорбція заліза активується в умовах дефіциту заліза та зростання еритропоезу, а знижується при запальних процесах та в умовах перевантаження залізом, що опосередковано нещодавно виявленим регулятором гомеостазу заліза, гепсидином, який блокує вивільнення заліза із ентероцитів та макрофагів2. Запаси заліза в організмі регулюються шляхом абсорбції заліза. Залізо в негемовій формі найкраще абсорбується у формі двовалентного заліза (Fe2). Утворення тривалентного заліза (Fe3) відбувається під впливом кислот шлунка, аскорбінової кислоти, що надходить із продуктами харчування, його абсорбції сприяють редуктази в просвіті кишечника. Абсорбція заліза в негемовій формі пригнічується при одночасному надходженні фітатів (містяться в зернових продуктах та бобових), таніну (міститься в чаї) та кальцію. Одночасне споживання продуктів, що є джерелом заліза в негемовій формі, із аскорбіновою кислотою сприяє абсорбції. При споживанні стандартного західного раціону абсорбується менше 20 % доступного заліза, при споживанні вегетаріанського раціону ця кількість є ще меншою. Рекомендовані норми добового надходження заліза на різних етапах життя наведені в таблиці 3.
Причини та наслідки дефіциту заліза
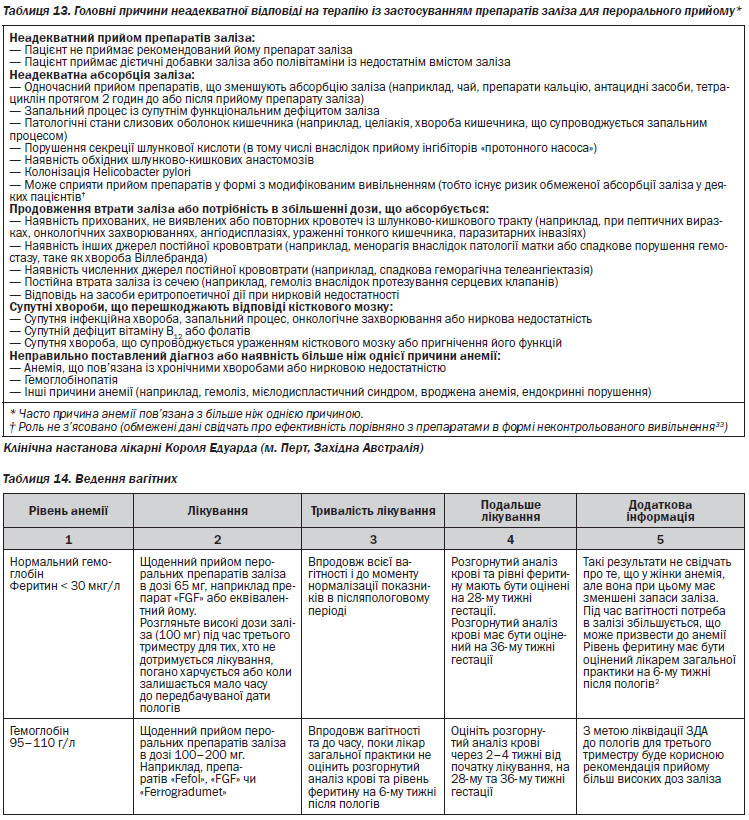
Дефіцит заліза виникає у випадках надмірної втрати заліза або коли потреба в ньому перевищує абсорбцію; часто дефіцит заліза обумовлений багатьма причинами. Він часто спостерігається у дітей в період інтенсивного росту та збільшення кількості клітин еритроїдного ряду, особливо в недоношених та дітей, народжених із низькою масою тіла, в перші роки життя, дошкільному віці та в підлітків. Вагітність обумовлює додаткову потребу в залізі, приблизно 1000 мг за весь період вагітності3. При грудному вигодовуванні із організму виводиться 1 мг заліза на добу, але загальна втрата може зменшуватись у випадку наявності індукованої лактацією аменореї. Крововтрата є найчастішою причиною дефіциту заліза у дорослих. Втрата кожного мілілітра крові (при рівні гемоглобіну 150 г/л) призводить до втрати приблизно 0,5 мг заліза. Кровотечі з шлунково-кишкового тракту є найчастішою причиною у жінок в період постменопаузи та чоловіків. У жінок дітородного віку втрата крові під час менструації часто викликає ЗДА, у них часто виявляють і ураження шлунково-кишкового тракту. Порушення абсорбції заліза можуть бути викликані патологією слизової оболонки кишечника (найчастіше целіакією), порушенням секреції шлункової кислоти (в тому числі внаслідок прийому інгібіторів «протонного насоса»), а також накладенням обхідних шлунково-кишкових анастомозів. Колонізація Helicobacter pylori також часто асоціюється із ЗДА, сприяє погіршенню захоплення заліза та збільшенню його втрати4. Анемія у спортсменів, які займаються видами спорту, що потребують витривалості («анемія спортсменів»), асоціюється із дефіцитом заліза (викликаним зменшеним споживанням заліза, порушенням абсорбції внаслідок підвищеного рівня гепсидину, шлунково-кишковими кровотечами та інтенсивним потовиділенням), а також із механічним гемолізом та гемодилюцією5.
ЗДА асоціюється із порушенням когнітивного розвитку дітей дошкільного віку, із зниженням продуктивності праці, когнітивними та поведінковими розладами у дорослих6, 7. ЗДА у жінок під час вагітності асоціюється із підвищеним ризиком народження дитини із низькою масою тіла, народження недоношеної дитини та підвищеною схильністю до захворювань матері8. Дефіцит заліза в неанемізованих тканинах може бути причиною патологій як у дорослих9, так і у дітей6. Нещодавнє рандомізоване дослідження показало, що внутрішньовенне введення карбоксимальтози заліза пацієнтам із хронічною серцевою недостатністю та дефіцитом заліза (з анемією або без неї) забезпечує зниження інтенсивності симптомів, покращення функціональних можливостей та якості життя незалежно від рівня гемоглобіну10.
British Committee for Standards in Haematology «UK guidelines on the management of iron deficiency in Pregnancy» (2011)
Клінічні наслідки дефіциту заліза
Навіть на ранніх стадіях залізодефіцитного еритропоезу зустрічається порушення функції тканинних ферментів. Описаний значний вплив залізодефіцитної анемії на материнську захворюваність і смертність, розвиток плода та новонародженого, результати вагітності.
Материнська захворюваність та смертність
Дефіцит заліза може впливати на материнську захворюваність за рахунок впливу на імунну функцію, тим самим збільшуючи сприйнятливість до тяжких інфекцій або впливаючи на тяжкість перебігу (Eliz et al., 2005); знижуючи працездатність і продуктивність (Haas et al., 2001), порушуючи післяпологовий когнітивний і емоційний стан (Beard et al., 2005). Існує мало інформації щодо порогового значення гемоглобіну, нижче від якого збільшується смертність, хоча це може бути більше ніж 89 г/л, що було асоційовано з подвоєнням ризику материнської смертності у Великій Британії в дослідженні в 1958 року (Brabin et al., 2001). Однак тяжка анемія, швидше за все, має декілька причин. Нез’ясованим залишається питання впливу безпосередньо анемії.
Вплив на плід та новонароджених
Плід відносно захищений від впливу дефіциту заліза завдяки позитивній регуляції білкового транспорту заліза плацентою (Gambling et al., 2001); дані свідчать про те, що материнський дефіцит заліза за допомогою різних механізмів підвищує ризик дефіциту заліза впродовж перших 3 місяців життя (Puolakka et al., 1980, Colomer et al., 1990). У дітей із залізодефіцитною анемією добре описано порушення психомоторного та/або психічного розвитку; також може зустрічатися негативний вплив на малюків та повсякденну соціальну поведінку (Перес et al., 2005); асоційовано із розвитком хвороб у дорослому віці, хоча це є спірним питанням (Beard et al., 2008; Insel et al., 2008).
Вплив на результати вагітності
Існують деякі дані щодо зв’язку між дефіцитом заліза у матері і передчасними пологами (Scholl et al., 1994), низькою масою тіла при народженні (Cogswell et al., 2003), можливо, відшаруванням плаценти і збільшенням перинатальної крововтрати (Arnold et al., 2009). Однак подальші наукові дослідження щодо впливу дефіциту заліза незалежно від супутніх факторів необхідні для встановлення чіткого причино-наслідкового зв’язку з вагітністю та результатами для плода.
UNICEF «National Iron Plus Initiative Guidelines for Control of IDA» (2013)
Що таке анемія?
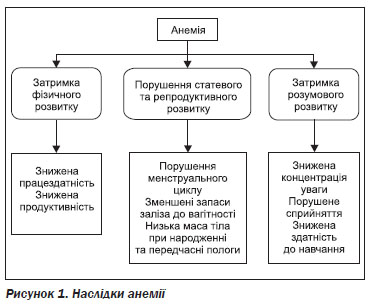
Анемія — це стан, при якому кількість еритроцитів і, як наслідок, обсяги кисню, який вони переносять, недостатні для задоволення фізіологічної потреби організму. Функція еритроцитів полягає в транспортуванні кисню від легенів до тканин і вуглекислого газу від тканин до легень. Це досягається за допомогою гемоглобіну, білка з четвертинною структурою, що складається із гема і глобіну. Анемія знижує здатність організму до газообміну через зменшення кількості еритроцитів, що транспортують кисень і вуглекислий газ. Анемія є наслідком одного або декількох наступних процесів: синтезу дефектних еритроцитів, збільшеного руйнування еритроцитів або крововтрати. Залізо необхідне для синтезу гемоглобіну. Дефіцит заліза вважається найбільш поширеною причиною анемії в світі. Окрім того, інші причини, які можуть впливають на синтез гемоглобіну чи еритроцитів або на тривалість життя еритроцитів, можуть викликати анемію. До них належать: дефіцит інших компонентів продуктів харчування (у тому числі фолієвої кислоти, вітаміну В12 і вітаміну А), гострі та хронічні запальні процеси, паразитарні інфекції, спадкові або набуті порушення. ЗДА проявляється затримкою розумового та моторного розвитку дітей та зниженням працездатності у дорослих (рис. 1). Тяжкі наслідки ЗДА притаманні дітям перших років життя. Під час вагітності ЗДА може бути причиною перинатальної смерті, недоношеності та низької маси тіла при народженні. ЗДА також негативно впливає на імунні реакції організму.
British Committee for Standards in Haematology «UK guidelines on the management of iron deficiency in Pregnancy» (2011)
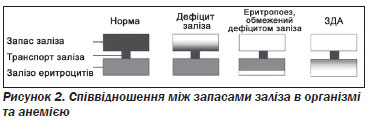
Дефіцит заліза являє собою спектр, починаючи від виснаження запасів заліза до залізодефіцитної анемії. При виснаженні запасів заліза депо заліза (визначається за концентрацією феритину в сироватці крові) зменшується, але кількість циркулюючого та функціонального заліза може бути в нормі. Пацієнти із зниженим рівнем заліза не мають необхідного його запасу в організмі, щоб мобілізувати, якщо організм буде мати потребу в додатковому залізі. При еритропоезі на фоні дефіциту заліза його запаси виснажуються, а в подальшому зменшується рівень транспортного заліза (вимірюється за насиченням трансферину); кількість абсорбованого заліза є недостатньою, щоб компенсувати рівень втрат або забезпечити необхідні потреби для розвитку та функцій. На цій стадії дефіцит заліза обмежує продукцію червоних клітин крові і призводить до збільшення концентрації протопорфірину еритроцитів. При залізодефіцитній анемії — найбільш тяжкій формі дефіциту заліза — відмічається виснаження запасів заліза, зниження рівнів транспортного і функціонального заліза, що призводить до зниження гемоглобіну на додаток до низької концентрації феритину в сироватці крові, низького насичення трансферину і збільшення концентрації протопорфірину еритроцитів.
Анемія визначається як зменшення гемоглобіну менше ніж на 2 стандартних відхилення від середнього значення для відповідної здорової популяції. Однак існують відмінності в тому, що вважається нормальним значенням для вагітних. Всесвітня організація охорони здоров’я (ВООЗ) визначає анемію у вагітних як зниження концентрації гемоглобіну нижче 110 г/л (ВООЗ, 2001), тоді як за даними великих досліджень серед кавказців визначається діапазон 104–135 г/л на початку третього триместру у жінок, які отримують препарати заліза (Мільман та ін., 2007). У зв’язку з відносним розширенням плазми, що особливо відзначається в другому триместрі, здавалося б розумним прийняти в якості референтного значення (для вагітності старше 12 тижнів) рівень в 105 г/л, як це було запропоновано американським Центром з контролю і профілактики захворювань (CDC) (Dowdle, 1989; Ramsey et al., 2000). Однак існує різниця між нормальними рівнями гемоглобіну залежно від раси; оптимальний рівень гемоглобіну може бути нижчим серед африканців, ніж серед європейців (Gam et al., 1981).
Анемія післяпологового періоду визначається ВООЗ як зниження гемоглобіну нижче від 100 г/л.
Рекомендація:
Існує варіації у визначенні нормального рівня гемоглобіну під час вагітності. Рівень > 110 г/л є адекватним для першого триместру і > 105 г/л для другого і третього триместрів (1B).
Анемія післяпологового періоду визначається як Hb < 100 г/л (2B).
Система градації якості доказів і сили рекомендацій в цій настанові базуються на методології Шотландської мережі міжуніверситетських настанов:
WHO. Haemoglobin concentrations for the diagnosis of anaemia and assessment of severity. Vitamin and Mineral Nutrition Information System. Geneva, World Health Organization, 2011 (WHO/NMH/NHD/MNM/11.1)
Точка відсічки для гемоглобіну 110 г/л для вагітних жінок була вперше представлена в доповіді 1968 року разом з результатами п’яти досліджень, згаданих раніше. У здорових, з достатніми запасами заліза жінок концентрації гемоглобіну значно змінюються впродовж вагітності, пристосовуючись до збільшення об’єму материнської крові і потреб плода в залізі (3). Концентрації знижуються впродовж першого триместру і, досягнувши своєї нижчої точки в другому триместрі, знову зростають в третьому триместрі вагітності. В даний час не існує ніяких рекомендацій ВООЗ з використання різних точок відсічки для гемоглобіну залежно від триместру, але визнано, що під час другого триместру вагітності концентрація гемоглобіну зменшується приблизно на 5 г/л.
Коментар робочої групи: робоча група вважає доцільним в практичній діяльності застосовувати наступні критерії для анемії у вагітних: 110 г/л — для першого і третього триместрів вагітності, 105 г/л — для другого триместру вагітності. Це обумовлено фізіологічним зниженням гемоглобіну у вагітної після 12-го тижня вагітності. Але, оскільки пологи передбачають крововтрату, а отже, і втрату заліза, то для третього триместру слід розглядати рівень 110 г/л.
UNICEF «National Iron Plus Initiative Guidelines for Control of IDA» (2013)
Наслідки анемії для здоров’я
Анемія завдає істотного небажаного впливу на здоров’я людини, а також на соціальний та економічний розвиток. Анемія є другою за поширеністю в світі причиною інвалідності, вона щороку віднімає життя у приблизно 1 мільйона людей, з яких три чверті є мешканцями Африки та Південно-східної Азії8. В показниках втрачених років здорового життя ЗДА є причиною 25 мільйонів років втраченого життя, скоригованого за інвалідністю (DALY); що становить 2,4 % від загальної кількості випадків DALY в усьому світі9. Відповідно до оцінок ВООЗ/Світового банку, ЗДА становить третю за частотою причину DALY серед жінок віком 15–44 роки10, 11. Вади фізичного та когнітивного розвитку, обумовлені ЗДА, коштують країнам, що розвиваються, до 4,05 % ВВП на рік, внаслідок чого уповільнюється їх соціальний та економічний розвиток12. Якщо означені дані перевести у відсоток від ВВП, то в Індії ці втрати становлять 1,18 % ВВП. В абсолютному вираженні ці втрати для Південної Азії сягають надзвичайно великих значень: близько 4,2 млрд доларів США на рік в Бангладеш, Індії та Пакистані12.
У маленьких дітей дефіцит заліза виникає внаслідок збільшеної потреби організму в залізі під час швидкого зростання, яка, в перерахунку на кілограм маси тіла, майже в 10 разів перевищує потребу в залізі організму дорослої людини. До того ж раціон немовлят та дітей молодшого віку часто містить недостатньо біологічно доступного заліза, особливо після відлучення від грудного вигодовування. У дітей, що страждають від анемії, уповільнюється психомоторний розвиток та погіршуються функціональні характеристики; до того ж у них спостерігається погіршення координації мовних та моторних навиків, еквівалентні зниженню коефіцієнта розумового розвитку на 5–10 балів13. Хоча уповільнення психомоторного та когнітивного розвитку у окремої дитини може бути незначним і не може розглядатись в якості симптому як такого, зростає кількість свідчень, що виражений дефіцит заліза може викликати істотні порушення центральної нервової системи (ЦНС), навіть при відсутності анемії. Найбільш вразливі до такого порушення діти в період від 9 до 18 місяців життя. Проте найбільша проблема полягає в тому, що результати деяких досліджень свідчать про не-оборотність таких порушень у ряді випадків, навіть при відновленні запасу заліза вже на ранньому етапі дефіциту заліза.
Наслідки анемії для жінок є колосальними, оскільки дана патологія несприятливо впливає не лише на їх працездатність, але й на репродуктивну здатність. У жінок дефіцит заліза спостерігається частіше, ніж у чоловіків, внаслідок втрати заліза під час менструації та задоволення потреби в залізі плода: в період вагітності потреба жінки в залізі зростає вдвічі порівняно із віковою нормою для жінок. Відповідно до проведеної оцінки, близько 20 % від усіх випадків смертей матерів обумовлені анемією; до того ж анемія є частковою причиною 50 % від усіх випадків материнської смертності14.
По-перше, анемія зменшує енергетичні запаси жінки та її працездатність, що, в свою чергу, загрожує безпеці харчування родини та її доходу. По-друге, анемія високого ступеня тяжкості в період вагітності перешкоджає належному постачанню плода киснем, що є причиною порушення нормального внутрішньоутробного розвитку, а в результаті — затримка внутрішньо-утробного розвитку, народження мертвого плода, народження дитини із малою масою тіла та загибель новонароджених. Отже, анемія становить головну причину незадовільного наслідку вагітності та пологів в країнах, що розвиваються, оскільки сприяє передчасним пологам, зростанню смертності в перинатальний період та зростанню ризику смерті в пологах або одразу після пологів.
Етіологія анемії
Порушення харчування та інфекційні хвороби є найбільш частими причинами анемії в країнах, що розвиваються, особливо серед найбільш уразливих верств населення (вагітні жінки та діти дошкільного віку). В зв’язку із цим причини анемії можна поділити на такі, що пов’язані із харчуванням і такі, що не пов’язані із ним. Цим самим підкреслюється важливість причин, пов’язаних із харчуванням, як основного фактора анемії.
Дефіцит заліза
Визначення рівня заліза слід розглядати при діагностиці наступних станів: ЗДА; дефіцит заліза без анемії; рівень запасів заліза в організмі при нормальних показниках заліза; перевантаження організму залізом, що може бути причиною ураження органів через дефіцит заліза, є результатом довготривалого негативного балансу заліза. ЗДА слід розглядати як найгірший варіант прояву дефіциту заліза.
Дефіцит заліза негативно впливає:
— на когнітивні функції, поведінку та фізичний розвиток немовлят, дітей дошкільного та шкільного віку;
— імунний статус та захворюваність на інфекційні хвороби у всіх вікових групах;
— використання джерел енергії м’язами, що, в свою чергу, впливає на працездатність та продуктивність підлітків і дорослих усіх вікових груп.
Найбільша потреба в залізі у вагітних жінок — 1,9 мг/1000 ккал в другому триместрі та 2,7 мг/1000 ккал в третьому триместрі. Трохи меншою є потреба у немовлят (1,0 мг), дівчат підліткового віку (0,8 мг), хлопчиків підліткового віку (0,6 мг), невагітних жінок (0,6 мг), дітей дошкільного та шкільного віку (0,4 мг) та чоловіків (0,3 мг).
Причини дефіциту заліза:
— зменшене надходження;
— збільшене виведення з організму;
— збільшена потреба в залізі.
Потреба в залізі збільшується під час активного росту дитини, особливо від 6 міс. до 3 років. У немовлят дефіцит заліза найчастіше є результатом відсутності виключно грудного вигодовування та вживання молочних продуктів, що містять недостатню кількість заліза. Молочні продукти містять недостатню кількість заліза, а продовження грудного чи штучного вигодовування без додаткового введення продуктів прикорму після 6-місячного віку часто призводить до дефіциту заліза, якщо дитина не отримує препаратів заліза. Потреба в залізі пропорційно збільшується у недоношених дітей та дітей, народжених із малою масою тіла. У дітей старшого віку причиною ЗДА може бути раціон харчування, що включає лише молочні та зернові страви, та особливості (вподобання) харчування.
Втрата крові під час менструацій та збільшена потреба в залізі впродовж вагітності та лактації є причиною зменшення заліза у жінок. За традиціями, індійська домогосподарка їсть після того, як поїли всі чоловіки та діти. До того ж в багатьох індійських сім’ях жінки їдять тільки залишки їжі. Отже, не зважаючи на те, що їжа в сім’ї готується для всіх однаково, жінки більш схильні до розвитку ЗДА.
Дефіцит вітамінів
Вітамін В12 необхідний для синтезу еритроцитів, а його дефіцит призводить до розвитку мегалобластної анемії. Раціон з низьким вмістом або відсутністю тваринних білків у поєднанні з порушенням абсорбції, обумовленим паразитарними інвазіями тонкого кишечника, є причиною дефіциту вітаміну В12 та анемії.
Не менш важливою для утворення та визрівання еритроцитів є фолієва кислота. Вона необхідна також і для росту та відновлення клітин. Дефіцит фолатів знижує швидкість синтезу ДНК, наслідком чого є погіршення проліферації клітин, їх загибель в кістковому мозку через аномалії будови. Результатом цього є вкорочений життєвий цикл еритроцитів і розвиток анемії.
Глистяні інвазії
Такі гельмінти, як анкілостоми і трематоди, спричинюють хронічну втрату крові. Через це втрачається залізо й розвивається анемія. Наявність в кишечнику 40–160 анкілостом (залежно від вмісту заліза в організмі господаря) стає причиною ЗДА.
Малярія
Малярія, особливо спричинена збудниками Plasmodium falciparum або Plasmodium vivax, викликає анемію за рахунок руйнування еритроцитів та пригнічення продукції еритроцитів. Знижена продукція еритроцитів є результатом гіпоплазії кісткового мозку внаслідок гострої інфекції. Інвазія Plasmodium falciparum є головною причиною тяжкої малярії в регіонах, де вона є ендемічною хворобою. Анемія, пов’язана із малярією, обумовлює хворобливість та летальність, особливо серед дітей і вагітних жінок, інфікованих Plasmodium falciparum. Малярія в період вагітності підвищує ризик розвитку анемії в матерів, мертвонародженості, спонтанних абортів, народження дітей із малою масою тіла або загибелі новонароджених.
Серпоподібноклітинна анемія та таласемія
Серпоподібноклітинна анемія — спадкове порушення структури гемоглобіну. Вона є однією з найбільш поширених генетичних хвороб у світі та призводить до рецидивуючої гемолітичної анемії. Таласемія є однією з основних причин гемоглобінопатій в світі. Вона пов’язана із зниженням або майже відсутністю одного з ланцюгів глобіну в структурі гемоглобіну. Близько 10 % пацієнтів з таласемією проживають в Індійському субконтиненті, а 3,4 % є носіями генів таласемії. Щорічно в Індії народжується близько 34 400 немовлят з гемоглобінопатіями1.
Інфекції та хронічні запальні процеси
Деякі хронічні хвороби, такі як рак, ВІЛ/СНІД, ревматоїдний артрит, хвороба Крона та інші хронічні запальні процеси, можуть перешкоджати синтезу еритроцитів, що призводить до хронічної анемії. Також причиною анеміє може бути ниркова недостатність.
«Diagnosis and management of iron deficiency anaemia: a clinical update» (2010)
Епідеміологія залізодефіцитної анемії
Лише в небагатьох дослідженнях наводиться інформація про поширеність дефіциту заліза або ЗДА серед населення Австралії. За результатами досліджень, проведених в Сіднеї та Аделаїді, наводяться дані про поширеність ЗДА серед малюків: 1–6 % та до 14 % серед груп азійського походження11–13. В інших дослідженнях йдеться про поширеність анемії (різної етіології) серед невагітних молодих жінок, що становить 10 %14, та 11 % у вагітних жінок, які не отримували препаратів заліза. Анемія дуже поширена серед корінного населення; відповідно до проведеного дослідження, анемія визначається у 55 % жінок та 18 % чоловіків Західної Австралії16. За даними США, 11 % чоловіків та 10 % жінок у віці понад 65 років страждають від анемії, 20 % цих випадків пов’язані із дефіцитом заліза17. До інших груп ризику належать донори крові, де поширеність ЗДА серед жінок перевищує 20 %18.
UNICEF «National Iron Plus Initiative Guidelines for Control of IDA» (2013)
Огляд світової проблеми
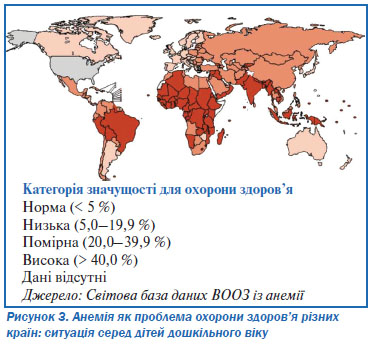
Відповідно до даних щодо анемії (1993–2005 рр.), наведених у всесвітній базі даних ВООЗ, яка охоплює майже половину популяції світу, поширеність анемії в світі становить близько 25 %2. При цьому поширеність анемії в країнах з високим рівнем розвитку становить близько 9 %, в той час як в країнах з низьким рівнем розвитку — близько 43 %3. В абсолютних цифрах: від анемії в світі страждає 1,62 мільярда людей; з них: близько 293 млн дітей дошкільного віку, 56 млн вагітних жінок та 468 млн невагітних жінок.
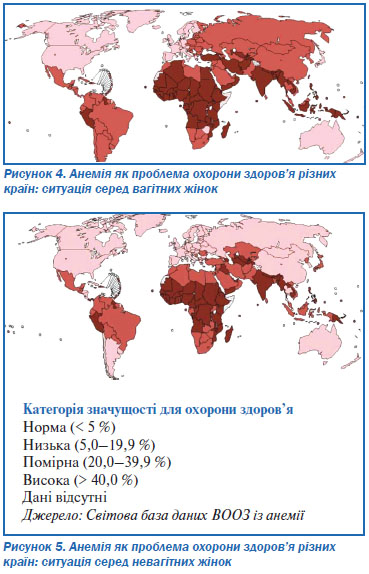
Діти і жінки репродуктивного віку належать до групи найбільшого ризику. Відповідно до існуючих даних у світі анемією уражені 47 % дітей віком до 5 років, 42 % вагітних жінок, а також 30 % невагітних жінок віком 15–49 років3. Понад 85 % проблем абсолютної анемії в Африці та Азії зустрічається серед груп підвищеного ризику. Найбільша кількість постраждалих припадає на Індію (див. табл. 4).
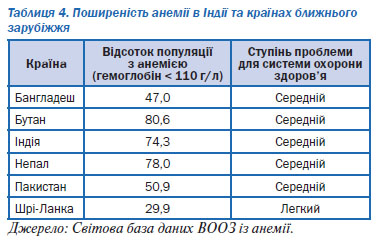
Вважається, що щорічно анемія призводить до 115 000 летальних випадків серед матерів та 591 000 випадків перинатальної смерті дітей4. Аналіз даних про поширеність цієї патології у світі свідчить про її непропорційний розподіл, з найбільшою частотою в групах із низьким соціально-економічним статусом, при цьому анемія у матерів прямо пов’язана із анемією у дітей.
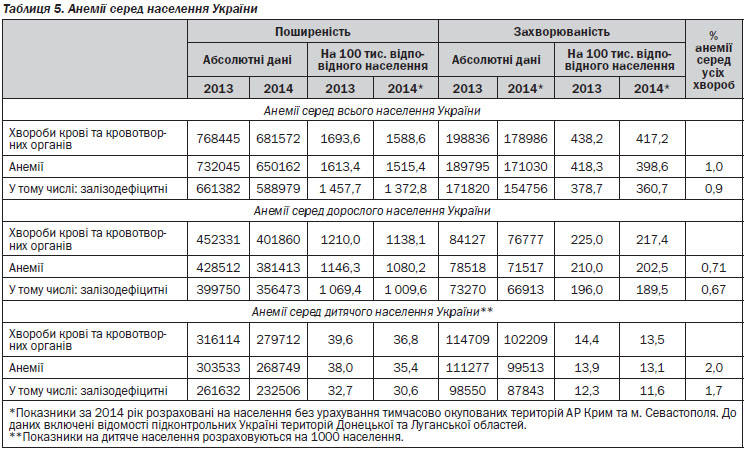
Коментар робочої групи: поширеність анемії в Україні представлена в таблиці 5 (згідно з даними Державного закладу «Центр медичної статистики Міністерства охорони здоров’я України»).
«Diagnosis and management of iron deficiency anaemia: a clinical update» (2010)
Діагностика та оцінка тяжкості ЗДА
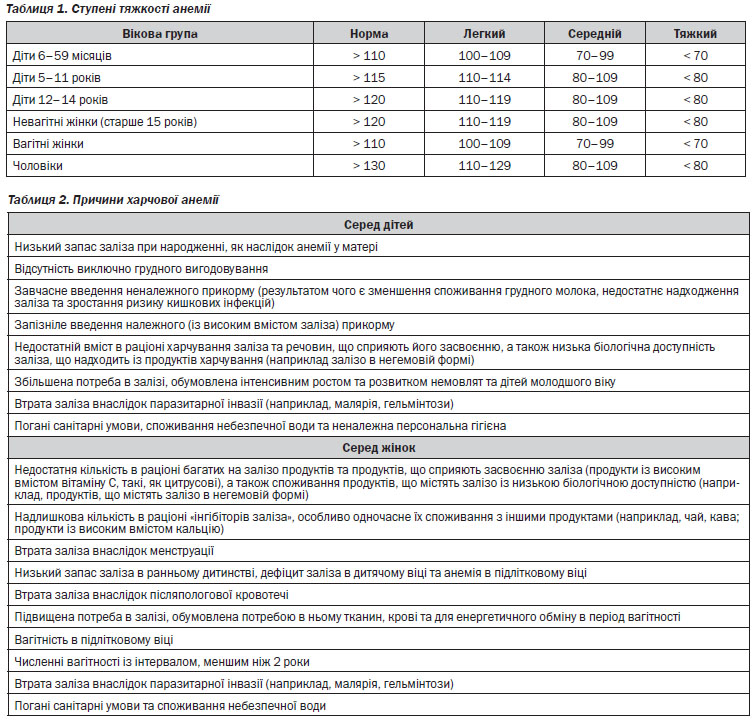
Анемія визначається, як концентрація гемоглобіну нижче референтного діапазону норми (із урахуванням віку, статі та наявності вагітності) лабораторії, якою здійснюється аналіз. Відповідно до визначення ВООЗ, про анемію свідчить концентрація гемоглобіну на рівні, нижчому ніж 130 г/л у чоловіків, 120 г/л у жінок та 110 г/л у вагітних жінок і дітей дошкільного віку19.
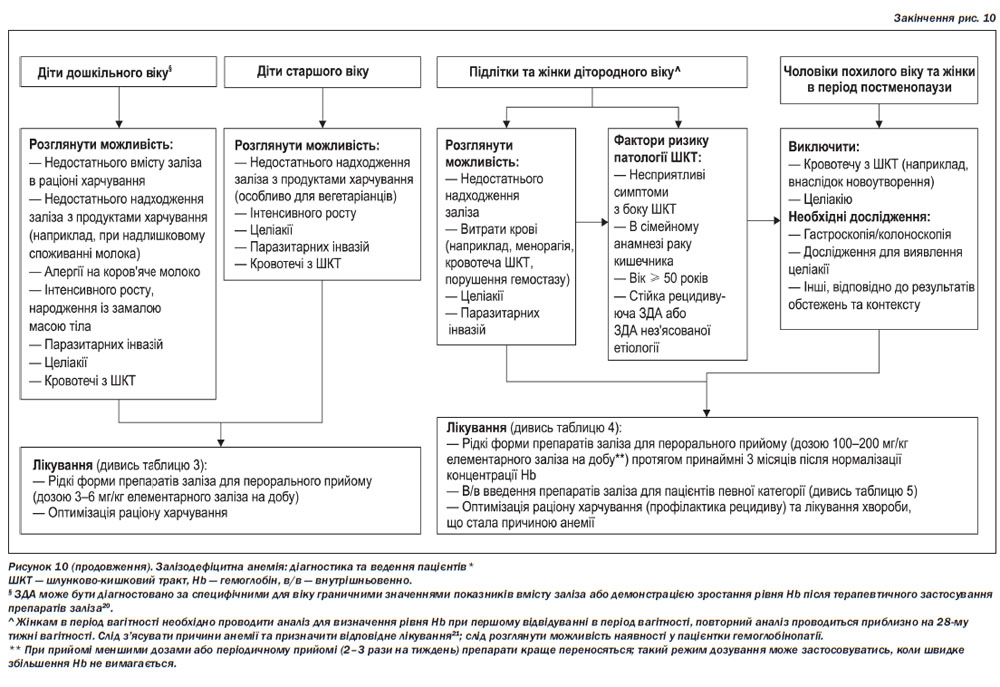
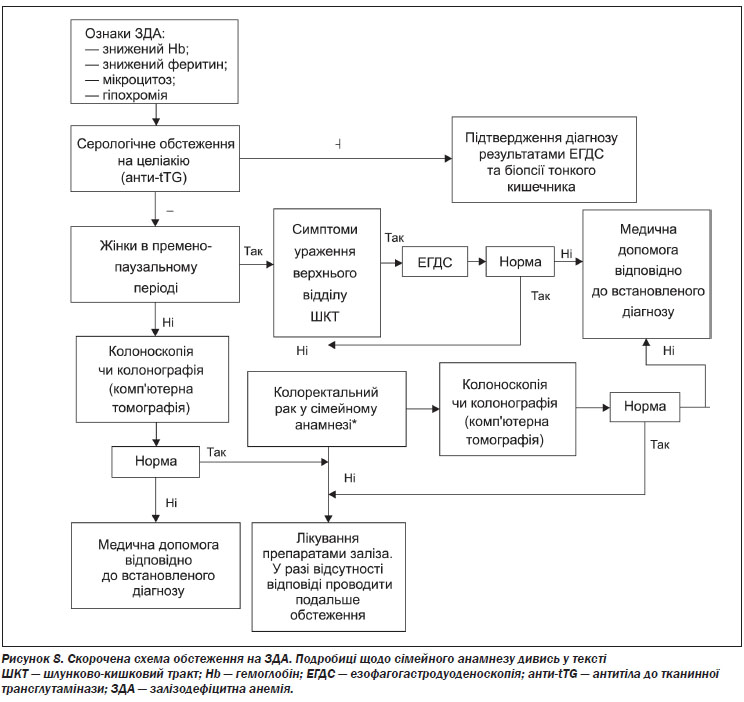
ЗДА слід відрізняти від анемій іншої етіології, оскільки перша асоціюється із порушеннями, для виявлення яких необхідні спеціальні дослідження; лікування ЗДА є простим, безпечним та ефективним. Анемія, для якої характерне зниженя середнього клітинного об’єму еритроцитів або зниження середнього вмісту гемоглобіну в клітині, імовірно, обумовлена дефіцитом заліза; дуже важливою є диференційна діагностика для виявлення порушень, обумовлених таласемією, наявність якої повинна бути виключена належними клінічними методами. Стратегію діагностики та лікування ЗДА наведено на рис. 10.
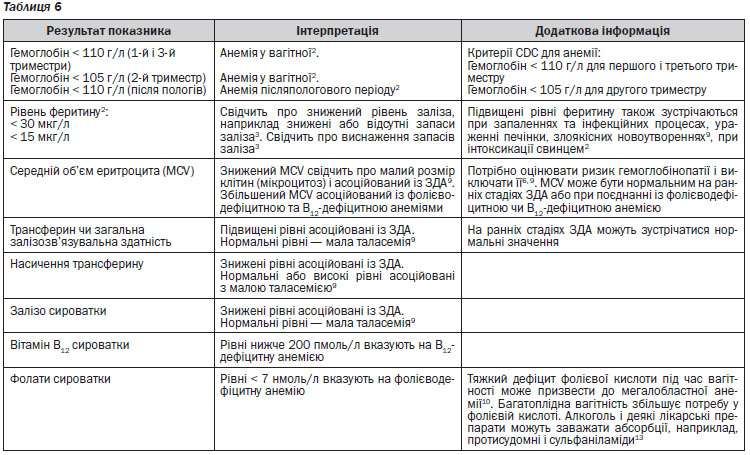
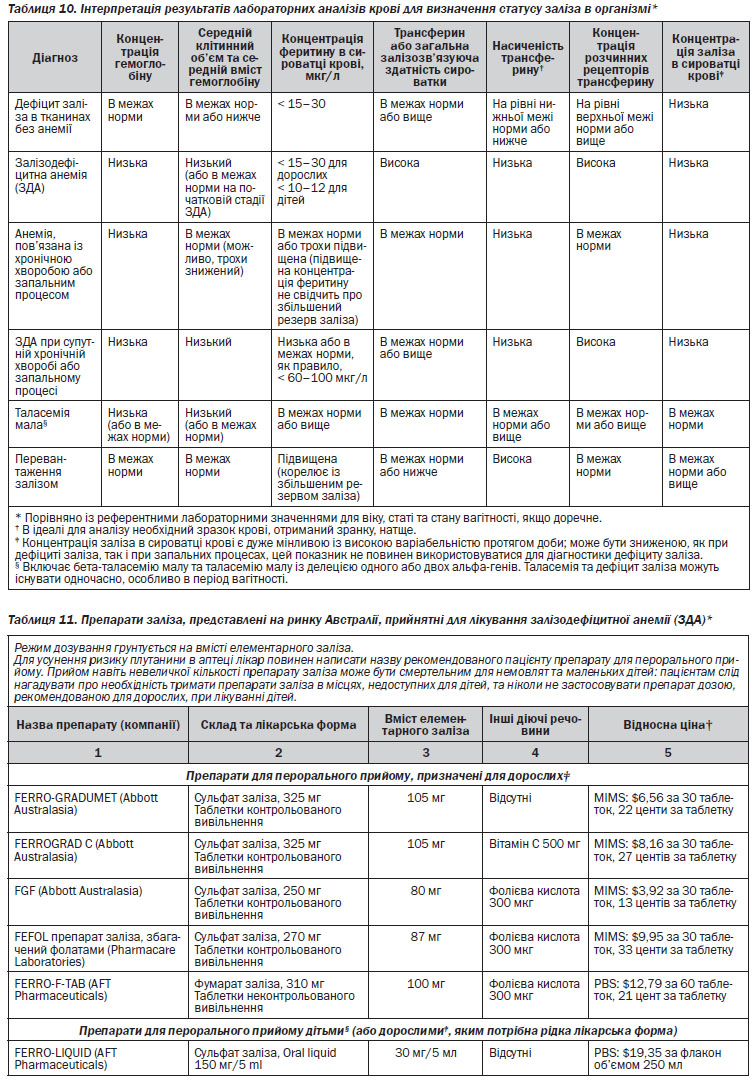
У випадку підозри на дефіцит заліза у пацієнта слід проводити визначення статусу заліза в організмі та співвідносити отримані результати з відповідними показниками рівня еритроцитів. В таблиці 10 наведено рекомендації з інтерпретації результатів лабораторних аналізів для визначення статусу заліза в організмі. Рівень феритину в сироватці крові є найбільш доступним для визначення та корисним показником дефіциту заліза22. У дорослого із анемією вміст феритину на рівні, нижчому ніж 15 г/л, є діагностичним критерієм дефіциту заліза, а на рівні 15–30 г/л дає підстави підозрювати наявність такого порушення. Для дітей застосовуються нижчі (від 10 до 12 г/л) порогові значення19, 20. Втім, феритин є також і білком, вміст якого зростає при гострофазових реакціях, тобто при запальних та інфекційних хворобах, хворобах печінки та злоякісних новоутвореннях. Внаслідок цього можливе хибне трактування підвищеного вмісту феритину у пацієнтів із дефіцитом заліза за наявності таких станів. У осіб похилого віку та пацієнтів із запальними процесами дефіцит заліза можливий при рівні феритину 60–100 г/л23, 24. Визначення таких маркерів, як вміст С-реактивного білка, допомагає ідентифікувати наявність запального процесу. Рівень заліза в сироватці крові істотно варіює протягом доби, знижується як при дефіциті заліза, так і при запальних процесах; означений показник не слід застосовувати для діагностики дефіциту заліза.
Функціональний дефіцит заліза діагностують у випадках, коли всупереч наявності адекватного резерву в організмі залізо не може бути мобілізоване для еритропоезу, що опосередковано підвищеним рівнем гепсидину. Таке порушення часто спостерігається у пацієнтів із хворобою нирок в термінальній стадії, у яких відповідь на засоби еритропоетичної дії може бути оптимізована при вмісті феритину понад 200 г/мл25. Функціональний дефіцит заліза може сприяти розвитку анемії в пацієнтів із запальними процесами, такими як ревматоїдний артрит. Показники відсоткового вмісту гіпохромних еритроцитів та вмісту гемоглобіну в ретикулоцитах (визначення забезпечується деякими автоматизованими гемоаналізаторами) використовуються для оцінки статусу заліза в організмі пацієнтів, які отримують засоби еритропоетичної дії, та є корисними індикаторами функціонального дефіциту заліза26, 27.
Додатковим показником вмісту заліза є концентрація розчинних рецепторів трансферину, яка зростає при дефіциті заліза в тканинах, проте означений показник не чутливий до запалення; значення співвідношення (концентрація розчинних рецепторів трансферину)/log та феритину корелює із резервом заліза в організмі28. Однак можливості визначення вмісту концентрації розчинних рецепторів трансферину обмежені варіабельністю граничних значень при проведенні аналізу різними методами та дуже низькими обсягами проведення досліджень в деяких лабораторіях. Дослідження кісткового мозку залишається золотим стандартом визначення ЗДА в складних випадках, хоча його проведення, як правило, намагаються уникнути. Не виключено, що для оцінки статусу заліза в організмі буде корисним визначення рівня гепсидину. Якщо діагноз залишається не з’ясованим, лікарям слід звертатись за консультацією до гістологів або інших спеціалістів.
Коментар робочої групи: в західній медичній літературі десятковий логарифм позначається як log.
British Committee for Standards in Haematology «UK guidelines on the management of iron deficiency in Pregnancy» (2011)
Діагностика ЗДА
Клінічні симптоми та ознаки
Клінічні симптоми та ознаки залізодефіцитної анемії у вагітних, як правило, неспецифічні, якщо анемія не тяжка. Втома є найбільш поширеним симптомом. Пацієнти можуть скаржитися на блідість, слабкість, головний біль, серцебиття, запаморочення, задишку і дратівливість. Рідко відмічається спотворений апетит, що проявляється потягом до споживання неїстівного, такого як лід і земля. Залізодефіцитна анемія також може погіршувати регуляцію температури, і через це вагітні жінки можуть мати температуру нижчу, ніж зазвичай.
Запаси заліза виснажуються перед зниженням гемоглобіну. Оскільки залізо є важливим елементом у всіх клітинах, то симптоми дефіциту заліза можуть проявлятися навіть без анемії. Вони включають: втому, дратівливість, знижену концентрацію і випадіння волосся.
Лабораторна діагностика
Розгорнутий аналіз крові, мазок крові та еритроцитарні індекси
Під час вагітності зазвичай проводиться розгорнутий аналіз крові. Він може показати низький рівень гемоглобіну, середній об’єм еритроциту (MCV), середній вміст гемоглобіну в еритроциті (MCH) та середню концентрацію гемоглобіну в об’ємі еритроцитів (МСНС). Мазок крові може підтвердити наявність мікроцитарних гіпохромних еритроцитів і характерними видовженими клітинами. Тим не менше, мікроцитарні, гіпохромні індекси також можуть зустрічатися при гемоглобінопатії. Окрім того, для більш легких випадків дефіциту заліза, MCV, можливо, не нижче нормальних значень.
Деякі аналізатори обчислюють відсоток гіпохромних червоних клітин. Це, як кажуть, чутливий маркер функціонального дефіциту заліза, але це доступно не для всіх аналізаторів. Існує мало даних про використання цього показника у вагітних.
Ці тести оцінюють запаси заліза або адекватність забезпечення залізом тканин.
Феритин сироватки
Феритин сироватки є стабільним глікопротеїном, який точно відображає запаси заліза за відсутності запального процесу. Це лабораторний тест, що в першу чергу стає ненормальним, коли запаси заліза зменшуються; на нього не впливає недавній прийому заліза. Цей тест, як правило, вважається кращим тестом для оцінки залізодефіцитної анемії під час вагітності. Феритин є реагентом гострої фази, тому його рівні будуть зростати при активному інфекційному процесі або запаленні.
Під час вагітності у жінок з адекватними запасами заліза на час зачаття концентрація феритину в сироватці крові спочатку зростає, а потім поступово зменшується (32-й тиждень) до 50 % від вихідного рівня (до вагітності). Це пов’язано із гемодилюцією і мобілізацією заліза. Рівень поступово збільшується в третьому триместрі (Asif et al., 2007). Навіть якщо рівень феритину може залежати від розведеної плазми на пізніх термінах вагітності, концентрація нижче 15 мкг/л вказує на виснаження заліза під час всіх стадій вагітності. У жінок репродуктивного віку рівень < 15 мкг/л показав специфічність 98 % і чутливість 75 % для дефіциту заліза, який визначався за рівнем заліза непофарбованого кісткового мозку (Hallberg et al., 1993). Існує безліч рівнів для лікування, що вказані в різних дослідженнях, але в цілому лікування слід розглядати, коли рівень феритину в сироватці крові опускається нижче 30 мкг/л, що вказує на раннє виснаження запасів заліза, яке буде посилюватися, якщо не лікувати. Van den Broek та ін. виявили, що феритин сироватки крові — єдиний кращий індикатор запасів заліза за умови використання точки відсічки в 30 мг/л, з чутливістю 90 % і специфічністю 85 % (van den Broek et al., 1998). Одночасно визначення С-реактивного (якщо є потреба) білка може бути корисним в інтерпретації більш високих рівнів. Концентрація С-реактивного білка, здається, є незалежною від вагітності і гестаційного віку, хоча деякі дослідження описують помірне збільшення.
Залізо сироватки та загальна залізозв’язувальна здатність
Залізо сироватки і загальна залізозв’язувальна здатність є ненадійними показниками наявності заліза в тканинах через широке коливання рівнів, що пов’язане із нещодавнім прийомом заліза, добовим ритмом та іншими факторами, такими як інфекції. Рівні насичення трансферину коливаються через добові коливання заліза сироватки і залежать від стану харчування (Adams et al., 2007). Це може призводити до відсутності чутливості і специфічності.
Цинк-протопорфірин
Цинк-протопорфірин збільшується, коли зменшується доступність заліза, при цьому цинк замість заліза включається в кільця протопорфірину. Це дає уявлення про наявність заліза в тканині. Цинк-протопорфірин сироватки має перевагу в тому, що не залежить від дилюції плазми; рівні збільшуються в третьому триместрі вагітності. Він залежить від запального та інфекційного процесів, хоча меншою мірою, ніж феритин сироватки. Цинк-протопорфірин червоних клітин крові має велику чутливість та специфічність для виснаження запасів заліза (Schifman та ін., 1989); рідко використовується.
Розчинні рецептори трансферину (sTfR)
В публікаціях повідомляється, що визначення розчинних рецепторів трансферину є чутливим показником забезпечення тканин залізом; цей показник не є реагентом гострої фази (Choi et al., 2000). Рецептор трансферину — трансмембранний білок, який транспортує залізо в клітину. Циркулюючі концентрації розчинних рецепторів трансферину пропорційні клітинній експресії мембранозв’язаних рецепторів трансферину і, отже, дає точну оцінку дефіциту заліза. Існують невеликі відмінності на ранніх стадіях виснаження запасів заліза, але як тільки дефіцит заліза встановлено, концентрація розчинних рецепторів трансферину зростає прямо пропорційно до загальної концентрації рецептора трансферину. Тим не менше, цей тест дорогий, що обмежує його загальнодоступність. Існує мало даних про його використання під час вагітності.
Гемоглобін ретикулоцитів та ретикулоцити
Дефіцит заліза спричиняє зниження числа ретикулоцитів і концентрації гемоглобіну ретикулоцитів. Використання автоматизованої техніки проточної цитометрії дозволяє надзвичайно рано вимірювати параметри ретикулоцитів. Це дозволяє зібрати об’єктивну інформацію щодо еритропоетичної активності при анемії. Це тест не широко доступний; немає ніяких даних щодо його застосування під час вагітності.
Залізо кісткового мозку
Пофарбовані зразки кісткового мозку (для визначення заліза) вважаються золотим стандартом для оцінки запасів заліза. Однак цей тест явно занадто інвазивний і не практичний для загалу, окрім найскладніших випадків під час вагітності, де основна причина(-и) анемії не можуть бути ідентифіковані за допомогою простих засобів.
Пробне лікування препаратами заліза
Пробне лікування препаратами заліза одночасно виступає діагностичним та лікувальним методом. Якщо пацієнту відомо, що у нього є гемоглобінопатія, то в першу чергу повинен бути визначений феритин; в інших випадках мікроцитарну або нормоцитарну анемію слід вважати спричиненою дефіцитом заліза до тих пір, поки не доведено іншого. З точки зору економічних і часових витрат оцінка відповіді на препарати заліза є ефективним методом. Зростання гемоглобіну через 2 тижні підтверджує дефіцит заліза. Якщо статус гемоглобінопатії невідомий, то, поки виконується обстеження (скринінг), доцільно розпочати лікування препаратами заліза. Скринінг повинен проводитися відразу відповідно до національних настанов щодо програм скринінгу таласемії і серповидних клітин (NHS). Тяжка анемія може впливати на результати обстеження на гемоглобінопатію; скорочення HbA2 до 0,5 % не є підставою для затримки (Ryan et al., 2009). Обов’язковою умовою є ефективна система перегляду результатів. Якщо не було ніякого збільшення гемоглобіну на другому тижні, пацієнтку слід направити в заклад, що надає вторинну медичну допомогу, з метою розглянути інші причини анемії, такі як дефіцит фолієвої кислоти.
Рекомендації
Пробне лікування препаратами заліза слід розглядати в якості першої лінії діагностики для нормоцитарної або мікроцитарной анемії. Збільшення гемоглобіну має бути продемонстроване на 2-му тижні; в іншому випадку необхідно проводити подальше обстеження (1B).
Феритин сироватки повинен перевірятися перед початком лікування препаратами заліза у пацієнтів з відомою гемоглобінопатією (1B).
Анемізованим жінкам з невідомим статусом гемоглобінопатії повинно бути запропоновано пробне лікування препаратами заліза (1B); скринінг гемоглобінопатії повинен бути зроблений негайно відповідно до національних настанов щодо програм скринінгу таласемії і серповидних клітин (NHS) (1А), але з усвідомленням того, що дефіцит заліза може викликати деякий відсоток зниження гемоглобіну А2.
Рівень феритину в сироватці є найбільш корисним і легко доступним параметром для оцінки дефіциту заліза. Рівні нижче 15 мкг/л є діагностичними для встановленого дефіциту заліза. Рівень нижче 30 мкг/л при вагітності є показанням для лікування (2A).
Показники цинк-протопорфірину або розчинних рецепторів трансферину можуть бути корисними доповненнями там, де дозволяють можливості. Коли запальні або інфекційні процеси підозрюються/мають місце, рівні С-реактивного білка в сироватці крові можуть сприяти оцінці (2B).
Клінічна настанова лікарні Короля Едуарда (м. Перт, Західна Австралія)
Ключові моменти
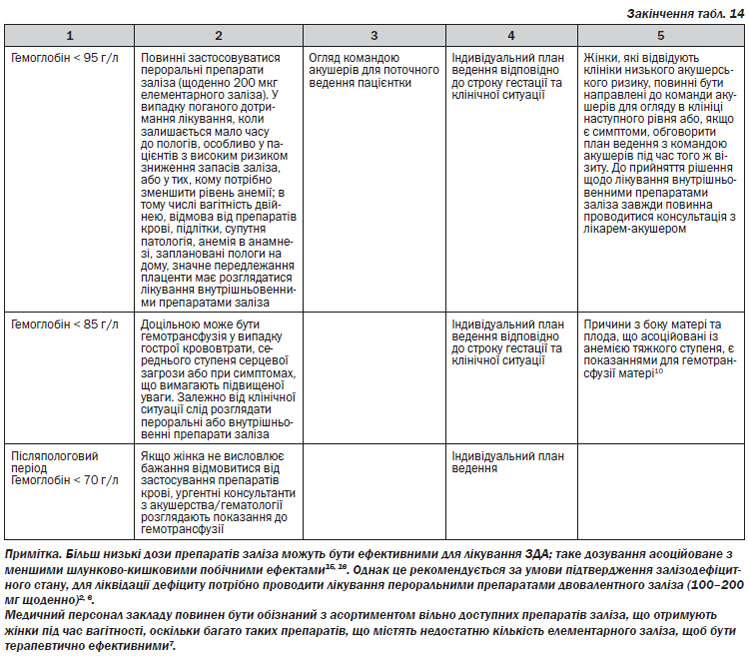
1. Всі жінки повинні розглядатися для скринінгового обстеження на анемію:
а. в першому триместрі (при встановленні на облік);
b. повторно між 24-м та 28-м тижнями вагітності;
c. на 36-му тижні вагітності.
2. Розгорнутий аналіз крові повинен бути проведений після 2–8 тижнів від початку лікування (залежить від вагітності) для оцінки відповіді та комплаєнсу на лікування пероральними препаратами заліза.
3. ЗДА в більшості випадків діагностується на підставі розгорнутого аналізу крові і рівнів феритину сироватки. Не використовуйте тільки залізо сироватки чи тільки феритин сироватки для діагностики ЗДА9. NB: рівень феритину підвищений при активному інфекційному процесі або запаленні. В цих випадках одночасне визначення С-реактивного білка допоможе інтерпретувати рівні феритину6.
4. Консультуйтеся з гематологом щодо діагностики та лікування ЗДА у жінок з відомими гемоглобінопатіями. Феритин сироватки повинен перевірятися перед початком лікування препаратами заліза у разі, якщо відомо про наявність гемоглобінопатії6.
5. Пероральні препарати заліза, якщо приймати їх у відповідних дозах впродовж достатнього часу, є ефективними засобами лікування першої лінії для більшості вагітних жінок2, 6, 7, 8, 9.
6. Якщо жінки не відповідають на лікування препаратами заліза, подальше обстеження має бути спрямоване на виявлення мальабсорбції, відсутність комплаєнсу, супутні хвороби або перегляд діагнозу10.
7. Парентеральні (внутрішньом’язові або внутрішньовенні) препарати заліза підвищують гематологічну відповідь порівняно з препаратами перорального заліза, але недостатньо даних щодо побічних ефектів, наприклад тяжких алергічних реакцій або венозного тромбозу4.
8. Внутрішньовенний препарат полімальтозного комплексу заліза — ефективна альтернатива пероральним препаратам впродовж другого або третього триместру (тільки для лікування ЗДА). Внутрішньовенні препарати заліза мають використовуватися тільки у жінок, які не реагують на пероральні препарати заліза з підтвердженою ЗДА, або у тих, кому потрібно швидко відновити запаси заліза.
9. Тип, доза і частота прийому препаратів заліза для лікування ЗДА повинні бути задокументовані в медичній документації — MR 220 «Pregnancy Health Record».
10. Під час кожного допологового візиту всіх жінок, які отримують препарати заліза, слід контролювати на дотримання схеми лікування і наявність побічних ефектів.
11. Щоб запобігти розвитку анемії, вагітні жінки з нормальним гемоглобіном і рівнем феритину менше 30 мкг/л повинні розпочаті отримувати пероральні препарати заліза. Дозу 65 мг елементарного заліза слід приймати один раз на день6.
Інтерпретація показників сироватки для анемізованих вагітних
Будь ласка, зверніть увагу, що деякі лабораторії при інтерпретації результатів наводять значення для невагітних дорослих. Використовуйте референтні значення, що наведені в таблиці 6.
Визначення, що використовуються для діагностики
В контексті ведення пацієнток із залізодефіцитною анемією в лікарні Короля Едуарда використовуються наступні визначення анемії:
— гемоглобін менше 110 г/л в першому і третьому триместрі;
— гемоглобін менше 105 г/л в другому триместрі.
Легкий ступінь залізодефіцитної анемії: гемоглобін 90–105 г/л в 2-му триместрі, 90–109 г/л в 1-му і 3-му триместрі14.
Більш тяжкий дефіцит заліза може призвести до більш значної анемії (гемоглобін менше 90 г/л)2, 14.
«Diagnosis and management of iron deficiency anaemia: a clinical update» (2010)
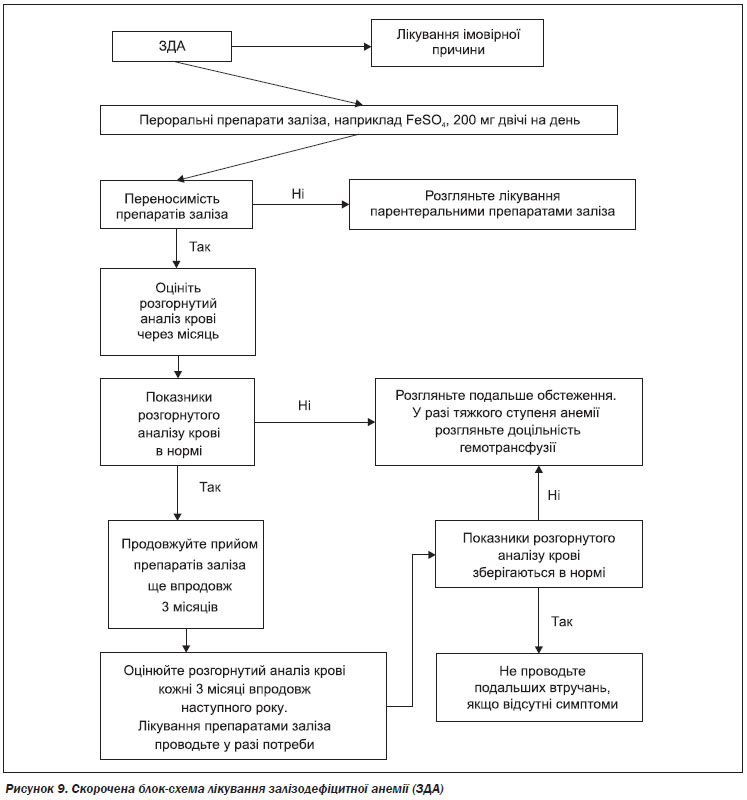
Ведення пацієнтів із залізодефіцитною анемією
Рекомендований алгоритм діагностики та лікування ЗДА наведено на рис. 10. В усіх випадках повинна бути діагностована першопричина анемії. У чоловіків та жінок постклімактеричного віку дуже важливо проводити обстеження для виявлення можливих доброякісних або злоякісних уражень шлунково-кишкового тракту, запальних процесів (наприклад, запалення кишечника) та пептичної виразки. Пацієнтів із ЗДА також необхідно обстежувати щодо виявлення можливої целіакії4, 29.
Дієтотерапія
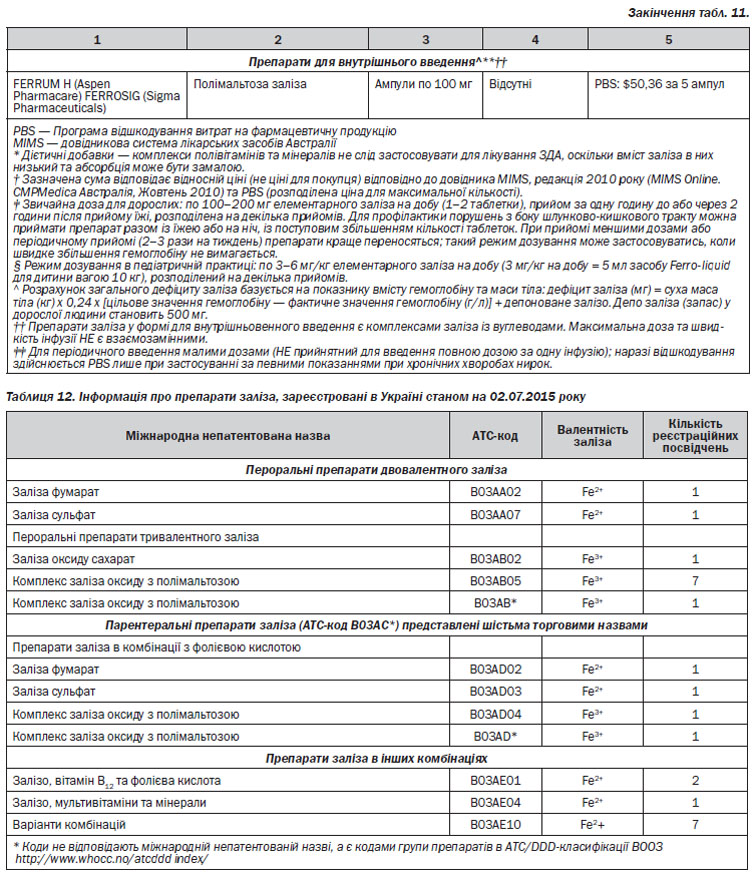
Збільшення споживання заліза із харчовими продуктами є недостатнім для лікування ЗДА. Для цього необхідно застосовувати препарати заліза у великих дозах (табл. 9). Тим не менше, збільшення надходження заліза та оптимізація його абсорбції за рахунок мінімізації факторів, що її пригнічують, та зростання сприятливих факторів є корисним в якості засобу профілактики рецидиву дефіциту заліза. Рекомендовані дози споживання заліза, із урахуванням віку, наведено в табл. 3.
British society of Gastroenterology «Guidelines for the management of iron deficiency anaemia» (2011)
Медичні втручання
Анамнез
Дієти із низьким вмістом заліза зустрічаються часто. Щоб запідозрити недостатнє надходження заліза із продуктами харчування, повинен бути зібраний дієтичний анамнез. Використання аспірину та інших нестероїдних протизапальних препаратів повинно бути відмічено. Використання цих препаратів повинно бути припинене в тих випадках, коли клінічні показання незначні або існують інші варіанти. В сімейному анамнезі слід шукати ЗДА (може вказувати на спадкові розлади абсорбції заліза23), гематологічні порушення (наприклад, таласемію), телеангіектазії і порушення зсідання крові. Повинні бути з’ясовані питання донорства крові або будь-якого іншого джерела крововтрати. Наявність одного або декількох з цих факторів в анамнезі не повинна, як правило, перешкоджати подальшому обстеженню. Слід з’ясувати наявність в сімейному анамнезі раку ободової і прямої кишки — наявність одного хворого родича першої лінії спорідненості віком до 50 років або наявність двох хворих родичів першої лінії спорідненості. Попередньо зібраний анамнез ЗДА може змінити порядок або доречності проведення тестів, особливо якщо він давній.
Обстеження
Обстеження, як правило, мало сприяє, але може виявити відповідні ознаки рідкісних причин гастроінтестинальної втрати крові з боку черевної порожнини або шкіри (наприклад, синдром Пейтца — Єгерса та спадкова геморагічна телеангіектазія). Ректальне дослідження рідко сприяє діагностиці у пацієнтів з ЗДА і, за відсутності таких симптомів, як кровотеча з прямої кишки і тенезми, може бути відкладено до проведення колоноскопії, якщо тільки не буде значної затримки. Обстеження сечі на наявність крові рекомендується проводити у всіх пацієнтів із ЗДА (B); приблизно у 1 % пацієнтів з ЗДА може бути виявлено злоякісне утворення нирок9. Анемія зустрічається приблизно у третини пацієнтів з нирковоклітинним раком24. Це пов’язано з гематурією та осадженням гемосидерину в пухлині. Якщо виявлено гематурію, рекомендується подальше УЗД обстеження ниркового тракту з подальшою внутрішньовенною урографією та/або комп’ютерною томографією за необхідності.
Обстеження верхнього та нижнього відділу шлунково-кишкового тракту
Обстеження верхнього та нижнього відділу шлунково-кишкового тракту має розглядатися для всіх жінок в постменопаузальному періоді і всіх чоловіків з підтвердженим діагнозом ЗДА, якщо в анамнезі відсутня значна крововтрата не з шлунково-кишкового тракту. За відсутності характерних симптомів (які є ненадійними) порядок обстеження визначається місцевими ресурсами, при цьому всі пацієнти повинні бути обстежені (серологія) на целіакію (B) — див. далі. Якщо езофагогастродуоденоскопія виконується в якості вихідного обстеження шлунково-кишкового тракту, то тільки у разі виявлення раку шлунка або целіакії, як описано нижче, не потрібно обстежувати нижній відділ шлунково-кишкового тракту (B). Зокрема, езофагіт, ерозії і виразкова хвороба не повинні розцінюватися в якості причини ЗДА до тих пір, поки не буде проведено обстеження нижнього відділу шлунково-кишкового тракту. Якщо серологічний тест на целіакію був позитивним або не виконувався, то повинна бути виконана біопсія тонкої кишки при проведенні езофагогастродуоденоскопії. Колоноскопія має такі переваги порівняно з радіологічним методом: дозволяє провести біопсію уражених ділянок, провести лікування аденом, ідентифікувати поверхневу патологію, таку як ангіодисплазія та ураження нестероїдними протизапальними препаратами. Виконання гастроскопії і колоноскопії на тому ж візиті прискорює обстеження і економить час як для лікарні, так і для пацієнта, оскільки для проведення ендоскопії потрібен один лише один візит. У тих випадках, де колоноскопія протипоказана, рентгенологічний метод є альтернативою. Чутливість комп’ютерної томографії товстого кишечника для уражень розміром > 10 мм більше ніж 90 %25. Барієва клізма менш надійна, але досі залишається корисним методом26, якщо колоноскопія або комп’ютерна томографія товстого кишечника недоступні.
British society of Gastroenterology «Guidelines for the management of iron deficiency anaemia» (2005)
Обстеження верхнього та нижнього відділів шлунково-кишкового тракту
У випадку підтвердженої ЗДА проведення обстеження верхнього та нижнього відділів шлунково-кишкового тракту для виявлення джерела кровотечі повинно бути розглянуто для всіх жінок в постменопаузальному періоді та чоловіків за умови відсутності значної втрати крові з інших джерел. При відсутності характерних симптомів (які не належать до надійних критеріїв встановлення діагнозу) порядок обстеження визначається з урахуванням місцевих ресурсів. Доцільність обстеження пацієнтів з наявною тяжкою супутньою патологією чи з урахуванням інших причин (в деяких випадках похилий вік), особливо якщо результат не буде мати впливу на ведення пацієнта, повинна бути ретельно обговорена (якщо це можливо) з пацієнтами та особами, які здійснюють догляд.
Всі пацієнти повинні бути обстежені на целіакію (B)а.
В ідеалі повинно бути проведено серологічне обстеження на целіакію (антиендомізіальні антитіла чи антитіла до тканинної трансглутамінази). Якщо отримано негативні результати серологічного обстеження на целіакію, то не повинна проводитися біопсія тонкого кишечника, при проведенні езофагогастродуоденоскопії, при умові, що немає інших симптомів чи ознак, що свідчили б на користь целіакії як найбільш імовірного діагнозу (B). Якщо отримано позитивні результати серологічного обстеження на целіакію, то діагноз целіакії більш імовірний і повинен бути підтверджений гістологічним дослідженням біопсійного матеріалу тонкого кишечника. Подальше обстеження шлунково-кишкового тракту (в тому числі колоноскопія) не є необхідним в даній ситуації. Однак ризик розвитку злоякісного процесу шлунково-кишкового тракту у пацієнтів з целіакією більший25. Тому рекомендується проводити обстеження верхнього та нижнього відділу шлунково-кишкового тракту у пацієнтів із ЗДА, які лікуються від целіакії.
Обстеження верхнього та нижнього відділу шлунково-кишкового тракту повинно починатися з проведення езофагогастродуоденоскопії. І тільки якщо при проведенні цього дослідження підтвердиться рак шлунка чи целіакія, можна не проводити обстеження нижнього відділу шлунково-кишкового тракту (В).
У випадку наявності езофагіту, ерозій чи пептичної виразки це не повинно розцінюватися в якості причини розвитку ЗДА до тих пір, поки не буде обстежений нижній відділ шлунково-кишкового тракту. Якщо було отримано позитивні результати серологічного обстеження на целіакію або обстеження не було проведено, то під час проведення езофагогастродуоденоскопії потрібно проводити забір матеріалу тонкого кишечника (біопсія) для проведення гістологічного обстеження.
Проведення колоноскопії (можливо навіть в день проведення езофагогастродуоденоскопії) має переваги в тім, що цей метод дозволяє виявити ангіодисплазію і провести біопсію ураженої ділянки. Однак іригоскопія з подвійним контрастуванням барієм є альтернативним методом26, 27, з чи без проведення ректороманоскопії26, 28, особливо якщо ресурси для проведення колоноскопії обмежені чи відсутні.
Подальше обстеження
Окрім того, безпосередня візуалізація тонкого кишечника, імовірно, не потрібна, якщо ЗДА не залежить від переливань крові (В)37. Дослідження показали, що такий підхід буде безпечним26, 29 за умови, що проводиться корекція харчової недостатності, припинено прийом нестероїдних протизапальних засобів та концентрація гемоглобіну контролюється. Однак якщо ЗДА залежить від переливань крові, ентероскопія може бути корисною для виявлення та лікування ангіодисплазії30, 31. При цьому може здійснюватися капсульна відеоендоскопія, діагностична точність якої становить 40–55 %32, 33. Більшість уражень, що виявляються за допомогою як ентероскопії, так і за допомогою капсульної відеоендоскопії, знаходяться в межах досягнення гастроскопа, тому перед цією процедурою повинно розглядатися проведення езофагогастродуоденоскопії. Проведення рентгенологічного чи радіоізотопного дослідження тонкого кишечника недоцільне, окрім випадків, коли історія хвороби містить дані, що можуть свідчити про наявність хвороби Крона5.
Колонізація Helicobacter рylori може стати причиною погіршення засвоєння заліза чи збільшення його втрат, внаслідок чого призвести до дефіциту заліза чи ЗДА34–36. За даними деяких невеликих досліджень можна зробити припущення, що ерадикація Н.рylori призводить до регресії анемії37. У разі отримання нормальних даних за результатами проведених езофагогастродуоденоскопії та колоноскопії слід шукати H.рylori та проводити ерадикацію у разі виявлення цієї інфекції (С).
Ангіографія мезентеріальних судин має обмежене застосування, але може мати значення у випадку ЗДА, залежної від гемотрансфузій. Цей метод дослідження допомагає виявляти судинні мальформації. Таким же чином діагностична лапаротомія з одночасним проведенням ендоскопії може розглядатися у випадках, коли було отримано суперечливі результати обстеження.
Інші дослідження, в тому числі звичайні обстеження печінки та нирок, а також дослідження зсідальної функції крові не мають діагностичної цінності, якщо тільки історія хвороби не наводить на думку про системну хворобу3. Дослідження випорожнень на приховану кров не надає ніякої користі в з’ясуванні причин ЗДА (В), оскільки є нечутливим та неспецифічним методом4, 38, 39.
British society of Gastroenterology «Guidelines for the management of iron deficiency anaemia» (2011)
Скринінг та подальше обстеження целіакії
В ідеалі повинно бути проведено серологічне обстеження на целіакію — антитіла до тканинної трансглутамінази27 або антитіла до ендомізію, якщо тестування на антитіла до тканинної трансглутамінази недоступне. Якщо такого дослідження не проводилось або якщо результат недоступний, то повинна бути виконана біопсія дванадцятипалої кишки. У разі негативного серологічного результату на целіакію біопсія тонкого кишечника не повинна проводитися під час езофагогастродуоденоскопії, якщо відсутні інші ознаки, такі як діарея, що свідчить на користь целіакії (В). Претестова імовірність целіакії у пацієнтів із ЗДА близько 5 %. Негативне відношення правдоподібності для тесту на антитіла до тканинної трансглутамінази з використанням рекомбінантної тканинної трансглутамінази людини складає 0,0627. Таким чином, якщо тест на антитіла до тканинної трансглутамінази є негативним, то післятестова імовірність целіакії складає 0,3 %, що менше, ніж у загальній популяції. Це означає, що зразки для біопсії дванадцятипалої кишки потрібно отримати від близько 330 пацієнтів з негативним результатом на антитіла до тканинної трансглутамінази, щоб виявити одного додаткового пацієнта з целіакією. За оцінками, додаткові витрати на це будуть складати £ 35 000. Якщо результати серологічного тесту на целіакію позитивні, то, швидше за все, діагноз целіакії більш імовірний і повинен бути підтверджений біопсією тонкої кишки. Хоча було рекомендовано одночасне тестування на дефіцит IgA, який зустрічається у 2 % пацієнтів з целіакією, ми не вважаємо це за необхідне рутинне обстеження, тому що це незначно змінює післятестову імовірність целіакії у пацієнтів з негативним результатом на антитіла до тканинної трансглутамінази (змінюється від 0,3 до 0,2 %, що не є клінічно значущим). Тим не менше, це слід розглянути28, якщо отримано низькі значення оптичної щільності в аналізі на IgA до тканинної трансглутамінази.
Якщо діагностовано целіакію, подальше обстеження шлунково-кишкового тракту, як правило, не потрібне. Тим не менше, довічний ризик розвитку малігнізації шлунково-кишкового тракту у пацієнтів з целіакією трохи збільшується29, зокрема, впродовж 1-го року після встановлення діагнозу. Колоноскопія повинна бути розглянута, якщо існує додатковий ризик — наприклад, якщо вік старше 50 років або якщо в сімейному анамнезі є колоректальний рак. Якщо ЗДА розвивається у пацієнта, який лікується від целіакії, рекомендовано обстежувати верхній і нижній відділ шлунково-кишкового тракту пацієнтам віком старше 50 років за відсутності іншої очевидної причини анемії. У рідкісних випадках у пацієнтів з позитивним серологічним обстеженням на целіакію зустрічаються нормальні результати гістологічного обстеження тонкого кишечника. В таких випадках ми рекомендуємо обстежувати пацієнта так, як у разі негативного результату серологічного обстеження на целіакію.
Подальше обстеження
Як правило немає потреби в проведенні візуалізуючих методів обстеження тонкої кишки, якщо тільки немає неадекватної реакції на лікування препаратами заліза або стан пацієнта не залежить від гемотрансфузій (Б)3, 7. Подальші дослідження показали, що такий підхід є досить надійним26, 30, 31, за умови, що харчова недостатність коригується, прийом нестероїдних протизапальних препаратів був зупинений, а концентрація гемоглобіну моніториться.
Відеокапсульна ендоскопія або ентероскопія може бути корисною для виявлення ангіодисплазії, хвороби Крона і неоплазій тонкої кишки у пацієнтів з неадекватною відповіддю32, 33. Відеокапсульна ендоскопія в цих умовах має діагностичну точність 40–55 %32–34. Тим не менше, це інколи призводить до сприятливого подальшого втручання35. Багато ушкоджень виявляються як ентероскопією, так і відеокапсульною ендоскопією в межах досяжності гастроскопа. Повторна езофагогастродуоденоскопія повинна розглядатися перед проведенням цих методів обстеження. Ураження, що кровлять, виявлені відеокапсульною ендоскопією, можуть піддаватися лікуванню двобалонною ентероскопією. Тим не менше, переваги цих методів лікування після проведення нормальної відеокапсульної ендоскопії в контексті ЗДА не доведеною.
Візуалізуючі методи обстеження тонкої кишки (магнітно-резонансна томографія з високою клізмою, комп’ютерна томографія тонкого кишечника або обстеження з барієм) також повинні розглядатися у пацієнтів із симптомами, що вказують на патологію тонкого кишечника, із залежною від гемотрансфузій ЗДА, із швидким рецидивом анемії після нормалізації концентрації гемоглобіну. Тим не менше, багато малих ушкоджень кишечника, які спричиняють безсимптомну анемію, є (або майже є) плоскими і локалізуються в слизовій оболонці. Обстеження більшої частини тонкого кишечника відеокапсульною ендоскопією є ефективними тільки при виявленні масових пошкоджень. Комп’ютерна томографія має додаткову перевагу, що дозволяє виявити позакишкову патологію, таку як пухлини нирок і лімфоми.
Колонізація Helicobacter рylori може погіршити засвоєння заліза і збільшити його втрату, що може спричинити дефіцит заліза і ЗДА36–39. Ерадикація H.pylori, здається, сприяє регресу анемії за даними поодиноких звітів і невеликий досліджень40. H.pylori слід виявляти неінвазивними методами дослідження, якщо ЗДА зберігається або повторюється після нормальних результатів езофагогастродуоденоскопії, колоноскопії та ерадикації, якщо вона проводилася (С). Уреазний тест біоптатів, взятих при проведенні гастроскопії (початкове обстеження), є альтернативним підходом.
Автоімунний гастрит був визначений в якості потенційної причини ЗДА у чверті випадків41, 42, але, незважаючи на інтерес, його діагностика в даний час не представляє практичної цінності.
Лямблії час від часу були знайдені в ході обстеження ЗДА. Якщо клінічні випадки асоційовані з діарею, то зразки біопсії тонкого кишечника в будь-якому випадку мають бути отримані. Це може допомогти діагностувати причину. В тих випадках, коли підозрюється лямбліоз, випорожнення повинні бути обстеженні методом ELISA, навіть якщо гістологія зразків біопсії дванадцятипалої кишки дала негативний результат.
Радіологічні методи візуалізації мезентеріальних судин мають обмежене застосування, але можуть мати значення у випадках залежної від гемотрансфузій ЗДА для демонстрації судинних вад розвитку або іншої прихованої патології. Так само діагностична лапаротомія з інтраопераційною ентероскопією рідко потрібна у випадках встановлення діагнозу іншими методами дослідженнями. Немає доказів, щоб рекомендувати метод обстеження з міченими еритроцитами або сканування дивертикулу Меккеля у пацієнтів з ЗДА.
Інші втручання, в тому числі рутинна оцінка стану печінки, нирок і зсідання крові, не мають діагностичного значення, якщо анамнез не вказує на системну хворобу3. Обстеження на приховану кров у випорожненнях не приносить ніякої користі в контексті обстеженні пацієнтів із ЗДА (B); є нечутливим і неспецифічним методом обстеження4, 43, 44.
Коментар робочої групи: однією із причин залізодефіцитної анемії виступають аномальні маткові кровотечі. Згідно із даними Національного консенсусу щодо ведення пацієнток із аномальними матковими кровотечами (Асоціація гінекологів-ендокринологів України — 2015), при аномальних маткових кровотечах пацієнтки рідко звертаються до лікаря саме з цього питання. Аналіз опитувальників надав можливість виділити питання, які на рівні первинної медичної допомоги дозволяють запідозрити пацієнток щодо додаткового обстеження на предмет діагностики аномальних маткових кровотеч. Рекомендовані питання для виявлення АМК:
1. Чи впливає менструація на Вашу щоденну активність (роботу, заняття спортом, спілкування з родиною)?
2. Чи доводиться Вам міняти засоби гігієни вночі?
3. Чи знаходяться у виділеннях великі згустки крові (більше 1 см)?
4. Чи відчуваєте Ви слабкість, задишку, підвищену стомлюваність або Вам ставили коли-небудь діагноз анемії?
При позитивній відповіді на одне і більше питань є підстави припускати у пацієнтки наявність АМК.
Даний інструмент (рекомендовані питання для виявлення АМК) не пройшов валідацію, тому на сьогоднішній день немає даних щодо операційних характеристик (чутливість, специфічність, точність та ін.) даного інструменту діагностики. Проте робоча група вважає за потрібне рекомендувати використовувати дані чотири запитання лікарями загальної практики — сімейної медицини під час збору анамнезу у пацієнток для виявлення фактора ризику розвитку ЗДА.
UNICEF «National Iron Plus Initiative Guidelines for Control of IDA» (2013)
Які заходи необхідні для ефективнішого подолання дефіциту заліза та ЗДА?
Анемія є порушенням, яке виникає внаслідок багатьох причин, що вимагає різноспрямованих заходів для її подолання. Дефіцит заліза та інфекційні хвороби є найпоширенішими етіологічними факторами. Втім, й інші причини також можуть робити свій внесок. Копенгагенським узгоджувальним комітетом (2004), до складу якого увійшли видатні економісти, було зроблено висновок, що результативність інвестування в програми забезпечення мікроелементами (в тому числі залізом) серед 17 можливих розглянутих програм інвестування поступається лише програмам боротьби із ВІЛ/СНІД. Відповідно до означеної оцінки співвідношення прибутків та витрат на програми, пов’язані із наданням препаратів заліза (із урахуванням економії ресурсів), покращення когнітивного розвитку, навчання та працездатності, сягає 200 : 1.
Профілактика як дефіциту заліза, так і ЗДА вимагає методик, спрямованих на усунення усіх можливих причинних факторів. Отже, втручання, спрямовані на профілактику та усунення дефіциту заліза та ЗДА, повинні передбачати заходи, спрямовані на стимуляцію збільшення споживання заліза із продуктами харчування, що потребує диверсифікації раціону харчування та збагачення залізом продуктів харчування; забезпечення дієтичними добавками, покращення медичного обслуговування та санітарних умов (рис. 6).
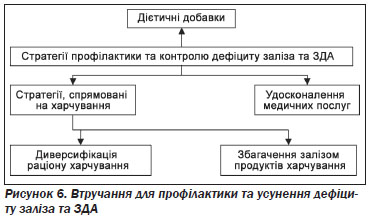
Що таке диверсифікація раціону харчування, збагачення продуктів харчування та дієтичні добавки?
Диверсифікація раціону харчування
Диверсифікація раціону харчування означає стимуляцію споживання харчових продуктів із високим вмістом мікроелементів (листових овочів темно-зеленого кольору, бобових) та фруктів із високим вмістом вітаміну С, які є доступними, але недостатньо споживаються відповідними популяціями.
Для забезпечення надходження адекватної кількості заліза шляхом зміни раціону слід враховувати традиційні методи приготування їжі та звички в харчуванні. Оскільки вміст заліза є низьким в раціоні, заснованому на зернових та бульбових продуктах, додавання бобових може трохи збільшити вміст заліза в такому раціоні. Однак біологічна доступність цих джерел негемової форми заліза низька. Отже, забезпечити отримання рекомендованої кількості заліза та цинку при такому традиційному харчуванні, шляхом стратегії, спрямованої на раціон харчування, неможливо, необхідне включення м’яса, птиці або риби. Наприклад, включення в раціон харчування невеличкої кількості (50 г) м’яса, птиці або риби збільшує загальне надходження заліза, а також кількість біологічно доступного заліза. Прийом аскорбінової кислоти разом із продуктами, багатими на залізо, покращує його абсорбцію. Існує критичний баланс між активаторами та інгібіторами абсорбції заліза.
Для забезпечення біологічної доступності заліза істотною передумовою є скорочення споживання інгібіторів абсорбції заліза та збільшення споживання активаторів абсорбції при кожному прийомі їжі. Харчовий статус може бути істотно покращений шляхом навчання господинь правильних методів приготування їжі, які мінімізують застосування інгібіторів абсорбції заліза. Також важливо рекомендувати мінімальну теплову обробку, в невеликій кількості води, овочів, багатих на вітамін С, фолати та інші водорозчинні або чутливі до нагрівання вітаміни. Відповідно до означеної стратегії рекомендовано збільшення споживання пророслого зерна, ферментованих зернових продуктів, зернових продуктів, що підлягають тепловій обробці, м’яса, фруктів та овочів, багатих на вітамін С, а також стимулювати споживання чаю, кави, шоколаду або трав’яних чаїв в інший час, а не одночасно із іншими продуктами. Отже, адекватність, тобто біологічна доступність заліза при споживанні звичайного раціону, може бути покращена за рахунок зміни харчових звичок із наданням переваги споживанню стимуляторів його абсорбції, відмови від інгібіторів або комбінації обох методів.
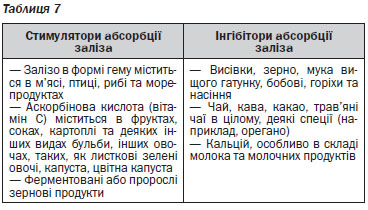
Збагачення продуктів харчування
Збагачення продуктів харчування означає додавання мікроелементів до готових харчових продуктів. В багатьох ситуаціях така стратегія забезпечує відносно швидке покращення статусу мікроелементів в організмі за дуже розсудливу ціну, особливо у випадку можливості застосування вже наявних технологій та місцевих мереж дистрибуції.
Дієтичні добавки
Дієтичні добавки — препарати із високою концентрацією вітамінів та мінеральних речовин, які виробляються фармацевтичною промисловістю в формі капсул, таблеток або ін’єкцій, та застосовуються в якості складової лікування або для виправлення специфічних проблем, обумовлених харчуванням.
Забезпечення дієтичними добавками впродовж життя
Запропонована програма забезпечення дієтичними добавками для подолання анемії впродовж життя, відповідно до якої пацієнти повинні отримувати дієтичні добавки, залізо із фолієвою кислотою, незалежно від статусу заліза в організмі/рівня гемоглобіну. Специфічні для кожного віку програми втручання ґрунтуються на рекомендаціях ВООЗ, накопичених в світі даних щодо застосування дієтичних добавок, IFA та рекомендаціях національних експертів (табл. 8 та рис 7).
ASHA повинні бути належним чином вмотивовані для постачання IFA дієтичних добавок відповідним групам населення.
Коментар робочої групи: центри Anganwadi в Індії є частиною державної системи охорони здоров’я. Вони були започатковані в 1975 році в рамках програми розвитку дітей та боротьби із дитячим голодом та недоїданням. Типові центри Anganwadi надають базову медичну допомогу в сільській місцевості. Основна медико-санітарна діяльність цих центрів пов’язана із консультуванням щодо питань контрацепції та харчування, дієтичних добавок та дошкільної зайнятості. Окрім того, центри можуть використовуватися для складського зберігання солей для пероральної регідратації, основних лікарських засобів та контрацептивів. http://en.wikipedia.org/wiki/Anganwadi.
Організація «сільських акушерок» (англ. auxiliary nurse midwives — ANM). У шістдесятих роках минулого століття в Індії була організована програма дворічної підготовки «сільських акушерок». Починаючи з 1966 року під тиском міжнародних організацій роль «сільських акушерок» змінилася в напрямку надання консультацій з питань плануванні сім’ї та щеплення. http://www.who.int/bulletin/volumes/86/4/07-048454/en/.
Коментар робочої групи: в оригінальному тексті документа далі наводиться національна програма забезпечення дієтичними добавками різних верств населення країни (починаючи з шестимісячного віку). Відповідно до цієї програми населення отримує комбіновані препарати заліза та фолієвої кислоти, дітям до 19 років та жінкам дітородного віку (15–45 років) раз на півроку проводиться дегельмінтизація альбендазолом. В програмі приділяється певна увага пропаганді виключно грудного вигодовування до шестимісячного віку, стимуляції належного та адекватного додаткового годування дітей до 2 років продуктами із високим вмістом заліза, стимуляції диверсифікації харчування. Окремий акцент ставиться на діагностиці, контролі та лікування паразитарних захворювань.
В Україні не проводилось досліджень щодо рівня фактичного споживання заліза з харчовими продуктами та його зв’язку із поширеністю ЗДА. З огляду на рентабельність загальної профілактики залізодефіциту на стан здоров’я популяції існує необхідність вивчення споживання аліментарного заліза з продуктами харчування в Україні. За результатами такого дослідження можна буде зробити обґрунтований висновок про необхідність або недоцільність масової профілактики ЗДА, пов’язаної з недостатнім надходженням аліментарного заліза у певних груп населення України.
British Committee for Standards in Haematology «UK guidelines on the management of iron deficiency in Pregnancy» (2011)
Ведення пологів у жінок з дефіцитом заліза
Таких ситуацій, відповідно до хорошої практики, як правило, слід уникати; однак існують випадки, коли жінки поступають пізно, останнім часом надходять з-за кордону або не займаються допологовою допомогою. У таких ситуаціях може бути необхідно вжити активних заходів для зведення до мінімуму крововтрати при пологах. Слід подумати про госпіталізацію, внутрішньо-венний доступ, групу крові і її збереження. Хоча має бути індивідуальний підхід, для госпіталізації, в тому числі в акушерський (акушерки — середній медперсонал) відділ лікарні, повинна бути запропонована точка відсічки — гемоглобін < 100 г/л і < 95 г/л — для госпіталізації в акушерський (лікарі-акушери) блок, з обговоренням і документальною фіксацією плана інтранатального догляду.
Ясні дані рандомізованих досліджень підтримують активне ведення третього періоду пологів як спосіб зниження післяпологової крововтрати (Prendiville et al., 1988; Rogers et al., 1988). Це має бути внутрішньом’язовий синтометрин/синтоцинон, а за умови додаткових факторів ризику, таких як тривалі пологи або інструментальне розродження, — внутрішньо-венна інфузія високих доз синтоцинону тривалістю 2–4 годин з метою збереження скорочення матки. Мізопростол може бути корисною альтернативою там, де ін’єкційні утеротоніки недоступні (Alfirevic et al., 2007).
Рекомендації:
Жінкам зі стабільною анемією на момент пологів можуть знадобитися додаткові запобіжні заходи для пологів, в тому числі пологи в умовах стаціонару, доступний внутрішньовенний доступ, визначення групи крові і збереження зразка, активне ведення третього періоду пологів і планування боротьби з надмірною кровотечею. Точка відсічки для гемоглобіну < 100 г/л — показання для госпіталізації і < 95 г/л — показання для госпіталізації в акушерський блок (2B).
Коментар робочої групи: синтоцинон — торгова назва препарату, який в складі має окситоцин; синтометрин — торгова назва препарату, який в складі має окситоцин + ергометрину малеат.
British society of Gastroenterology «Guidelines for the management of iron deficiency anaemia» (2011)
Ведення пацієнтів
Мета лікування
Після приділення уваги виявленню будь-якої основної причини мета лікування повинна спрямовуватися на відновлення концентрації гемоглобіну і еритроцитарних індексів до нормальних рівнів і відновлення запасу заліза. Якщо цього не може бути виконано, увага повинна бути приділена подальшій оцінці.
Лікування препаратами заліза
Лікування основної причини повинно запобігти подальшій втраті заліза, але всі пацієнти повинні отримувати препарати заліза для ліквідації анемії та відновлення запасів заліза в організмі (B)45. Найбільш просто і дешево це досягається застосуванням 200 мг заліза сульфату двічі на день. Менші дози можуть бути ефективними і краще сприйматися46, 47; повинні розглядатися у пацієнтів, які не переносять традиційні дози. Інші сполуки заліза (наприклад, заліза фумарат, заліза глюконат) або лікарські форми препаратів заліза (суспензії) можуть краще переноситися, ніж заліза сульфат. Пероральні препарати заліза слід приймати впродовж 3 місяців після відновлення дефіциту з метою відновлення його запасів в організмі.
Аскорбінова кислота (250–500 мг двічі як доповнення до препаратів заліза) може посилити всмоктування заліза48, але дані щодо її ефективності в лікуванні ЗДА відсутні.
Для тих, хто не переносить або не відповідає на прийом препаратів заліза, є три доступні парентеральні препарати, два з яких можуть бути введені тільки внутрішньовенно [сахароза заліза (Venofer) і карбоксимальтоза заліза (Ferinject)], і один, який може бути введений або внутрішньовенно, або внутрішньом’язово у великий сідничний м’яз [залізо (III) гідроксид декстран (Cosmofer)], хоча це може супроводжуватися болем і вимагати декількох ін’єкцій. Порівняння внутрішньовенних препаратів заліза показано в таблиці 9.
Головна перевага карбоксимальтози заліза, останнє досягнення у внутрішньовенній терапії, — це скорочена тривалість інфузії без необхідності введення пробної дози (15 хв) порівняно з 6 год для «Cosmofer» [що складається з пробної дози (15 хв), спостереження (45 хв), інфузії (4 год) та подальшого спостереження (1 год)]. Хоча вартість лікарського засобу вища, але тривалість днів перебування в стаціонарі або днів лікування в закладі, що надає первинну медичну допомогу, знижується.
Внутрішньовенні препарати сахарози заліза добре переносяться (35 % пацієнтів мають незначні побічні ефекти, включаючи біль у животі, нудоту, головний біль, діарею), мають низький показник значних побічних реакцій (0,03–0,04 %)48, 49. Болюсна внутрішньовенна доза сахарози заліза (200 мг заліза) впродовж 10 хв передбачена інструкцією до застосування та краще переноситься, ніж інфузія впродовж 2 год. Внутрішньо-венні препарати декстрану заліза можуть поповнити концентрацію заліза і гемоглобін однією інфузією, але при цьому можуть виникати значні реакції (0,6–0,7 %) і летальні випадки, асоційовані з інфузіями (31 повідомлення між 1976 і 1996 роками)49, 50. Частота побічних ефектів на карбоксимальтозу заліза порівнянна з іншими внутрішньовенними препаратами (22–29 %)51, 52; на сьогоднішній день не наводяться дані про анафілаксію. Слід зазначити, що в інструкціях для медичного застосування, що наведені в Британському національному формулярі, зазначені застереження та протипоказання. Може зустрічатися анафілаксія, тому повинні бути доступні засоби реанімації при внутрішньовенному введенні. Хоча початкове зростання рівня гемоглобіну є більш швидким для парентеральних препаратів заліза53, зростання рівня гемоглобіну через 12 тижнів порівняне із застосуванням пероральних препаратів заліза4, 51, 52.
Переливання крові повинно бути зарезервовано для пацієнтів з симптоматичною анемією, яка зберігається, незважаючи на лікування препаратами заліза, або для груп ризику розвитку серцево-судинної нестабільності через ступінь анемії (C), особливо якщо вони мають проходити ендоскопічне обстеження перед очікуваною відповіддю на лікування препаратами заліза54. Гемотрансфузія повинна бути спрямована на відновлення рівня гемоглобіну до безпечного рівня, але не обов’язково нормального значення. Лікування препаратами заліза після проведеної гемотрансфузії повинно поповнити його запаси.
Подальше ведення пацієнтів
Після досягнення нормальних показників концентрація гемоглобіну та еритроцитарні індекси повинні моніторуватися з певними інтервалами. Ми пропонуємо 3-місячний інтервал впродовж 1-го року, потім ще раз наприкінці 2-го року і якщо симптоми анемії повторяться. Окрім того, пероральні препарати заліза повинні прийматися, якщо гемоглобін або еритроцитарні індекси стають менше норми (концентрація феритину може бути зарезервована для сумнівних випадків). Якщо гемоглобін і еритроцитарні індекси не можуть нормалізуватися, необхідно провести подальше обстеження. Втішає те, що дефіцит заліза не повториться у більшості пацієнтів, у яких причину анемії не було знайдено після проведення ендоскопії верхнього і нижнього відділу шлунково-кишкового тракту, обстеження на целіакію26, 31.
Загальна схема обстеження та лікування
Скорочена схема обстеження показана на рисунку 8, скорочена схема лікування — на рисунку 9. Обидві схеми повинні використовуватися в поєднанні з текстом.
Особливості обстеження жінок у пременопаузі
ЗДА зустрічається в 5–12 % в іншому плані здорових жінок пременопаузального періоду55, 56. Як правило, це пов’язано з менструальними крововтратами, підвищеною потребою в залізі під час вагітності та годуванням груддю або дефіцитом заліза в раціоні харчування57. Результати обстеження шлунково-кишкового тракту серед цих «пацієнтів» були досліджені в кількох дослідженнях58–66. Злоякісні пухлини були виявлені у 0–6,5 % пацієнтів, але два дослідження64–66 з високими рівнями виявлення були піддані критиці як нерепрезентативні. Тому цілком імовірно, що хоча злоякісні пухлини можуть виникати у безсимптомних жінок в пременопаузі, вони зустрічаються надзвичайно рідко. За даними цих досліджень, целіакія зустрічається приблизно у 4 % жінок в пременопаузі. Всі жінки із ЗДА в пременопаузі мають бути обстежені на целіакію (B). Вік є сильним предиктором патології у пацієнтів із ЗДА9. Таким чином, обстеження шлунково-кишкового тракту, викладене вище, рекомендується для безсимптомних жінок із ЗДА в пременопаузі віком 50 років або старше (B).
Відповідно до рекомендацій Департаменту охорони здоров’я щодо підозри на рак верхнього відділу шлунково-кишкового тракту езофагогастродуоденоскопія повинна розглядатися для будь-яких жінок із ЗДА в пременопаузі із симптомами ураження верхнього відділу шлунково-кишкового тракту12.
Обстеження товстого кишечника у жінок в пременопаузі віком < 50 років повинно бути зарезервовано для тих, хто має симптоми ураження товстого кишечника, переконливий сімейний анамнез (два хворих родича першого ступеня споріднення або тільки один хворий родич першого ступеня споріднення віком до 50 років67) або персистуючу ЗДА після лікування препаратами заліза і корекції можливих причин втрати заліза (наприклад, менорагії, донорство крові і погане харчування).
Незважаючи на зручність використання терміну «пременопауза», це менструація, яка впливає на шляхи медичного втручання. Таким чином, ті жінки в пременопаузі, які мають ЗДА, але не менструюють (наприклад, після гістеректомії), повинні бути повністю обстежені.
Пацієнти із супутніми інфекціями
До доцільності обстеження ослаблених пацієнтів і/або із тяжкою супутньою патологією слід підходити індивідуально, залежно від випадку. Фактори, які необхідно брати до уваги, включають: тяжкість і періодичність анемії, ризик підготовки кишечника перед обстеженням нижнього відділу шлунково-кишкового тракту, потенційну здатність пацієнта витримати лікування у разі виявлення причини, пов’язаної з ободовою і прямою кишкою. Найменш інвазивне обстеження повинно бути використане, коли це є доцільним. В літературі відсутні дані про частоту виявлення раку у пацієнтів із ЗДА, які були обстежені на комп’ютерній томографії без підготовки або з мінімальною підготовкою, порівняно зі стандартною комп’ютерною томографією-колонографією або колоноскопією. Попередні дані за даними національного скринінгу раку кишечника показують рівень виявлення 6,9 % для комп’ютерної томографії без підготовки або з мінімальною підготовкою (101 пацієнт) порівняно із 11 % для колоноскопії (>33 000 пацієнтів). Таким чином, незважаючи на те, що комп’ютерна томографія без підготовки може пропустити випадки раку, ми, як і раніше, рекомендуємо цей метод для дуже ослаблених пацієнтів, у яких підготовка кишечника може бути ризикованою. У пацієнтів старечого віку з втратою маси тіла можна отримати вигоду з початкового проведення комп’ютерної томографії черевної порожнини, таза та грудної клітки. У разі виявлення малігнізації проведення ендоскопії може не знадобитися.
Пацієнти, які очікують операції
Швидке та ефективне відновлення запасів заліза необхідне перед невідкладним хірургічним втручанням. При цьому внутрішньовенні препарати заліза, імовірно, є економічно ефективним рішенням, яке може усунути необхідність в переливанні крові.
Молоді люди
Хоча поширеність значної патології шлунково-кишкового тракту у молодих чоловіків є низькою, відсутні дані про доцільність обстеження тих, у кого є ЗДА. За відсутності таких даних ми рекомендуємо обстежувати молодих людей таким же чином, як і чоловіків літнього віку (C). Там, де є очевидна причина крововтрати (наприклад, донорство крові), доцільно уникати обстеження, за виключенням ситуації, коли анемія повторюється всупереч корекції причини крововтрати.
Вагітні жінки
Легкий ступінь ЗДА часто зустрічається під час вагітності. Як тільки діагноз виставлений, слід заохочувати відновлювати запаси заліза. Повинні проводитися ретельний збір анамнезу та обстеження, а саме: пошук в сімейному анамнезі випадків шлунково-кишкової неоплазії або целіакії. Повинно бути проведено обстеження на серологічні маркери целіакії. У разі позитивного результату може бути проведена ендоскопія з біопсією дванадцятипалої кишки; оскільки немає ніяких доказів, цей метод є ненадійним під час вагітності. Якщо є побоювання з приводу патології нижнього відділу шлунково-кишкового тракту, слід розглядати подальше обстеження, хоча у деяких пацієнтів це може бути відкладено до післяпологового періоду. Виконання гнучкої ректороманоскопії без седації під час вагітності вважається цілком безпечним68. Однак недостатньо даних про безпеку проведення колоноскопії під час вагітності. Через її здатність викликати серйозні несприятливі події вона повинна бути зарезервована для дуже значних показань68. Магнітно-резонансна колонографія вважається безпечною для матері та плода; перевагу слід надати цьому методу порівняно із рентгенологічними методами. Національна рада з радіологічної охорони вважає розумним уникати магнітно-резонансного обстеження в першому триместрі вагітності.
Стан після гастроектомії
ЗДА дуже часто зустрічається у пацієнтів з частковою або повною резекцією шлунка69. Імовірно, це пов’язано з поганим хелатоутворенням і абсорбцією заліза в результаті втрати аскорбінової і соляної кислот; з втратою вільного заліза в результаті ексфоліації клітин. Тим не менше, ці пацієнти також мають у два-три рази збільшений ризик раку шлунка після 20 років і, імовірно, підвищений ризик раку товстого кишечника. Рекомендується обстежувати на ЗДА пацієнтів віком старше 50 років, які перенесли резекцію шлунка (С). Баріатрична операція може призвести до дефіциту заліза, але, щоб запобігти проблемі, після операції рекомендуються препарати заліза.
Вживання варфарину та аспірину
Не було знайдено суттєвої різниці в поширеності раку шлунково-кишкового тракту у пацієнтів, які отримують аспірин або варфарин (самостійно або в поєднанні), порівняно з пацієнтами, які не отримують цих ліків9. Отже, ЗДА не повинна трактуватися як спричинена цими препаратами, поки не було завершено обстеження шлунково-кишкового тракту.
Використання інгібіторів протонного насосу
Відсутні дані, які свідчать, що інгібітори протонного насосу спричиняють ЗДА у людей. Пацієнтів, які отримують ці препарати, не слід розглядати як таких, які менш імовірно матимуть новоутворення.
Дефіцит заліза без анемії
Дефіцит заліза без анемії (підтверджується низьким вмістом феритину в сироватці крові — гіпоферитинемія) зустрічається в три рази частіше, ніж ЗДА63, але відсутній консенсус щодо того, чи слід обстежувати цих пацієнтів. Є потреба в подальших наукових дослідженнях з цього питання. Велике за розміром дослідження показує дуже низьку поширеність злоякісних новоутворень шлунково-кишкового тракту серед пацієнтів з дефіцитом заліза без анемії (жінки в постменопаузі і чоловіки — 0,9 %; жінки в пременопаузі — 0 %)63. Більш високі рівні були опубліковані тільки серед більш відібраних груп70, 71. З огляду на відсутність переконливих доказів попередньо ми рекомендуємо проводити серологічне обстеження на целіакію у всіх цих пацієнтів, але з урахуванням того, що інші обстеження зарезервовані для тих, хто має високий ризик (наприклад, вік > 50 років) за результатами обговорення ризиків і потенційних вигод від обстеження верхнього та нижнього відділів шлунково-кишкового тракту (C). Всі інші повинні бути ліковані емпірично пероральними препаратами заліза впродовж 3 місяців і обстежені, якщо дефіцит заліза повторюється впродовж наступних 12 місяців (С).
Запропоновані стандарти якості
Ми вважаємо, що:
1. Всі пацієнти із ЗДА мають бути обстежені на целіакію.
2. Всі пацієнти (окрім менструюючих жінок) із ЗДА і без очевидної причини анемії повинні пройти як ендоскопічне обстеження верхнього відділу шлунково-кишкового тракту, так і колоноскопію або рентгенологічні методи обстеження (якщо не виявлено раку або целіакії).
3. Всі пацієнти отримують лікування препаратами заліза.
4. Всіх тих, хто не відповідає на лікування, слід розглядати для подальшого обстеження.
5. У всіх пацієнтів, які обстежуються на ЗДА, розумні докази ЗДА повинні бути задокументовані із зазначенням відповідних рівнів гемоглобіну, MCH і MCV або значень феритину, або повинно бути пояснено, чому підозрюється дефіцит заліза у пацієнтів, результати аналізу крові яких не є типовими для залізодефіцитної анемії.
«Diagnosis and management of iron deficiency anaemia: a clinical update» (2010)
Терапія із застосуванням препаратів для перорального прийому
Хоча на ринку Австралії представлено більше 100 препаратів, що містять залізо і відпускаються без рецепту, лише в деяких з них вміст елементарного заліза є достатнім для ефективного лікування ЗДА. Як правило, рекомендована доза заліза в складі препарату для перорального прийому для лікування ЗДА у дорослих становить 100–200 мг елементарного заліза на добу, можливий розподіл на 2–3 прийоми30; рекомендована доза для дітей становить 3–6 мг/кг/добу елементарного заліза20, 31. Перелік препаратів, що задовольняють цим вимогам, наведено в табл. 11. Дієтичні добавки — комплекси полівітамінів та мінералів не слід застосовувати для лікування ЗДА, оскільки вміст заліза в них низький та абсорбція може бути замалою.
Дослідження, проведені із включенням жінок та дітей, показали можливість ефективного застосування препаратів заліза для перорального прийому, що асоціюється із зниженням частоти побічних реакцій з боку шлунково-кишкового тракту32. Лікування дорослих меншими дозами може бути забезпечене прийомом таблеток із проміжним вмістом заліза (30–60 мг елементарного заліза) або періодичним прийомом (наприклад, через день або один раз на тиждень); саме цей метод рекомендований ВООЗ для країн, що розвиваються. Обидва методи є прийнятними в лікуванні пацієнтів із ЗДА легкого ступеня тяжкості, у яких спостерігаються розлади шлунка при прийомі препаратів заліза зі стандартною дозою заліза, коли швидке збільшення рівня гемоглобіну не є важливим; втім, препарати у формі таблеток із проміжним вмістом заліза в Австралії відсутні. Небажані явища з боку шлунково-кишкового тракту можна попередити, приймаючи препарат на ніч або з їжею.
Пероральні препарати різних солей заліза при вживанні однакових (в перерахунку на елементарне залізо) доз характеризуються такою самою переносимістю та ефективністю. Хоча відповідні дані є обмеженими, препарати заліза в формах з модифікованим вивільненням забезпечують зниження частоти побічних реакцій з боку шлунково-кишкового тракту при порівняній частоті випадків необхідності відміни подальшого лікування та ефективності33; вивільнення заліза на відстані від ділянки максимальної абсорбції в кишечнику теоретично може знижувати відповідь у деяких пацієнтів.
При пероральному прийомі препаратів заліза ретикулоцитоз настає не пізніше ніж через 72 години, та рівень гемоглобіну повинен зростати приблизно на 20 г/л кожні три тижні. Доцільним є поповнення запасу заліза шляхом прийому відповідних препаратів протягом 3–6 місяців (для дітей впродовж 2–3 місяців20) після нормалізації рівня гемоглобіну. Причини відсутності відповіді на пероральний прийом препаратів заліза наведено в таблиці 13. Якщо після поповнення запасу заліза відбувається рецидив ЗДА, слід наполегливо шукати джерело кровотечі.
«European Guidelines on cardiovascular disease prevention in clinical practice, version 2012»
Генетичні і патологічні дослідження, так само як обсерваційні та інтервенційні дослідження, довели вирішальну роль дисліпідемії, особливо гіперхолестеринемії, у розвитку серцево-судинної патології. Підвищення рівня холестерину ліпопротеїнів високої щільності надає захисний ефект, тоді як підвищення рівня ліпопротеїнів низької щільності і ліпопротеїнів дуже низької щільності надає атерогенний ефект. Хіломікрони і ліпопротеїни дуже низької щільності — не атерогенні, але висока концентрація цих багатих тригліцеридами ліпопротеїнів може бути причиною гострого панкреатиту.
Коментар робочої групи: впродовж громадського обговорення проектів медико-технологічних документів зі стандартизації медичної допомоги пацієнтам із залізодефіцитною анемією надійшла пропозиції щодо виключення пероральних форм препаратів тривалентного (неіонного) заліза з Уніфікованого клінічного протоколу медичної допомоги «Залізодефіцитна анемія».
Слід зазначити, що в настановах ВООЗ, як і в інших настановах (Велика Британія, Австралія, Британська Колумбія, Індія), в контексті пероральних препаратів заліза зазначається, що доза препарату заліза повинна підбиратися із розрахунку на дозу елементарного заліза. При цьому в якості прикладів наводяться препарати двовалентного заліза, а саме: заліза сульфат, заліза глюконат, заліза фумарат. В настановах відсутні рекомендації НЕ застосовувати пероральні препарати тривалентного заліза, в той же час не наголошується на тому, що потрібно застосовувати виключно препарати двовалентного заліза. Пероральні препарати двовалентного заліза доступні, дешеві, зручні для транспортування. Водночас їхній прийом супроводжується побічними реакціями, які впливають на комплаєнс, а отже і результат лікування.
Робочою групою проведено пошук додаткових джерел інформації щодо ефективності пероральних препаратів тривалентного (неіонного) заліза.
Інформаційний пошук проводився серед англомовних настанов, метааналізів та систематичних оглядів, опублікованих в PubMed. Часовими рамками пошук не обмежувався. Для пошуку були використані наступні слова: «iron deficiency» AND «iron preparation» AND «non-ionic». В результаті було знайдено один метааналіз J.E. Toblli, R. Brignoli. Iron(III)-hydroxide polymaltose complex in iron deficiency anemia // Thieme. 2007; 57(6): 431-438 — https://www.thieme-connect.com/DOI/D01?10.1055/s-0031-1296692.
«Iron(III)-hydroxide polymaltose complex in iron deficiency anemia/ review and meta-analysis (2007)» охоплює 6 досліджень (319 дорослих в групі комплексу заліза з полімальтозою; 238 дорослих в групі сульфату заліза). За результатами даного дослідження повідомляється, що побічні реакції зустрічалися рідше в групі комплексу заліза з полімальтозою (14,9 %), ніж в групі заліза сульфату (34,1 %; р < 0,001). В кінці дослідження (8–13 тижнів) середній рівень гемоглобіну складав 12,13 (1,19 г/дл) в групі заліза полімальтозного комплексу та 11,94 (1,84 г/дл) в групі заліза сульфату [зважена різниця середніх = 0,01 г/дл (95 % ДІ –0,23; 0,21)]. Не всі дослідження наводять дані щодо рівнів заліза (вище в групах заліза полімальтозного комплексу), насиченості трансферину (немає різниці) або феритину (нижче в групах заліза полімальтозного комплексу). Побічні реакції (зокрема, проблеми верхнього відділу шлунково-кишкового тракту, забарвлення зубів та діарея) зустрічаються рідше в групах заліза полімальтозного комплексу (14,9 %) порівняно з групами заліза сульфату (34,1 %; Р < 0,001).
За результатами проведеної експертної оцінки наявних даних можна зробити висновки про те, що доказова база на користь ефективності пероральних препаратів тривалентного заліза значно менша за доказову базу ефективності пероральних препаратів двовалентного заліза. Існують дані про роль препаратів заліза в перекисному окисленні ліпідів: препарати двовалентного заліза (заліза сульфат) більше сприяють окисленню ліпопротеїнів дуже низької та низької щільності, ніж препарати тривалентного заліза (заліза полімальтозний комплекс). При цьому в Європейській настанові з профілактики серцево-судинних захворювань (European Guidelines on cardiovascular disease prevention in clinical practice, version 2012) наголошується на тому, що підвищення рівня ліпопротеїнів низької і дуже низької щільності спричиняє атерогенний ефект. Дані свідчать про однаково ефективний вплив пероральних препаратів як двовалентного (заліза сульфат), так і тривалентного (заліза полімальтозний комплекс) заліза на гематологічні показники. При цьому доведено, що прийом препаратів тривалентного заліза супроводжується меншою кількістю побічних реакцій (зокрема, з боку шлунково-кишкового тракту).
В пункті 13.1.1 7-го випуску Державного формуляра лікарських засобів, що затверджений наказом МОЗ України від 30.03.2015 року № 183, представлені наступні препарати заліза:
1) препарати двовалентного заліза для перорального застосування: заліза сульфат;
2) препарати трьохвалентного заліза: заліза сахарат, заліза гідроксид з полімальтозою;
3) комплексні лікарські засоби, що містять залізо та фолієву кислоту: заліза гідроксид з полімальтозою + кислота фолієва;
4) препарати заліза у комбінації із різними сполуками: заліза амонійного цитрат + ціанокобаламін + кислота фолієва; заліза фумарат + ціанокобаламін + кислота фолієва; заліза сульфат + кислота фолієва; заліза сульфат + серин; заліза глюконат + марганцю глюконат + міді глюконат; заліза сульфат + кислота аскорбінова.
«Diagnosis and management of iron deficiency anaemia: a clinical update» (2010)
Терапія із парентеральним введенням препаратів заліза
Терапія із внутрішньом’язовим (в/м) введенням препаратів заліза
Хоча внутрішньом’язове введення препаратів заліза є ефективним, ін’єкції є болісними, асоціюються із стійким забарвленням шкіри в місці ін’єкції і не є безпечнішими за внутрішньовенне введення. Отже, такий спосіб введення не рекомендується34, за винятком випадків, коли інші способи не можливо здійснити внаслідок об’єктивних причин (наприклад, коли показане парентеральне введення препаратів заліза в умовах неможливості внутрішньовенного введення).
Терапія із внутрішньовенним введенням препаратів заліза
Хоча пероральний прийом препаратів заліза є наріжним каменем в лікуванні ЗДА, деяким пацієнтам показане внутрішньовенне введення препаратів заліза (табл. 15).
Можливо, небажання вводити препарати заліза внутрішньовенно ґрунтується на побоюванні щодо виникнення серйозних алергічних реакцій, оскільки у 0,6 % пацієнтів при введенні декстрану заліза із високою молекулярною масою (більше не застосовується в Австралії) спостерігались загрозливі для життя алергічні реакції35. Наразі в Австралії представлені такі препарати заліза для парентерального введення: полімальтоза заліза [Ferrum H (Aspen Pharmacare), Ferrosig [Sigma Pharmaceuticals]) та цукроза заліза [Venofer (Aspen Pharmacare)]. Інфузія «повною дозою» (тобто дозою, достатньою для поповнення запасу заліза при одноразовому проведенні) можлива лише із застосуванням полімальтози заліза.
Полімальтоза заліза
Хоча полімальтоза заліза (декстрин заліза) широко застосовувалась в Австралії з 1960-х років, в літературі є лише обмежені дані стосовно безпеки, особливо при застосуванні не в терапії пацієнтів із хворобами нирок. За результатами аудиту, проведеного в Австралії, з безпеки та переносимості полімальтози заліза, при застосуванні в лікарнях не виявлено випадків анафілактичних реакцій та інших ускладнень з боку серцевої та респіраторної системи; при проведенні 401 інфузії відмічено лише нечасті незначні побічні реакції під час інфузії36. Такий висновок суперечить клінічному досвіду деяких членів нашої групи. Відповідно до результатів нещодавно проведеного дослідження, побічні реакції, що не потребують лікування, в тому числі головний біль, гарячка та артралгії впродовж 2 днів після інфузії, є частими та спостерігаються у 26 % пацієнтів37.
Середня тривалість інфузії «повної дози» полімальтози заліза (достатньої для поповнення запасу заліза; це, як правило, 1000–2500 мг для дорослих), при здійсненні із швидкістю, зазначеною в затвердженій в Австралії інструкції на лікарський засіб, становить приблизно 5 годин. Результати нещодавно проведеного огляду методів, що застосовуються в різних закладах охорони здоров’я в штаті Новий Південний Уельс, свідчать про широкі розбіжності в практиці проведення інфузії та премедикації38. Лише в кількох публікаціях міститься інформація про найменшу швидкість безпечного інфузійного введення або «повною дозою» або подрібненими дозами пацієнтам із хворобами нирок (по 500–1000 мг або менше). В деяких нефрологічних відділеннях в Австралії розроблено протоколи для проведення інфузій із більшою швидкістю (Rowan Walker, заступник директора відділення нефрології, Королівська клініка Мельбурну, штат Вікторія та Ashley Irish, старший нефролог, Королівська клініка м. Перт, штат Західна Австралія, із персонального спілкування). Проведення інфузії полімальтози заліза «повною дозою» із більшою швидкістю успішно здійснювалось деякими авторами (SC F-B, RT, PRG) в спеціалізованих амбулаторних центрах із проведенням стандартної премедикації або без неї. Звіти про цей досвід будуть опубліковані після завершення проспективних клінічних досліджень, які проводяться в Австралії та Новій Зеландії, оскільки застосування полімальтози заліза за межами цих країн є обмеженим. У нас немає інформації стосовно прискореного введення полімальтози заліза дітям.
Коментар робочої групи: станом на 29 липня 2015 року в Україні не зареєстровані парентеральні форми полімальтози заліза з показаннями для лікування ЗДА повною дозою.
Цукроза заліза
Витрати на цукрозу заліза відшкодовуються за Програмою відшкодування витрат на фармацевтичну продукцію лише у випадку застосування в терапії дефіциту заліза у пацієнтів із хронічними хворобами нирок, які отримують засоби еритропоетичної дії, у яких спостерігається системна реакція на полімальтозу заліза. Тим не менше, препарат зареєстрований за показаннями для лікування ЗДА в країнах Європи вже кілька десятиліть та характеризується доведеним профілем безпеки39. Його не можна застосовувати у формі інфузії «повною дозою» (внаслідок швидкості вивільнення вазоактивного заліза), замість цього препарат слід вводити внутрішньовенно кількома меншими дозами (як правило, по 100–200 мг). Всупереч цьому обмеженню, застосування препарату є гнучкою альтернативою застосуванню полімальтози заліза; препарат зареєстрований до застосування у формі «повільної внутрішньовенної ін’єкції» в багатьох країнах, в тому числі у Великій Британії та Новій Зеландії. Застосування цукрози заліза може бути корисним для часткового поповнення запасу заліза, допомагає забезпечити скоріше зростання вмісту гемоглобіну, коли це є необхідним за клінічними показаннями. Запас заліза може бути поповнений препаратами для перорального прийому (якщо вони переносяться пацієнтом), внутрішньовенним введенням полімальтози заліза або подальшим внутрішньо-венним введенням цукрози заліза. Деякими комітетами із госпітальних лікарських засобів дозволяється застосування цукрози заліза, незареєстрованої за цими показаннями, для лікування ЗДА, в тому числі при проведенні хірургічних втручань.
Нові внутрішньовенні препарати заліза
Існує ряд нових препаратів заліза для внутрішньовенного введення. Як виявилось, карбоксимальтоза заліза, що вже застосовується в Європі, але на яку ще не надано реєстраційне посвідчення в Австралії, характеризується меншим ризиком розвитку серйозних побічних реакцій, дозволена інфузія дозою 1000 мг впродовж 15 хвилин40. Іншими препаратами, представленими на міжнародному ринку, є декстрани заліза із низькою молекулярною масою, глюконат заліза та ферумокситол.
Коментар робочої групи: станом на червень 2015 року ферумокситол відсутній в ATC/DDD класифікації (ВООЗ). В Україні ферумокситол не зареєстрований.
Переливання еритроцитів
Переливання еритроцитів залишається методом лікування ЗДА, що широко застосовується41. Цей метод є дорогим та потенційно небезпечним. Для пацієнтів, здорових за іншими показниками, переливання еритроцитів асоціюється із додатковим ризиком та не виконує завдання — поповнення спустошеного запасу заліза. Пероральний прийом препаратів заліза в адекватній дозі забезпечує нормалізацію рівня гемоглобіну за декілька тижнів, а внутрішньовенне введення препаратів заліза забезпечує прогнозоване збільшення в коротші терміни, коли це є клінічно важливим. Переливання еритроцитів асоціюються із несприятливими наслідками, в тому числі гіперволемією (спостерігається приблизно у 1 % пацієнтів), а також із рядом імунологічних та інфекційних загроз. Отже, означений метод слід застосовувати виключно у випадках необхідності надання миттєвої, цілеспрямованої допомоги пацієнтам із анемією високого ступеня тяжкості, яка загрожує функціонуванню органа-мішені (наприклад, при стенокардії або серцевій недостатності), або при ЗДА, ускладненій серйозною, гострою кровотечею, яку не вдається зупинити. Після переливання еритроцитів завжди необхідна терапія із введенням препаратів заліза для поповнення запасу заліза в організмі.
British Committee for Standards in Haematology «UK guidelines on the management of iron deficiency in Pregnancy» (2011)
Показання для гемотрансфузії і пов’язані з цим ризики
Питання безпеки, високої вартості та доступності донорської крові сприяли більш ретельному вивченню практики гемотрансфузії (Департамент охорони здоров’я, 2007). Існує безліч потенційних небезпек, пов’язаних із гемотрансфузією, але частіше вони виникають через клінічні та лабораторні помилки. Окрім того, специфічні ризики для жінок дітородного віку включають потенційну сенсибілізацію (індуковану гемотрансфузією) до антигенів еритроцитів, розглядається ризик розвитку в майбутньому гемолітичної хвороби плода.
Масивна акушерська кровотеча широко визнається як важлива причина хворобливості та смертності і вимагає оперативного використання крові та її компонентів в рамках відповідної медичної допомоги (Lewis, 2007). В останніх настановах Британського коледжу акушерства та гінекології (RCOG, 2009) вказується на необхідності всебічного охоплення міждисциплінарним підходом, поєднання як інтраопераційного порятунку клітин в цих умовах, так і стратегії щадної гемотрансфузії. Однак у випадках немасивних крововтрат дані аудиту показують, що висока частка гемотрансфузій в післяпологовому періоді може бути недоречною при недостатньому використанні препаратів заліза (Parker et al., 2009; Butwick et al., 2009; So-Osman et al., 2010).
Клінічну оцінку і концентрацію гемоглобіну необхідно враховувати для обрання кращого способу відновлення запасів заліза в післяпологовому періоді. Там, де немає кровотечі, рішення проводити гемотрансфузію повинно прийматися індивідуально на підставі поінформованості. У практично здорових, безсимптомних пацієнтів мало доказів на користь гемотрансфузій (ASATF, 1996). Вони повинні бути зарезервовані для жінок з тривалими кровотечами або ризиком подальшої кровотечі, з неминучим негативним впливом на серце або вираженими симптомами, які потребують термінової корекції.
Якщо після ретельного розгляду було обрано проведення гемотрансфузії, то жінки повинні бути всебічно консультовані щодо потенційних ризиків, повинна бути надана інформація в письмовому вигляді і отримана згода на проведення гемотрансфузії.
Рекомендації
При масивних акушерських кровотечах слід використовувати кров і її компоненти, як зазначено в місцевій мультидисциплінарній настанові. Щоб зменшити використання донорської крові, в деяких випадках повинна зберігатися інтраопераційно втрачена кров (1А).
На додаток до настанови з масивних акушерських кровотеч акушерські пункти повинні мати настанови щодо критеріїв проведення гемотрансфузії у жінок з анемією, які не мають активної крововтрати (1А).
Рішення щодо необхідності проведення гемотрансфузії для жінок в післяпологовому періоді повинні ґрунтуватися на ретельній оцінці, включаючи питання існування ризику кровотечі, порушення серцевої діяльності або симптомів, що вимагають невідкладної уваги, розгляд в якості альтернативного методу лікування пероральними або парентеральними препаратами заліза (1А).
Жінкам, які отримують гемотрансфузії, повинна бути надана повна інформація про показання до гемотрансфузії і доступні альтернативні методи лікування.
В медичній документації має бути задокументована поінформована згода (1A).
Швидка діагностика дефіциту заліза в антенатальному періоді з подальшим призначенням препаратів заліза може зменшити необхідність в подальших гемотрансфузіях (1A).
«Diagnosis and management of iron deficiency anaemia: a clinical update» (2010)
Висновки
ЗДА залишається поширеною та серйозною проблемою. Для полегшення навантаження внаслідок цієї хвороби заходи в Австралії повинні ґрунтуватись на стратегіях, завданням яких є збільшення поінформованості лікарів та населення стосовно цієї проблеми, забезпечення доступності прийнятних засобів для перорального прийому, полегшення доступу до сучасних методів лікування із застосуванням препаратів заліза для внутрішньовенного введення, проведення проспективних досліджень для визначення епідеміології, діагностики та лікування ЗДА, необхідних для розробки настанов із найкращої практики лікування.
Коментар робочої групи: залізодефіцитна анемія є актуальним медичним питанням для України. Дана адаптована клінічна настанова висвітлює медичні аспекти, пов’язані із діагностикою та лікуванням цього стану. Медичний персонал має проводити серед громади санітарно-просвітницьку роботу всіма доступними засобами. Це буде сприяти обізнаності людей з причинами та наслідками залізодефіцитної анемії; покращить порозуміння між лікарями та пацієнтами; зменшить ресурсне навантаження на систему охорони здоров’я, пов’язане з витратами на лікування тяжких анемій та їх ускладнень та інше.
Перед сімейними лікарями ця настанова окреслює коло питань, до яких потрібно підійти з наукової точки зору. Наприклад, існує потреба в сучасних репрезентативних даних щодо норми рівня гемоглобіну в Україні, в тому числі серед дітей.