Газета «Новости медицины и фармации» Гастроэнтерология (563) 2016 (тематический номер)
Вернуться к номеру
Клинические практические рекомендации: аутоиммунный гепатит (в сокращении) Европейская ассоциация по изучению болезней печени (European Association for the Study of the Liver, EASL)
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 35-43
Введение
Аутоиммунный гепатит (АИГ) — первое заболевание печени, для которого в контролируемых клинических исследованиях была убедительно продемонстрирована эффективность терапевтического вмешательства, лечения кортикостероидами. Тем не менее 50 лет спустя АИГ по-прежнему остается одной из основных проблем в плане диагностики и лечения. Есть две основные причины этого явного противоречия: во-первых, АИГ является относительно редким заболеванием. Во-вторых, АИГ является очень гетерогенным заболеванием.
Как и для других редких заболеваний, клинические исследования затруднены вследствие ограниченного количества пациентов, которые могут принять в них участие. Возможно, и что более важно, интерес фармацевтической промышленности в отношении разработки эффективной специфической терапии редких заболеваний незначителен ввиду ограниченности рынка для реализации такой продукции. Значительная неоднородность пациентов и клинических проявлений болезни ограничивает диагностические и дальнейшие терапевтические исследования. Возрастной диапазон АИГ чрезвычайно широк: впервые заболеть могут как дети грудного возраста, так и восьмидесятилетние люди. АИГ может протекать в очень легкой субклинической форме, а может иметь и очень острое течение, в редких случаях приводя к молниеносной печеночной недостаточности. Иногда для АИГ характерны довольно резкие изменения в течении заболевания с периодами выраженных спонтанных ремиссий, резких обострений и/или вялотекущего течения. АИГ может сочетаться с рядом других заболеваний печени, в частности с холестатическими заболеваниями печени — первичным билиарным циррозом (ПБЦ) или первичным склерозирующим холангитом (ПСХ), а также с медикаментозным поражением печени (МПП), алкогольным или неалкогольным стеатогепатитом (НАСГ), вирусным гепатитом. Наличие каждого из заболеваний вызывает дополнительные диагностические и терапевтические затруднения. Несмотря на подобные проблемы и затруднения, в диагностике и лечении АИГ были достигнуты поразительные успехи, и сегодня пациенты в специализированных центрах имеют благоприятный прогноз как в отношении выживания, так и качества жизни.
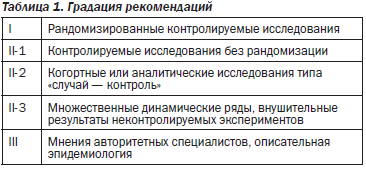
Цель данного практического руководства заключается в обеспечении гепатологов и врачей общей практики рекомендациями по диагностике и лечению АИГ, которые позволят улучшить оказываемую пациентам помощь. Ввиду ограниченных данных широкомасштабных контролируемых исследований многие рекомендации основаны на согласованном мнении экспертов. Это в некоторой степени ограничивает настоящие рекомендации Европейской ассоциации по изучению болезней печени (EASL), но в то же время является и их особым достоинством: экспертное мнение в данных рекомендациях основано на интенсивных дискуссиях экспертов крупных лечебных центров. Ключевая рабочая группа имеет личный опыт лечения более тысячи пациентов с АИГ, а рекомендации были рассмотрены как управляющим советом EASL, так и независимыми экспертами с аналогичным внушительным опытом. Таким образом, рекомендации основаны на крупнейшем доступном на сегодня опыте. В то же время мы сформулировали ключевые научные вопросы, вытекающие из многочисленных обсуждений, обусловленных ограниченностью имеющихся в настоящее время знаний. Все рекомендации данного руководства были одобрены единогласно (100 %) в анонимном режиме. Градация рекомендаций выполнена в соответствии с Системой по оценке, разработке и экспертизе рекомендаций (Grading of Recommendations Assessment, Development and Evaluation, GRADE) (табл. 1) [1].
Эпидемиология АИГ
АИГ — неизлечимое хроническое заболевание печени, которое поражает в основном женщин и характеризуется наличием гипергаммаглобулинемии даже при отсутствии цирроза, наличием циркулирующих аутоантител, ассоциацией с антигенами DR3 или DR4 главного комплекса гистосовместимости человека (human leukocyte antigens, HLA), гистологической картиной межуточного гепатита и удовлетворительным ответом на иммуносупрессивную терапию [2–5]. При отсутствии лечения заболевание часто приводит к циррозу печени, печеночной недостаточности и смерти.
АИГ считается относительно редким заболеванием, его распространенность в Европе составляет от 16 до 18 случаев на 100 000 жителей и увеличивается и у женщин, и у мужчин (II-2). АИГ может возникать во всех популяциях и возрастных группах (II-2) [6–11].
Клинические характеристики
Клинические признаки АИГ
В начале 1950-х годов шведским врачом Jan Waldenström [22], а позднее Kunkel et al. [23] был описан новый тип хронического гепатита с несколькими характерными особенностями, такими как предрасположенность у молодых женщин, прогрессирующее течение, часто с фатальным исходом, сопровождающееся артралгией, эндокринной дисфункцией, кожными стриями и акне, и очень высоким уровнем иммуноглобулинов в сыворотке крови, связанным с избытком плазматических клеток в печени. В 1955 г. у данной группы пациентов был описан LE-клеточный феномен (феномен клеток красной волчанки) и группой Ian Mackay в 1956 г. был представлен термин «волчаночный гепатит» [24], но десять лет спустя этот термин был заменен термином «аутоиммунный гепатит» [25], который после ряда различных предложенных терминов был окончательно принят в 1990 г. Международной группой по АИГ (International AIH Group, IAIHG) [26].
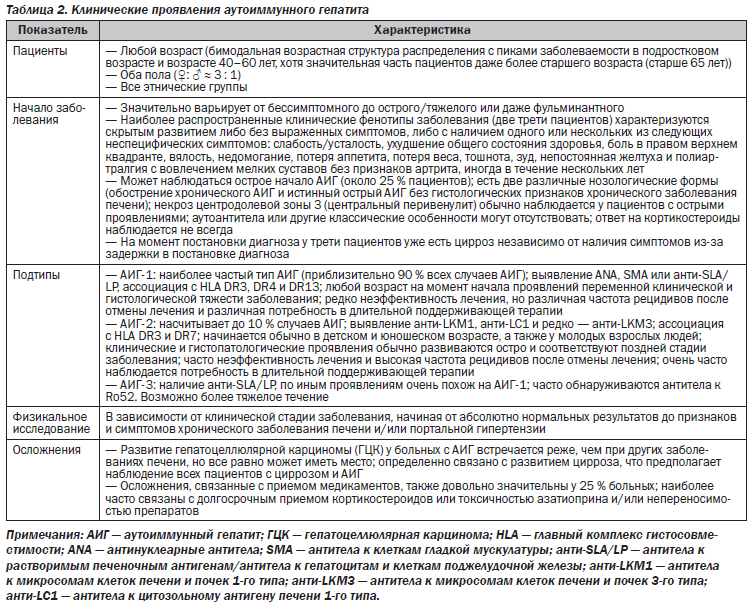
В настоящее время достоверно известно, что АИГ является клинически обособленным синдромом и характеризуется значительной неоднородностью клинических, лабораторных и гистологических проявлений (табл. 2).
Поэтому возможность наличия АИГ следует рассматривать у любого пациента с острым или хроническим заболеванием печени, особенно при наличии гипергаммаглобулинемии, а также признаков других аутоиммунных заболеваний (табл. 3) [2–4, 26–28]. Заболевание может также поражать мужчин (около 25–30 % всех больных АИГ) и наблюдаться в любом возрасте и в любых этнических группах [8–13, 29–33]. В большинстве исследований сообщается о бимодальной возрастной структуре распределения гепатита: первый пик заболевания приходится на детский/подростковый возраст, а второй — на средний возраст 40–60 лет [8, 11, 13, 33, 34]. Недавние исследования продемонстрировали возрастающее количество случаев заболевания и у пациентов пожилого возраста (старше 65 лет) [30–32, 35]. Недавно было продемонстрировано, что надлежащее внимание должно быть уделено качеству жизни, связанному со здоровьем (КЖСЗ), поскольку среди пациентов с АИГ наблюдается высокая частота ранее не распознанных психических нарушений с симптомами депрессии и тревоги [36].
Диапазон клинических проявлений варьирует от отсутствия каких-либо очевидных признаков или симптомов заболевания печени до тяжелой и почти идентичной острому или даже фульминантному эпизоду вирусного гепатита формы (табл. 2) [3, 4, 37]. На самом деле примерно у 25 % пациентов наблюдается острое развитие АИГ, фенотипически схожее с острым гепатитом, вызванным другими причинами [33, 38]. Однако острое развитие АИГ фактически позволяет предполагать две разные нозологические формы. Одной из них является обострение хронического АИГ (случаи обострения недиагностированного или ошибочно диагностированного АИГ), а другой — подлинный острый АИГ без хронических гистологических изменений (острая форма АИГ, табл. 2) [33, 37–39]. Отметим, что у некоторых пациентов с острым развитием АИГ уровень иммуноглобулина G (IgG) может оставаться в пределах нормы, а результаты проводимого в качестве первичного скрининга анализа на антинуклеарные антитела (antinuclear antibodies, ANA) и/или антитела к клеткам гладкой мускулатуры (smooth muscle antibodies, SMA) могут быть отрицательными; таким образом, врач может не заподозрить АИГ [3, 4, 34, 40, 41]. В таких случаях может оказаться полезным более развернутое и чувствительное серологическое исследование на аутоиммунную патологию печени. Кроме того, у некоторых пациентов тест на наличие аутоантител может дать положительные результаты только через несколько месяцев после начала болезни. Некоторые случаи острого АИГ редко могут прогрессировать до острой печеночной недостаточности, о чем следует помнить. Определение АИГ как этиологического фактора острого гепатита и/или фульминантной печеночной недостаточности очень важно, потому что задержка в постановке диагноза и вследствие этого задержка начала лечения приводят к худшим исходам АИГ, в то время как проведение иммуносупрессивной терапии стероидами может помочь избежать трансплантации печени (ТП) [33, 37–39, 41–43].
Обычно (приблизительно у одной трети пациентов) клиническая картина характеризуется наличием одного или нескольких неспецифических симптомов, перечисленных в табл. 2 [8, 11, 13, 18, 21, 29, 33, 44, 45]. Аменорея также распространена, в то время как макулопапулезная кожная сыпь и необъяснимая субфебрильная температура тела являются редкими проявлениями. Результаты физикального исследования могут быть нормальными, но иногда наблюдается увеличение печени, порой болезненное, спленомегалия, и при развитии выраженного цирроза можно обнаружить такие признаки и симптомы хронического заболевания печени, как ладонная эритема и паукообразные гемангиомы. На более поздних стадиях доминирует клиническая картина портальной гипертензии, включая наличие асцита, варикозного расширения вен пищевода и портальной гипертензивной гастропатии, цитопении вследствие гиперспленизма, а также печеночной энцефалопатии.
Приблизительно для трети пациентов характерно скрытое начало и постепенное прогрессирование без видимых симптомов на момент постановки диагноза (бессимптомное течение), а окончательный диагноз обычно устанавливается во время выяснения причины необъяснимого повышения уровня аминотрансфераз в сыворотке при рутинном исследовании или исследовании, проведенном по другим причинам [8, 11, 13, 29, 31, 32, 44, 45]. Тем не менее примерно у трети взрослых пациентов и приблизительно у половины детей на момент постановки диагноза выявляется уже поздняя стадия с наличием цирроза, который в большинстве исследований связан с низкой общей выживаемостью независимо от наличия или отсутствия симптомов [8, 13, 29, 44–47]. Цирроз вместе с наличием гистологической картины хронической патологии по результатам биопсии печени у пациентов с острым развитием указывают на то, что у пациентов, вероятно, имело место бессимптомное заболевание в течение длительного времени [37, 38, 42]. На самом деле это одна из серьезных диагностических проблем, так как бессимптомное течение заболевания часто предшествует развитию симптомов болезни, при том что длительные периоды бессимптомного течения могут также иметь место после развития заболевания.
В соответствии с типом обнаруженных антител было предложено разделение заболевания на два или три подтипа. Первоначально было предложено два основных типа, АИГ-1 и АИГ-2 (табл. 2). АИГ-1 характеризуется наличием ANA и/или SMA [3, 4, 27, 28, 34, 40]. АИГ-2 характеризуется обнаружением специфических антител к микросомам клеток печени и почек 1-го типа (anti-liver/kidney microsomal antibody type 1 анти-LKM1) или, редко, — антител к микросомам клеток печени и почек 3-го типа (анти-LKM 3) и/или антител к цитозольному антигену клеток печени 1-го типа (antibodies against liver cytosol type 1 antigen, анти-LC1) [3, 4, 27, 28, 34, 40]. Это различие было изначально основано лишь на циркуляции аутоантител, но затем были установлены и другие различия (табл. 2). Аналогичным образом открытие антител к растворимым печеночным антигенам (antibodies against soluble liver antigens, анти-SLA), которые, как оказалось позже, идентичны ранее описанным антителам к гепатоцитам и клеткам поджелудочной железы (antibodies against liver pancreas, анти-LP) и поэтому называются антителами к SLA/LP (анти-SLA/LP), привело к определению третьего подтипа аутоиммунного гепатита, АИГ-3 (табл. 2) [48]. Различия между АИГ-1 и АИГ-3 казались менее выраженными, чем между АИГ-1 и АИГ-2, но некоторые авторы предположили более тяжелое течение заболевания и необходимость пожизненной иммуносупрессивной терапии если не у всех, то у большинства пациентов с АИГ-3 [48–50]. Достоверность данной классификации, однако, вызывает сомнения и подлежит дальнейшему обсуждению [3].
Дифференциальная диагностика аутоиммунного гепатита
Другие аутоиммунные заболевания печени:
— первичный билиарный цирроз;
— первичный склерозирующий холангит (в том числе первичный склерозирующий холангит малых протоков);
— IgG4-ассоциированный холангит.
Хронический вирусный гепатит:
— хронический гепатит В с гепатитом дельта или без такового;
— хронический гепатит С.
Холангиопатия вследствие инфицирования вирусом иммунодефицита человека.
Алкогольная болезнь печени.
Медикаментозное поражение печени.
Гранулематозный гепатит.
Гемохроматоз.
Неалкогольный стеатогепатит.
Дефицит α1-антитрипсина.
Болезнь Вильсона — Коновалова.
Системная красная волчанка.
Целиакия.
Наличие АИГ следует подозревать у любого пациента с острым или хроническим заболеванием печени, в особенности при выявлении гипергаммаглобулинемии (II-2).
Быстрая и своевременная диагностика имеет решающее значение, так как нелеченый АИГ ассоциируется с высоким уровнем смертности (I).
Приблизительно 1/3 взрослых пациентов и около 1/2 детей с АИГ имеют цирроз на момент манифестации заболевания (II-2).
Острое развитие АИГ может наблюдаться как в виде обострения ранее не выявленного АИГ, так и впервые развившегося острого АИГ без гистологических изменений, характерных для хронического заболевания (II-2).
АИГ связан со многими другими аутоиммунными заболеваниями (II-2).
Всем детям с диагнозом АИГ необходимо выполнить МРТ-холангиографию с целью исключения аутоиммунного склерозирующего холангита (II-2).
Пациентам с АИГ и циррозом печени следует выполнять УЗИ печени каждые 6 месяцев с целью скрининга на предмет ГЦК (II-2).
Пациентов, которые принимают иммуносупрессоры, следует консультировать по поводу превентивных мер в отношении УФ-излучения. После длительной иммуносупрессивной терапии может быть рассмотрена необходимость дерматологического мониторинга на предмет немеланомных злокачественных новообразований кожи (III).
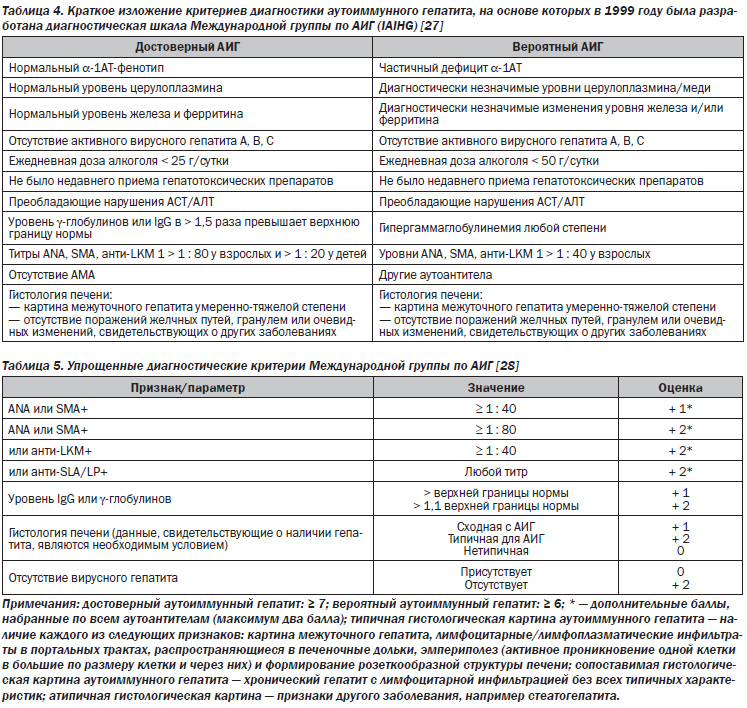
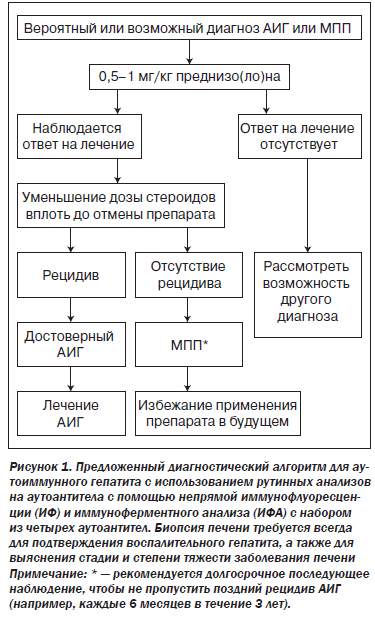
АИГ является клиническим диагнозом. Диагноз АИГ основывается на присутствии аутоантител, гипергаммаглобулинемии и типичной или сопоставимой гистологической картины (II-2).
Наличие повышенного уровня IgG, особенно при отсутствии цирроза, является отличительным признаком АИГ. Изолированное повышение уровня IgG при отсутствии повышения уровней IgA и IgM в особенности указывает на АИГ (II-3).
Нормальный уровень IgG или γ-глобулинов не исключает наличие АИГ. У большинства из этих пациентов наблюдается снижение уровня IgG во время лечения (III).
У подавляющего большинства пациентов с АИГ присутствуют циркулирующие органонеспецифические антитела. Профили аутоантител используются для классификации АИГ:
— АИГ-1 (АNА- и/или SMA-положительный);
— АИГ-2 (анти-LKM1-, анти-LKM3- и/или анти-LC-1-положительный);
— АИГ-3 (анти-SLA/LP-положительный).
Клиническая роль данных подтипов сомнительна (II-2).
Непрямая иммунофлуоресценция является методом выбора для определения ANA, SMA, анти-LKM и анти-LC-1. Иммунологические анализы (ИФА/вестерн-блоттинг) являются анализами выбора для выявления анти-SLA/LP. Методы и их референсные значения должны быть предоставлены лабораторией (III).
Гистологическое исследование на предмет гепатита является необходимым условием для постановки диагноза АИГ и должно быть частью первичного обследования (II-2).
Морфологические признаки, которые были бы патогномоничны для АИГ, отсутствуют, но картина межуточного гепатита, перипортальный некроз, эмпериполез и розеткообразование указывают на АИГ. Патологоанатому следует сообщать об этих особенностях при оценке степени тяжести (индексе активности гепатита) и стадии заболевания (II-2).
При остром развитии АИГ может наблюдаться перицентральный некроз, гистологически неотличимый от МПП (II-3).
Упрощенная система балльной оценки IAIHG (2008 г.) очень полезна для ежедневной клинической практики (II-2). Пересмотренная система оценки (1999 г.) IAIHG, в которой учитывается ответ на лечение, может быть полезна при диагностике в сложных случаях (II-2).
Взрослым пациентам с АИГ и изменениями лабораторных показателей, указывающими на холестаз, следует выполнять MРТ-холангиографию для исключения склерозирующего холангита (II-3).
Могут наблюдаться одновременно признаки АИГ и холестатических заболеваний печени как при диагностике, так и во время последующего наблюдения. Пациентам с признаками холестаза следует проводить диагностические исследования на предмет ПБЦ и ПСХ (II-2).
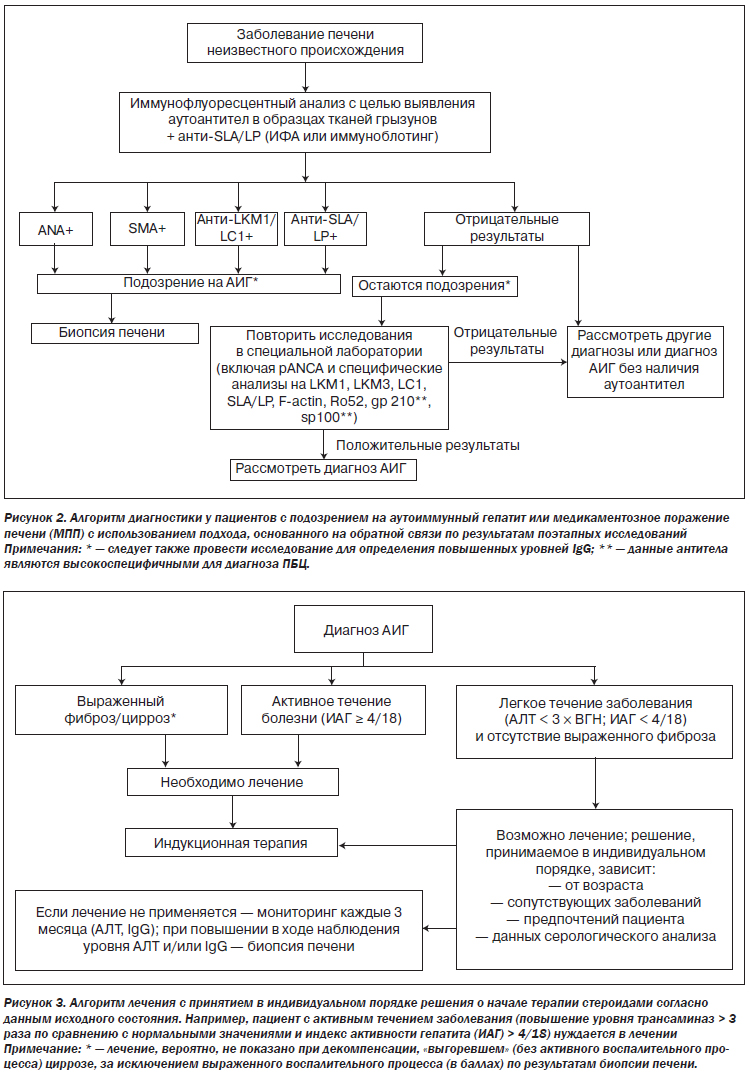
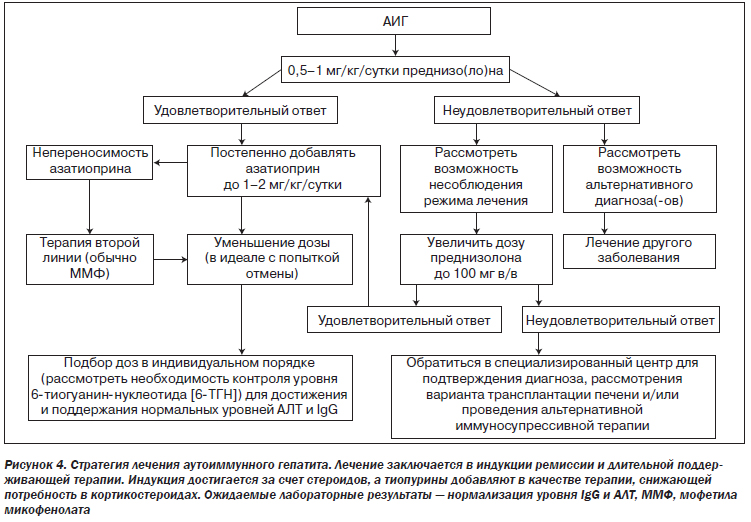
Лечение АИГ должно быть направлено на достижение полной биохимической и гистологической ремиссии с целью предотвращения дальнейшего прогрессирования заболевания печени (II-2).
Лечение пациентов с АИГ также должно предусматривать раннее распознавание внепеченочных проявлений и симптомов, ассоциированных аутоиммунных заболеваний, а также наблюдение за возникновением осложнений, специфичных для заболевания или лечения (III).
Всем пациентам с активным АИГ следует проводить соответствующую терапию (I).
Режим лечения следует адаптировать согласно степени активности заболевания (III).
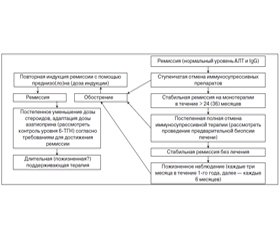
Отказаться от лечения можно только у пациентов с (спонтанной) ремиссией, но их следует внимательно наблюдать (каждые три-шесть месяцев) (III).
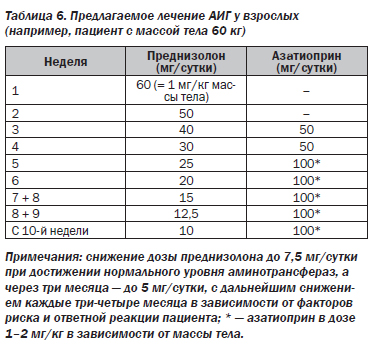
Терапия первой линии АИГ заключается в первоначальном назначении преднизо(ло)на с последующим добавлением азатиоприна через две недели (I).
Стартовая доза преднизо(ло)на должна составлять 0,5–1 мг/кг/сутки. Более высокие стартовые дозы позволяют быстрее добиться ремиссии, однако с соответствующими побочными эффектами (II-2).
Азатиоприн можно начинать применять при уровне билирубина ниже 6 мг/дл (100 мкмоль/л) и в идеале через две недели после начала лечения стероидами. Стартовая доза должна составлять 50 мг/сутки и увеличиваться в зависимости от токсичности и реакции организма до поддерживающей дозы 1–2 мг/кг (II-2).
Алгоритм лечения АИГ должен основываться на ответной реакции пациента; лечение следует подбирать в индивидуальном порядке (III).
Отсутствие удовлетворительного ответа на лечение требует пересмотра диагноза или анализа соблюдения режима лечения (II-2).
У пациентов с неудовлетворительным ответом на лечение, несмотря на повторное подтверждение диагноза и соблюдение режима лечения, дозу преднизолона и азатиоприна следует увеличить или же использовать альтернативные лекарственные средства (II-2).
Лечение пациентов с острым тяжелым АИГ следует начинать с высоких доз внутривенных кортикостероидов (≥ 1 мг/кг) как можно раньше. При отсутствии улучшения в течение семи дней следует срочно рассмотреть возможность неотложной трансплантации печени (III).
Биохимическая ремиссия заключается в нормализации уровней IgG и трансаминаз. Гистологическая ремиссия определяется наличием нормальной гистологической картины или минимальных признаков гепатита (ИАГ < 4) (II-2).
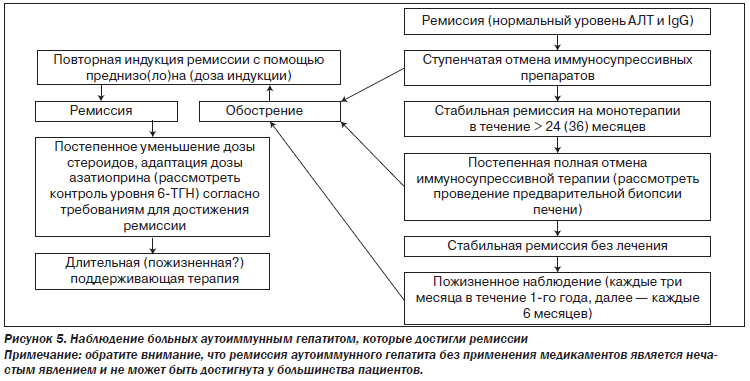
Иммуносупрессивную терапию следует продолжать в течение по крайней мере трех лет и по крайней мере двух лет после полной нормализации уровня трансаминаз и IgG (II-2).
Пациентам без биохимической ремиссии прекращать лечение не следует. Пациентам с биохимической ремиссией в течение более двух лет перед отменой лечения следует рассмотреть проведение биопсии печени. Пациентам с продолжающимся гистологически активным заболеванием (ИАГ > 3) прекращать лечение также не следует (II-2).
Лишь незначительное количество пациентов пребывают в стадии ремиссии без поддерживающей терапии. Попытка отмены лечения требует тесного сотрудничества пациента и врача. Рецидив чаще всего происходит в течение 12 месяцев после прекращения лечения. Однако рецидив может наступить и гораздо позже, спустя годы. Поэтому следует тщательно наблюдать за состоянием пациентов после отмены лечения; наблюдение следует осуществлять пожизненно. Повышение уровня IgG может предшествовать повышению трансаминаз при рецидиве (II-2).
Лечение рецидива или обострения может потребовать использования таких же доз стероидов, как и при режиме индукции. Раннее выявление рецидива заболевания позволяет обойтись более низкими дозами иммуносупрессоров для повторного достижения полной ремиссии (II-2).
Пациентам, получившим адекватную иммуносупрессивную терапию, у которых во время отмены препарата наступил рецидив или наблюдалось обострение во время адекватной поддерживающей терапии, иммуносупрессивные препараты следует принимать постоянно (II-2).
У пациентов с легкой формой заболевания и непереносимостью азатиоприна может быть рассмотрена монотерапия преднизолоном (II-2).
У всех остальных пациентов целью поддерживающей терапии является нестероидная монотерапия азатиоприном (или ММФ). Дозировку поддерживающего лечения следует адаптировать для поддержания стабильной ремиссии с нормализованными уровнями трансаминаз и IgG. Частота рецидивов после отмены преднизолона может быть уменьшена путем применения азатиоприна в дозе до 2 мг/кг/сутки (II-2).
Измерения уровня 6-тиогуанин-нуклеотида (6-ТГН) могут помочь адаптировать дозу азатиоприна и выявить потенциальное несоблюдение пациентом режима лечения. Недоступные для определения уровни 6-ТГН могут быть обусловлены измененным метаболизмом или несоблюдением режима лечения. Высокие уровни 6-ТГН могут свидетельствовать о токсичности (II-2).
Контролируемый АИГ не является противопоказанием ни к беременности, ни к грудному вскармливанию (II-2). Поддерживающую терапию азатиоприном с преднизо(ло)ном или без такового следует продолжать (II-2).
Легкие обострения заболевания могут наблюдаться в первом триместре беременности и особенно после родов и могут потребовать временного повышения дозы иммуносупрессивных препаратов (II-2).
ММФ противопоказан при беременности (II-2).
Дети с АИГ нуждаются в более высоких стартовых дозах стероидов. Принципы лечения АИГ у детей в целом схожи с таковыми у взрослых (II-2).
Перед началом стероидной терапии рекомендуется измерение плотности костной ткани. Всем пациентам, получающим стероиды, следует рекомендовать надлежащее восполнение витамина D и адекватное потребление кальция (II-2).
Традиционные схемы лечения следует оптимизировать (комбинация высоких доз преднизо(ло)на с азатиоприном в дозе 2 мг/кг/сутки) пациентам, которые нуждаются в длительной высокодозовой стероидной терапии (> 20 мг/сутки). В качестве альтернативы можно пробовать применять ингибиторы кальциневрина (циклоспорин или такролимус), инфликсимаб, метотрексат или циклофосфамид. Относительная эффективность препаратов второй линии в клинических исследованиях не изучалась. Таким образом, данные препараты следует использовать только после консультации со специализированным центром (II-3).
Пациентам с неполным ответом на терапию на основе будесонида следует рассмотреть замену последнего преднизо(ло)ном (изначально в дозе > 20 мг/сутки) (III).
Пациентам с неполным ответом на терапию на основе азатиоприна и преднизо(ло)на можно рассмотреть увеличение дозы азатиоприна до 2 мг/кг/сутки с дозой преднизо(ло)на до 5–10 мг/сутки с повторением биопсии печени через 12–18 месяцев (II-3).
Полный ответ на лечение может быть недостижим у некоторых пациентов, и целью в таком случае следует считать достижение минимально возможной биохимической активности при минимуме побочных эффектов. Может понадобиться гистологический контроль эффективности лечения и/или прогрессирования болезни (II-3).
Обеспечение соблюдения режима лечения имеет особое значение у подростков и молодых взрослых пациентов (II-2).
Переход на алгоритмы лечения для взрослых пациентов при достижении пациентом соответствующего возраста лучше осуществлять в специализированных центрах с привлечением многопрофильной команды специалистов (II-3).
У пациентов без цирроза печени в качестве индукционной терапии можно использовать комбинацию будесонида с азатиоприном, которая также может быть рассмотрена для пациентов с сопутствующими заболеваниями, которые могут обостриться на фоне приема преднизо(ло)на (II-2).
Долгосрочных данных по безопасности и эффективности будесонида при АИГ недостаточно (I).
Если адекватной дозы азатиоприна для поддержания ремиссии у пациентов, отвечающих на лечение преднизо(ло)ном, но имеющих тяжелые побочные эффекты на стероиды, недостаточно, можно рассмотреть вариант замены преднизо(ло)на будесонидом.
У пациентов с непереносимостью азатиоприна препаратом выбора второй линии является микофенолат (II-2).
Относительная эффективность и переносимость ММФ у других пациентов в сравнении с азатиоприном установлена не была (II-2).
У пациентов с непереносимостью азатиоприна в качестве альтернативного варианта можно пробовать 5-меркаптопурин (6-МП) или 6-ТГН (III).
У больных АИГ с признаками ПБЦ (вариантный синдром АИГ-ПБЦ) рекомендуется комбинированная терапия урсодезоксихолевой кислотой (УДХК) и иммунодепрессантами (III).
У больных АИГ с признаками ПСХ (вариантный синдром АИГ-ПСХ) может быть рассмотрено добавление УДХК к иммунодепрессантам (III).
У пациентов с доминирующими признаками АИГ альтернативный подход заключается в начале лечения только иммуносупрессантами с последующим добавлением УДХК при недостаточном ответе (III).
Лечение АИГ (рецидива или впервые развившегося (de novo)) после трансплантации печени должно соответствовать стандартным принципам лечения АИГ (II-3).
Хронический вирусный гепатит
Несмотря на то что перед постановкой диагноза АИГ следует исключить наличие гепатита В или С, иногда АИГ может развиться у больных с инфекцией ВГВ или ВГС спонтанно либо на фоне терапии интерфероном; также у пациентов с АИГ может развиться вирусная инфекция. Вакцинацию против вируса гепатита А и гепатита В следует проводить всем пациентам с АИГ, которые ранее не получали таковую и не были инфицированы вирусом гепатита. Пациентам с вирусным гепатитом В или С, у которых отмечается репликация вируса и присутствуют признаки АИГ при постановке диагноза, прежде всего следует назначать противовирусную (против ВГВ или ВГС) терапию без применения интерферона, а необходимость иммуносупрессивной терапии следует повторно оценивать после эрадикации или супрессии вирусной инфекции. Поступали сообщения о реактивации гепатита во время лечения АИГ, поэтому всем пациентам, получающим иммуносупрессивные препараты, рекомендуется проведение серологических исследований на предмет наличия ВГВ. В соответствии с рекомендациями EASL [317], пациентам с положительными результатами исследования HBsAg следует определять уровни ДНК ВГВ и проводить превентивную терапию аналогами нуклеозидов/нуклеотидов во время применения иммуносупрессивных препаратов (независимо от уровня ДНК ВГВ) и в течение 12 месяцев после прекращения терапии. Пациентам с ожидаемой продолжительной иммуносупрессивной терапией и всем пациентам с АИГ рекомендовано использование энтекавира либо тенофовира.
Всем пациентам с АИГ следует проводить вакцинацию против вирусов гепатита А и B, а также ежегодную вакцинацию против гриппа (III)
ВИЧ-инфекция
Случаи впервые развившегося (de novo) АИГ вследствие восстановления иммунной системы были описаны у ВИЧ-инфицированных пациентов, получавших высокоактивную антиретровирусную терапию [318]. Решающее значение в постановке диагноза АИГ и выявлении других многочисленных причин патологических результатов печеночных проб в данных условиях имеет биопсия печени [319]. Стандартная иммуносупрессивная терапия АИГ может быть эффективной, однако иногда ассоциируется с угрожающими жизни инфекциями. Лечение АИГ у ВИЧ-инфицированных пациентов следует подбирать индивидуально после тщательного взвешивания возможных рисков и пользы [320].
Неоднородность и сложность АИГ требует специализированного диагностического и терапевтического подхода. Пациентам следует обеспечить соответствующую специализированную помощь (на базе специализированных центров либо многопрофильных специализированных сетей, оказывающих помощь пациентам с АИГ) с целью улучшения исхода, выживаемости и качества жизни (II-3).
Снижению качества жизни у больных АИГ уделяется все больше внимания. Лечение пациентов с АИГ также должно предусматривать психологическую помощь (II-2).
Перевод Е. Куща
Список литературы
Список литературы находится в редакции