Статтю опубліковано на с. 57-62
Вступ
Знання сучасних ефективних методів терапії алергічних хвороб, впровадження їх у клінічну практику є одним із першорядних завдань лікаря алерголога-імунолога. Безумовною перевагою в патогенетичній терапії алергічного риніту та бронхіальної астми є алергенспецифічна імунотерапія (АСІТ) [1–3].
Ефективним методом, здатним змінити патофізіологічні механізми атопічних захворювань, призупинити формування більш тяжких їх форм на фоні зниження вживання протиалергічних лікарських препаратів, продовжити стійку ремісію, а також попередити розвиток полісенсибілізації, змінити перебіг захворювання, покращити якість життя, є АСІТ [3, 4].
АСІТ — це введення в організм пацієнта з ІgЕ-залежним захворюванням зростаючих доз алергенів або їх компонентів (алергенної вакцини, екстракту алергенів), до яких виявлена підвищена чутливість, що призводить до зменшення або до повного зникнення клінічних симптомів захворювання.
Сублінгвальна алергенспецифічна імунотерапія (СЛАСІТ) як метод лікування алергічних захворювань уперше почав широко обговорюватись у 1993 р., коли побачив світ документ з АСІТ Европейської академії алергології і клінічної імунології (ЕААСІ), де було вперше рекомендовано проведення досліджень для доказовості ефективності та безпеки СЛАСІТ. У 1998 р. експерти ВОЗ, спираючись на літературні дані, офіційно схвалили сублінгвальний метод АСІТ як альтернативний варіант підшкірній АСІТ і потім включили цей метод у рекомендаційні документи (АRІА, GINA, PRACTALL та ін.). Цей висновок було також підтверджено Європейською академією алергології і клінічної імунології в документі АRІА. У 2006 р. опубліковано стандарти проведення АСІТ ЕААСІ, де велика увага приділена неін’єкційним методам АСІТ. Із 2005 р. вивчається безпечність проведення АСІТ у дітей віком до 5 років [2–5].
За сучасними даними [1, 2, 4, 5], АСІТ обумовлює два різних, можливо, послідовних механізми — генерацію Т-регуляторних клітин (Т-regs) і переключення імунної відповіді з Тh2 на Th1. Введення алергенів активує секрецію інтерлейкіну-10 (ІЛ-10) дендритними клітинами, які сприяють індукції Т-регуляторних клітин, що секретують -ІЛ-10 і трансформуючий фактор росту β (TGF-β), викликаючи супресію як Тh2-, так і Тh1-клітин. Крім, того ІЛ-10 індукує секрецію В-клітинами алергенспецифічних ІgG1, IgG4, ІgА. Ряд дослідників [1–4] підтвердили важливу роль у механізмах АСІТ специфічних ІgG1, IgG4, ІgА, яким відводиться роль блокуючих антитіл. При проведенні АСІТ можливо утворення антиізоптичних антитіл, тобто анти-ІgЕ-антитіл.
Переключення Тh2-відповіді на Тh1-відповідь приводить до переключення ІgЕ імунної відповіді на ІgG-відповідь або формування Т-клітинної толерантності. Ступінь відповідності АСІТ класичним моделям толерантності залишається предметом вивчення та дискусій.
АСІТ діє практично на всі патогенетично важливі ланки алергічного процесу, справляє гальмуючу дію на клітинний і медіаторний компоненти алергічного запалення, гальмує ранню та пізню фазу ІgЕ-опосередкованої реакції. При АСІТ пригнічуються ефекторні ланки алергічного процесу. Ранні ефекти пов’язані з десенсибілізацією тучних клітин і базофілів і зниженням їх здатності до викиду медіаторів, потім зменшується їх кількість у тканинах. Проміжний за часом ефект АСІТ пов’язаний з імунологічними механізмами Т-клітинної проліферації, індукцією Т-регуляторних клітин, секрецією ІЛ-10 і TGF-β, супресією Тh2-клітин і їх цитокінів, зменшенням кількості Т-клітин у пізню фазу алергічної реакції. Останніми включаються механізми, пов’язані з В-клітинами (початкове збільшення і пізнє зменшення продукції алергенспецифічних ІgЕ) й ефекторними клітинами запалення. Зменшення кількості клітин запалення (еозинофілів, нейтрофілів, базофілів і моноцитів), у свою чергу, призводить до зниження накопичення в тканинах організму хворого медіаторів запалення, що вивільняються з цих клітин, і секреції хемотаксичних посередників, що ініціюють пізню фазу алергічного запалення і неспецифічну тканинну реактивність [4, 5].
Виникаючі при АСІТ зміни якісного та кількісного профілю цитокінових маркерів, зниження тканинної чутливості до експозиції алергену, зниження неспецифічної тканинної гіперреактивності, пригнічення ознак алергічного запалення зберігаються протягом довгого часу. Сукупність цих механізмів визначає специфічний компонент алерговакцинації.
Мета роботи — оцінити ефективність -СЛАСІТ сублінгвальними алергенами кліщів домашнього пилу та пилковими (суміш рання та пізня весняна трав та осіння) компанії Sevapharma (Чехія) у пацієнтів із сезонним алергічним ринітом (САР), цілорічним алергічним ринітом (ЦАР) та цілорічним алергічним ринітом із бронхіальною астмою та легким персистуючим перебігом (ЦАР із БАЛПП), бронхіальною астмою та середньотяжким персистуючим перебігом (БАСТПП). До складу суміші побутових алергенів входили Acarussiro, Dermatophagoides farinae і Dermatophagoides pteronyssinus. Активність алергену визначається в одиницях білкового азоту (PNU). Концентрації алергену становили: 1, 10, 100, 1000, 10 000 PNU/мл.
Матеріали та методи
Під спостереженням було 95 дітей з алергічним ринітом віком від 4 до 16 років, серед них: 32 дитини з САР (інтермітуючий перебіг), 33 хворі із ЦАР (персистуючий перебіг), 20 пацієнтів із ЦАР і БАЛПП та 20 дітей із ЦАР і БАСТПП. У дітей із САР у 63,7 % виявлена сенсибілізація до різних видів пилкових алергенів, у 36,3 % — до одного виду пилкових алергенів. У хворих із ЦАР у 78,2 % виявлена сенсибілізація до пилкових та побутових алергенів, у 21,8 % — до різних видів пилкових алергенів. Серед пацієнтів із ЦАР і БАЛПП у 82,4 % виявлена сенсибілізація до різних видів пилкових та побутових алергенів, у 17,6 % — до пилкових алергенів. Серед дітей із ЦАР і БАСТП у 87,5 % виявлена сенсибілізація до різних видів пилкових та побутових алергенів, у 12,5 % — до пилкових алергенів.
Проведено загальноклінічні методи дослідження (анамнез захворювання, алергологічний анамнез, клінічний огляд), лабораторне обстеження крові та назального секрета в дітей у динаміці, дослідження з визначення sIgA в назальному секреті, слині, визначено показники клітинної ланки імунітету СD3+ ,СD4+, СD8+, СD4+/СD8+, СD16+, СD22+, методом непрямої імунофлюоресцентної реакції з моноклональними антитілами виробництва ЗАТ «Сорбент-сервіс» (м. Москва, Росія) та гуморальної — вміст сироваткових імуноглобулінів (G, A, M) визначали за методом Mancini et al. (1965) [8].
Використовували такі схеми лікування:
1-ша фаза — ініціююча, проводиться за допомогою введення ряду зростаючої концентрації алергену до досягнення максимально допустимої дози.
2-га фаза — підтримуюча, під час якої максимально допустима доза вводиться протягом 3 років. Препарат приймається однією денною дозою (вранці або ввечері), не менше ніж за 30 хв до їжі. Під’язикові краплі всмоктуються протягом 1–2 хвилин.
Пацієнт починав прийом із 1 краплі мінімальної концентрації (1 PNU), щодня підвищуючи дозу на 1 краплю до досягнення 10 крапель, після чого переходив на 1 краплю наступної підвищеної концентрації до досягнення максимальної дози і концентрації (10 крапель, 10 000 PNU).
Для оцінки сприйняття лікування прийом першої дози алергену проводився в присутності алерголога в алергологічному кабінеті. Відповідно до інструкції виробника алерген рекомендується застосовувати 1 раз на день (вранці або ввечері) за 30 хв до їжі.
Раніше показано, що при попаданні в шлунок алергени протягом 10 хв втрачають 90 % своєї алергенності. Щоб зменшити фрагментацію алергенів у шлунково-кишковому тракті, рекомендовано застосування СЛАСІТ після невеликого прийому їжі, бажано ввечері перед сном, тому що в нічний час знижена продукція пепсиногену шлунка. Під час фази ініціації СЛАСІТ пацієнти приходили 1 раз на тиждень на проміжні візити — для видачі нового флакона наступної концентрації, оцінки правильності прийому алергенів і переносимості лікування.
Пацієнт може самостійно при гострому захворюванні або появі симптомів алергічного захворювання подовжити інтервал між прийомом чергових доз або знизити дозу з подальшим повідомленням лікуючого лікаря. Застосування підтримуючої дози (10 крапель, 10 000 PNU) — протягом декількох років. Згідно з інструкцією виробника, максимально допустима доза повинна використовуватися 3 рази на тиждень.
У нашому дослідженні для безпеки СЛАСІТ підтримуючу дозу хворі приймали 2 рази на тиждень.
Схема проведення 2-го етапу лікування СЛАСІТ може бути змінена залежно від стану хворого. У разі погіршення стану рекомендується знизити дозу алергену на половину максимальної дози. У нашому дослідженні всі пацієнти отримували підтримуюче лікування алергенами цілорічно 2 рази на тиждень.
Для врахування ступеня проявів симптомів риніту і бронхіальної астми, можливих побічних ефектів від проведеної терапії, використання симптоматичної терапії для купірування симптомів бронхіальної астми та алергічного риніту пацієнти заповнювали щоденники самоконтролю. Ступінь проявів і клінічних симптомів алергічного захворювання враховувався в балах від 0 до 3. Симптоми риніту включали оцінку закладеності носа, ринореї, свербіння в носі, чхання. Симптоми бронхіальної астми включали оцінку нападів ядухи/утруднення дихання, епізодів свистячих хрипів у грудях, кашель, почуття стиснення у грудях.
Для оцінки ефективності лікування використовувався загальний бал клінічних проявів (ЗБКП) алергічного риніту та бронхіальної астми і дні з симптомами. Ці показники оцінювалися протягом 1 місяця до початку і 1 місяця після закінчення курсу СЛАСІТ. Як препарати невідкладної терапії при алергічному риніті використовувалися антигістамінні засоби (цетиризин 10 мг), інтраназальні глюкокортикостероїди (ГКС) (мометазону фуроат 50 мкг) і агоністи β2-адренорецепторів короткої дії (сальбутамол). Використання препаратів невідкладної терапії оцінювалося за такою шкалою: 0 балів — препарати невідкладної терапії пацієнт не приймав; 1 бал — хворий приймав антигістамінні препарати; 2 бали — пацієнт застосовував інтраназальні ГКС; 3 бали — хворий використовував агоністи -β2-адренорецепторів короткої дії.
Результати та обговорення
Результати статистичного аналізу підтвердили вірогідне зниження загального бала клінічних проявів, частоти виникнення симптомів і прийому препаратів невідкладної терапії в групі пацієнтів, які отримували СЛАСІТ. До кінця дослідження ЗБКП знизився на 87,4 % у хворих із САР, 84,6 % — із ЦАР, 82,7 % — із ЦАР і БАЛПП, 75,2 % — із ЦАР і БАСТПП, а кількість днів із симптомами — на 93,5 % в обстежених із САР, 91,4 % — із ЦАР, 89,3 % — із ЦАР і БАЛПП, 87,4 % — із ЦАР і БАСТПП порівняно з даними до початку лікування. Зменшення частоти й інтенсивності клінічних симптомів супроводжувалося статистично вірогідним зниженням потреби в симптоматичних препаратах порівняно з даними до СЛАСІТ на 97,3 % у дітей із САР, 96,4 % — із ЦАР, 94,5 % — із ЦАР і БАЛПП, 92,7 % — із ЦАР і БАСТПП. В контрольній групі пацієнтів відзначалось статистично значиме збільшення частоти й інтенсивності клінічних проявів, що супроводжувалося підвищенням потреби у препаратах невідкладної терапії.
Результати порівняльного аналізу підтвердили статистично значуще зниження ЗБКП на 74,2 % у пацієнтів, які отримували СЛАСІТ, порівняно з контрольною групою. Кількість днів із симптомами була значно нижчою (на 88,3 %) у групі хворих, які приймали СЛАСІТ, порівняно з контрольною групою. Також виявлено значне зниження тривалості прийому препаратів невідкладної терапії в групі лікування (на 95,2 %) порівняно з контрольною групою.
Обстеження хворих на САР показало, що кількість СD3+-клітин вірогідно знижена у 65,7 %, СD4+-лімфоцитів — у 68,4 %, субпопуляції СD8+-клітин — у 69,3 % та СD22+-лімфоцитів — у 66,8 % дітей, вміст СD16+-клітин — у 58,6 % хворих. Для хворих на САР характерною є наявність дисгаммаглобулінемії, зниження концентрації ІgG, IgA, IgM — у 64,7, 67,8, 64,3 % випадків відповідно та підвищення рівня загального IgE у 2 рази у 37,4 % дітей, зниження концентрації sIgA у 2,2 раза у 72,4 % обстежених (табл. 1). Спостерігалося підвищення кількості еозинофілів у назальному секреті — до 29,5 ± 0,8 у 78,6 % хворих та у крові — до 10,5 ± 1,1 % у 75,4 % дітей.
/60.jpg)
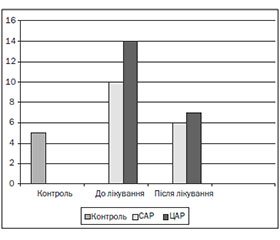
Після курсу лікування у хворих на САР спостерігалося вірогідне підвищення вмісту СD3+-лімфоцитів, СD4+-клітин, субпопуляції СD8+-клітин та СD22+-лімфоцитів і кількості СD16+-клітин (р < 0,001). Рівень сироваткових імуноглобулінів ІgG, IgA, IgM вірогідно підвищився порівняно з контролем і даними до лікування; рівень загального IgE знизився до рівня контролю, а концентрація sIgA збільшилась у 3 рази (табл. 1). При проведенні СЛАСІТ відбувається стимуляція місцевої імунної відповіді в шоковому органі. Висока проникність слизових оболонок в атопічних хворих, тривалий контакт алергену з лімфоїдними утвореннями слизової оболонки, а також здатність IgA-секретуючих клітин мігрувати в усі ефекторні ділянки респіраторного тракту і секреторних залоз викликають максимальну стимуляцію продукції імуноглобулінів і секреторного IgA в шокових органах. Спостерігалось вірогідне зниження рівня еозинофілів у назальному секреті до 14,3 ± 0,8 та у крові до 5,3 ± 0,6 % у дітей із САР (р < 0,05) (рис. 1, 2).
/61.jpg)
У хворих на ЦАР виявлено вірогідне зниження вмісту СD3+-лімфоцитів, СD4+-клітин, субпопуляції СD8+-клітин та СD22+-лімфоцитів у 74,3, 76,8, 77,5, 73,4 % випадків відповідно. Рівень субпопуляції СD16+ клітин був вірогідно знижений у 72,4 % порівняно з контролем (р < 0,001). Концентрація сироваткових імуноглобулінів ІgG, IgA, IgM у 69,8, 72,4, 70,6 % була нижча за дані контрольної групи. В обстежених дітей із ЦАР спостерігалося підвищення загального рівня ІgE в 4 рази порівняно з контролем (р < 0,01) та зниження концентрації sIgA у 2,5 раза (p < 0,001) (табл. 1). Характерним було підвищення кількості еозинофілів у назальному секреті до 32,7 ± 0,8 у 82,6 % хворих та у крові до 16,3 ± 0,5 % у 85,4 % дітей.
При обстеженні хворих на ЦАР спостерігалося вірогідне підвищення порівняно з даними до лікування показників СD3+-лімфоцитів, СD4+-клітин, субпопуляції СD8+-клітин та СD22+-лімфоцитів та кількості СD16+-клітин (р < 0,001). Концентрація сироваткових імуноглобулінів ІgG, IgA, IgM вірогідно підвищилася порівняно з контролем і даними до лікування, рівень загального IgE знизився до рівня контролю, а концентрація sIgA збільшилась у 3,2 раза (табл. 1). Характерним було вірогідне зниження рівня еозинофілів у назальному секреті до 14,3 ± 0,9 та у крові до 6,4 ± 0,4 % у дітей із ЦАР (р < 0,05) (рис. 1, 2).
Обстеження хворих на ЦАР із БАЛПП показало, що кількість СD3+-лімфоцитів, СD4+-клітин, субпопуляції СD8+-клітин та СD22+-лімфоцитів у 82,4, 85,6, 86,4, 82,3 % була вірогідно нижча за дані контрольної групи. Рівень СD16+-клітин був вірогідно знижений у 75,7 % порівняно з контролем (р < 0,001).
Концентрація сироваткових імуноглобулінів ІgG, IgA, IgM у 73,8, 75,4, 76,7 % була нижча за дані контрольної групи. В обстежених дітей із ЦАР спостерігалося підвищення загального рівня ІgE в 4 рази порівняно з контролем (р < 0,001) та зниження концентрації sIgA у 2,8 раза (p < 0,001) (табл. 1). Спостерігалося підвищення кількості еозинофілів у назальному секреті у 85,6 % хворих до 35,7 ± 1,3 та у крові до 13 ± 0,9 % у 87,4 % дітей.
У хворих на ЦАР і БАЛПП нами виявлено вірогідне підвищення порівняно з даними до лікування вмісту СD3+-лімфоцитів, СD4+-клітин, субпопуляції СD8+-клітин та СD22+-лімфоцитів і зменшення кількості СD16+-клітин (р < 0,001). Концентрація сироваткових імуноглобулінів ІgG, IgA, IgM вірогідно підвищилася порівняно з контролем і даними до лікування; рівень загального IgE знизився майже до рівня контролю, а концентрація sIgA збільшилась у 3,5 раза (табл. 1). Спостерігалось вірогідне зниження рівня еозинофілів у назальному секреті до 17,3 ± 0,5 та у крові до 6,2 ± 0,5 % у дітей із ЦАР і БАЛПП (р < 0,05).
При обстеженні хворих на ЦАР із БАСТПП нами відзначено вірогідне зниження кількості СD3+-лімфоцитів, СD4+-клітин, субпопуляції СD8+-клітин та СD22+-лімфоцитів у 88,5, 89,4, 92,6, 85,7 % випадків порівняно з контролем, кількість СD16+-клітин була вірогідно підвищена. Для хворих на ЦАР із БАСТПП характерним є також явище дисгаммаглобулінемії, зниження концентрації ІgG, IgA, IgM у 84,7, 87,8, 84,3 % випадків відповідно та підвищення рівня загального IgE у 7 разів, а також зниження концентрації sIgA у 3 рази порівняно з контрольною групою (р < 0,05), що свідчить про сенсибілізацію організму та зниження захисту слизових. Характерним було підвищення кількості еозинофілів у назальному секреті до 36,8 ± 1,5 у 89,6 % хворих та у крові до 17,6 ± 1,5 % у 89,4 % дітей.
Після лікування в обстежених із ЦАР і БАСТПП характерним було вірогідне підвищення вмісту субпопуляції СD3+-, СD4+-, СD8+-клітин та СD22+-лімфоцитів і зменшення кількості СD16+-клітин (р < 0,001) у 78,5 % хворих. Рівень сироваткових імуноглобулінів ІgG, IgA, IgM вірогідно підвищився порівняно з контролем і даними до лікування; рівень загального IgE знизився до рівня контролю у 74,5 %, а концентрація sIgA збільшилась у 3,7 раза (табл. 1). Спостерігалось вірогідне зниження рівня еозинофілів у назальному секреті до 17,2 ± 0,9 та у крові до 7,2 ± 1,3 % у дітей із ЦАР і БАСТПП (р < 0,05).
Хворим на ЦАР із БАСТПП (25,5 %), у яких не спостерігалось зниження загального рівня ІgЕ, рекомендовано 2-й курс підтримуючої терапії СЛАСІТ.
Після лікування СЛАСІТ у 89,5 % дітей із САР спостерігався відмінний ефект, у 10,5 % — хороший ефект. У хворих на ЦАР у 87,3 % відзначено відмінний ефект, у 10,5 % — хороший, у 2,2 % — задовільний ефект. У пацієнтів із ЦАР і БАЛПП відмінний ефект спостерігався у 85,7 %, хороший — в 11,3 %, задовільний — у 3 %. В обстежених дітей з ЦАР і БАСТПП у 84,5 % відзначено відмінний ефект, у 12,4 % — хороший, у 3,1 % — задовільний.
Висновки
1. Після проведеного лікування СЛАСІТ відмінний ефект спостерігався у 89,5 % дітей із САР, у 87,3 % хворих із ЦАР, у 85,7 % пацієнтів із ЦАР і БАЛПП, у 84,5 % обстежених дітей із ЦАР і БАСТПП, що свідчить про високу ефективність цієї терапії.
2. Вірогідне зниження (р < 0,05) кількості еозинофілів у назальному секреті в дітей із САР, ЦАР, ЦАР із БАЛПП, БАСТПП може бути непрямим підтвердженням впливу СЛАСІТ на алергічне еозинофільне запалення.
3. При призначенні СЛАСІТ спостерігається вірогідна позитивна динаміка вмісту СD3+-лімфоцитів, СD4+-клітин, субпопуляції СD8+-клітин та СD22+-лімфоцитів, зменшення кількості СD16+-клітин і підвищення рівня сироваткових імуноглобулінів ІgG, IgA, IgM у хворих із САР, ЦАР, ЦАР із БАЛПП, БАСТПП.
4. Висока лікувальна ефективність СЛАСІТ обумовлює широке використання цього методу в клінічній алергологічній практиці з метою проведення лікування пацієнтів у домашніх умовах, що дозволяє скоротити число візитів пацієнтів до лікаря та покращити якість життя хворих.

/60.jpg)
/61.jpg)