Статья опубликована на с. 58-64
Последнее десятилетие характеризуется изменением подходов к лечению сердечно-сосудистых заболеваний (ССЗ), в частности эссенциальной гипертензии (ЭГ), основанной на доказательной медицине с учетом патогенеза заболевания. Основная цель лечения больных ЭГ состоит в максимальном снижении риска развития сердечно-сосудистых осложнений (ССО) и смерти от них. В связи с этим большое значение имеет оценка общего сердечно-сосудистого риска, степень которого зависит не только от уровня артериального давления (АД), но и от наличия или отсутствия сопутствующих факторов риска ССЗ, поражений органов-мишеней и ассоциированных клинических состояний.
Целенаправленный поиск признаков поражений органов-мишеней, к которым относятся доклинические, не сопровождающиеся жалобами и потенциально обратимые или, по крайней мере, стабилизируемые состояния, очевидно, представляет собой одну из основных задач обследования больных артериальной гипертензией (АГ), поскольку выявление их зачастую требует коррекции антигипертензивной терапии с приоритетом некоторых классов антигипертензивных препаратов.
Для достижения целевого АД большинство пациентов нуждается в двух или трех антигипертензивных препаратах. При монотерапии устойчивое снижение АД достигается всего лишь у одной трети больных. На старте лечения АГ используются две равноправные стратегии: монотерапия и низкодозовая комбинированная терапия, при этом комбинированный режим терапии имеет потенциальное преимущество в сравнении с монотерапией.
Завершившиеся и обработанные последние исследования, на основе которых были внесены изменения в ESH/ESC 2009 г. (ONTARGET, PROFESS, TRASCEND, ACCORD, ADVANCE, HYVET, ACCOМPLISH) [1], определили наиболее рациональные комбинации антигипертензивных препаратов (АГП): сочетания тиазидоподобного диуретика с ингибиторами ангиотензинпревращающего фермента (ИАПФ) или блокаторами ангиотензиновых рецепторов (БАР), тиазидного диуретика с антагонистом кальция (АК), АК с ИАПФ или БАР, АК (дигидропиридинового ряда) с бета-адреноблокаторами. Согласно рекомендациям ESH/ESC 2007 г. [2], комбинированную терапию уже на старте лечения, минуя монотерапию, следует назначать больным АГ с уровнем АД более 160/100 мм рт.ст., а также пациентам с высоким и очень высоким риском ССО.
Цель исследования: изучить антигипертензивную эффективность и возможность органопротекции комбинированной терапии лерканидипином с блокаторами ренин-ангиотензин-альдостероновой системы (РААС) периндоприлом или эпросартаном в процессе 12-недельной терапии у больных ЭГ с высоким и очень высоким риском ССО и выявить возможности лечения двух- или трехкомпонетной терапии.
Материал и методы исследования
В исследование были включены 78 больных эссенциальной артериальной гипертензией I–III степени (ESH/ESC, 2007) мужского и женского пола. Средний возраст больных составил 46,52 ± 10,31 года, средняя длительность заболевания — 5,96 ± 4,04 года.
Дозы препаратов титровались постепенно каждые 2 недели до достижения целевых значений САД (< 140 мм рт.ст.) и ДАД (< 90 мм рт.ст.) либо снижения среднего АД (АДср) на 10 % и более. Таким образом, среднесуточные дозы препаратов к концу терапии составили: лерканидипин 10,26 ± 4,58 мг/сут с периндоприлом 6,09 ± 2,68 мг/сут; лерканидипин 11,36 ± 4,41 мг/сут с эпросартаном 681,82 ± 210,75 мг/сут.
Критерием эффективного снижения АД считалось снижение АДср на 10 % и более. Критерием целевого снижения АД был выбран уровень САД < 140 мм рт.ст.,
ДАД < 90 мм рт.ст. ЭхоКГ-исследование проводилось в соответствии с рекомендациями Американской ассоциации эхокардиографии в М- и В-режимах [3] на аппарате ультразвуковой системы En VisorC (Philips, Голландия). Масса миокарда левого желудочка (ММЛЖ) оценивалась с использованием М-режима ЭхоКГ. Гипертрофия ЛЖ (ГЛЖ) определялась на основании расчета ММЛЖ и ее индексированной к площади поверхности тела величине — индекса ММЛЖ (ИММЛЖ). За уровень ГЛЖ принимался критерий –ИММЛЖ > 125 г/м2 у мужчин, > 110 г/м2 — у женщин. Толщину комплекса интима-медиа (КИМ) общей сонной артерии оценивали методом дуплексного сканирования на аппарате ультразвуковой системы Еп VisorC (Рhilips, Голландия). Оценивали эндотелийзависимую вазодилатацию (ЭЗВД) по приросту диаметра (∆D%) плечевой артерии с использованием формулы: ∆D = [D (1΄) – Dисх]/Dисх × 100 %, где D (1΄) — диаметр артерии на первой минуте декомпрессии, Dисх — диаметр артерии на исходе исследования. Нормальной реакцией плечевой артерии считалось ее расширение на фоне реактивной гиперемии на 10 % и более от исходного диаметра. Биохимические анализы (липиды, креатинин, микроальбуминурия (МАУ)) проводили на автоанализаторе DAYTONA. Скорость клубочковой фильтрации (СКФ) определяли по формуле MDRD (Modification of Diet in Renal Disease Study) (мл/мин/1,73 м2):
СКФ = 186 × (креатинин сыворотки, мг/дл) –
– 1,154 × (возраст, годы) – 0,203.
Для женщин результат умножали на 0,742 [4].
Статистическая обработка полученных результатов проводилась с использованием программ из пакета Microsoft Office Excel 2007 и Statistics 6.0 для Windows. Для анализа достоверности различий между качественными признаками использовали критерий χ2. Для всех видов анализа статистически значимыми считали значения р < 0,05.
Результаты исследования
Так, в общей группе больных (n = 78) АГ I степени была выявлена у 31 пациента (39,7 %), АГ II степени — у 30 (38,5 %), АГ III степени — у 17 (21,8 %). У 55 (70,5 %) больных наблюдалась ГЛЖ, у 23 больных (29,5 %) было выявлено увеличение толщины КИМ сонной артерии > 0,9 мм. Нарушенная ЭЗВД, оцениваемая по приросту диаметра плечевой артерии (∆D < 10 %), была выявлена у 59 больных (75,65). Индекс массы тела (ИМТ) составил 30,00 ± 4,01 кг/м2, дислипидемия выявлена у 74 (94,8 %) больных, МАУ > 20 мг/л — у 28 (35,9 %) больных, что в целом определяет высокий и очень высокий риск развития ССО у обследуемых больных. Обследование проводилось до и после лечения. Длительность терапии составила 12 недель (табл. 1).
В соответствии с протоколом исследования 12-недельную терапию завершили 78 больных. Показатели гемодинамики в общей группе составили: САД — 154,81 ± 11,24 мм рт.ст., ДАД — 99,74 ± 8,79 мм рт.ст., АДср — 118,10 ± 8,70 мм рт.ст. Комбинированное применение лерканидипина с периндоприлом и эпросартаном в целом характеризовалось удовлетворительной клинической эффективностью и переносимостью. Степень снижения САД, ДАД и АДср составила: 16,17 ± 4,91, 15,17 ± 6,34, 16,09 ± 4,81 % соответственно, во всех случаях р = 0. Целевые значения САД были достигнуты у 66 (84,6 %), ДАД — у 63 (80,8 %), АДср — у 61 (78,2 %). К концу 12-недельной терапии степень снижения САД составила 16,17 ± 4,91 %, ДАД — 15,17 ± 6,34 %, АДср — 16,09 ± 4,81 %, во всех случаях р = 0 (табл. 2).
Комбинированная терапия лерканидипином с периндоприлом и эпросартаном (табл. 3) в целом по группе больных характеризовалась достоверным снижением выраженности ГЛЖ. Следует отметить, что регрессия ГЛЖ была обусловлена как за счет высокодостоверного снижения толщины межжелудочковой перегородки (МЖП), задней стенки левого желудочка (ЗСЛЖ), так и за счет конечного диастолического размера (КДР). ММЛЖ снизилась от 293,54 ± 63,15 г на исходе исследования до 254,79 ± 52,97 г (р = 0,003) к его концу. При этом динамика ИММЛЖ была следующей: от 144,36 ± ± 30,94 г/м2 на исходе до 125,23 ± 25,45 г/м2 к концу наблюдения (р = 0,005), а степень ее снижения составила 12,92 ± 5,27 %. Выявленная положительная динамика ММЛЖ в основном ассоциировалась с достоверным уменьшением толщины ЗСЛЖ (р = 0,001), МЖП (р = 0,000). Прослеживалось также некоторое снижение КДР: от 5,45 ± 0,45 см до 5,36 ± 0,41 см (р = 0,005) и КСР: от 3,35 ± 0,39 см до 3,26 ± 0,33 см (р = 0,006). Антиремоделирующие эффекты лерканидипина с блокаторами РААС ассоциировались с уменьшением числа больных с ГЛЖ, составив 44 (56,4 %) против 34 (43,6 %) на начальном этапе, т.е. в целом по группе процент больных с ГЛЖ уменьшился на 32,9 % (табл. 3).
Учитывая наличие дисфункции эндотелия и оценивая динамику процессов сосудистого ремоделирования, ассоциируемых со снижением ЭЗВД и наличием парадоксальной вазоконстрикции (у 8 больных), толщины КИМ, нарастанием МАУ, креатинина, снижением СКФ у обследуемых больных, мы провели анализ возможной вазо- и нефропротективной эффективности указанных изменений в процессе терапии (табл. 3).
/60.jpg)
Включение периндоприла или эпросартана в схему терапии наряду с лерканидипином сопровождалось благотворным влиянием на ЭЗВД, толщину КИМ сонной артерии: достоверность после лечения высокая (p < 0,010). Так, после комбинированной терапии лерканидипином с блокаторами РААС прирост ∆D% достиг 11,96 ± 5,33 % против 7,07 ± 3,51 % на исходе (р = 0), который способствовал улучшению ЭЗВД с полным его восстановлением. У 6 больных с парадоксальной вазоконстрикцией среднее значение ∆D% достигло 8,98 ± 6,07 % против –3,14 ± 1,73 % (р = 0), при этом не осталось ни одного больного с парадоксальной вазоконстрикцией, а у 3 больных отмечалась полная нормализация ЭЗВД. Также наблюдалось достоверное уменьшение толщины КИМ от 0,81 ± 0,21 мм на исходе до 0,76 ± 0,20 мм в динамике (р = 0,006).
Следует отметить, что обследуемая группа больных характеризовалась большой частотой нарушения липидного спектра крови. В частности, какой-либо вид дислипидемии наблюдался у 68 (87,1 %) пациентов. Так, гиперхолестеринемия (ГХС) была отмечена у 68 (87,1 %) больных, гипертриглицеридемия (ГТГ) — у 54 (69,2 %), гиперхолестеринемия по липопротеидам низкой плотности (ГХС ЛПНП) — у 59 (75,6 %), гипохолестеринемия по липопротеидам высокой плотности (гипоХС ЛПВП) — у 49 (62,8 %) больных. В целом «липидная триада» — ГТГ с ГХС ЛПНП и гипоХС ЛПВП была выявлена у 25 больных (32,1 %).
В процессе 12 недель приема лерканидипина с блокаторами РААС на фоне соблюдения рекомендуемого диетического режима была отмечена метаболическая нейтральность (табл. 4). Так, на фоне терапии было отмечено уменьшение уровня наиболее атерогенных фракций липидного спектра — общего холестерина (ОХС) и ХС ЛПНП. ОХС достоверно уменьшился с 222,40 ± 36,37 мг/дл до 200,18 ± 36,09 мг/дл (p = 0,019), а уровень ХС ЛПНП снизился с 148,31 ± 34,06 мг/дл
до 125,91 ± 36,26 мг/дл (p = 0,027). Следует отметить, что наблюдаемый уровень снижения показателей ОХС и ХС ЛПНП носил умеренный характер, не превышая в среднем 3–8 %. Уровень ТГ уменьшился со 180,86 ± 75,82 мг/дл до 156,96 ± 69,54 мг/дл (p = 0,038), а ХС ЛПВП достоверно возрос с 38,88 ± 7,86 мг/дл до 39,86 ± 8,71 мг/дл (p = 0,041) (табл. 3).
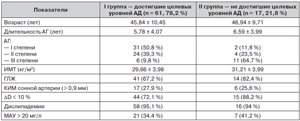
Далее, учитывая наличие высокого и очень высокого риска развития ЭГ и то, что целевых уровней АД достигли 78,2 % больных, мы дополнительно провели анализ больных, достигших (n = 61, 78,2 %) и не достигших целевых уровней АД (n = 17, 21,8 %) на фоне двухкомпонентной терапии лерканидипином с блокаторами РААС (табл. 4).
Так, в группе больных, не достигших целевых уровней АД (28 % больных), выявлено следующее: АГ I степени была отмечена у 2 больных (11,8 %), АГ II степени — у 4 (23,5 %), АГ III степени — у 11 (64,7 %), по сравнению с больными, достигшими целевых уровней АД: АГ I степени — у 31 больного (50,8 %), АГ II степени — у 24 (39,3 %), АГ III степени — у 6 (9,8 %). Во II группе отмечалось увеличение массы тела, которое составило 31,21 ± 3,99 кг/м2 против 29,66 ± 3,98 кг/м2
в I группе. У 82,4 % во II группе больных наблюдалось наличие ГЛЖ против 67,2 % больных в I группе. Нарушенная ЭЗВД была выявлена у 88,2 % больных во II группе против 72,1 % больных в I группе. МАУ > 20 мг/л отмечалась у 41,2 % больных во II группе против 34,4 % больных в I группе. В целом эти показатели определяют высокий и очень высокий риск развития ССО у обследуемых больных, не достигших целевых уровней АД (табл. 4).
На фоне терапии целевые уровни АД в I группе достигли 100,0 % больных, во II группе — соответственно по САД — 29,4 % и ДАД — 11,8 % больных (табл. 6). Исходные цифры АД до лечения достоверно различались (р = 0).
На фоне комбинированной терапии выявлена наиболее выраженная ГЛЖ в группе терапии больных, не достигших целевых уровней АД: ИММЛЖ составил 155,69 ± 29,10 г/м2 против 140,31 ± 31,07 г/м2, которые достоверно различались (z2 = 2,668, р = 0,008). Однако на фоне терапии отмечалась достоверная регрессия ГЛЖ в обеих группах: ∆% ИММЛЖ составил 14,02 ± ± 8,46 % и 13,49 ± 4,32 % соответственно. При оценке исходно нарушенной ЭЗВД на фоне терапии выявлено улучшение вазорегуляторной функции эндотелия в обеих группах, которые достоверно не различались (р = нд). Толщина КИМ на фоне терапии достоверно уменьшилась в обеих группах (р = 0). Анализируя вазопротективную эффективность комбинированной терапии в обеих группах сравнения, мы также рассмотрели такие параметры, как МАУ, уровень креатинина в крови, СКФ. Так, при достаточно сопоставимом положительном влиянии комбинированной терапии на уровень ЭЗВД и толщину КИМ сонной артерии было отмечено улучшение показателей МАУ, креатинина с увеличением СКФ в обеих группах. Отмечалось также исходное повышение МАУ в обеих группах, однако МАУ была выше в группе не достигших целевых уровней АД, но не достоверно (р = нд) (табл. 6).
/62.jpg)
Заключение
Разработка тактики лечения ЭГ является одной из наиболее важных проблем современной кардиологии [5]. Однако гетерогенность ответа на гипотензивную терапию, спектр нежелательных побочных эффектов способствуют снижению приверженности больных к проводимому лечению. Несмотря на наличие широкого спектра АГП, указанная стратегическая цель лечения больных АГ весьма далека от своего разрешения.
Чем может быть обусловлена столь высокая эффективность комбинации ДГП АК с ингибиторами РААС (ИАПФ и БАР)? Такой эффект достигается, с одной стороны, вследствие выраженного артериодилатирующего действия АК, с другой — нивелирования эффектов РААС. Совместное применение АК и ингибиторов РААС позволяет нейтрализовать контррегуляторные механизмы, снижающие эффективность препаратов. Так, ИАПФ и БАР подавляют активность РААС и САС, активация которых снижает эффективность АК. В свою очередь, отрицательный баланс натрия, вызываемый последними, устраняется ингибиторами РААС. Кроме того, комбинированное назначение препаратов этих классов позволяет значительно уменьшить число побочных эффектов. Показано, что такой нежелательный побочный эффект ДГП АК, как отек лодыжек, при парралельном применении ИАПФ/БАР исчезает или значительно уменьшается. Использование АК позволяет снизить частоту возникновения сухого кашля, который относится к наиболее частым побочным эффектам ИАПФ [6]. Следует отметить, что ингибиторы РААС и АК относятся к метаболически нейтральным АГП, что делает эту комбинацию привлекательной для пациентов с нарушенным липидным, углеводным и пуриновым обменом.
Несмотря на столь положительную эффективность двойной комбинации «АК + блокаторы РААС», 21,8 % пациентов не достигли целевого уровня АД на фоне 12-недельной комбинированной терапии. При анализе группы резистентных к двойной комбинации больных АД выявлено выраженное поражение со стороны органов-мишеней, в частности достоверно большая ММЛЖ и ИММЛЖ с нарушением диастолической функции ЛЖ. Также отмечены достоверно высокая степень АГ у лиц, не достигших целевых уровней АД, и тенденция к увеличению ИМТ. Результаты нашего исследования указывают на необходимость дифференцированного подхода к лечению больных АГ с высоким и очень высоким кардиоваскулярным риском с учетом поражения органов-мишеней и факторов риска, а также обоснованность трехкомпонентной терапии таких больных для достижения основной цели антигипертензивной терапии — снижения АД < 140/90 мм рт.ст. И как следующий шаг — обоснованная тройная комбинация АГП по рекомендациям ESH/ESC, комбинация АК, блокаторов РААС и диуретиков. В дальнейшем 17 больных, резистентных к двухкомпонентной АГТ, были переведены на указанную тройную комбинацию АГП.
Таким образом, комбинированное применение АК с ингибиторами РААС отличается высокой АГЭ, выраженностью органопротективных воздействий, метаболической нейтральностью либо положительным профилем, хорошей переносимостью, что в целом характеризует данную комбинацию как наиболее оптимальную и эффективную в снижении риска ССО у большинства обследуемых больных АГ (78,2 %). При этом, следуя международным рекомендациям, 21,8 % больных, не достигших целевого уровня АД на комбинации «АК + блокатор РААС», рекомендуется наиболее оптимальная комбинация «АК + блокатор РААС + диуретик».
Выводы
1. Применение комбинированной терапии лерканидипином с блокаторами РААС периндоприлом и эпросартаном у больных ЭГ с высоким и очень высоким риском ССО позволяет достоверно потенцировать антигипертензивный эффект в отношении достижения целевых САД и ДАД.
2. Применение комбинированной терапии лерканидипином с периндоприлом и лерканидипином с эпросартаном обеспечивает достоверный органопротективный эффект, способствуя регрессии ГЛЖ, влияя на процессы сосудистого ремоделирования с нормализацией эндотелийзависимой вазодилатации плечевой артерии и уменьшением толщины КИМ общей сонной артерии.
3. На фоне комбинированного применения лерканидипина с периндоприлом или эпросартаном отмечается достоверное снижение уровня МАУ, креатинина сыворотки крови, повышение расчетной скорости клубочковой фильтрации, что приводит к достоверному снижению стадии хронической болезни почек и характеризует высокий нефропротективный эффект комбинированной терапии.
4. Применение лерканидипина в комбинации с периндоприлом или эпросартаном характеризуется позитивным влиянием на липидный профиль крови. Наряду с достоверным снижением уровня общего холестерина и уровня триглицеридов на фоне комбинированной терапии лерканидипином с периндоприлом отмечается достоверное повышение уровня холестерина ЛПВП. При этом оба режима терапии характеризуются хорошей переносимостью.

/60.jpg)
/61.jpg)
/62.jpg)