Журнал «Почки» 1 (11) 2015
Вернуться к номеру
Приклад ренопротективної терапії в дитячій нефрології: клінічний випадок
Авторы: Добрик О.О. — Львівський національний медичний університет ім. Данила Галицького; Секунда М.О. — Львівська міська комунальна дитяча лікарня
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
У статті наведено клінічний випадок розвитку хронічного захворювання нирок та хронічної ниркової недостатності у дитини з перинатальною гіпоксією та гострою нирковою недостатністю на фоні тромбозу ниркових вен у ранньому неонатальному періоді, яка отримувала засоби ренопротекції протягом 7 років життя, що дозволило стабілізувати ниркові функції.
В статье представлен клинический случай развития хронической болезни почек и хронической почечной недостаточности у ребенка с перинатальной гипоксией, острой почечной недостаточностью на фоне тромбоза почечных вен в раннем неонатальном периоде, который получал средства ренопротекции в течение 7 лет жизни, что позволило стабилизировать почечные функции.
The article presents a clinical case of chronic kidney disease and chronic renal failure in a child with perinatal hypoxia and acute renal failure on the background of renal vein thrombosis in the early neonatal period, who received renoprotective agents within 7 years of life that helped us to stabilize renal function.
діти, Кетостерил, ренопротекція.
дети, Кетостерил, ренопротекци.
children, Ketosteril, renoprotection.
Статья опубликована на с. 18-23
Нефро-, або ренопротекція, — це термін, що складається з двох частин: nephros (грец.) або ren (лат.) — нирка, protectio — захист, прикриття. Він означає лікувальну тактику, скеровану на захист нирки та гальмування розвитку хронічного захворювання нирок (ХЗН).
Хронічна патологія нирок є глобальною медичною та соціальною проблемою.
Статистичні дані показують, що у розвинутих країнах на 1 млн населення у середньому припадає 450–600 діалізних пацієнтів (у США — 1900, у Японії — 2300).
В Україні щороку на 1 млн населення реєструється до 150 пацієнтів із термінальним ступенем хронічної ниркової недостатності, тобто щороку 6000 громадян потребують діалізних методів терапії з приростом на рік приблизно на 8,0–11,0 %.
Світова нефрологічна практика показала, що нирково-замісна терапія (діаліз та трансплантація нирки) є надзвичайно дороговартісним та енергозатратним заходом. У США витрати на пацієнтів Medicare, які отримують той чи інший варіант діалізу або трансплантації нирки, становлять 7,8 % бюджету (близько 18 млрд доларів на рік).
Особливо гостро проблема нирково-замісної терапії стоїть в Україні, оскільки, окрім фінансового питання, існуючі центри гемодіалізу не в змозі забезпечити потребу всіх пацієнтів. Процедура трансплантації нирки законодавчо ще не оформлена.
Серед дітей термінальна стадія хронічної ниркової недостатності (тХНН) у світі трапляється з частотою 1–3 нових випадки на рік на 1 млн загального населення. Є дані, що поширеність хронічної ниркової недостатності (ХНН) у дітей становить 2–18 випадків на 1 млн дитячого населення.
У центрі уваги нефрологів сьогодні знаходяться саме діти, оскільки надання нирково-замісної терапії в дитячому віці є більшою проблемою, ніж у дорослих, та багато нефропатій, що починаються в дитячому віці, продовжують прогресувати у дорослих до стадії тХНН.
Тому основним завданням нефрологів та лікарів загальної практики є раннє виявлення ниркового захворювання як у дітей, так і у дорослих та проведення заходів ренопротекції, корекція можливих порушень ще до розвитку термінальної стадії ХНН та ХЗН.
На відміну від дорослих, у яких серед етіологічних факторів ХЗН переважають цукровий діабет та артеріальна гіпертензія, для дитячого віку значимими є вроджені вади нирок та їх хронічні захворювання, що розпочались у ранньому віці. До таких станів належать:
— полікістоз нирок або інші генетичні хвороби нирок;
— мала маса при народженні;
— гостра ниркова недостатність (ГНН) унаслідок перинатальної гіпоксемії та інших гострих ушкоджень нирок;
— ниркова дисплазія або гіпоплазія;
— урологічні аномалії, особливо обструктивні уропатії;
— міхурово-сечовідні рефлюкси з повторними інфекціями сечових шляхів та рубцюванням нирок;
— гострий нефрит або нефротичний синдром в анамнезі;
— гемолітико-уремічний синдром в анамнезі;
— васкуліти в анамнезі;
— цукровий діабет;
— системний червоний вовчак;
— тромбоз ниркових артерій та вен у перинатальному періоді.
Вищеназвані тяжкі захворювання нирок у дітей призводять до прогресуючого зменшення кількості функціонуючих нефронів, і з певного моменту механізми прогресування ураження нирок стають однаковими при будь-якому захворюванні. Наслідком патологічного процесу є гломерулярний склероз у поєднанні зі склерозом інтерстицію, що стає морфологічним субстратом ХНН уже незалежно від причини (И.Е. Иванова, 2013).
Якщо стратегія ренопротекції достатньо вивчена та ефективно застосовується в дорослих, то застосуванню ренопротективних заходів у дітей присвячені лише поодинокі повідомлення (Т.П. Борисова, О.Н. Герасименко, Е.Н. Бурбело, 2008; С.С. Паунова, Д.В. Длин, 2010, 2011).
У зв’язку з тим, що на даний час відсутні чіткі критерії призначення ренопротективних засобів та оцінки їх ефективності у дітей з урахуванням особливостей різних вікових груп, метою нашої роботи є привернути увагу лікарів-нефрологів та лікарів інших спеціальностей, які працюють із дітьми, до доцільності використання заходів ренопротекції з метою максимального відстрочення нирково-замісної терапії в дитячому віці та розпочати дискусію з цієї проблеми.
У даній роботі ми хочемо поділитися власними 7-річними спостереженнями за дитиною з поєднаною тяжкою неврологічною та нефрологічною патологією.
У Центрі дитячої нефрології та артеріальної гіпертензії Львівської міської дитячої клінічної лікарні на обліку знаходиться дитина Р., 2007 року народження, яка вперше надійшла на стаціонарне обстеження у віці 3 місяців для дослідження функції нирок.
З анамнезу: хлопчик від ІІ вагітності, яка перебігала із загрозою переривання, ІІ патологічних пологів, ІІ з двійні. Народився у гестаційному віці 38–39 тижнів масою 3250 г, довжиною 52 см, з оцінкою за шкалою Апгар 5–6–7 балів.
У пологах — ножне передлежання, випадіння петель та оболонкове прикріплення пуповини, тракція плода за ніжку, меконіальне забруднення навколоплідних вод.
Наростання тяжкості стану дитини спостерігалося з 1-ї доби життя, коли з’явилися клоніко-тонічні судоми, напади апное, що стало причиною для переведення дитини у відділення реанімації новонароджених Львівської міської дитячої лікарні у віці 27 годин. Тяжкість стану в реанімації була зумовлена ураженням ЦНС, судомним синдромом, респіраторним дистрес-синдромом. При обстеженні в животі пальпувалися пухлиноподібні утворення. Сечовиділення по катетеру, макрогематурія. У крові визначалася тромбоцитопенія, лейкоцитоз, зсув лейкоцитарної формули вліво. Об’єм діурезу на 2-гу добу життя становив 1,7 мл/кг/год. У коагулограмі виявлялося зниження рівня фібриногену до 1,6 г/л, тромбоцитарного індексу до 65,2 %, подовження протромбінового часу до 23 с. Показники гематокриту становили 50–52 %.
Було запідозрено, що в дитини розвинувся тромбоз ниркових вен. Частота всіх венозних тромбозів становить 5 на 100 тис. новонароджених, серед яких 40 % припадає саме на тромбоз ниркових вен. Методом ультразвукового дослідження (УЗД) із використанням кольорової допплерографії було доведено наявність тромбозу ниркових вен у даної дитини.
З третьої доби життя діурез дитини почав зменшуватися, на 4-ту добу розвинулася анурія, значно підвищилися показники сечовини та креатиніну, що стало приводом для проведення перитонеального діалізу ручним методом через катетер. Було проведено 10 сеансів перитонеального діалізу.
Окрім перитонеального діалізу дитині проводилася штучна вентиляція легень, інфузійна терапія, застосовувалися дезагреганти, гепаринотерапія, преcорні аміни в діуретичних дозах, антибактеріальна терапія, симптоматичне лікування. Діагностований внутрішньошлуночковий крововилив був протипоказанням для тромболітичної терапії.
Поступово стан дитини покращувався. До грудей хлопчик був прикладений у віці 1 міс., у віці 2 міс. виписаний додому. Спостерігався дільничним педіатром. Вигодовувався зцідженим грудним молоком.
Таким чином, у даного хлопчика спостерігалося поєднання декількох факторів із названих вище, які є причиною виникнення ХЗН та ХНН у дитячому віці.
При первинному обстеженні дитини у віці 3 місяців у нефрологічному відділенні клінічно було встановлено: маса тіла 4900 г, прояви гіпоксично-ішемічної і токсичної енцефалопатії, затримка психомоторного розвитку, синдром рухових розладів, анемія (Нb 90 г/л). Лабораторно: рівень загального білка становив 59,8 г/л, сечовини — 6,4 ммоль/л, креатиніну — 0,124 ммоль/л. УЗД нирок показало: права нирка розмірами 42,3 x 21 мм, ліва нирка — 43,2 x 20 мм, підвищеної ехогенності, з нечіткою кортико-медулярною диференціацією, гіпертрофією пірамідок. Було виставлено діагноз: ХЗН І ст., оскільки патологічні зміни в нирках зберігалися 3 міс. (тривалість ниркових змін понад 3 місяці є критерієм ХЗН), період реконвалесценції після ГНН та рекомендовано продовжити грудне вигодовування, курси хофітолу, сорбентів, полівітамінів, вітаміну D3, препаратів кальцію.
При надходженні у віці 1 року 4 міс. після проведеного обстеження (дані наведені в табл. 1) дитині було встановлено діагноз «ХЗН ІІ ст.». У неврологічному статусі прояви гіпоксично-ішемічної енцефалопатії, затримка нервово-психічного та фізичного розвитку. Хлопчик почав тримати голову з 6 міс., зуби прорізались у 12 міс. Дитина знаходилась на обліку як у нефролога, так і у невролога, отримувала комплекс неврологічного лікування.
З метою нефрологічного лікування дитині було призначено суміш амінокислот Кетостерил, оскільки хлопчик переходив на загальний стіл, але через неврологічну симптоматику були технічні труднощі з харчуванням — дитина не могла вживати їжу об’ємом та якістю згідно з віком та потребувала корекції білково-амінокислотної недостатності, продовжено курси хофітолу, сорбентів, полівітамінних комплексів, препарати заліза перорально. Надалі пацієнт надходив на планове обстеження функції нирок щопівроку. У табл. 1 стисло наведена динаміка показників функції нирок за весь час спостереження.
У віці 2 роки зміни зі сторони будови та функції нирок (табл. 1) хлопчика Р. відповідали ХЗН ІІ–ІІІ ст. та ХНН І–ІІ ст. До лікування було додано еналаприл у дозі 2,5 мг/добу.
Як можна бачити з даних, наведених у табл. 1, із нефрологічної точки зору у хлопчика після перенесеної в перинатальному періоді гіпоксії, ГНН на фоні тромбозу ниркових вен розвинувся нефросклероз з ознаками ХНН. З огляду на розвиток у дитини ХНН та тяжкої неврологічної патології прогноз у даного пацієнта був та залишається надзвичайно серйозним. Але в той же час позитивним фактом є те, що в даному випадку вдається стабілізувати функцію нирок протягом 7 років життя.
Саме тепер доцільним буде зупинитися на особливостях заходів ренопротекції, що застосовувалися для даної дитини.
Об’єм терапії було складено за визначеними канонами:
1. Режим (у нашому випадку догляд за дитиною).
2. Дієта.
3. Медикаментозні середники.
Найбільша кількість публікацій щодо ренопротекції в медичній літературі присвячується саме медикаментозній терапії, у той час як режиму та дієті приділяється дещо менше уваги. Проте в нефрології, особливо в дитячій нефрології, перші два пункти займають провідне місце у збереженні тривалості життя та функції нирок.
Щодо режиму в даному випадку слід зазначити, що мама хлопчика Р. за фахом медсестра і сім’я надзвичайно зацікавлена у здоров’ї даної дитини. У родині є ще абсолютно здоровий брат-близнюк, навчається в другому класі, та старша дівчинка віком 12 років, теж здорова. Але в той же час усі рекомендації щодо режиму дня, лікувальної фізкультури, призначень нефролога та невролога батьками виконуються не завжди ретельно. Наявність візуально вираженої неврологічної симптоматики та об’єм неврологічної терапії періодично відсували призначення нефролога на другий план (мама самостійно періодично відміняла прийом еналаприлу).
Дієта потребувала значно більшої уваги, оскільки це щоденний довічний фактор впливу на стан нирок.
Як добре відомо, харчування людини складається з макронутрієнтів (білки, жири, вуглеводи) та мікронутрієнтів (вітаміни, мікроелементи), кількість та якість яких повинна бути повноцінною та збалансованою для оптимального розвитку і функції як окремих органів та систем, так і всього організму, особливо в дітей, які ростуть та розвиваються.
Найбільшу увагу викликає саме білкова квота, оскільки білки є донаторами не тільки амінокислот для будування власних білків, але й азотистих продуктів (100 г білка містить 16 г азоту), фосфатів (на 1 г білка припадає близько 13 мг фосфору), натрію, тваринних жирів, що накопичуються при нирковій патології в організмі пацієнтів, призводять до метаболічних змін, які в подальшому потребують нирково-замісної терапії.
Нефрологи всього світу вже протягом майже 100 років вивчають вплив білків на стан та функцію нирок. Дані були суперечливими, змінювалися залежно від нових методів фармакотерапії та нирково-замісної терапії. Але все ж таки всі дійшли висновку, що малобілкова дієта (кількість білка 0,8–0,4 г/кг залежно від стадії ХЗН) справляє позитивний вплив на тривалість життя нирок.
Окрім позитивного впливу на обмінні процеси в організмі пацієнтів, малобілкові дієти мають сприятливу дію на саму паренхіму нирок, оскільки надлишок білка призводить до гіперфільтрації в залишкових нефронах, протеїнурії, яка, у свою чергу, призводить до фіброзу нефронів та стимулює апоптоз, викликає утворення молекул середньої маси та малонового альдегіду, що призводять до оксидантного стресу.
Тому малобілкова дієта має саме ренопротективний ефект, оскільки дає змогу продовжити життя ниркової паренхіми та продовжити додіалізний період на декілька років.
Але в той же час слід застерігати щодо іншої проблеми — білкової недостатності, що також призводить до негативних наслідків — білково-амінокислотної недостатності, імунодефіциту, анемії, зменшення синтезу гормонів та ферментів, затримки фізичного розвитку та ін.
При розщепленні білків утворюються амінокислоти (близько 25 назв). Розрізняють незамінні та замінні амінокислоти. З них утворюються власні білки, специфічні для кожного організму. Відомо, що білкова молекула може бути синтезована за наявності в організмі повного набору амінокислот, якщо хоча б однієї (лімітуючої) не вистачає, всі інші амінокислоти не можуть бути використаними з пластичною метою (для синтезу білків) та виводяться з сечею.
Тому при зниженні кількості тваринного та рослинного білка в раціоні нефрологічних хворих загальноприйнятим каноном стало додавання в раціон комплексів амінокислот, що повністю задовольняють потреби пацієнтів та призводять до нормалізації азотистого балансу.
Доведено, що вживання 80–90 г білка з традиційними продуктами харчування еквівалентне 13 г суміші амінокислот.
На сьогодні загальновизнаним комплексом амінокислот, що містить весь перелік незамінних амінокислот та кетокислот (кетовалін, кетолейцин, кетоізолейцин) в оптимальних співвідношеннях, є препарат Кетостерил (Fresenius Kabi, Німеччина).
Кетокислоти не містять азоту, що дозволяє зменшити загальний вміст азоту в одній таблетці до 36 мг. Метаболізм цих кетокислот в організмі супроводжується заміною кетогрупи на ендогенну NH2 шляхом трансамінування, тобто утворення повноцінних амінокислот через утилізацію ендогенного азоту. Призначення кето-/амінокислот покращує азотистий баланс при нижчому споживанні азоту, задовольняє потребу в незамінних амінокислотах, одночасно зменшує утворення азотистих «шлаків», внаслідок чого зменшуються симптоми уремії при збереженні харчового статусу (рис. 1).
/22/22.jpg)
Амінокислоти у складі препарату представлені у вигляді солей кальцію — у кожній таблетці їх міститься 50 мг. Кальцієві солі незамінних кето-/амінокислот можна розглядати як альтернативні м’які фосфатбіндери, що сприяють зв’язуванню фосфатів у кишечнику із збільшенням їх екскреції та допомагають зменшити вираженість гіперпаратиреозу.
При дезамінуванні амінокислоти вона перетворюється на безазотистий аналог — кетокислоту, при амінуванні кетокислоти відбувається її перетворення на незамінну амінокислоту.
V. Teplan (2012) показав, що кетокислоти не впливають на ниркову гемодинаміку, не викликають гіперфільтрації, що знижує протеїнурію.
В Україні налічується понад 1200 дітей із ХЗН, які мають порушення функції нирок та потребують постійної ренопротективної терапії та раціонального дієтичного харчування.
Більшість із них є інвалідами з дитинства та повинні бути забезпечені необхідними ліками безкоштовно. Згідно з наказом МОЗ України № 365 від 20.07.05 «Про затвердження протоколів надання медичної допомоги дітям за спеціальністю “Дитяча нефрологія”», розділ «Протокол лікування дітей з хронічною нирковою недостатністю», дітям передбачене призначення незамінних кетокислот у вигляді Кетостерилу, оскільки його застосування потенціює ренопротективну терапію та подовжує додіалізний період, що надає можливість для фізіологічного формування й росту організму дитини.
Незамінні кетокислоти входять до наказу № 169 МОЗ України «Перелік лікарських засобів вітчизняного та іноземного виробництва, які можуть закуповувати заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів» (2006).
Дітям Кетостерил призначають із розрахунку 0,1 г/кг/добу. Традиційно дозу Кетостерилу розраховують так: 1 таблетка на 5 кг маси тіла пацієнта.
Склад препарату Кетостерил
1 таблетка, вкрита оболонкою, містить:
67 мг — a-кетоаналог ізолейцину, кальцієва сіль;
101 мг — a-кетоаналог лейцину, кальцієва сіль;
68 мг — a-кетоаналог фенілаланіну, кальцієва сіль;
86 мг — a-кетоаналог валіну, кальцієва сіль;
59 мг — a-гідроксіаналог метіоніну, кальцієва сіль;
105 мг — лізин-ацетат;
53 мг — треонін;
23 мг — триптофан;
38 мг — гістидин;
30 мг — тирозин;
50 мг — кальцій.
Загальний азот — 36 мг.
З огляду на тяжку неврологічну патологію пацієнта Р., що значно утруднювала та продовжує утруднювати процес харчування хлопчика (необхідна рідка їжа в меншій кількості щодо вікових норм), кількість білка в раціоні відповідала малобілковій дієті (0,8 г/кг), додавання суміші амінокислот мало характер корекції білково-амінокислотної недостатності (як було зазначено вище), що клінічно проявлялося збільшенням росту та референтними показниками протеїнограми, стабільними показниками рівня кальцію та фосфору крові, а також позитивною динамікою в неврологічному статусі хлопчика Р. (при останньому надходженні хлопчик сидить, стоїть, ходить за підтримки).
Пацієнт Р. згідно з наведеними вище наказами отримував Кетостерил безкоштовно за місцем проживання в дозі 2 табл., потім 3 табл/добу, курсами з нетривалими перервами.
Надзвичайно важливий ренопротективний ефект інгібітору ангіотензинперетворюючого фермента (ІАПФ), а саме еналаприлу, полягає в розширенні діаметра виносної артерії, завдяки чому зменшується внутрішньоклубочковий тиск і відповідно протеїнурія. При останньому надходженні доза еналаприлу пацієнту Р. була збільшена до 5 мг/добу та в майбутньому буде корегуватися в динаміці до зниження артеріального тиску та ліквідації протеїнурії (мамі доведена необхідність постійного прийому ІАПФ дитиною).
Не можна не зупинитися на ренопротективній дії фітопрепарату хофітол. Хофітол — це готовий фітофармпрепарат — екстракт артишоку, що випускається фірмою Rosa Phytofarma (Франція). Екстракт артишоку відомий медицині з античних часів через його гепато- та ренопротективну дію. Ренопротективна дія препарату хофітол полягає в покращенні клубочкової фільтрації, помірному діуретичному ефекті (калій-зберігаючому, що в нашому випадку не було протипоказанням, максимальний рівень калію у пацієнта Р. становив 5,0 ммоль/л), здатності нормалізовувати білковий, азотистий, жировий та вуглеводний обмін.
При дослідженні результатів позитивного впливу препарату хофітол на біохімічні показники у хворих із ХНН відмічено зниження сечовини крові на 32,2 %, креатиніну — на 29 % (Медикус.ру: http://www.medicus.ru/pharmacology/patient/hofitol-ekstrakt-iz-artishoka-proshloe-nastoyaschee-buduschee-31756.phtml).
Гепатопротективний ефект екстракту артишоку полягає в цитопротективній дії, покращенні ензимної функції печінки, нормалізації процесів жовчоутворення та жовчовиведення, нормалізації тонусу жовчного міхура, що покращує детоксикаційну функцію печінки. Покращення детоксикаційної функції печінки підсилює позаренальний шлях виведення продуктів обміну.
Наявність препарату хофітол у розчині для перорального застосування та таблетках дала змогу призначати його пацієнту Р. у краплях із грудного віку та з переходом у майбутньому на прийом таблеток.
Дія сорбентів полягає у здатності зв’язувати креатинін, сечовину та інші токсини, що секретуються у шлунково-кишковий тракт разом із травними соками, та запобігати їх зворотному всмоктуванню (кишковий діаліз).
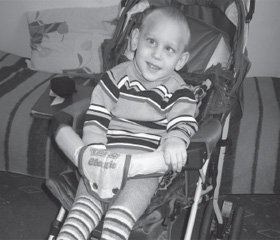
Динаміку зовнішнього виду пацієнта Р. можна бачити на рис. 2–4.
Підбиваючи підсумки розгляду клінічного прикладу дитини з ХЗН ІІ–ІІІ ст. і ХНН І–ІІ ст. та тяжкою неврологічною симптоматикою, що утруднювала повноцінне проведення заходів ренопротекції, можна сказати, що заходи ренопротекції для даної дитини, які складалися з малобілкової дієти та додавання комплексу амінокислот Кетостерил, ІАПФ, фітопрепарату артишоку хофітол, ентеросорбентів, мають позитивний ефект та можуть бути рекомендовані для застосувння в дитячому віці.
Будемо вдячні колегам за дискусію та зауваження щодо питання ренопротекції у дітей.
Конфлікту інтересів не заявлено.
Рецензент: Лук’яненко Наталія Сергіївна, д.м.н.,
старший науковий співробітник, керівник відділення
епідеміології вродженої та спадкової патології ДУ
«Інститут спадкової патології» НАМНУ
Рецензент: інформація закрита

/20/20.jpg)
/23/23.jpg)