Журнал «Почки» 4 (10) 2014
Вернуться к номеру
Нефропатії при антифосфоліпідному синдромі
Авторы: Таран О.І. — Національна медична академія післядипломної освіти ім. П.Л. Шупика, кафедра нефрології і нирково-замісної терапії
Рубрики: Нефрология
Разделы: Медицинское образование
Версия для печати
Статья опубликована на с. 74-78
Визначення поняття
Антифосфоліпідний синдром (АФС) — хронічне судинне оклюзивне захворювання, що клінічно проявляється рецидивуючими венозними та артеріальними тромбозами, тромбоцитопенією та звичним невиношуванням вагітності (або іншою акушерською патологією). АФС описують як системне автоімунне захворювання (або клініко-лабораторний симптомокомплекс), пов’язаний із синтезом антитіл до фосфоліпідів (аФЛ) та генералізованим протромботичним станом.
АФС описаний у 1986 році G.R.V. Hughers і співавт. і іноді в літературі зустрічається під назвою «синдром Hughers».
Епідеміологія
АФС розвивається в молодому віці, у 4–5 разів частіше у жінок, ніж у чоловіків. Достеменна популяційна поширеність АФС не з’ясована. аФЛ зустрічаються в середньому у 6 % здорових людей, у жінок із рецидивуючою акушерською патологією — у 5–15 %, у хворих на системний червоний вовчак (СЧВ) — у 40–60 %, а частота тромботичних ускладнень у цих хворих досягає 35–45 %.
Класифікація
На цей час доведено існування первинного АФС (ПАФС), який, імовірно, є самостійною нозологічною формою, та вторинного АФС (ВАФС), виникнення якого пов’язано з системним червоним вовчаком або з іншими хворобами автоімунної природи (ревматоїдний артрит, синдром Шегрена), лімфопроліферативними захворюваннями (парапротеїнемічні гемобластози, гострий і хронічний лімфолейкоз), інфекціями (сифіліс, хвороба Лайма, СНІД), постійним застосування деяких лікарських засобів (гідралазин, фенітоїн, хлорпромазин, новокаїнамід). Частка ПАФС становить 53 %, ВАФС — 47 %. Особливим варіантом АФС є катастрофічний із розвитком швидкоплинної поліорганної патології.
Етіологія
Причини АФС не відомі. Найчастіше АФС розвивається при ревматичних та автоімунних захворюваннях, переважно у разі СЧВ. Підвищений рівень аФЛ спостерігають при інфекціях (стрепто- і стафілококи, мікобактерії туберкульозу, ВІЛ, цитомегаловірус, гепатит В і С, вірус Епштейна — Барр), злоякісних новоутвореннях, прийомі деяких ліків (гідралазин, ізоніазид, пероральні контрацептиви, інтерферон). Є дані про імуногенетичну детермінованість до АФС, засновані на виявленні більш високої частоти аФЛ у сім’ях пацієнтів із ПАФС і ВАФС. Описані випадки розвитку ПАФС у членів однієї родини.
Численність та різноманітність клінічної симптоматики АФС і часте поєднання з іншими патологічними станами, що також перебігають із тромботичними ураженнями багатьох органів із системною запальною відповіддю (синдром дисемінованого внутрішньосудинного згортання, тромботична тромбоцитопенічна пурпура), бурхливий розвиток атеросклеротичного ураження судин при АФС, відсутність вірогідних лабораторних показників, за якими можливо прогнозувати рецидиви тромбозів, привертають увагу дослідників із метою пошуку специфічних імунологічних і молекулярно-біологічних характеристик синдрому.
Патогенез
Розвиток АФС пов’язують із синтезом аФЛ — гетерогенної популяції антитіл до антигенних детермінант негативно заряджених (аніонних) фосфоліпідів і/або до фосфоліпідоз’язуючих (кофакторних) білків плазми:
— до кардіоліпіну класів G і M;
— фосфатидилетаноламіну, фосфатидилхоліну;
— антитіл, що відповідають за утворення хибнопозитивних реакцій на сифіліс;
— антитіл, що подовжують час згортання крові (in vitro) у фосфоліпідзалежних коагуляційних тестах (вовчаковий антикоагулянт).
При СЧВ ці антитіла, як і вовчаковий антикоагулянт, виявляють із частотою від 7 до 86 %, що пояснюють використанням різних методик їх визначення та неоднорідністю груп пацієнтів. У популяції їх частота становить не більше 2–4 %.
Важливу роль в утворенні аФЛ відіграють речовини-кофактори (протромбін, тромбомодулін, кініноген, кініногензв’язуючий білок, β2-глікопротеїн І).
Взаємодія аФЛ із фосфоліпідами та кофакторними білками, яким належить центральне місце в її реалізації, є складним процесом. Одним із відомих кофакторних білків є Р2-глікопротеїн, що має антикоагуляційну дію.
Р2-глікопротеїн взаємодіє з фосфоліпідами мембран тромбоцитів, клітин ендотелію судин, нейронів та інших клітин, що призводить до різноманітних структурних зміни молекул цих мембран, дисбалансу у послідовних перетвореннях компонентів коагуляційної, фібринолітичної, кінінової систем, можливо, цитокінових перетвореннях. У процесі взаємодії відбувається формування «неоантигенів», з якими і реагують циркулюючі аФЛ, у результаті чого відбувається активація тромбоцитів, втрата антитромбогенних властивостей ендотелієм, порушується фібриноліз та пригнічується активність білків системи природних антикоагулянтів (протеїни С і S).
Після взаємодії аФЛ із фосфоліпідами мембран клітин розвиваються порушення, що викликають генералізовані або оклюзивні тромботичні мікроваскулярні ураження різних судинних ділянок організму; васкуліт, зумовлений накопиченням у стінці судин імунних комплексів; дисеміноване внутрішньосудинне згортання крові; внутрішньосудинну активацію комплементу, нейтрофілів із розвитком лейкоцитарного тромбозу на тлі дисфункції ендотелію. Утворення тромбозів пояснюють гіпотезою подвійного удару:
— перший удар — циркулюючі аФЛ сприяють гіперкоагуляції та створюють підґрунтя для утворення тромбозів;
— другий удар — дія додаткових факторів (вік, травма, інфекція, вагітність та ін.) та індукція ними тромбоутворення.
Клініка
Порушення, що виникають у конкретних хворих на АФС, різноманітні за ступенем вираженості і клінічно проявляються різними комбінаціями.
У деяких випадках АФС, особливо на тлі гострих рецидивуючих тромбозів, можуть виникати поліорганна ішемія та різноманітні клінічні прояви: сітчасте ліведо, поперечний мієліт, мігрень, хорея, епілепсія, асептичні некрози кісток, хронічні виразки гомілок, неінфекційний міокардит, синдром Рейно, автоімунна гемолітична анемія, артеріальна, легенева та портальна гіпертензія, первинна безплідність, кардіальні прояви (гострий інфаркт міокарда, мітральний порок серця) [3].
Загальновизнаним є виділення катастрофічного АФС [6, 13] — особливого варіанта ПАФС, що характеризується бурхливим розвитком тромботичних уражень судинних басейнів та поліморфною симптоматикою зі швидкопрогресуючим перебігом (ниркова недостатність та артеріальна гіпертензія (АГ), легенева недостатність, неврологічні порушення, респіраторний дистрес-синдром, периферична гангрена). Поодинокі повідомлення стосуються розвитку катастрофічного АФС на тлі синдрому Шегрена та ревматоїдного артриту. Розвиток катастрофічного АФС викликають інфекційні захворювання, хірургічні втручання, провокує — застосування деяких лікарських засобів (петльових діуретиків, каптоприлу, оральних контрацептивів).
Оскільки клінічна симптоматика АФС надзвичайно різноманітна, характер прогресування симптомів може змінюватись у широких межах. Особлива увага приділяється характеристиці критеріїв його діагностики. Виділяють дві основні та одну допоміжну групи критеріїв [1].
Основні:
— перша група — тромботичні судинні ураження (тромбози великих глибоких вен кінцівок, тромботичні ураження легеневої артерії, поверхневі тромбофлебіти, сітчасте ліведо; ураження мікросудин — поширені некрози шкіри, тромботична мікроангіопатія в нирках, підтверджена даними біопсії [9], та тромботичні ураження в декількох судинних ділянках) [12].
— друга група — акушерські критерії (три епізоди і більше загибелі ембріона, не пов’язані з анатомічними, генетичними або гормональними причинами; один епізод або більше загибелі плода в строки понад 10 тижнів вагітності при нормальному розвитку плода; загибель одного новонародженого або більше без аномалій розвитку, що обумовлена недоношенням, тяжкою прееклампсією або тяжкою плацентарною недостатністю; передчасне відшарування плаценти, прееклампсія і еклампсія, HELLP-синдром).
До допоміжної групи критеріїв зараховують: тромбоцитопенію, гемолітичну автоімунну анемію, аваскулярні некрози кісток, судоми, хорею, синдром, що нагадує розсіяний склероз, мігрень, поперечний мієліт, різноманітні ураження серця, некрози надниркових залоз, перфорацію носової перегородки.
Ураження нирок при АФС
Виникнення нефропатії у хворих на ПАФС та ВАФС пов’язують з інтраренальним судинним ураженням. Клінічні й морфологічні прояви тромботичної мікроангіопатії в межах АФС подібні до інших мікроангіопатій — гемолітико-уремічного синдрому та тромботичної тромбоцитопенічної пурпури. При вивченні ниркових біоптатів у хворих на люпус-нефрит встановлений тісний зв’язок виникнення внутрішньоклубочкового тромбозу з підвищеним рівнем антитіл типу IgG до кардіоліпіну, а більш висока частота гломерулосклерозу виникає на тлі утворення тромбів на початкових стадіях хвороби. Розвиток тромботичної ангіопатії при люпус-нефриті асоціюється з АФС та визнається фактором прогресування нефропатії.
Щодо розвитку АФС-асоційованої нефропатії при ПАФС, то її виникнення описане в нечисленних пацієнтів. Частота нефропатії, за даними N. Amigo і співавт. (1992), становить 25 % при ПАФС, у разі ВАФС — у 32 % хворих на СЧВ. Основним клінічним симптомом нефропатії є артеріальна гіпертензія, часто помірна, значно рідше — транзиторна. У деяких пацієнтів описаний злоякісний перебіг АГ із розвитком гострої ниркової недостатності. Причиною АГ у пацієнтів з АФС є зміни внутрішньониркових судин, що призводять до ішемії нирок та стимуляції ренін-ангіотензин-альдостеронової системи. Активація ренін-ангіотензин-альдостеронової системи доведена знахідками збільшення ренінумісних клітин у біоптатах нирок та підвищенням рівня реніну в плазмі крові хворих на АФС. АФС-нефропатія може проявлятись лише АГ, що поєднується з порушеннями функціонального стану нирок або перебігає з сечовим синдромом, при якому рівень протеїнурії рідко досягає нефротичного. Еритроцитурія має місце в половини хворих, а випадки макрогематурії не описані. Хронічна ниркова недостатність виражена помірно і прогресує лише у випадках злоякісної АГ.
АФС-нефропатія у разі ПАФС може перебігати гостро з формуванням гострого нефритичного синдрому з вираженими еритроцитурією та протеїнурією в поєднанні з АГ і погіршенням азотовидільної функції нирок. Хронічний перебіг АФС-нефропатії у більшості пацієнтів представлений мінімальним сечовим синдромом, зниженням переважно фільтраційної функції нирок та АГ. Дуже рідко зустрічається нефротичний синдром.
Патоморфологія
Для морфологічної картини АФС-нефропатії характерне поєднання гострих та хронічних вазоконстрикторних змін. Гострі зміни представлені тромботичною мікроангіопатією з фібриновими тромбами в капілярах клубочків і прегломерулярних судин, яку знаходять лише у 30 % біоптатів нирок пацієнтів з АФС-нефропатією.
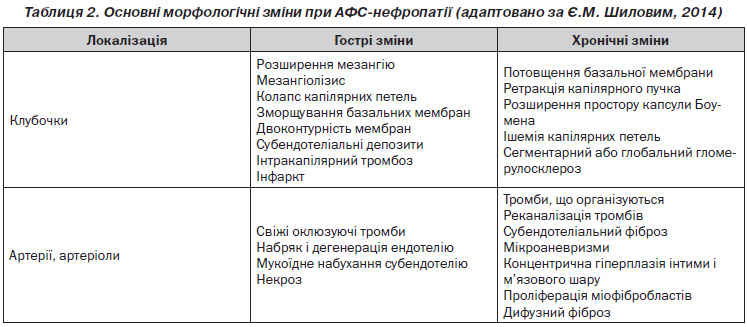
Морфологічно при АФС-нефропатії встановлюють склероз внутрішньоклубочкових артерій та артеріол, за рахунок проліферації міофібробластів — фіброзну гіперплазію інтими міжчасточкових артерій та їх гілок, що призводить до повної оклюзії артерій і артеріол фіброзною тканиною. Тромботична мікроангіопатія призводить до утворення фібринових тромбів, які закупорюють просвіт прегломерулярних артеріол та капілярів клубочка. Спостерігається атрофія кори нирок, вогнищевий фіброз інтерстицію, атрофія канальців. Клубочки склерозовані або збільшені за рахунок кіст, що утворюються. Зрідка на тлі тромботичної мікроангіопатії визначались дифузна інтерпозиція мезангію з утворенням двоконтурної мембрани та явища мезангіолізису. У літературі описані випадки розвитку АФС-нефропатії з фокальним сегментарним гіалінозом/склерозом та мембранозним гломерулонефритом. Основні морфологічні зміни наведені в табл. 2.
При морфологічному дослідженні нирок у хворих на СЧВ із люпус-нефритом та АФС є ознаки вовчакового нефриту та вираженого інтерстиціального фіброзу. Іноді на тлі СЧВ АФС є єдиною формою ураження нирок.
Клініка нефропатії
АФС-нефропатія найчастіше клінічно проявляється помірною протеїнурією та розвитком артеріальної гіпертензії. АГ при ПАФС трапляється у 70–90 % хворих. У частини хворих АГ може бути єдиним симптомом ураження нирок, але в більшості випадків виявляється її поєднання з ознаками порушення ниркових функцій. Розвиток нефротичного синдрому спостерігається рідко, а зростаючу протеїнурію відмічають при тяжкій, погано корегованій АГ. Зрідка захворювання може розпочатись із гострої ниркової недостатності та прогресувати до хронічної ниркової недостатності. Перебіг ВАФС-нефропатії маскується ознаками люпус-нефриту. Особливістю АФС-нефропатії є раннє ізольоване зниження швидкості клубочкової фільтрації, що надовго випереджає порушення азотовидільної функції нирок. Ниркова недостатність виражена помірно і має повільно прогресуючий перебіг, частіше пов’язаний з АГ. Необоротне гостре ушкодження нирок розвивається у хворих на катастрофічний АФС зі злоякісною АГ.
У більшості випадків ВАФС-нефропатія, що асоціюється з цим синдромом, поєднується з люпус-нефритом, і її клінічна картина характеризується зниженням ниркових функцій та формуванням АГ. У разі, якщо АФС є самостійною формою ураження нирок при СЧВ, її клінічні симптоми спостерігаються у вигляді зростаючої ниркової недостатності, тяжкої АГ, протеїнурії й гематурії і практично симулюють картину швидкопрогресуючого гломерулонефриту.
Діагностика
Для АФС характерна помірна тромбоцитопенія, що не супроводжується геморагічними ускладненнями, та Кумбс-позитивна гемолітична анемія. У разі катастрофічного АФС із нефропатією можливий розвиток мікроангіопатичної гемолітичної анемії. У хворих, у яких виявляється вовчаковий антикоагулянт, може бути подовження активованого часткового тромбопластинового часу і протромбінового часу.
Методом ELISA (імуносорбційні тести) визначають рівні автоантитіл до кардіоліпіну класу IgG і/або IgМ, β2-глікопротеїну І, високі показники яких свідчать про АФС. Діагноз підтверджують позитивні тести на вовчаковий антикоагулянт. Про АФС можуть свідчити виявлені хибнопозитивні серологічні реакції на сифіліс.
При виявленні нефропатії у разі підтвердженого діагнозу АФС необхідне морфологічне дослідження нирок із метою підтвердження тромботичних процесів у судинах нирок. Додаткову інформацію може надати ультразвукове (УЗ) допплерівське дослідження нирок із виявленням ішемії паренхіми нирок та зниження швидкості ниркового кровотоку. У разі розвитку тромбозу інтраренальних судин та інфаркту нирок доцільна УЗ-діагностика.
Диференціальна діагностика
Диференціальна діагностика АФС-нефропатії проводиться з такими станами:
— класичні форми тромботичної мікроангіопатії (тромботична тромбоцитопенічна пурпура та гемолітико-уремічний синдром);
— ураження нирок при СЧВ та системній склеродермії;
— швидкопрогресуючий гломерулонефрит і гостра склеродермічна нефропатія у разі катастрофічного АФС.
Виключати АФС-нефропатію при гострому ушкодженні нирок, гострому нефритичному синдромі, злоякісній гіпертензії у пацієнтів молодого віку, що супроводжується зниженням ниркових функцій.
Лікування нефропатії
При ПАФС глюкокортикоїди та цитостатичні засоби не застосовуються.
У разі ВАФС у межах СЧВ застосування кортикостероїдів та цитостатичних засобів проводиться в дозах, що визначаються активністю хвороби.
Профілактика й лікування АФС
Оскільки методи лікування імунопатологічних порушень, що лежать в основі АФС, не розроблені, а ризик повторних тромбозів дуже високий, пацієнти профілактично приймають антикоагулянти і/або антиагреганти після виявлення факторів ризику і рецидивування тромбозів, до яких зараховують похилий вік, порушення жирового обміну (гіперліпідемія), стабільну системну артеріальну гіпертензію, гіподинамію, паління, гіпергаммацистеїнемію, тромбоцитопенію, вагітність, прийом оральних контрацептивів, гормональну замісну терапію, інтеркурентні інфекції, активний СЧВ, хірургічні операції, стрес, швидку відміну антагоністів вітаміну К. Після циклу гепаринотерапії призначають непрямі антикоагулянти. Препаратом вибору на сьогодні є варфарин у дозі 1,0–2,5 мг/добу. Ефективність лікування цим лікарським засобом контролюють за допомогою міжнародного нормалізованого відношення, значення якого підтримується в межах 2,5–3,0. Питання про інтенсивність та тривалість антикоагулянтного лікування має особливе значення з огляду на ризик геморагічних ускладнень. У нефрологічній клініці особливе значення мають такі фактори ризику, як висока неконтрольована артеріальна гіпертензія, прийом декількох лікарських препаратів, включаючи застосування нестероїдних протизапальних препаратів, прийом метилпреднізолону у високих дозах, прийом азатіоприну та похилий вік. В осіб молодого віку більш показане застосування комбінованої терапії непрямими антикоагулянтами та низькими дозами ацетилсаліцилової кислоти (і/або дипіридамолу), особливо у випадках вторинного АФС із тромбоцитопенією, порушеннями функції тромбоцитів, дефектами протромбіну. З огляду на високий ризик атеросклеротичного ураження судин при СЧВ та АФС, як і при цукровому діабеті, особлива увага приділяється контролю за гіперліпідемією шляхом застосування дієти з малим вмістом жирів та статинів на тлі контролю за гіперглікемією при постійному лікуванні супутньої артеріальної гіпертензії інгібіторами АПФ та блокаторами рецепторів А2.
Хворим із гострим перебігом АФС-нефропатії призначають нефракціоновані гепарини або низькомолекулярні гепарини, але тривалість терапії та дози гепарину не визначені. При хронічному перебігу АФС-нефропатії з поступовою втратою ниркових функцій та помірною АГ лікування можливе лише непрямими антикоагулянтами. Лікування катастрофічного АФС, первинного або вторинного, полягає в застосуванні пульс-терапії метилпреднізолону та циклофосфаміду, прямих антикоагулянтів і плазмаферезу з метою видалення аФЛ та медіаторів внутрішньосудинного згортання крові.
Прогноз
За умови природного перебігу АФС-нефропатії прогноз захворювання несприятливий: 10-річна виживаність становить близько 50 %. Антикоагулянтна терапія сприяє збільшенню 10-річної виживаності до 98 %.
Факторами ризику розвитку ХНН у пацієнтів із АФС-нефропатією є висока АГ, епізоді погіршення функції нирок, ішемія нирки за даними УЗ-дослідження, розвиток інтерстиціального фіброзу та артеріолосклерозу за даними морфологічного дослідження біоптатів нирок.

1. Багрий А.Э., Дядык А.И., Колесник Н.А. и др. Антифосфолипидный синдром // Системная красная волчанка. — Донецк: КП «Регион», 2003. — С. 327–335.
2. Казимирко В.К., Коваленко В.Н. Ревматология: Учебное пособие. — Донецк: Издатель Заславский А.Ю., 2009. — С. 146–153.
3. Козловская Н.Л., Тареева И.Е., Камышева Е.С. и др. Поражение почек при первичном антифосфолипидном синдроме // Тер. архив. — 2001. — № 6. — С. 25–31.
4. Насонов Е.Л. Клинические рекомендации. Ревматология. — М.: ГЭОТАР-Медиа, 2006. — 288 с.
5. Національний підручник з ревматології / За ред. В.М. Коваленка, Н.М. Шуби. — К.: МОРІОН, 2013. — С. 245–253.
6. Рациональная фармакотерапия в нефрологии. Руководство / Под ред. Н.А. Мухина и соавт. — М.: Литтерра, 2006. — С. 376–387.
7. Asherson R.A., Cervera D.D. Antiphospholipid syndrome // Textbook of Rheumatolgy / Ed.by W. Kelly et al. — Philadelphia; London: W.B. Saunders Company, 1997. — Vol. 2, Ch. 66. — P. 1057–1064.
8. Williams F.M.K., Chinn S., Hughes G.R.V., Leach R.M. Criticalillness in systemic lupus erythematosus and the antiphospholipid syndrome // Ann. Rheum. Dis. — 2002. — Vol. 61. — P. 414–421.