Журнал «Почки» 3 (09) 2014
Вернуться к номеру
Інфекції сечових шляхів
Авторы: Іванов Д.Д. — зав. кафедри нефрології і НЗТ НМАПО імені П.Л. Шупика; Іванова М.Д. — к.м.н., асистент кафедри патологічної анатомії НМУ ім. О.О. Богомольця; Домбровський Я.А. — зав. відділенням КЛ № 18, м. Київ
Рубрики: Нефрология
Разделы: Медицинское образование
Версия для печати
Статья опубликована на с. 57-62
Інфекції сечових шляхів (ІСШ) є однією з найчисленніших груп серед нефрологічних захворювань. Вони займають провідне місце серед інфекцій організму людини загалом. Існують маніфестні та малосимптомні (приховані) варіанти із латентним перебігом, здатні до маніфестації на тлі інших інфекційних захворювань.
У репродуктивному віці інфекції сечових шляхів переважно документуються у вигляді хронічних циститів (переважно в жінок) та простатоциститів у чоловіків.
Тривалий перебіг даних захворювань може призводити до зниження функцій нирок за рахунок тубулоінтерстиціального процесу та порушень уродинаміки, що трактується як хронічна хвороба нирок. Як наслідок, розвивається вторинно-зморщена нирка та хронічна ниркова недостатність. Таким чином, актуальність проблеми інфекційного ураження сечових шляхів і нирок обумовлена значною поширеністю та високим ризиком хронізації процесів.
ІСШ розглядається як мікробно-запальне ураження органів сечових шляхів без уточнення топічного рівня ураження. Пієлонефрит (ПН) — неспецифічне мікробне запалення нирки з переважним вогнищевим ушкодженням тубулоінтерстиціальної тканини, чашок та миски. Цистит — неспецифічне мікробне запалення слизової оболонки сечового міхура.
До ІСШ відносять інфекції нижніх (уретральний синдром/уретрит, цистит, простатоцистит) та верхніх сечових шляхів (уретрит, пієлонефрит первинний та вторинний, карбункул нирки, апостематоз нирки, паранефрит).
Класифікація ІСШ (EAU, 2013) за рівнем інфекції:
— уретрит;
— цистит;
— пієлонефрит;
— уросепсис.
У 2013 році EAU (Європейська асоціація урологів) запропонувала, щоб класифікація ІСШ базувалась:
— на анатомічному рівні інфекції (уретрит, цистит, пієлонефрит, сепсис);
— рівні тяжкості інфекції (цистит — 1-й, пієлонефрит — 2–3-й, уросепсис — 4–6-й);
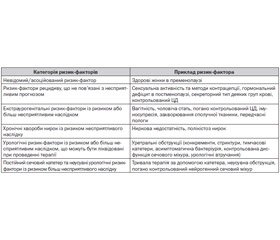
— наявності ризик-факторів (немає ризик-факторів, ризик-фактори рецидивуючих ІСШ, екстраурогенітальні ризик-фактори, нефрологічні захворювання, урологічні ризик-фактори);
— наявності катетера (ORENUC — ОРЕНУК);
— мікробіологічних чинниках.
Категоризація ризик-факторів більш детально наведена в табл. 1.
Збудники
Найбільш поширеними збудниками інфекції сечових шляхів є представники грамнегативної флори (80 %), такі як кишкова паличка, протей, клебсієла, ентерокок, рідше — грампозитивна, а саме стафілококи, що характерні для хронічних латентних процесів. Етіологічним чинником можуть також бути віруси (аденовіруси, ентеровіруси, віруси герпетичної групи — з 1-ї по 5-ту, парагрипу), найпростіші (Trichomonas vaginalis), гельмінти, гриби, внутрішньоклітинні збудники (Chlamydia trachomatis, Ureaplasma urealiticum, Mycoplasma genitalium, Mycoplasma hominis) та зоонозні інфекції.
Діагностичні критерії інфекції сечових шляхів
Уретральний синдром (в осіб жіночої статі) та уретрит (в осіб чоловічої статі) документується на підставі частих болючих сечовипускань (особливо на початку сечовипускання), дизурії, імперативних позивів до сечовипускання, бактеріурії 104–105 КУО/мл та нейтрофільної (понад 50 % нейтрофілів) лейкоцитурії.
У хлопчиків уретральний синдром найчастіше виникає за наявності фімозу, у підлітковому віці — із початком статевого життя, у похилому віці — на тлі зменшення вмісту статевих гормонів (крауроз препуціальної тканини, зниження бар’єрних функцій епітелію).
У дівчаток найчастіше уретральний синдром зустрічається при вульвовагініті, із початком статевого життя, а у жінок похилого віку — за наявності краурозу вульви при зниженому вмісті естрогенів. На відміну від чоловіків, у жінок уретральний синдром упродовж годин переходить у цистит. Слід відзначити, що аналіз сечі, у тому числі використання методу тест-смужки, з оцінкою наявності лейкоцитів, еритроцитів та визначення нітритів рекомендується як рутинний для встановлення діагнозу (ступінь рекомендацій C). Кількість колонієутворюючих одиниць (КУО) > 104/мл є ознакою діагностично значущої бактеріурії (ступінь рекомендацій C).
Цистит діагностується на підставі частих болючих сечовипускань (особливо наприкінці сечовипускання), дизурії, імперативних позивів до сечовипускання, болю внизу живота та бактеріурії понад 103 МТ/мл у середній порції сечі або будь-якої бактеріурії, визначеної методом надлобкової пункції. Нерідко при циститі спостерігається термінальна еритроцитурія. Наявність клінічних проявів при меншій бактеріурії може свідчити про латентну інфекцію сечових шляхів.
Критерії встановлення діагнозу ІСШ відповідно до протоколів IDSA/ESCMID подані в табл. 2.
Лікування інфекції сечових шляхів
Основним методом лікування ІСШ є антимікробна терапія. На сьогодні немає доказових даних про ефективність інших методів для одужання від ІСШ.
Терапію уретриту/уретрального синдрому проводять одноразовою добовою дозою фосфоміцину (монурал) або 3-денним курсом фторхінолону чи цефалоспорину 3-ї генерації.
Доцільність вибору терапевтичного підходу визначається трьома головними факторами. Перший — наявність в анамнезі ознак, що вказують на зменшення захисних властивостей сечових шляхів; другий — наявність елементів обструкції та відокремлених вогнищ бактеріовиділення; третій — виявлення окремих мікроорганізмів – анаеробів, мікроаерофілів, Chlamydia trachomatis, Mycoplasma genitalium i hominis, Ureaplasma urealiticum, найпростіших.
Для лікування гострого циститу використовують 3-денний курс фторхінолону (ципро-, левофлоксацин) або цефалоспорину 3-ї генерації (цефікс) або 5-денний курс уроантисептика (фурамаг, триметоприм/сульфаметоксазол, фурадонін). При рецидиві циститу проводиться зміна препарату, збільшення лікування на 2 дні (5 діб фторхінолон або цефалоспорин, 7 діб — уроантисептик), діагностика захворювань, що передаються статевим шляхом, та призначається профілактичне тривале лікування.
У випадку виявлення найпростіших, мікроаерофілів, анаеробів або збудників з невизначеним положенням у таксономічному ряду раціональним є такий підхід: лікування в першу чергу найпростіших (наприклад, Trichomonas vaginalis) або кліщів, які можуть бути факультативними господарями для інших збудників, потім (або одночасно) лікування гарднерел, анаеробів або бактерій і в останню чергу — ліквідація хламідій, уреаплазм, мікоплазм. Таким чином, тривалість лікування циститу збільшується до 3 тижнів; необхідне призначення похідних імідазолу та хінолінів (метронідазол, орнідазол, ципрофлоксацин, офлоксацин, левофлоксацин, моксифлоксацин) чи азаліду (азитроміцин). Після ліквідації проявів циститу в пацієнтів жіночої статі доцільно застосування для профілактики дози уроантисептика, що становить 1/3–1/4 від терапевтичної, на ніч протягом 1–6 місяців.
Для терапії статевих інфекцій препаратами першого вибору в лікуванні Ureapl.urealiticum є рокситроміцин, кларитроміцин — 7–10 діб, Chlamid. trachomatis — азитроміцин, левофлоксацин — 7 діб, Mycoplasma genitalium (hominis) — рокситроміцин, кларитроміцин, моксифлоксацин — 7 діб, Trichom. vaginalis — орнідазол 5 діб.
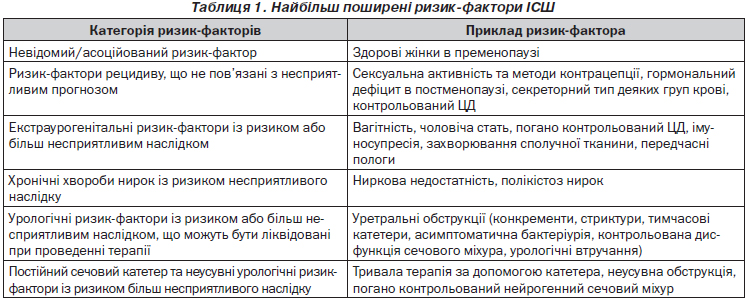
У жінок із початком клімаксу окрім вищеперерахованих препаратів доцільно використовувати замісну місцеву або системну гормональну терапію (овестин, менорест, естрожель, клімадинон та ін.) після консультації гінеколога (табл. 3).
Критерієм одужання при циститі вважається відсутність скарг та нормальні аналізи сечі протягом одного року диспансерного спостереження.
Принципи лікування пієлонефриту
Етіотропна терапія — призначення антибіотиків; патогенетична терапія — дезінтоксикація; симптоматичне лікування — жарознижуючі та профілактичне лікування після досягнення ремісії.
Лікування ПН передбачає можливість як амбулаторного, так і стаціонарного лікування. Показанням для стаціонарного лікування є необхідність парентеральної (внутрішньовенної) терапії антибіотиком, жарознижуючим препаратом та дезінтоксикації. Слід відзначити, що внутрішньом’язове введення антибіотиків сьогодні не практикується.
Внутрішньовенна дезінтоксикація проводиться реосорбілактом (200–400 мл на добу), а в пацієнтів із кетоацидозом або цукровим діабетом — ксилатом 200–400 мл на добу. З метою зниження температури використовують парацетамол та німесулід. Існує внутрішньовенна форма парацетамолу — інфулган.
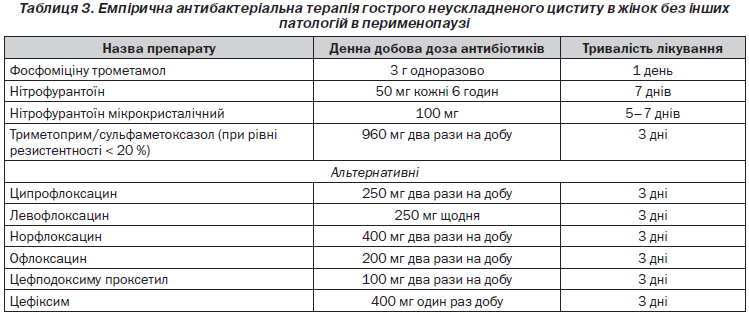
У легких і помірної активності випадках гострого неускладненого пієлонефриту (нетяжкий та середнього ступеня тяжкості гострий неускладнений пієлонефрит) зазвичай достатньо пероральної терапії протягом 10–14 днів (рівень доказовості 1b, ступінь рекомендацій B).
Фторхінолони впродовж 7–10 днів можуть бути рекомендовані як терапія першого ряду, якщо резистентність E.coli до них нижча за 10 % (рівень доказовості 1b, ступінь рекомендацій A). Із фторхінолонів найчастіше призначають ципрофлоксацин та левофлоксацин, гатифлоксацин.
Якщо використовувати підвищену дозу фторхінолону, лікування може бути скорочене до 5 днів. Наприклад, ципрофлоксацин 0,75 г двічі або левофлоксацин (лефлоцин) 0,75 г/добу (рівень доказовості 1b, ступінь рекомендацій B). Проте існують відомості про зростання резистентності E.coli до фторхінолонів, що обмежує їх емпіричне використання.
Найчастіше як стартову терапію використовують цефалоспорин третьої генерації протягом 3 діб із переходом на цефіксим протягом 7 діб або фторхінолони. Курс лікування при неускладненому ПН триває 10 діб.
Ко-амоксиклав не рекомендується як препарат першого вибору для емпіричної пероральної терапії гострого пієлонефриту (рівень доказовості 4, ступінь рекомендацій B). Він призначається, коли підтверджена наявність чутливого до нього грампозитивного збудника (рівень доказовості: 4, ступінь рекомендації C).
У регіонах із високою резистентністю до фторхінолонів і бета-лактамазпродукуючими штамами E.coli (> 10 %) початкову емпіричну терапію аміноглікозидом або карбапенемом слід розглядати як пріоритетну, доки згідно з мікробіологічними дослідженнями не будуть рекомендовані до використання інші пероральні препарати (рівень доказовості 4, ступінь рекомендацій B).
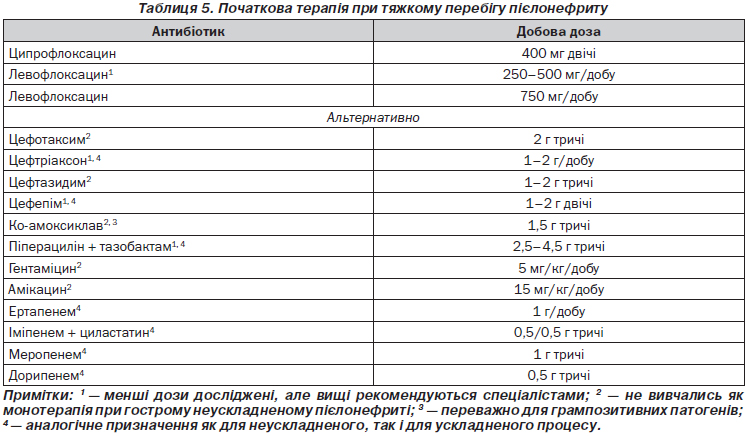
Хворих на тяжкий пієлонефрит, які не можуть приймати препарати перорально за наявності системних симптомів, наприклад нудоти або блювоти, доводиться лікувати спочатку одним із парентеральних антибіотиків.
При рівні резистентності E.coli, меншому за 10 %, призначають фторхінолони (рівень доказовості 1b, ступінь рекомендацій B) або третю генерацію цефалоспоринів (рівень доказовості 1b, ступінь рекомендацій B). У разі резистентності E.coli понад 10 % до перелічених антибіотиків використовують аміноглікозиди або карбапенеми (рівень доказовості 1b, ступінь рекомендацій B). Амінопеніцилін/сульбактам призначають за наявності грампозитивних патогенів (рівень доказовості 4, ступінь рекомендацій B).
Показанням до госпіталізації є неможливість ліквідації ускладнень або наявність клінічних симптомів сепсису (рівень доказовості 4, ступінь рекомендацій B). Для його верифікації використовують тест на прокальцитонін. Після покращення пацієнт переводиться на пероральний прийом вищезазначених антибіотиків, якщо виявлений мікроорганізм чутливий до них, до завершення 1–2-тижневого курсу лікування (рівень доказовості 1b, ступінь рекомендацій B).
Рекомендовані препарати для емпіричної терапії гострого неускладненого пієлонефриту наведені в табл. 4.
У подальшому спостереженні після видужання пацієнта з ПН за відсутності скарг не доведена доцільність регулярного проведення аналізів сечі і культуральних досліджень сечі (рівень доказовості 4, ступінь рекомендацій C). У разі відсутності позитивної динаміки симптомів протягом 3 діб або при рецидиві захворювання протягом 2 тижнів необхідно провести культуральне дослідження сечі та УЗД нирок, комп’ютерну томографію або реносцинтиграфію (рівень доказовості 4, ступінь рекомендацій B). Якщо урологічна патологія не виявлена, слід призначити інший антибіотик за виявленою чутливістю культурального дослідження сечі (рівень доказовості 4, ступінь рекомендацій B). У разі рецидиву пієлонефриту із тим самим збудником інфекції слід провести додаткові дослідження для виявлення факторів, що ускладнюють перебіг захворювання (рівень доказовості 4, ступінь рекомендацій C).
Фітотерапія, окрім препаратів із вмістом проантоціанідину А 35 мг, на сьогодні не має надійної доказової бази. Проте в Україні вже традиційно використовується німецький рослинний препарат Канефрон Н, що створений за концепцією фітонірингу і має на сьогодні вже значний досвід призначень різним віковим групам та категоріям пацієнтів. У складі — спеціальний екстракт BNO 1040 (саме тому Канефрон Н не може мати генериків навіть із тих самих ботанічних видів рослин), стандартизований за вмістом біологічно активних речовин лікарських рослин: трави золототисячнику, кореня любистку, листя розмарину. Крім стандартизованого складу, що обумовлює передбачуваний ефект лікування, важливою перевагою Канефрону Н є комплексний вплив на нирки й сечовивідні шляхи (протизапальна, спазмолітична, антибактеріальна, сечогінна та антипротеїнурічна дія), а також формування доказової бази. Так, у 2013 році в GSP-дослідженні отримані дані щодо успішного використання Канефрону Н замість уроантисептиків у лікуванні гострого неускладненого циститу. Канефрон Н як альтернативу антибактеріальній терапії призначали протягом 7 днів із спостереженням до 1 місяця. Результати показали, що повна ліквідація клінічних симптомів спостерігалась на 7-й день лікування у більшості (71,2 %) пацієнток. 97,6 % пацієнток не потребували лікування антибіотиками до 7-ї доби, у жодної не було зафіксовано рецидивів на 37-й день дослідження. Ці результати обґрунтовують думку, що Канефрон Н може бути ефективним альтернативним препаратом для лікуванням неускладнених ІСШ та значущим доповненням до антибіотикотерапії, що актуально на тлі розвитку антибіотикорезистентності. Слід відзначити, що, на нашу думку, Канефрон Н у краплях виявляє більш виражений сечогінний ефект. Додатковою перевагою Канефрону Н є антипротеїнурічний ефект у пацієнтів із діабетичною нефропатією (Іванов Д.Д. із співавт., 2005; Семідоцька Ж.Д., 2012).
Антимікробна профілактика
Антимікробна профілактика для запобігання рецидивуючій ІСШ може бути рекомендована після неефективності поведінкової модифікації життя (рівень доказовості 4, ступінь рекомендацій A). Перед тим як буде ініційований будь-який режим профілактики, слід підтвердити видужання від ІСШ за результатами негативного культурального аналізу сечі через 1–2 тижні після лікування (рівень доказовості 4, ступінь рекомендацій A). Вибір антибіотика повинен спиратися на результати виділення збудника ІСШ та його чутливість до препарату і наявність алергічних реакцій пацієнта.
Особливості діагностики та лікування ІСШ у дітей
ІСШ у дітей — часта проблема, що поступається за своєю поширеністю тільки інфекціям дихальних шляхів та кишкового тракту. Частота ІСШ залежить від віку й статі. У перший рік життя, переважно в перші місяці, ІСШ частіше зустрічаються в хлопчиків (3,7 %), ніж у дівчаток (2 %), а потім спостерігається протилежне співвідношення: у 3 % дівчаток і в 1,1 % хлопчиків. Дитячі ІСШ — найчастіша причина гарячки невідомого походження у хлопчиків віком до 3 років. В етіології ІСШ E.сoli становить 90 % серед усіх уропатогенів, грампозитивні мікроорганізми — 5–7 %. Аномалії розвитку сечової системи створюють передумови для колонізації сечової системи висхідним шляхом. Дисбактеріози, запори уможливлюють гематогенний шлях потрапляння інфекції. Дисфункції сечового міхура сприяють повторним ІСШ.
Клінічна картина ІСШ у немовлят і новонароджених може змінюватись від гарячки до ознак гастроінтестинального ураження, симптомів ураження нижніх або верхніх сечових шляхів. Дослідження (мікційну цистограму) треба проводити після двох епізодів ІСШ у дівчаток і першого епізоду ІСШ у хлопчиків (ступінь рекомендацій B). Мета — виключити обструкцію, міхурово-сечовідний рефлюкс або нейрогенну дисфункцію сечового міхура. У дітей важливим фактором ризику є дисфункція сечового міхура та кишечника, і наявність такої дисфункції підлягає виявленню та окремому лікуванню.
Наявність міхурово-сечовідного рефлюксу як у поєднанні з інфекційним агентом, так і без нього (наприклад, внутрішньоутробний) може призводити до розвитку обструктивної нефропатії, появи рубців і вогнищ склерозу ниркової тканини.