Международный неврологический журнал 1 (71) 2015
Вернуться к номеру
Церебральна гемодинаміка та когнітивна діяльність у хворих із дисциркуляторною енцефалопатією та метаболічним синдромом
Авторы: Копчак О.О., Єна Л.М. - ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України», м. Київ;
Щербаков А.І. - ТОВ «Меддіагностика», м. Київ; Бачинська Н.Ю. - ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України», м. Київ
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Метою роботи було вивчення стану церебральної гемодинаміки та його зв’язку з когнітивними порушеннями у хворих на дисциркуляторну енцефалопатію (ДЕ) з метаболічним синдромом (МС). Обстежені 93 пацієнти середнього та старшого віку, хворі на ДЕ ІІ та ІІІ стадії з когнітивними порушеннями різного ступеня тяжкості, та 37 практично здорових осіб контрольної групи без ознак когнітивного зниження; групи порівнянні за віком, статтю та рівнем освіти. Пацієнти з ДЕ були розподілені на 2 основні групи: з МС (58 осіб) та без МС (35 хворих). У результаті проведених досліджень в обстежених пацієнтів із ДЕ та МС порівняно з особами без МС встановлено більш виражені зміни в екстра- та інтракраніальних судинах у вигляді стенозуючого атеросклерозу та збільшення товщини комплексу інтима-медіа загальних сонних артерій, а також зниження швидкісних характеристик церебрального кровотоку на тлі дифузного підвищення судинного опору. Для хворих із МС притаманний більш виражений когнітивний дефіцит порівняно з пацієнтами без МС, що проявлявся у змінах показників негайної та відстроченої пам’яті, виконавчих функцій та розумової працездатності. Численні кореляційні зв’язки між показниками когнітивної діяльності, з одного боку, та станом церебральної гемодинаміки — з іншого у хворих із ДЕ та МС свідчать, що одним із шляхів реалізації негативного впливу на когнітивні функції є атеросклеротичне і гіпертензивне ураження судин і погіршення церебральної гемодинаміки.
Целью работы было изучение состояния церебральной гемодинамики и ее связи с когнитивными нарушениями у больных дисциркуляторной энцефалопатией (ДЭ) с метаболическим синдромом (МС). Обследованы 93 пациента среднего и старшего возраста с ДЭ II и III стадии с когнитивными нарушениями разной степени тяжести, и 37 практически здоровых лиц контрольной группы без признаков когнитивного снижения; группы сопоставимы по возрасту, полу и уровню образования. Пациенты с ДЭ были распределены на 2 основные группы: с МС (58 человек) и без МС (35 больных). В результате проведенных исследований у обследованных пациентов с ДЭ и МС по сравнению с лицами без МС установлено более выраженные изменения в экстра- и интракраниальных сосудах в виде стенозирующего атеросклероза и увеличение толщины комплекса интима-медиа общих сонных артерий, а также снижение скоростных характеристик церебрального кровотока на фоне диффузного повышения сосудистого сопротивления. Больным с МС присущ более выраженный когнитивный дефицит по сравнению с пациентами без МС, который проявлялся в изменении показателей немедленной и отсроченной памяти, исполнительных функций и умственной работоспособности. Многочисленные корреляционные связи между показателями когнитивной деятельности, с одной стороны, и состоянием церебральной гемодинамики — с другой у больных с ДЭ и МС свидетельствуют, что одним из путей реализации негативного влияния на когнитивные функции является атеросклеротическое и гипертензивное поражение сосудов и ухудшение церебральной гемодинамики.
The objective of the study was to investigate the state of cerebral hemodynamics and its relation to cognitive impairment in patients with dyscirculatory encephalopathy (DE) and metabolic syndrome (MS). We have examined 93 middle-aged and elderly patients with II and III stages of DE and cognitive impairment of varying severity and 37 healthy controls without signs of cognitive decline, matched by age, gender and level of education. Patients with DE were divided into 2 groups: with MS (58 subjects) and without MS (35 patients). We have found more pronounced changes in extra- and intracranial vessels such as stenosing atherosclerosis and increased common carotid artery intima-media thickness in patients with DE and MS, as well as cerebral blood flow velocity on the background of diffuse increase in vascular resistance, compared with those without MS. Patients with MS were characterized by more severe cognitive decline, in comparison with patients without MS, which manifested in changes of immediate and delayed memory, executive functions and mental capacity. Numerous correlations between indicators of cognitive activity, on the one hand, and the state of cerebral hemodynamics — on the other in patients with DE and MS indicate that one of the ways of the negative impact on the cognitive functions are atherosclerotic and hypertensive vascular lesion and cerebral hemodynamic impairment.
церебральна гемодинаміка, метаболічний синдром, когнітивні порушення.
церебральная гемодинамика, метаболический синдром, когнитивные нарушения.
cerebral hemodynamics, metabolic syndrome, cognitive impairment.
Статья опубликована на с. 110-118
Відповідно до прогнозів ВООЗ, протягом наступних 20–30 років очікується загрозливе зростання поширеності деменції [17]. Чільне місце серед причин набутого когнітивного дефіциту, особливо судинної деменції, посідають цереброваскулярні хвороби [21]. За останні 10 років кількість хворих на цереброваскулярні захворювання в Україні зросла вдвічі [5, 16]. На особливу увагу заслуговує проблема когнітивних порушень (КП), пов’язаних із хронічною цереброваскулярною патологією головного мозку [3, 5, 10, 13] — дисциркуляторною енцефалопатією (ДЕ). ДЕ — синдром прогресуючого багатовогнищевого або дифузного ураження головного мозку, що переважно розвивається на тлі артеріальної гіпертензії, атеросклерозу та їх поєднання, проявляється клініко–неврологічними, нейропсихологічними та/або психічними порушеннями, обумовленими хронічною судинною мозковою недостатністю та/або повторними епізодами гострих порушень мозкового кровообігу (транзиторна ішемічна атака, інсульт) [8].
Церебральна гемодинаміка відіграє важливу роль у когнітивній діяльності. Зокрема, у популяційному дослідженні за участю 4971 особи віком від 55 до 94 років встановлено вірогідний зв’язок між наявністю атеросклеротичних бляшок у каротидних судинах, перенесеним інфарктом міокарда та низьким балом за короткою шкалою психічного статусу (Mini Mental State Examination — MMSE) [18]. В інших дослідженнях виявлено зв’язок між станом когнітивних функцій та такими характеристиками каротидної судинної стінки, як наявність атеросклеротичних бляшок та товщина комплексу інтима–медіа (КІМ) каротидних артерій [19, 27].
В останні десятиріччя спостерігається пандемічне зростання поширеності метаболічного синдрому (МС), до складу якого входять фактори серцево–судинного ризику [22]. Разом із тим у літературі недостатньо даних щодо особливостей порушень церебральної гемодинаміки у хворих із судинними когнітивними порушеннями за наявності метаболічного синдрому.
Метою дослідження було вивчення стану церебральної гемодинаміки та його зв’язку з когнітивними порушеннями у хворих на дисциркуляторну енцефалопатію з метаболічним синдромом.
Матеріали і методи
Обстежені 93 пацієнти середнього та старшого віку, хворі на ДЕ ІІ та ІІІ стадії з когнітивними порушеннями різного ступеня тяжкості, та 37 практично здорових осіб контрольної групи без ознак когнітивного зниження. Досліджені групи були порівнянні за віком, статтю та рівнем освіти (табл. 1). Пацієнти з ДЕ були розподілені на 2 основні групи: з МС (58 осіб) та без МС (35 хворих). ДЕ ІІ стадії діагностовано в 48 пацієнтів із МС, у 25 хворих без МС, ДЕ ІІІ стадії — у 10 пацієнтів із МС та 10 хворих без МС. Діагноз ДЕ встановлювали за загальноприйнятими критеріями [2, 8]. МС діагностовано в обстежених нами хворих згідно з оновленими критеріями рекомендацій Асоціації кардіологів України та Асоціації ендокринологів України [11]. Верифікацію діагнозу гіпертонічної хвороби (ГХ) проводили згідно з уніфікованим клінічним протоколом первинної, екстреної та вторинної (спеціалізованої) медичної допомоги [15].
Було проведено загальноклінічне, неврологічне, лабораторне та інструментальне обстеження. Спеціальні методи включали антропометричне дослідження (індекс маси тіла (ІМТ), окружність талії), визначення ліпідного спектра крові (ліпідограма) та концентрації гормонів щитоподібної залози в крові, магнітно–резонансну томографію головного мозку.
Вивчення церебральної гемодинаміки проводилося на приладі Philips HD11ХЕ. З метою обстеження –екстракраніальних каротидних судин використовувався лінійний мультичастотний датчик L12–3. Сканування інтракраніальних судин проводилося секторним мультичастотним датчиком S4–2. Дуплексне сканування судин шиї та голови проводилося за загальноприйнятою методикою [6]. Вивчалися якісні (прохідність та ступінь стенозування судини, наявність атеросклеротичних бляшок) та кількісні (усереднена за часом максимальна швидкість кровотоку (TAMX), індекс периферичного опору (Ri)) показники [6, 12]. Комплекс інтима–медіа сонних артерій вимірювався по задній стінці судини в місці його товщини, що максимально візуалізується, і на рівні біфуркації загальних сонних артерій (ЗСА) із двох сторін. Для оцінки кількісних показників кровотоку використовувалася усереднена за часом максимальна швидкість кровотоку, тому що на відміну від показника пікової систолічної швидкості кровотоку вона дозволяє враховувати швидкісні показники за кілька серцевих циклів (у тому числі в пацієнтів із порушеннями ритму серця) і на відміну від усередненої за часом середньої швидкості кровотоку може бути розрахована як в автоматичному, так і в ручному режимі.
Для оцінки когнітивних функцій було застосовано: коротку шкалу оцінки психічного статусу (MMSE) (визначення орієнтування в часі, місці, стану короткотривалої, довготривалої пам’яті, функції мови, гнозису, праксису) [23], методику заучування 10 слів (дослідження процесів запам’ятовування, збереження й відтворення інформації); тест заучування парних взаємопов’язаних слів (The Paired Associates Learning Test — PALT) (дослідження негайної та відстроченої розпізнавальної пам’яті на вербальні стимули) [25]; таблиці Шульте (визначення темпу сенсомоторних реакцій, розумової працездатності, об’єму активної уваги пацієнтів); тест кольорово–словесної взаємодії (the Stroop Color–Word Interference Test/SСWT) (оцінка швидкості обробки інформації та уваги) [26]; тест малювання годинника; батарею лобної дисфункції (Frontal assessment battery — FAB) [4, 9]. Оцінка 29–30 балів за MMSE свідчила про відсутність порушення когнітивних функцій, 28–27 балів — легкі когнітивні порушення, 24–26 — помірні, < 24 балів — про деменцію [1].
Статистичну обробку отриманих результатів проводили на комп’ютері з використанням пакетів статистичного аналізу Microsoft Excel 97. Вірогідність різниці між середніми кількісними значенням двох вибірок визначали за коефіцієнтом Стьюдента (t). Для перевірки статистичних гіпотез про різницю абсолютних і відносних частот, часток і відношень у двох незалежних вибірках використовували критерій хі–квадрат (x2). Ймовірність впливу окремих факторів оцінювали за відношенням шансів (OR). Довірчі інтервали (CI), що наводяться в роботі, будувались для довірчої ймовірності, p = 95 %. Для з’ясування характеру та ступеня взаємозв’язку між різними показниками визначали коефіцієнт парної кореляції (r) та коефіцієнт кореляції рангів Спірмена (p).
Результати та їх обговорення
Найчастішою скаргою хворих із дисциркуляторною енцефалопатією як з МС (96 %), так і без МС (94 %) був локальний або дифузний головний біль тиснучого характеру, що локалізувався переважно в потиличній, лобній або скроневій ділянках. Запаморочення спостерігалось у 87 % хворих у групі з МС та в 78 % пацієнтів без МС. Скарги на шум у голові пред’являли 83 % хворих із МС та 71 % пацієнтів без МС. Розлади сну зустрічалися в 79 % хворих із ДЕ з МС та у 66 % пацієнтів без МС і полягали в утрудненому засинанні, поверхневому, переривчастому сні, ранньому пробудженні. Пацієнти з МС вірогідно частіше пред’являли скарги на оніміння кінцівок (52 %) порівняно з хворими без МС (15 %). Хворі обох клінічних груп відзначали зниження пам’яті та уваги на події недавнього минулого, поточні події, імена, дати тощо. Пацієнти з основних клінічних груп також скаржились на підвищену дратівливість, загальну слабкість та підвищену стомлюваність, зниження фізичної та розумової працездатності, нестійкість настрою, його часте зниження, підвищену тривожність.
У неврологічному статусі у пацієнтів найчастіше відзначалися порушення черепної іннервації. Легкі окорухові розлади спостерігалися в переважної більшості хворих із ДЕ та МС і без МС та проявлялися у вигляді слабкості конвергенції. Легка згладженість носогубної складки відзначалася у 53 % хворих з МС та в 49 % пацієнтів без МС, легка девіація язика при висовуванні — у 33 % обстежених з МС та у 34 % хворих без МС. Серед порушень рефлекторно–рухової сфери ознаки пірамідної недостатності виявляли у 39 % пацієнтів із ДЕ та МС та у 38 % пацієнтів із ДЕ без МС. Порушення статики та координації у вигляді похитування в позі Ромберга мали місце в переважної більшості хворих обох клінічних груп. Порушення чутливості вірогідно частіше виявлялися в пацієнтів із МС (61 %) порівняно з хворими без МС (25 %) і були представлені в основному парестезіями в дистальних відділах кінцівок у вигляді відчуття повзання мурашок, легкого оніміння на обличчі й кінцівках. Вегетативні розлади у вигляді підвищеної пітливості, похолодання та акроціанозу кінцівок частіше виявляли в пацієнтів із ДЕ та МС порівняно з хворими без МС. Слід зазначити, що скарги хворих та дані об’єктивного обстеження відповідали клінічним стадіям дисциркуляторної енцефалопатії.
Відповідно до результатів МРТ головного мозку в переважної більшості хворих спостерігалися мультифокальне ураження в білій речовині, базальних гангліях головного мозку, численні ділянки лейкоареозу перивентрикулярно і в субкортикальних відділах головного мозку, префронтальній корі, вогнища ішемії в медіальних відділах скроневих часток, таламусі. Характерною особливістю в пацієнтів із МС були численні та/або поодинокі лакунарні вогнища, що розташовувалися у глибинних відділах білої речовини, у лобній та скроневій частках.
При проведенні дуплексного сканування брахіо–цефальних судин серед пацієнтів із ДЕ та МС атеросклеротичні бляшки у загальних сонних артеріях знайдено в 62,5 % осіб, що вірогідно перевищувало частоту виявлених атеросклеротичних бляшок у ЗСА в пацієнтів без МС (33,8 %) (x2 = 16,49, р < 0,001). При цьому у хворих із МС спостерігались певні особливості локалізації бляшок у ЗСА: у 40 % обстежених останні локалізувались у правій загальній сонній артерії, у 40 % пацієнтів — у лівій та у 20 % — в обох загальних сонних артеріях. У пацієнтів без МС локалізація атеросклеротичних бляшок у ЗСА була такою: у 8,7 % хворих останні виявлено в ЗСА справа, у 26 % — зліва, у 65,3 % хворих — в обох ЗСА. У хворих із ДЕ та МС атеросклеротичні бляшки у внутрішніх сонних артеріях (ВСА) виявлялися в 37,5 %, що вірогідно перевищувало частоту встановлених у пацієнтів без МС атеросклеротичних бляшок у ВСА (23,8 %) (x2 = 4,41, р < 0,05). При цьому виявлені в пацієнтів із МС бляшки локалізувались тільки в правій ВСА. Серед пацієнтів без МС у 26,7 % осіб бляшки локалізувались у правій ВСА, у 73,3 % обстежених — у лівій ВСА.
У пацієнтів із МС вірогідно частіше виявлялося локальне стенозування сонних артерій порівняно з пацієнтами без МС (x2 = 10,6, р < 0,01), при цьому стеноз становив не більше 30 % (без значущих гемодинамічних змін). Товщина комплексу інтима–медіа ЗСА становила 1,05 ± 0,04 мм у групі пацієнтів із МС, 0,86 ± 0,05 мм у групі хворих без МС та 0,67 ± 0,03 мм у контрольній групі. Збільшення товщини комплекса інтима–медіа ЗСА > 1 мм виявлено в 62 % пацієнтів із МС, у 32 % хворих без МС та не виявлено в осіб контрольної групи (рис. 1). Ризик збільшення товщини КІМ ЗСА був вірогідно вищим у групі пацієнтів із МС порівняно з хворими без МС (OR = 3,68; р = 0,003; 95% CI = 1,50–9,02) та особами з контрольної групи (OR = 130,8; р < 0,0001; 95% CI = 7,63–224). У пацієнтів без МС ризик збільшення товщини КІМ ЗСА також був вищим, ніж в осіб конт–рольної групи (OR = 35,2; р = 0,0002; 95% CI = 1,98–625,60). З метою виявлення різниці щодо товщини КІМ ЗСА у хворих без МС залежно від наявності ГХ у групі хворих без МС виділили дві підгрупи. При цьому товщина КІМ у цих підгрупах вірогідно не відрізнялась і становила 0,85 ± 0,05 мм у хворих із ГХ та 0,89 ± 0,08 мм у пацієнтів без ГХ (р = 0,49).
/113/113.jpg)
У табл. 2 наведені показники мозкового кровообігу у хворих з ДЕ з МС та без МС (табл. 2).
При аналізі параметрів гемодинаміки виявлено, що усереднена за часом максимальна швидкість кровотоку була вірогідно нижчою в пацієнтів із ДЕ (із МС та без МС) порівняно з особами з контрольної групи. Встановлено також вірогідне зниження ТАМХ у пацієнтів із МС в середній мозковій артерії (СМА) справа (табл. 2). Отримані результати узгоджуються з даними A.C. Birdsill та співавт. [24] про вірогідне зниження швидкості мозкового кровотоку за даними перфузійної МРТ у пацієнтів із МС порівняно з контрольною групою, по значній частині поверхні кори головного мозку, за винятком медіальної і нижніх відділів потиличної та скроневої часток.
Виходячи з наведених у табл. 3 даних, показники індексу Ri були вірогідно вищими в пацієнтів із МС порівняно з контрольною групою, однак вірогідно не відрізнялися в пацієнтів із МС та без МС у більшості судин. При цьому в пацієнтів із МС порівняно з хворими без МС вірогідно вищий індекс Ri виявлено лише в правій СМА. У пацієнтів із МС вищими були показники індексу Ri справа та зліва в ЗСА та ХА, лівій СМА порівняно з особами з контрольної групи. Вірогідну різницю щодо показників індексу Ri у пацієнтів без МС та в контрольній групі виявлено лише в лівій ХА. Таким чином, у цілому індекс судинного опору був підвищений у хворих із метаболічним синдромом і мав дифузний характер.
При вивченні стану когнітивних функцій у пацієнтів із МС встановлено легкі КП у 17,2 % пацієнтів, помірні КП — у 72,4 %, деменцію — у 10,4 % хворих. Серед пацієнтів без МС легкі КП спостерігалися в 48,6 % випадків, помірні КП — у 31,4 %, деменція — у 20 %. Отже, у пацієнтів без МС статистично вірогідно вищою була частота легких КП порівняно з пацієнтами з МС (x2 = 10,4, р < 0,001), у той час як у хворих із МС була вірогідно вищою частота помірних КП (x2 = 14,9, р < 0,001). Вірогідної різниці щодо частоти деменції між групами пацієнтів із МС та без МС виявлено не було (x2 = 1,7, р > 0,05) (рис. 2).
З урахуванням отриманих результатів дуплексного сканування брахіоцефальних судин у пацієнтів із МС і без МС із деменцією вірогідно частіше виявлялися ехографічні ознаки стенозуючого атеросклерозу без значущих гемодинамічних змін порівняно з хворими з помірними та легкими КП. Ознаки потовщення комплексу інтима–медіа ЗСА > 1 мм значно частіше було встановлено у пацієнтів із ДЕ з МС і без МС із помірними КП та деменцією порівняно з пацієнтами з легкими КП (рис. 3, 4).
Таким чином, спільною характеристикою досліджуваних груп хворих була також залежність між морфологічними змінами судинної стінки сонної артерії й вираженістю когнітивного дефекту. Як наявність стенозуючого атеросклеротичного процесу, так і гіпертрофія судинної стінки асоціювались із погіршенням когнітивних параметрів, що узгоджується з даними інших авторів. Зокрема, K.A. Arntzen та співавт. у популяції пацієнтів середнього віку зареєстровано, що такі показники субклінічного атеросклерозу каротидних артерій, як наявність бляшок, їх кількість та загальна площа є незалежними довготривалими предикторами когнітивного зниження у хворих. Виявлено зв’язок між кількістю бляшок, їх загальною площею та низькими показниками тесту на вербальне запам’ятовування [20]. Відповідно до даних М.М. Одинак та співавт. [14], –ознаки дифузного ураження магістральних артерій голови виявлені в більшості пацієнтів із судинною деменцією. Атеросклеротичні бляшки вірогідно частіше визначалися при безінсультному перебігу судинної деменції. Стенотичні процеси у великих церебральних судинах і їх локалізація значною мірою впливали на когнітивні функції [7, 14].
В обстежених нами пацієнтів із ДЕ з МС та без МС було вивчено стан когнітивних функцій за результатами експериментально–психологічних тестів залежно від наявності стенозу ЗСА.
Проведений аналіз результатів експериментально–психологічного дослідження показав, що в пацієнтів із МС за наявності стенозування каротидних артерій загальний бал MMSE був вірогідно нижчим порівняно з показниками пацієнтів із МС без стенозу (табл. 4). Наявність стенозуючого процесу поєднувалась із зменшенням обсягу негайної та відстроченої пам’яті на вербальні стимули за методикою PALT, що узгоджується з даними інших авторів. Зокрема, за даними A.C. Birdsill та співавт., у пацієнтів із МС встановлено знижені показники негайної пам’яті, що корелювало зі зниженням швидкості мозкового кровотоку [24]. За нашими даними, не було встановлено відмінностей показників виконавчих функцій, таких як швидкість обробки інформації за методикою SСWT, у пацієнтів із МС при наявності стенозування каротидних артерій порівняно з хворими без стенозування. При дослідженні темпу сенсомоторних реакцій за таблицями Шульте у хворих із МС із стенозами каротидних артерій відмічено вірогідне збільшення сумарного часу виконання спеціального експериментально–психологічного завдання порівняно з пацієнтами без стенозування. Це вказувало на зниження швидкості сенсомоторних реакцій, розумової працездатності, обсягу активної уваги у хворих із метаболічним синдромом зі стенозуючими змінами каротидних артерій. У пацієнтів із МС зі стенозами каротидних артерій також встановлено вірогідне зниження балів за тестом малювання годинника та батареєю лобної дисфункції порівняно з пацієнтами без стенозу (табл. 4).
У групі пацієнтів без МС за наявності стенозування каротидних артерій загальний бал MMSE був вірогідно нижчим (24,3 ± 0,4) порівняно з показниками пацієнтів цієї ж групи за відсутності стенозу (25,8 ± 0,4, р < 0,05). У той же час вірогідних змін у показниках пам’яті, розумової працездатності, виконавчих функцій за даними експериментально–психологічних тестів у пацієнтів із ДЕ без МС залежно від наявності стенозу каротидних артерій не встановлено.
З метою поглибленого вивчення зв’язку між гемодинамічними та когнітивними показниками застосовано кореляційний аналіз. У пацієнтів із МС виявлено вірогідний обернений кореляційний зв’язок між товщиною комплексу інтима–медіа загальних сонних артерій та показниками, що характеризують короткочасну вербальну і семантичну пам’ять та увагу за методикою заучування 10 слів (p = –0,27, p < 0,05), обсягом відстроченої памяті на вербальні стимули за методикою PALT (p = –0,31, p < 0,05), загальним балом за батареєю лобної дисфункції (p = –0,25, p < 0,05). Результати щодо взаємозв’язку між товщиною КІМ та тяжкістю КП –узгоджуються з даними проведених раніше досліджень, у яких встановлено слабкий вірогідний зв’язок між тяжкістю КП та товщиною КІМ каротидних артерій лише в осіб чоловічої статі [27]. У лонгітудинальному дослідженні W. Zhong та співавт. [19] виявлено, що збільшення товщини комплексу інтима–медіа каротидних артерій було фактором ризику розвитку когнітивних порушень із часом.
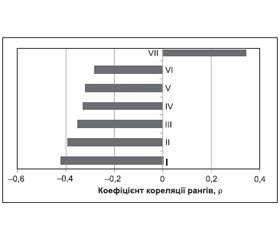
У проведеному нами дослідженні не встановлено кореляційного зв’язку між показниками ТАМХ та тяжкістю когнітивних порушень за загальним балом MMSE у пацієнтів із МС та без МС. У пацієнтів із МС виявлено обернений кореляційний зв’язок між показниками індексу периферичного опору Ri лівої ХА (r = –0,30, p < 0,05) та правої СМА (r = –0,31, p < 0,05) та загальним балом MMSE, зниження якого віддзеркалює ступінь когнітивної недостатності. Крім того, у пацієнтів із МС також встановлено вірогідний обернений кореляційний зв’язок між індексами Ri лівої ХА, правої СМА та показниками, що характеризують короткочасну вербальну і семантичну пам’ять та увагу, обсяг негайної та відстроченої пам’яті на вербальні стимули, швидкість обробки інформації, загальним балом за батареєю лобної дисфункції та тестом малювання годинника. У той же час у хворих із МС знайдено вірогідний прямий кореляційний зв’язок між індексами Ri лівої ХА та правої СМА і показниками часу, що витрачався на виконання спеціального експериментально–психологічного завдання за таблицями Шульте (рис. 5, 6).
Таким чином, у результаті проведених досліджень в обстежених пацієнтів із ДЕ та МС порівняно з особами без МС встановлено більш виражені зміни в екстра– та інтракраніальних судинах у вигляді стенозуючого атеросклерозу та збільшення товщини КІМ ЗСА, а також зниження швидкісних характеристик церебрального кровотоку на тлі дифузного підвищення судинного опору.
Хворим із МС притаманний більш виражений когнітивний дефіцит порівняно з пацієнтами без МС, що проявлявся у змінах показників негайної та відстроченої пам’яті, виконавчих функцій та розумової працездатності. У пацієнтів із МС встановлено суттєвий зв’язок між атеросклеротичним ураженням каротидних артерій та станом когнітивних функцій. Стенози каротидних артерій у хворих із МС асоціювались зі зниженням загального бала MMSE, обсягу негайної та відстроченої пам’яті на вербальні стимули, швидкості сенсомоторних реакцій, розумової працездатності, обсягу активної уваги та інших виконавчих функцій. У той же час у пацієнтів без МС стенозування каротидих артерій асоціювалось лише зі зниженням загального бала MMSE. Численні кореляційні зв’язки між показниками когнітивної діяльності з одного боку та станом церебральної гемодинаміки — з іншого у хворих з ДЕ та МС свідчать, що одним із шляхів реалізації негативного впливу на когнітивні функції є атеросклеротичне і гіпертензивне ураження судин і погіршення церебральної гемодинаміки.
1. Бачинська Н.Ю. Синдром умеренных когнитивных нарушений / Н.Ю. Бачинська // НейроNews. — 2010. — № 2(1). — С. 12–17.
2. Дамулин И.В. Дисциркуляторная энцефалопатия: Метод. рекомендации / И.В. Дамулин, В.В. Захаров; Под ред. Н.Н. Яхно. — М., 2003. — 32 с.
3. Дзяк Л.А. Эффективность тиоцетама в лечении дисциркуляторных энцефалопатий вследствие атеросклеротического поражения церебральных артерий / Л.А. Дзяк, В.В. Голик // Мистецтво лікування. — 2004. — № 7(13). — С. 80–83.
4. Захаров В.В. Когнитивные расстройства в пожилом и старческом возрасте: Метод. пособие для врачей / В.В.Захаров, Н.Н. Яхно. — М., 2005. — 71 с.
5. Кузнецова С.М. Тиоцетам в системе реабилитации больных, перенесших инсульт / C.M. Кузнецова // Запорожский медицинский журнал. — 2010. — № 5. — С. 142–146.
6. Лелюк С.Э. Ультразвуковая ангиология / С.Э. Лелюк, В.Г. Лелюк. — Москва, 2009. — 324 с.
7. Лобзин В.Ю. Церебральная гемодинамика и когнитивные расстройства у больных с сосудистой деменцией: Дис... канд. мед. наук: 14.00.13 / Лобзин Владимир Юрьевич. — Санкт–Петербург, 2009. — 169 с.
8. Мачерет Е.Л. Современные подходы к дефиниции дисциркуляторной энцефалопатии / Е.Л. Мачерет, И.С. Паламарчук // Зб. наук. праць співробітників КМАПО. — 2003. — Вип. 12, Кн. 1. — С. 591–605.
9. Мищенко Т.С. Клинические шкалы и психодиагностические тесты в диагностике сосудистых заболеваний головного мозга (методические рекомендации) / Т.С. Мищенко, Л.Ф. Шестопалова, М.А. Трищинская. — Харьков, 2008. — 36 с.
10. Мищенко Т.С. Cовременные подходы к лечению больных дисциркуляторной энцефалопатией / Т.С. Мищенко // NeuroNews. — 2007. — № 11/1. —С. 5–21.
11. Мітченко О.І. Діагностика і лікування метаболічного синдрому, цукрового діабету, предіабету і серцево–судинних захворювань: рекомендації асоціації кардіологів України та асоціації ендокринологів України / О.І. Мітченко, В.В. Карпачов // Серцево–судинні захворювання: рекомендації з діагностики, профілактики та лікування / За ред. В.М. Коваленка, М.І. Лутая. — К.: Моріон, 2011. — С. 68–79.
12. Никитин Ю.М. Ультразвуковая допплеровская диагностика сосудистых заболеваний / Ю.М. Никитин, А.И. Труханова. — М.: Видар, 1998. — 432 с.
13. Особливості синдрому помірних когнітивних порушень у хворих на гіпертонічну дисциркуляторну енцефалопатію та можливості корекції когнітивних змін препаратом прамістар / Н.Ю. Бачинська, О.В. Демченко, К.М. Полєтаєва, В.О. Холін // Міжнародний неврологічний журнал. — 2012. — 2(48). — С. 99–106.
14. Ультразвуковая диагностика нарушений церебральной гемодинамики у больных сосудистой деменцией / М.М. Одинак, В.Ю. Лобзин, А.Ю. Емелин, Н.А. Лупина // Мед. акад. журн. — 2008. — Т. 8, № 4. — С. 115–122.
15. Уніфікований клінічний протокол первинної, екстреної та вторинної (спеціалізованої) медичної допомоги. Артеріальна гіпертензія / М.К. Хобзей, В.З. Нетяженко, Л.І. Божко та ін. — К., 2012. — 72 с.
16. Хобзей Н.К. Особенности эпидемиологии инвалидности при заболеваниях нервной системы в Украине / Н.К. Хобзей, Т.С. Мищенко, В.А. Голик, Н.А. Гондуленко // Международный неврологический журнал. — 2011. — № 5(43). — С. 15–19.
17. Alzheimer’s disease and vascular dementia in developing countries: prevalence, management, and risk factors / R.N. Kalaria, G.E. Maestre, R. Arizaga [et al.] // Lancet Neurol. — 2008. — № 7. — Р. 812–826.
18. Cardiovascular disease and distribution of cognitive function in elderly people: the Rotterdam study / M.M.B. Breteler, J.J. Claus, D.E. Grobbee, A. Hofman // B.M.J. — 1994. — Vol. 308. — P. 1604–1608.
19. Carotid atherosclerosis and 10–year changes in cognitive function / W. Zhong, K.J. Cruickshank, C.R. Schubert [et al.] // Atherosclerosis. — 2012. — Vol. 224(2). — P. 506–10.
20. Carotid atherosclerosis predicts lower cognitive test results: a 7–year follow–up study of 4,371 stroke–free subjects — the Tromsø study / K.A. Arntzen, H. Schirmer, S.H. Johnsen [et al.] // Cerebrovasc. Dis. — 2012. — 33(2). — P. 159–65.
21. Contribution of vascular pathology to the clinical expression of dementia / D. Strozyk, D.W. Dickson, R.B. Lipton [et al.] // Neurobiol. Aging. — 2010. — Vol. 31(10). — Р. 1710–20.
22. Farooqui T. Metabolic syndrome and neurological disorders / T. Farooqui, A.A. Farooqui. — Willey Blackwell, 2013. — 553 p.
23. Folstein M. Mini–mental state: a practical method for grading the cognitive state of patients for the clinical / M. Folstein, S. Folstein, P.R. McHugh // J. Psychiatr. Res. — 1975. — № 12. — P. 189–198.
24. Low cerebral blood flow is associated with lower memory function in metabolic syndrome / A.C. Birdsill, C.M. Carlsson, A.A. Willette [et al.] // Obesity (Silver Spring). — 2013. — Vol. 21(7). — P. 1313–20.
25. Parmenter B.A. The cognitive perfomance of patients with multiple sclerosis during periods of high and low fatigue / B.A. Parmenter, D.R. Denney, S.G. Lynch // Multiple Sclerosis. — 2003. — № 9. — Р. 111–118.
26. Stroop J.R. Studies of interference in serial verbal reactions / J.R. Stroop // J. Exp. Psychol. — 1975. — Vol. 18. — P. 643–62.
27. Ultrasonographic Assessment of Carotid Wall Characteristics and Cognitive Functions in a Community Sample of 59– to 71–Year–Olds / A. Auperin, C. Berr, C. Bonithon–Kopp [et al.] // Stroke. — 1996. — Vol. 27. — Р. 1290–1295.

/111/111.jpg)
/113/113_2.jpg)
/114/114.jpg)
/114/114_2.jpg)
/115/115.jpg)
/116/116.jpg)