Газета «Новости медицины и фармации» Кардиология (519) 2014 (тематический номер)
Вернуться к номеру
Инновационные технологии лечения больных с остеоартрозом коленных и тазобедренных суставов
Авторы: Татьяна Тлустова
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 5-7
30–31 октября в Киеве прошла научно-практическая конференция Ассоциации ревматологов Украины «Инновационные технологии лечения в ревматологии с позиций доказательной медицины». Медицинский форум проходил под эгидой Национальной академии медицинских наук Украины, Министерства здравоохранения Украины, Ассоциации ревматологов Украины, Института кардиологии имени Н.Д. Стражеско, Национальной медицинской академии последипломного образования имени П.Л. Шупика. Ведущие специалисты и ученые обсудили современные достижения и проблемы ревматологии: инновационные технологии диагностики и лечения болезней суставов, современные возможности лабораторной диагностики системных заболеваний соединительной ткани, информативность современных методов визуализации суставов (УЗИ, КТ, МРТ), коморбидные состояния при заболеваниях суставов и патологии внутренних органов, вопросы патогенеза обмена мочевой кислоты, возможности реабилитационных мероприятий при заболеваниях суставов.
С докладом «Новые индикации в модифицирующей терапии остеоартрита» выступил д.м.н., профессор О.П. Борткевич. Он напомнил, что остеоартроз — это хроническое прогрессирующее заболевание синовиальных суставов неизвестной этиологии, которое характеризуется дегенерацией суставного хряща, что впоследствии приводит к изменению структуры субхондральной кости и явно или скрыто протекающему синовиту. Остеоартроз характеризуется статистической неоднородностью в разных странах. В частности, в странах Северной Америки (например, США) в подавляющем большинстве случаев характерно поражение коленных суставов и очень низкая распространенность поражения тазобедренных суставов. В Китае, Индии, странах Ближнего Востока чаще встречается поражение тазобедренных суставов. Данная статистика свидетельствует о генетической неоднородности популяции.
В современных рекомендациях выделены факторы риска развития остеоартроза, которые условно разделили:
— на локальные модифицируемые факторы риска (сила мышц, физическая активность/занятость пациента, поражение сустава, положение сустава/ось, неодинаковая длина нижних конечностей);
— системные модифицируемые факторы риска (ожирение, диета, характер метаболизма хрящевой и костной ткани);
— системные факторы риска, которые невозможно изменить (возраст, пол, генетика, этничность).
Также большую роль в течении остеоартроза и влиянии на эффективность лечения играет коморбидность:
— сердечно–сосудистые заболевания;
— ожирение;
— сахарный диабет;
— менопауза;
— гиперхолестеринемия и другие.
В современных руководствах по ведению больных с остеоартрозом большое внимание уделяется обучению пациента, поддержанию им физической активности, а также фармакотерапевтическим рекомендациям. В рекомендациях EULAR (European League Against Rheumetism) 2014 года начинать лечение рекомендуется с основных методов, которые являются универсальными для пациентов с остеоартрозом различных локализаций: снижения массы тела, физических упражнений (аэробика, общеукрепляющая гимнастика, водные упражнения, тренировка силы) в виде обучения пациента и самостоятельных занятий. Отмечено, что физические упражнения сравнимы по эффективности с простыми анальгетиками (парацетамол) и НПВП.
Остеоартроз — заболевание хроническое, поэтому современные рекомендации предусматривают длительное применение препаратов с целью не только купирования клинических проявлений, но и предупреждения структурных повреждений опорно-двигательного аппарата. В стандарты современного лечения остеоартроза входят медленнодействующие симптоматические препараты (так называемый класс SYSADOA), поэтому особое внимание уделено не только эффективности, но и безопасности лечения при длительном применении, в том числе и при коморбидности.
Одним из новых препаратов класса SYSADOA для Украины является препарат на основе неомыляемых соединений масел авокадо и соевых бобов Пиаскледин 300 (ASU), обладающий симптом- и структурно-модифицирующими эффектами. Этот препарат имеет хорошую доказательную базу и включен в рекомендации как Европейской организации ревматологов (EULAR) — с 2003 года, так и Всемирной организации по исследованию остеоартроза (OARSI) — с 2010 года.
В многочисленных исследованиях in vitro доказано, что Пиаскледин 300:
— повышает экспрессию трансформирующего фактора роста-1, 2 (TNF-1, 2) и ингибитора активатора плазминогена-1 (PAI-1);
— стимулирует синтез протеогликанов и образование коллагеновых волокон;
— ингибирует и блокирует ИЛ-1, 6 и 8, которые оказывают прямой или опосредованный коллагенолитический эффект на хондроциты и синовиоциты;
— угнетает синтез хондроцитами металлопротеаз (коллагеназы, стромелизина).
Эффективность и безопасность применения Пиаскледина 300 у пациентов с остеоартрозом коленных и тазобедренных суставов были продемонстрированы в нескольких рандомизированных клинических плацебо-контролируемых исследованиях. Кроме того, в 2008 году был проведен метаанализ 4 крупных исследований, что позволило отнести Пиаскледин 300 к препаратам с уровнем доказательности 1А.
Симптом-модифицирующее действие Пиаскледина было продемонстрировано в исследовании Maheu at al. в 1998 году.
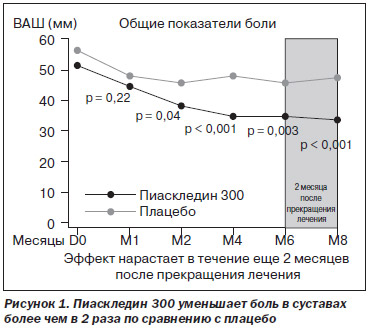
Исследование представляло собой проспективное рандомизированное двойное слепое плацебо-контролируемое многоцентровое клиническое испытание с участием 164 пациентов с остеоартрозом коленного (n = 114) и тазобедренного (n = 50) суставов. Характер заболевания должен был быть активным, и продолжаться оно должно было не менее 6 месяцев, регулярно вызывая боль в течение не менее 3 месяцев до начала испытания. Длительность исследования — 6 месяцев с последующим наблюдением больных в течение 2 месяцев.
Эффективность лечения определялась:
— по функциональному индексу Лекена (LFI);
— интенсивности боли по визуальной аналоговой шкале Хаскиссона (ВАШ);
— общему баллу недееспособности;
— уровню успешности лечения.
По результатам исследования установлено, что Пиаскледин 300 продемонстрировал выраженную симптоматическую эффективность в отношении боли по визуальной аналоговой шкале и функциональному индексу Лекена. Эффект отмечался уже со второго месяца приема Пиаскледина 300 с достоверной разницей с плацебо и нарастал в последующие месяцы приема. Важно отметить, что эффективность в отношении боли и функциональной подвижности суставов нарастала даже после окончания курса лечения (еще в течение 2 месяцев) (рис. 1).
Еще одно испытание, в котором изучался симптом-модифицирующий эффект Пиаскледина 300 (Blotman еt al., 1997), включало 163 пациента с остеоартрозом коленных и тазобедренных суставов в стадии ІВ, ІІ, ІІІ по классификации Kellegren — Lawrence. Обязательными условиями включения в исследование были наличие хронической боли в течение 3 месяцев до начала исследования (уровень боли по ВАШ ≥ 25 мм, LFI ≥ 4 мм) и необходимость ежедневного использования НПВП в течение по меньшей мере последних 3 месяцев. Длительность исследования составила 3 месяца.
Дизайн исследования предусматривал запрет на прием болеутоляющих препаратов, а также всех других медленнодействующих средств для лечения остеоартроза на протяжении всего испытания (за исключением некоторых предварительно определенных случаев).
Критерием эффективности исследования являлся показатель возвращения пациентов к приему НПВП; также оценивались кумулятивная и среднесуточная доза НПВП (в эквиваленте к диклофенаку), общее количество дней на терапии НПВП после 45 дней приема Пиаскледина 300, изменения индекса Лекена (LFI) и показатель боли по визуальной аналоговой шкале.
Исследователями было установлено, что 6 из 10 пациентов снизили дозу или отменили НПВП на фоне приема Пиаскледина 300, в то время как на фоне приема плацебо — только 3 из 10 пациентов. Среднесуточная и кумулятивная доза НПВП на фоне приема Пиаскледина 300 значительно ниже, чем на фоне приема плацебо (в 3 раза). Значительно большее число пациентов и исследователей оценивали эффективность и переносимость лечения Пиаскледином 300 как «хорошую» или «очень хорошую» по сравнению с плацебо после 3 месяцев приема.
Структурно-модифицирующий эффект Пиаскледина впервые был продемонстрирован в исследовании Lequesne еt al. в 2002 году.
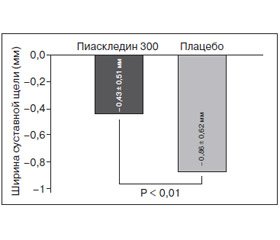
Это проспективное рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование, целью которого была оценка структурно-модифицирующего эффекта Пиаскледина 300 (эффект замедления или прекращение разрушения суставного хряща) при лечении пациентов с остеоартрозом тазобедренного сустава. В испытании участвовали 163 пациента (средний возраст — 63 года) с симптомами остеоартроза, отмечающих боль в течение более 6 месяцев до начала исследования (высота суставной щели > 1 мм, функциональный индекс Лекена ≥ 4), длительность исследования составляла 2 года.
Первичной конечной точкой исследования было замедление сужения суставной щели, определяемое с помощью рентгенографии (в начале исследования, через 1 и 2 года). Кроме того, оценивались вторичные конечные точки:
— функциональная недостаточность (LFI);
— боль (ВАШ);
— использование НПВП (доза и длительность применения);
— общая удовлетворенность лечением пациента и исследователя.
Основные результаты данного исследования: Пиаскледин 300 достоверно замедлял сужение суставной щели (в 2 раза) после 2 лет применения у пациентов с выраженным остеоартрозом тазобедренного сустава, что дало основания отнести его к структурно-модифицирующим препаратам (рис. 2).
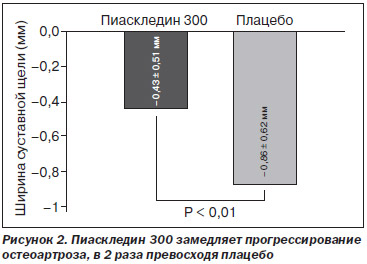
После получения результатов исследования Lequesne Пиаскледин был внесен в европейские рекомендации по лечению остеоартроза (EULAR 2003) как препарат с возможным структурным действием.
Структурное действие Пиаскледина 300 исследовали еще в 2009 году (испытание ERADIAS).
Это проспективное рандомизированное двойное слепое плацебо-контролируемое исследование, включавшее 345 пациентов с первичным остеоартрозом тазобедренного сустава (продолжительностью не менее 4 лет по критериям ACR) с умеренно выраженным болевым синдромом (ВАШ более 40 мм более 1 года), несмотря на прием НПВП или анальгетиков. У всех пациентов диагноз остеоартроза был верифицирован клинически и рентгенологически: средняя высота суставной щели — 2,8 ± 0,9 мм. Длительность исследования составляла 3 года.
В ходе испытания оценивались:
— клинические показатели боли по WOMAC;
— индекс движений Лекена;
— общая боль в тазобедренном суставе;
— суммарная оценка эффекта;
— потребность в приеме НПВП/анальгетиков.
Первичная оценка: анализ изменения сужения суставной щели (мм) в течение 3 лет.
Вторичная оценка: количество пациентов (%) с прогрессированием сужения суставной щели более 0,5 мм после 3 лет терапии.
При анализе результатов исследования установлено, что количество пациентов, у которых выявлено сужение суставной щели после 3 лет терапии, было на 20 % ниже в группе Пиаскледина 300 по сравнению с плацебо, хотя существенного различия между группами в изменении JSW в общей популяции участников исследования не наблюдалось. При этом на лечение лучше отвечали пациенты с более тяжелой формой коксартроза (II–III ст.).
Метаанализ исследований применения Пиаскледина 300 при остеоартрозе коленных и тазобедренных суставов был проведен R. Christenen et al. в 2008 году. Были включены 4 рандомизированных плацебо-контролируемых исследования с общим количеством пациентов 664. Длительность исследований составляла от 3 до 24 месяцев.
В 3 исследованиях продемонстрирована высокая эффективность Пиаскледина 300 в устранении болевого синдрома и улучшении функциональной подвижности суставов (Mahеu, Blotman, Appelboom), а также его хорошая переносимость и приверженность пациентов к лечению (прекратили лечение только 3 % пациентов). В результате проведенного метаанализа сделан вывод о возможности применения Пиаскледина в качестве базисной терапии остеоартроза.
Таким образом, Пиаскледин 300 (ASU) — европейский оригинальный препарат, обладающий доказанной эффективностью и безопасностью в лечении больных с остеоартрозом коленных и тазобедренных суставов (уровень доказательности 1А), обладает очевидными преимуществами, которые необходимо использовать в практике врачей Украины:
— высокой эффективностью в отношении симптомов остеоартроза (боль, нарушение функции);
— доказанной способностью замедлять прогрессирование остеоартроза;
— возможностью значительно снизить дозу или отменить прием НПВП, тем самым предупреждая развитие осложнений и побочных эффектов;
— высоким уровнем безопасности, отличной переносимостью;
— отсутствием взаимодействия с другими препаратами, что важно для пациентов с сопутствующей патологией;
— удобной схемой приема — 1 капсула 1 раз в сутки;
— признанный стандарт лечения остеоартроза с 2003 года, входит в число препаратов, рекомендованных европейскими и международными организациями по лечению остеоартроза.