Журнал «Почки» 3 (09) 2014
Вернуться к номеру
Чи необхідна дієтотерапія для хворих на хронічну хворобу нирок в додіалізному періоді?
Авторы: Кушніренко С.В. - Національна медична академія післядипломної освіти імені П.Л. Шупика, кафедра нефрології та нирково-замісної терапії, м. Київ
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
У статті розглядаються критерії діагностики хронічної хвороби нирок і доцільність застосування дієтотерапії в поєднанні з кетоаналогами незамінних амінокислот на додіалізному етапі. Доведено, що додаткове призначення хворим із додіалізною хронічною хворобою нирок кетоаналогів незамінних амінокислот посилює метаболічно сприятливі ефекти малобілкової дієти, сприяє нормалізації амінокислотного складу крові й корекції метаболічного ацидозу, підтримує в умовах зменшеного вживання білка показники вуглеводного й ліпідного обміну на оптимальному рівні, обумовлюючи подальше сповільнення прогресування хронічної хвороби нирок.
В статье рассматриваются критерии диагностики хронической болезни почек и целесообразность применения диетотерапии в сочетании с кетоаналогами незаменимых аминокислот на додиализном этапе. Дополнительное назначение больным с додиализной хронической болезнью почек кетоаналогов незаменимых аминокислот усиливает метаболически благоприятные эффекты малобелковой диеты, способствует нормализации аминокислотного состава крови и коррекции метаболического ацидоза, поддерживает в условиях уменьшенного употребления белка показатели углеводного и липидного обмена на оптимальном уровне, замедляя дальнейшее прогрессирование хронической болезни почек.
The article examines the criteria for diagnosis of chronic kidney disease and the feasibility of diet therapy in combination with keto-analogues of essential amino acids at predialysis stage. It is proved that additional administration to the patients with predialysis chronic kidney disease of keto-analogues of essential amino acids enhances the metabolic beneficial effects of low-protein diet, promotes normalization of the amino acid composition of the blood and correction of metabolic acidosis, supports the parameters of carbohydrate and lipid metabolism at an optimum level under reduced protein intake, slowing further progression of chronic kidney disease.
хронічна хвороба нирок, Кетостерил.
Статья опубликована на с. 15-20
На межі XX і XXI століть світове співтовариство зіткнулося з глобальною проблемою, що має медичне й величезне соціально-економічне значення, — пандемією хронічних неінфекційних хвороб. Серед них патологія нирок, у тому числі хронічна хвороба нирок (ХХН), займає важливе місце внаслідок значної поширеності в популяції, високої смертності пацієнтів та значних витрат, пов’язаних із необхідністю застосування методів замісної ниркової терапії (ЗНТ).
Поширеність ХХН (табл. 1) можна порівняти з такими соціально значущими хворобами, як гіпертонічна хвороба і цукровий діабет, а також ожиріння та метаболічний синдром. У 2002 р. у США було презентоване поняття хронічної хвороби нирок із класифікацією її стадій.
Швидке зростання в популяції числа хворих зі зниженою функцією нирок не вузькоспеціальна, а загальномедична міждисциплінарна проблема, що має серйозні соціально-економічні наслідки (Remuzzi G. et аl.). За даними Національного реєстру, у 2012 році в Україні на обліку з приводу хронічної хвороби нирок перебували 490 234 хворі, причому значною мірою від ХХН страждає молода, працездатна частина населення. Можливості нефропротекторної терапії, що дозволяє загальмувати прогресування ХХН і стабілізувати функцію нирок, використовуються неефективно. Зазначимо, що витрати на нефропротекторну терапію у 100 разів нижчі, ніж на ЗНТ.
Під ХХН слід розуміти наявність будь-яких маркерів пошкодження нирок (табл. 2), що існують більше ніж три місяці незалежно від нозологічного діагнозу та негативно впливають на здоров’я. Алгоритм діагностики ХХН наведений на рис. 1.
/15/15.jpg)
Сучасна класифікація ХХН (табл. 3) заснована на показниках швидкості клубочкової фільтрації (ШКФ) та ознаках ушкодження нирок (протеїнурія, альбумінурія).
Для розрахунку ШКФ застосовується декілька формул.
Широке застосування в нефрології отримала формула Кокрофта — Гоулта (Cockcroft D.W., Gault M.H., 1976):
ШКФ = (140 – вік (роки)) • маса тіла (кг) • 0,85 (для жінок) / 0,814 • креатинін сироватки (мкмоль/л).
Пізніше для дорослих була розроблена формула MDRD:
ШКФ = 170 • (Cr сир. • 0,0113)–0,999 • вік (роки)–0,176 x (Ur сир. • 2,8)–0,17 • Alb сир. • 0,762 (для жінок),
де Cr сир. — рівень креатиніну сироватки крові, мкмоль/л; Ur сир. — рівень сечовини сироватки крові, ммоль/л; Alb сир. — рівень альбуміну сироватки, г/дл.
У 2009–2011 рр. було розроблено найбільш універсальний і точний метод розрахунку ШКФ, що працює на будь-якій стадії ХХН і у представників усіх трьох рас, — рівняння CKD-EPI (табл. 4). Це найбільш універсальна й точна формула з тих, що використовуються сьогодні.
Прогноз перебігу ХХН
Окрім стадії ХХН, за показниками ШКФ та рівнем альбумінурії можна визначити прогноз перебігу захворювання (табл. 5).
Деякі питання профілактики
Основою первинної профілактики ХХН є усунення або мінімізація факторів ризику. Вторинна профілактика ХХН повинна бути одночасно направлена на уповільнення темпів прогресування ХХН (ренопротекція) і запобігання розвитку серцево-судинної патології (кардіопротекція), оскільки прогресуюче зниження функції нирок та розвиток серцево-судинних ускладнень тісно пов’язані, кожен із цих факторів впливає на спільний прогноз.
Одним із серйозних модифікованих факторів ризику розвитку серцево-судинних захворювань є паління. Епідеміологічні дослідження свідчать, що паління є й дозозалежним фактором ризику зниження ШКФ і появи мікроальбумінурії (Pinto-Siersma S.J. і співавт., 2000), причому негативний вплив паління на стан нирок має місце як у чоловіків, так і у жінок (Haroun N.K. і співавт., 2003). Найбільш яскраво цей ефект проявляється у курців-гіпертоніків (Warmoth L. і співавт., 2005). Не менш значущими в профілактиці ХХН є обмеження споживання алкоголю.
Ефективна антигіпертензивна терапія є важливим засобом кардіопротекції, а також вірогідно віддаляє час настання ХХН (Maki D.D. і співавт., 1995; He J., Whelton P.K., 1999; Jafar Т.Н. і співавт., 2003; Casas J.P. і співавт., 2005; Ritz E., 2010; Segura J., Ruilope L.M., 2011).
Спільність причин та механізмів прогресування ХХН та серцево-судинних захворювань визначає необхідність єдиних методів лікування. До них відносять низькосольову дієту, малобілкову дієту (МБД) та кетоамінокислоти, боротьбу з ожирінням і палінням, корекцію порушень вуглеводного та білкового обміну, лікування препаратами, що впливають на ренін-ангіотензин-альдостеронову систему (інгібітори АПФ, блокатори ангіотензинових рецепторів, інгібітори реніну).
Важливим напрямком профілактики й лікування ХХН є корекція способу життя й характеру харчування з метою найбільш повного впливу на фактори ризику розвитку та прогресування ХХН, що модифікуються. Дієтотерапія є найважливішим патогенетичним методом лікування ХХН. Основними цілями розробки та застосування дієтотерапії для хворих на ХХН є зменшення вираженості уремічних симптомів і метаболічних порушень, пов’язаних із нирковою недостатністю, та уповільнення втрати функції нирок.
До можливих патогенетичних механізмів позитивного впливу малобілкової дієти на прогресування ниркової недостатності можна віднести гемодинамічні й негемодинамічні (зменшення протеїнурії, гемосидерозу канальців, тубулярного гіперметаболізму, продукції цитокінів, рівня системних гормонів, перевантаження ниркових клітин кальцієм і фосфором, протидія ацидозу і зменшення продукції амонію, нормалізація балансу між синтезом і деградацією білка за рахунок протеїназ). Концентрація кінцевих продуктів азотистого обміну в сироватці залежить від кількості білка, що надходить із їжею, рівня білкового катаболізму та ступеня ниркової недостатності. Білки харчових продуктів являють собою дуже складні високомолекулярні сполуки з різних амінокислот, яких налічують до 80. Однак у більшості продуктів міститься близько 20 амінокислот. Різноманітність білків визначається первинною, вторинною та третинною структурою білка. Певна частина амінокислот розщеплюється до органічних кетокислот, із яких в організмі знову синтезуються нові амінокислоти і потім білки. Ці амінокислоти назвали замінними. Однак 9 амінокислот (ізолейцин, лейцин, лізин, метіонін, фенілаланін, триптофан, треонін, валін і гістидин) не можуть утворюватися в організмі дорослої людини з інших амінокислот і повинні надходити з їжею. Найбільш близькі до ідеального білка тваринні білки. Більшість рослинних білків має недостатній уміст однієї або навіть двох-трьох незамінних амінокислот. Слід також враховувати, що рослинні білки засвоюються організмом гірше, ніж тваринні: білки яєць і молока — на 96 %, білки риби та м’яса — на 95 %, білки бобових — на 70 %.
Добре відомо, що високе споживання білка асоціюється зі своєрідними гемодинамічними зрушеннями в нирках, які виражаються в зниженні ниркового судинного опору, наростанні ниркового кровотоку і гломерулярної ультрафільтрації. На цьому тлі зменшується коефіцієнт гломерулярної ультрафільтрації (Kf). Зниження Kf у даних умовах розглядається як реакція, покликана обмежити неконтрольоване зростання ШКФ в окремому нефроні. Зрозуміло, що в такій ситуації зменшення величини Kf повинно призводити до збільшення інтрагломерулярної гіпертензії. Такі зміни можуть сприяти акцелерації ниркових ушкоджень за гемодинамічним механізмом (Кучер А.Г. та співавт., 2004; Кучер А.Г. та співавт., 2007). Однак вплив значної кількості протеїнів у раціоні на стан нирок не вичерпується тільки гемодинамічними ефектами.
Наприклад, на тлі підвищеного споживання білка спостерігається наростання кінцевих продуктів глікозування, які запускають складний каскад реакцій, що включає генерацію активних форм кисню. Останні, у свою чергу, активують сигнальні шляхи мітогенактивуючої протеїнкінази, протеїнкінази С і активаторів транскрипції. Це супроводжується наростанням експресії прозапальних (NF-kB, моноцитарного хемоатрактантного протеїну-1, фактора некрозу пухлини a) та профібротичних (трансформуючого фактора росту b, фактора росту сполучної тканини, фактора росту тромбоцитарного походження) субстанцій. У такій ситуації відбувається трансформація канальцевих клітин у міофібробласти, що врешті–решт призводить до тубулярної атрофії та фіброзу інтерстицію. Свій внесок у формування ниркових ушкоджень в умовах високого споживання білка робить посилення ацидозу й активація ендотеліну-1 (Uribarri і співавт.).
Певне значення у прогресуванні ХХН має не тільки кількість, а й якість харчового білка. У 1964 р. S. Giovanetti і Q. Maggiore довели, що дієта з умістом 24–25 г білка в добовому раціоні з додаванням есенціальних амінокислот здатна збільшити виживання хворих із вираженою хронічною нирковою недостатністю (ХНН), а C. Giordano (1981) і G. Masshino показали, що у хворих із початковою стадією ХНН малобілкова дієта запобігає прогресуванню уремії.
Сьогодні дієтичне лікування ХХН у додіалізному періоді ґрунтується на таких основних принципах:
— знизити споживання білка до 0,8 г/кг/добу хворим на ХХН як із цукровим діабетом (2С), так і без нього (2В) і зі ШКФ < 30 мл/хв/1,73 м2 із додаванням кето/амінокислот 0,1 г/кг масси тіла на добу;
— не допускати високого споживання білка (> 1,3 г/кг/добу) дорослим пацієнтам із ХХН, які мають ризики прогресування (2С);
— забезпечити достатню калорійність раціону відповідно до енерготрат організму за рахунок жирів і вуглеводів і повну компенсацію потреб організму у вітамінах та мікроелементах;
— обмежити надходження в організм іонів натрію до тих мінімальних меж, при яких вдається забезпечити підтримання нормального водного та електролітного складу внутрішнього середовища організму, особливо за наявності гіпертензивного синдрому;
— забезпечити добрими смаковими якостями страви за рахунок використання кислих фруктових і овочевих соків, лимонів, зелені петрушки, кропу, цибулі, селери, лаврового листа, гвоздики і в невеликій кількості — гіркого перцю, хрону, гірчиці;
— широко застосовувати в дієті свіжі фрукти, овочі й баштанні культури;
— подрібнене 5–6-разове харчування з обов’язковим прийомом невеликої кількості їжі за 2 години перед сном.
Включення до МБД комбінації кетоаналогів амінокислот сприяє уповільненню прогресування ХХН (Teschan P.E. і співавт., 1998; Prakash S. і співавт., 2004; Mitch W.E., 2005). При використанні препаратів кетоаналогів есенціальних амінокислот тривале застосування малобілкової дієти в додіалізному періоді не викликає порушення білкового обміну, що сприятливо позначається на результатах подальшої замісної терапії (Chauveau P. і співавт., 2009). Малобілкова дієта в поєднанні з препаратами кето/амінокислот є одним з методів ренопротекції, застосування якого вірогідно уповільнює темпи прогресування ХХН та подовжує додіалізний період. Окрім того, висока вартість діалізної терапії та великі ризики можливих ускладнень у пацієнтів після початку діалізу надають переваги в призначенні МБД у поєднанні з препаратами кето/амінокислот.
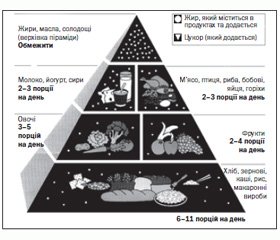
При формуванні раціонів у пацієнтів із ХХН можна керуватись пірамідою харчування (рис. 2).
/19/19.jpg)
Ця схема принципів здорового харчування розроблена Гарвардською школою громадського здоров’я під керівництвом американського дієтолога Уолтера Віллетте. Продукти, розташовані знизу, потрібно вживати в їжу якомога частіше, розташовані вгорі — виключити з раціону або вживати в обмеженій кількості. У піраміді всі продукти розподілені на 6 груп: 1-ша — зернові; 2-га — овочі; 3-тя — фрукти; 4-та — молочні продукти; 5-та — м’ясо, риба, горіхи, 6-та — жири, солодощі та алкоголь.
За умови обмеження квоти білка калорійність раціону збільшується за рахунок простих і складних вуглеводів, тваринних і рослинних жирів.
Одним з ускладнень малобілкової дієти може бути розвиток білково-енергетичної недостатності. Доведено, що з прогресуванням ниркової недостатності у хворих із захворюваннями нирок збільшуються порушення нутритивного статусу. Для визначення ступеня порушень нутритивного статусу у хворих із ХНН можна використовувати метод, запропонований G.L. Bilbrey, T.L. Cohen, що включає декілька параметрів: індекс маси тіла, товщину шкірно-жирової складки над трицепсом, вимірювану каліпером, окружність плеча (ОП = 0,314 • товщина жирової складки над трицепсом), концентрацію альбуміну в плазмі, абсолютне число лімфоцитів периферичної крові, рівень трансферину крові і С-реактивного білка. Кожен з отриманих показників порівнюється з нормальним його значенням. Наявні дані підтверджують, що МБД і застосування кетоаналогів незамінних амінокислот ефективні для лікування затримки азотистих шлаків, порушень кислотно-лужної рівноваги та фосфорно–кальцієвого обміну, інсулінорезистентності та для відстрочки початку ЗНТ, не впливає негативно на нутритивний статус хворих на ХХН.
Міжнародною консультативною радою із застосування кетокислот (Кетостерилу) розроблені рекомендації щодо раціональної дієтотерапії (Рим, 23–24.09.2003, Падуя, 22–24.06.2004). При цьому окремо визначені правила для пацієнтів на додіалізному етапі ХХН та для тих, хто отримує діаліз.
Основні положення рекомендацій такі:
— у додіалізному періоді добове споживання білка при МБД становить 0,6 г/кг (0,4 г/кг) у поєднанні із кетокислотами 0,1 г/кг/добу (1 таблетка на 5 кг маси тіла на добу) з енергетичною цінністю дієти 35 ккал/кг/добу. Білкові калорії повинні заміщатися вуглеводами;
— у пацієнтів із діабетичною нефропатією коректно призначена терапія кетокислотами може гальмувати прогресування ниркової недостатності та подовжувати додіалізний період;
— при проведенні гемодіалізу, що чинить потужний катаболічний ефект, призначення кетокислот дозволяє корегувати розлади харчування, збільшує сироватковий альбумін, знижує рівень паратгормону та сприяє зниженню дози еритропоетину.
При цьому KDOQI рекомендує для гемодіалізних пацієнтів вживання білка 1,2 г/кг/добу з енергетичним умістом 30–35 ккал/кг/добу.
Абсолютним показанням для призначення кетокислот у пацієнтів, які отримують гемодіаліз, є ознаки мальнутриції (сироватковий альбумін менше ніж 35 г/л). Це пов’язано з тим, що смертність пацієнтів із гіпоальбумінемією (менше ніж 35 г/л) майже у два рази більша, ніж при нормоальбумінемії.
Слід відзначити, що пацієнти похилого віку, які отримують МБД у поєднанні з кето/амінокислотами, порівняно з пацієнтами, які отримують гемодіаліз, мають такі ж показники виживаності, але значно нижчий рівень госпіталізацій та низький ризик порушення статусу харчування (Brunori et al., 2004).
Таким чином, збалансована малобілкова дієта в поєднанні з кетоаналогами незамінних амінокислот сприяє підтриманню білкового балансу, регуляції показників фосфорно-кальцієвого обміну і кислотно-лужної рівноваги, запобігає розвитку білково-енергетичної недостатності, сповільнюючи темпи прогресування ниркової недостатності у хворих на хронічну хворобу нирок на додіалізному етапі.
1. Іванов Д.Д., Корж О.М. Нефрологія в практиці сімейного лікаря. — 3-тє вид., переробл. і доповн. — Донецьк: Видавець Заславський О.Ю., 2014. — 464 с.
2. Наказ МОЗ України та НАМН України від 11.05.2011 № 280/44 «Стандарт надання медичної допомоги хворим із хронічною хворобою нирок V стадії, які лікуються гемодіалізом».
3. Николаев А.Ю., Милованов Ю.С. Лечение почечной недостаточности. — М.: Медицинское информационое агентство, 2011. — 592 с.
4. Ромаданова О.И., Семидоцкая Ж.Д., Власенко Е.М., Бутикова Е.А. Ренопротективные эффекты малобелковой диеты с применением кетоаналогов незаменимых аминокислот / О.И. Ромаданова, Ж.Д. Семидоцкая, Е.М. Власенко, Е.А. Бутикова // Почки. — 2013. — № 4. — С. 11–17.
5. Aparicio M., Cano N.J., Cupisti A. et al. Keto-acid therapy in predialysis chronic kidney disease patients: consensus statements // J. Ren. Nutr. — 2009. — Vol. 19, Issue 5, suppl. — P. 33–35.
6. Chauveau P., Aparicio M. Benefits in nutritional interventions in patients with CKD stage 3–4 // J. Ren. Nutr. — 2011. — Vol. 21. — P. 20–22.
7. Kidney Disease: Improving Global Outcomes (KDIGO) СKD Work Group. KDIGO 2012 Clinical Practice Guideline for the for the Evaluation and Management of Chronic Kidney Disease // Kidney inter. — 2013. — Suppl., № 3. — Р. 1–150.
8. The Renal Association «Nutrition in CKD», 2010. http: www.renal.org/clinical/guidelines section/Nutrition in CKD.aspx

/16/16.jpg)
/17/17.jpg)
/18/18.jpg)