Международный эндокринологический журнал 4 (60) 2014
Вернуться к номеру
Роль вісцеральної жирової тканини у розвитку гормонально-метаболічних порушень у хворих на цукровий діабет 2-го типу з ожирінням та артеріальною гіпертензією
Авторы: Зуєв К.О. - Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
У статті подані результати дослідження рівня адипокінів (лептину та адипонектину), а також резистентності до інсуліну та секреторної активності β-клітин підшлункової залози залежно від кількості жирової тканини в організмі й типу її розподілу, що вивчався за допомогою двофотонної рентгенівської абсобціометрії, у 106 пацієнтів (50 чоловіків і 56 жінок віком 55,90 ± 2,15 року) із цукровим діабетом (ЦД) 2-го типу, ожирінням та артеріальною гіпертензією порівняно з контрольною групою обстежуваних (без ЦД, ожиріння й артеріальної гіпертензії). Було показано, що надлишкова кількість жирової тканини у хворих на ЦД 2-го типу справляє вплив на розвиток гормонально-метаболічних порушень, що пов’язано з особливостями продукції адипокінів. Було виявлено, що гіперпродукція лептину жировою тканиною та зниження базального рівня адипонектину при ожирінні створюють передумови до зниження чутливості клітин-мішеней до інсулін-опосередкованого засвоєння глюкози, перенапруження й подальшого виснаження секреторної функції β-клітин підшлункової залози, а також до підтримання стійкого стану резистентності до інсуліну та зміщення гомеостазу глюкози в напрямку переважання гіперглікемічних станів. Також встановлено фізіологічно детермінований статевий диморфізм рівня адипокінів, що обумовлює більш високу толерантність жіночого організму до надлишку маси жирової тканини. Підтверджено, що стан гіперлептинемії та гіпоадипонектинемії лежить в основі порушень вуглеводного обміну у хворих на ЦД 2-го типу з ожирінням та артеріальною гіпертензією.
В статье представлены результаты исследования уровня адипокинов (лептина и адипонектина), а также резистентности к инсулину и секреторной активности β-клеток поджелудочной железы в зависимости от количества жировой ткани в организме и типа ее распределения, изучавшегося при помощи двухфотонной рентгеновской абсорбциометрии, у 106 пациентов (50 мужчин и 56 женщин в возрасте 55,90 ±
± 2,15 года) с сахарным диабетом (СД) 2-го типа, ожирением и артериальной гипертензией по сравнению с контрольной группой обследуемых (без СД, ожирения и артериальной гипертензии). Было показано, что избыточное количество жировой ткани у больных СД 2-го типа оказывает влияние на развитие гормонально-метаболических нарушений, что связано с особенностями продукции адипокинов. Было выявлено, что гиперпродукция лептина жировой тканью и снижение базального уровня адипонектина при ожирении создают предпосылки к снижению чувствительности клеток-мишеней к инсулин-опосредованному усвоению глюкозы, перенапряжению и последующему истощению секреторной функции β-клеток поджелудочной железы, а также к поддержанию устойчивого состояния резистентности к инсулину и смещению гомеостаза глюкозы в направлении преобладания гипергликемических состояний. Также был показан физиологически детерминированный половой диморфизм уровня адипокинов, обусловливающий более высокую толерантность женского организма к избытку массы жировой ткани. Было подтверждено, что состояния гиперлептинемии и гипоадипонектинемии лежат в основе нарушений углеводного обмена у больных СД 2-го типа с ожирением и артериальной гипертензией.
The article presents the results of adipokines (leptin and adiponectin) level study, as well as insulin resistance and secretory activity of the β-cells of the pancreas, depending on the amount of adipose tissue and its distribution type, studied using dual-energy X-ray absorptiometry, in 106 patients (50 men and 56 women aged 55.90 ± 2.15 years) with diabetes mellitus (DM, type 2, obesity and arterial hypertension, as compared with the control group (without DM, obesity, and hypertension). It has been shown that an excess amount of adipose tissue in patients with DM type 2 affects the development of hormone-metabolic disorders related to the features of adipokines production. It was found that overproduction of leptin by adipose tissue and decreased basal level of adiponectin in obesity create conditions to decrease the sensitivity of target cells to insulin-mediated glucose uptake, defatigation and subsequent depletion of the secretory function of β-cells of the pancreas, as well as to the maintenance of steady state of resistance to insulin and glucose homeostasis deviation towards hyperglycemic conditions prevail. Also there been shown physiologically determined sexual dimorphism of adipokines level conditioning higher tolerance of the female body to excess of adipose tissue mass. It was confirmed that the state of hyperleptinemia and hypoadiponectinemia underlie disorders of carbohydrate metabolism in patients with DM 2 with obesity and hypertension.
цукровий діабет 2-го типу, ожиріння, артеріальна гіпертензія, лептин, адипонектин, двофотонна рентгенівська абсорбціометрія, жирова тканина.
сахарный диабет 2-го типа, ожирение, артериальная гипертензия, лептин, адипонектин, двухфотонная рентгеновская абсорбциометрия, жировая ткань.
diabetes mellitus type 2, obesity, arterial hypertension, leptin, adiponectin, dual-energy X-ray absorptiometry, adipose tissue.
Статья опубликована на с. 57-62
Надлишкове накопичення вісцеральної жирової тканини (ЖТ) у хворих на цукровий діабет (ЦД) 2-го типу є одним з основних чинників, що обумовлюють тяжкість клінічних та гормонально-метаболічних порушень, які супроводжують перебіг цього захворювання. Такі гормони жирової тканини, як лептин і адипонектин, відіграють провідну роль у підтриманні енергетичного балансу в організмі [1, 2]. Відомо, що чутливість до інсулін-опосередкованого засвоєння глюкози в організмі здорової людини залежить від концентрації циркулюючого в крові адипонектину, який також опосередковує метаболізм ліпопротеїнів та справляє вплив на постпрандіальну супресію вивільнення вільних жирних кислот [3]. В осіб із надлишковою масою тіла та ожирінням знижений базальний рівень адипонектину розглядається як одна з причин розвитку резистентності до інсуліну [4]. З іншого боку, накопичення жиру в організмі супроводжується гіперпродукцією лептину, що призводить до зниження чутливості до інсуліну тканин-мішеней із подальшим формуванням симптомокомплексу, притаманного метаболічному синдрому та ЦД 2-го типу [5].
Дотепер недостатньо досліджене питання про взаємозв’язок рівня гормонів жирової тканини та кількості жирової тканини із точною оцінкою її кількості та урахуванням розподілу в абдомінальній та глютеофеморальній ділянках у хворих на ЦД 2-го типу з ожирінням та артеріальною гіпертензією (АГ).
Метою нашого дослідження було встановити залежність між рівнем лептину й адипонектину та масою жирової тканини, а також деякими показниками вуглеводного обміну у хворих на ЦД 2-го типу з ожирінням та АГ.
Матеріали та методи дослідження
У дослідженні брали участь 106 пацієнтів (50 чоловіків та 56 жінок) віком 55,90 ± 2,15 року з ЦД 2-го типу із середньою тривалістю захворювання 7,0 ± 1,5 року, гіпертонічною хворобою І–ІІ стадії та ожирінням І–ІІІ ступеня, які перебували на амбулаторному або стаціонарному лікуванні у відділі профілактики ендокринних захворювань Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України.
Групу порівняння становили 26 пацієнтів — 13 чоловіків і 13 жінок віком від 45 до 65 років без ЦД 2-го типу та АГ з індексом маси тіла (ІМТ) у межах норми.
Діагноз АГ встановлювався відповідно до рекомендацій Української асоціації кардіологів 2008 р. [6]. АГ у всіх обстежуваних хворих відповідала I і II ступеням (м’яка та помірна АГ). Визначення ступеня ожиріння проводилося відповідно до рекомендацій ВООЗ (1997 р.) шляхом розрахунку ІМТ за формулою: ІМТ = маса тіла/зріст2 (кг/м2). Надлишковою маса тіла вважалася при ІМТ від 25 до 29,9 кг/м2, ожиріння I ступеня діагностувалося при ІМТ від 30,0 до 34,9 кг/м2, а ожиріння II і III ступенів — при значеннях цього показника від 35,0 до 39,9 кг/м2 і понад 40 кг/м2 відповідно. Абдомінальне ожиріння верифікувалося при окружності талії (ОТ) в чоловіків > 94 см, у жінок — > 88 см.
Усім пацієнтам проводилося вимірювання антропометричних показників: зросту та маси тіла з подальшим розрахунком ІМТ, а також окружності талії й окружності стегон (ОС). Визначення структури тіла проводилося методом двофотонної рентгенівської абсорбціометрії (ДРА), або денситометрії на апараті Lunar Prodigy Primo фірми General Electric (США). При цьому вимірювались показники загальної маси жирової тканини (МЖТз) та її вміст в окремих ділянках: андроїдному (абдомінальному, МЖТа) та гіноїдному (глютеофеморальному, МЖТг) компартментах. Визначення глюкози в сироватці крові проводили колориметричним методом на автоматичному біохімічному аналізаторі Sapphire-400, Tokio Boek L.T.D. Elitech diagnostics виробництва Seppin S.A.S. (Франція). Рівень імунореактивного інсуліну (ІРІ), С-пептиду, лептину та адипонектину в сироватці крові натще визначався імуноферментним методом за допомогою реактивів фірми DRG (Німеччина) на автоматичному аналізаторі iEMS Reader MF фірми ThermoLabsystems (Фінляндія).
Чутливість до інсуліну та секреторну функцію b-клітин підшлункової залози оцінювали за допомогою удосконаленої НОМА2-моделі (homeostasis model assessment) із використанням НОМА-калькулятора (HOMA Calculator v. 2.2) [7]. Початковими даними для оцінки усіх НОМА2-індексів у хворих на ЦД 2-го типу були: базальний рівень С-пептиду в сироватці крові натще та глюкоза плазми крові натще [8]. Чутливість до інсуліну визначалася за допомогою індексу НОМА2-S% та секреторної функції b-клітин — за допомогою індексу НОМА2-B% (значення наводяться у відсотках). За 100 % прийняті однойменні показники, що були отримані у здорових досліджуваних молодого віку. Рівень інсулінорезистентності оцінювався за індексом HOMA2-ІР, який у здорових досліджуваних був прийнятий за 1.
Порівняння незалежних вибірок проводилося за допомогою дисперсійного аналізу. Спочатку проводили перевірку кількісних показників розподілу на відповідність закону Гауса. Залежно від типу розподілу даних використовували параметричний критерій Фішера чи непараметричний критерій Крускала — Уолліса. Статистичні характеристики наведені у вигляді середнього арифметичного (M) і стандартної похибки (± SE), а також 95% довірчого інтервалу (95% СІ). Асоціація між залежними та незалежними змінними аналізувалася методом регресійного аналізу [9]. Характеристиками регресійних моделей, поданих у вигляді графіків, були коефіцієнт регресії (r), коефіцієнт детермінації R2, рівень статистичної значущості моделі (p). Статистичний аналіз даних проводився за допомогою комп’ютерної програми SPSS 9.0.
Результати та їх обговорення
Методом дисперсійного аналізу була проведена порівняльна оцінка рівня лептину й адипонектину в досліджуваних групах пацієнтів. Аналіз показав, що рівень лептину в пацієнтів основної групи був статистично значуще (р < 0,001) вищим, а рівень адипонектину — статистично значуще (р < 0,01) нижчим, ніж у групі порівняння (табл. 1).
Індекс співвідношення лептин/адипонектин у пацієнтів із ЦД 2-го типу був вищим (р < 0,001), ніж у групі порівняння (табл. 1). Отримане підвищення рівня лептину у хворих на ЦД 2-го типу з ожирінням та АГ можна порівняти зі значеннями контрольної групи, воно відповідає результатам інших дослідників та вказує на те, що надлишок жирової тканини в організмі призводить до гіперпродукції цього гормону [5]. Знижений рівень адипонектину, що був наявний у хворих на ЦД 2-го типу з ожирінням, також характерний для надлишку жирової тканини в організмі. Цей показник супроводжується низкою клінічних та метаболічних розладів, що, зокрема, проявляються порушенням вуглеводного обміну [12, 13].
Аналіз даних адипокінів у загальній виборці виявив двомодальний характер розподілу показників рівня лептину й адипонектину, обумовлений гендерними відмінностями. Було показано, що в чоловіків із ЦД 2-го типу рівень лептину та адипонектину (р < 0,01), а також індекс співвідношення лептин/адипонектин був статистично значуще (р < 0,05) нижчим, ніж у жінок з аналогічним діагнозом (табл. 1).
Надалі ці факти стали підставою для врахування гендерного фактора при аналізі ролі вісцеральної жирової тканини в розвитку гормонально–метаболічних порушень у хворих на ЦД 2-го типу з ожирінням та АГ.
При визначенні методом ДРА як загальної маси ЖТ, так і ЖТ, локалізованої в абдомінальному і глютеофеморальному компартментах, у хворих на ЦД 2-го типу з ожирінням та АГ були виявлені також статистично значущі гендерні відмінності. Так, МЖТз у чоловіків у середньому становила 32,10 ± 1,35 %, а в жінок — 45,80 ± 1,29 % від маси тіла. В абдомінальній ділянці тіла в чоловіків було розташовано в середньому 44,70 ± 1,04 % жирової тканини (МЖТа), а в жінок — 51,60 ± 0,98 % МЖТа. У глютеофеморальній ділянці тіла у чоловіків жирова тканина становила 35,00 ± 1,46 %, а в жінок — 47,50 ± 1,38 % від загальної маси тіла. Порівняльний аналіз показав, що в жінок із ЦД 2-го типу вміст МЖТз, МЖТа і МЖТг був статистично значуще (р < 0,001) вищим порівняно з аналогічними показниками в чоловіків (рис. 1).
/59/59_2.jpg)
Середній індекс співвідношення МЖТа та МЖТг у чоловіків був статистично значуще (р < 0,001) вищим, ніж у жінок, і становив 1,31 ± 0,03 і 1,09 ± 0,0 відповідно. Андроїдний тип ожиріння (індекс МЖТа/МЖТг > 1) був наявний у 92 % чоловіків (46 із 50) та у 89 % жінок (50 з 56). Цей факт свідчить на користь переважно андроїдного типу ожиріння в обстежених пацієнтів із ЦД 2-го типу.
З метою встановлення закономірностей залежності рівня досліджуваних адипокінів в плазмі крові хворих на ЦД 2-го типу з ожирінням та АГ від маси жирової тканини та її локалізації був проведений регресійний аналіз як за загальною вибіркою, так і в групах чоловіків і жінок окремо.
За результатами аналізу всієї вибірки рівень лептину збільшувався експоненційно зі збільшенням МЖТз (r = 0,74; R2 = 55,8 %, р < 0,01). У чоловіків МЖТз визначає 43,3 % (r = 0,65; R2 = 43,3 %, р < 0,01) варіабельності рівня лептину, у жінок — 27,8 % (r = 0,52; R2 = 27,8%, р < 0,01) (рис. 2).
/59/59_3.jpg)
Параметрами моделі позитивної асоціації рівня лептину з МЖТа були в чоловіків показники r = 0,51; R2 = 26,8 % (р < 0,01) і в жінок — r = 0,46; R2 = 21,4 % (р < 0,01) відповідно, а також лептину з МЖТг у чоловіків (r = 0,58; R2 = 33,7 %; р < 0,01) і в жінок (r = 0,35; R2 = 12,6%; р < 0,01). Ці факти можуть вказувати на те, що в чоловіків андроїдний і гіноїдний компартменти однаково залучені до продукції лептину, тоді як у жінок ЖТ, яка локалізована в гіноїдному компартменті, меншою мірою впливає на рівень циркулюючого в крові лептину порівняно із ЖТ, локалізованою в андроїдному компартменті. У той же час регресійний аналіз показав, що ні в чоловіків, ні в жінок рівень циркулюючого в крові адипонектину не був асоційований із МЖТз, МЖТа та МЖТг.
У зв’язку з тим, що вплив ЖТ на функціональні ланки вуглеводного обміну опосередкований адипокінами, становило неабиякий інтерес проведення детального аналізу характеру взаємозв’язку лептину й адипонектину з рівнем чутливості до інсулін-опосередкованого засвоєння глюкози, секреторною активністю b-клітин підшлункової залози, а також із резистентністю до інсуліну у хворих досліджуваної групи — пацієнтів із ЦД 2-го типу з ожирінням та АГ з урахуванням їх статі. Результати порівняльного аналізу вищеперерахованих розрахункових показників вуглеводного обміну подані на рис. 3.
Індекс НОМА2-S% чутливості до інсулін-опосередкованого засвоєння глюкози в пацієнтів із ЦД 2-го типу, ожирінням та АГ становив у середньому в чоловіків 31,9 ± 2,3 %, у жінок — 34,8 ± 3,2 % від нормальної прийнятої за 100 % чутливості до інсуліну в здорових досліджуваних. Індекс HOMA2-В% активності b-клітин підшлункової залози в обстежуваних пацієнтів з ЦД 2-го типу становив у середньому в чоловіків 60,2 ± 5,5 %, у жінок — 63,5 ± 5,2 % від нормальної прийнятої за 100 % секреторної активності в здорових досліджуваних осіб. Індекс інсулінорезистентності НОМА2-ІР становив у середньому в чоловіків основної групи 4,00 ± 0,03, а в жінок — 3,30 ± 0,28. Слід зазначити, що статистично значущих гендерних відмінностей у досліджуваних показниках, які характеризують вуглеводний обмін, відзначено не було.
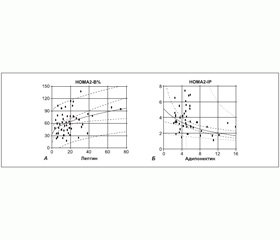
Взаємозв’язок рівня чутливості до інсуліну, рівня активності b-клітин підшлункової залози та рівня резистентності до інсуліну з рівнем адипокінів у плазмі крові вивчався за допомогою регресійного аналізу. Серед закономірностей, притаманних як чоловікам, так і жінкам, слід відзначити позитивну асоціацію рівня лептину з індексом HOMA2–В% секреторної активності b-клітин підшлункової залози, що за всією вибіркою пацієнтів основної групи становила R2 = 14,2 % (r = 0,37; p < 0,01) (рис. 4А), зокрема в чоловіків R2 = 15,8 % (r = 0,39; p < 0,05), а в жінок R2 = 21,7 % (r = 0,46; p < 0,01). Рівень резистентності до інсуліну за всією вибіркою був негативно асоційований із рівнем адипонектину — R2 = 19,8 % (r = –0,44; p < 0,01) (рис. 4Б), у чоловіків ця асоціація мала більш високий ступінь — R2 = 45,0 % (r = –0,67; p < 0,01), ніж у жінок — R2 = 14,1 % (r = –0,37; p < 0,05).
Отримані в ході обстеження хворих основної групи з ЦД 2-го типу з ожирінням та АГ результати узгоджуються за низкою фактів із результатами інших дослідників [12–15]. Гіперпродукція лептину, обумовлена надлишковою масою жирової тканини, була наявною в загальній вибірці. Проте в чоловіків вона рівною мірою асоціювалася з масою ЖТ в андроїдному й гіноїдному компартментах, тоді як у жінок роль андроїдного компартменту ЖТ у розвитку гіперлептинемії була вищою, ніж гіноїдного компартменту. Виявлені гендерні розбіжності за вмістом лептину збігаються з відомими фактами [10] і є додатковим підтвердженням більш високої толерантності жіночого організму до розвитку метаболічних порушень, пов’язаних з надлишковим накопиченням ЖТ і, можливо, станом перманентної гіперлептинемії. У наших дослідженнях вдалося показати зв’язок гіперлептинемії зі ступенем напруження секреторної функції b-клітин підшлункової залози у хворих на ЦД 2-го типу з ожирінням та АГ. Наші результати не показали зв’язку між індексами НОМА2-S% та НОМА2-ІР і рівнем лептину в плазмі крові в обстежених нами пацієнтів із ЦД 2-го типу. У той же час неможливо виключити роль лептину в розвитку інсулінорезистеності на ранніх стадіях ЦД 2-го типу, про що свідчать дані літератури [5, 15].
Згідно з результатами нашого дослідження, у всіх хворих на ЦД 2-го типу з ожирінням та АГ спостерігався знижений базальний рівень адипонектину, що також узгоджується з літературними даними. Незважаючи на відсутність прямих доказів безпосереднього взаємозв’язку ступеня збільшення маси ЖТ зі зниженням продукції адипонектину, вплив адипонектину на деякі показники вуглеводного обміну в пацієнтів із ЦД 2-го типу на тлі ожиріння та АГ підтверджений іншими дослідженнями [3, 4]. Так, була показана зворотна асоціація між індексом НОМА2–ІР та рівнем адипонектину, що була найбільш виражена в чоловіків із ЦД 2-го типу порівняно з подібною асоціацією в жінок. Відомо, що знижений рівень адипонектину може бути самостійним патогенетичним чинником розвитку ЦД 2-го типу незалежно від маси тіла [12, 13]. У той же час недостатність цього гормону в осіб з ожирінням робить свій внесок у формування набутої інсулінорезистентності.
Слід зазначити, що обстежені пацієнти з ЦД 2-го типу (як чоловіки, так і жінки) не відрізнялися за основними показниками, що характеризують вуглеводний обмін: рівнем ІРІ, С-пептиду, гіперглікемії натще, індексами НОМА2-S%, НОМА2-В% і НОМА2-ІР, незважаючи на більш високий відсотковий уміст ЖТ в абдомінальній та глютеофеморальній ділянках тіла у жінок. Цей факт вказує на те, що чоловіки набагато більше чутливі до надлишку ЖТ в організмі, ніж жінки, а також дозволяє зробити припущення про те, що фізіологічні механізми, які є підґрунтям для статевого диморфізму рівня адипокінів у плазмі крові, впливають на характер клінічних та метаболічних порушень, пов’язаних з ожирінням, у цієї категорії пацієнтів [10, 11].
Висновки
1. Вплив надлишкової маси жирової тканини на розвиток гормонально-метаболічних порушень у хворих на ЦД 2-го типу з ожирінням та АГ опосередкований особливостями продукції адипокінів.
2. Гіперпродукція лептину жировою тканиною та зниження базального рівня адипонектину при ожирінні створюють передумови до зниження чутливості клітин-мішеней до інсулін-опосередкованого засвоєння глюкози, перенапруження та подальшого виснаження секреторної функції b-клітин підшлункової залози, а також до підтримання стійкого стану резистентності до інсуліну та зміщення гомеостазу глюкози в напрямку формування стійкої гіперглікемії.
3. Незважаючи на збережений фізіологічно детермінований статевий диморфізм рівня адипокінів, що обумовлює більш високу толерантність жіночого організму до надлишку маси жирової тканини, стани гіперлептинемії та гіпоадипонектинемії лежать в основі порушень вуглеводного обміну у хворих на цукровий діабет 2-го типу з ожирінням та АГ.
1. Kershaw E.E., Flier J.S. Adipose tissue as an endocrine organ // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89, № 6. — P. 2548–2556.
2. Ahima R.S., Qi Y., Singhal N.S. et al. Brain adipocytokine action and metabolic regulation // Diabetes. — 2006. — Vol. 55, Suppl. 2. — P. 145–154.
3. Tschritter O., Fritsche A., Thamer C. et al. Plasma adiponectin concentrations predict insulin sensitivity of both glucose and lipid metabolism // Diabetes. — 2003. — Vol. 52. — P. 239–243.
4. Kadowaki T., Yamauchi T., Kubota N. et al. Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome // J. Clin. Invest. — 2006. — 116(7). — 1784–1792.
5. Widjaja A., Stratton I.M., Horn R. et al. UKPDS 20: plasma leptin, obesity, and plasma insulin in type 2 diabetic subjects // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82. — P. 654–657.
6. Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії. Посібник до Національної програми профілактики і лікування артеріальної гіпертензії. — К.: ПП ВМБ, 2008. — 80 с.
7. www.dtu.ox.ac.uk/Homacalculator/index.php
8. Wallace T.M., Levy J.C., Matthews D.R. Use and abuse of HOMA modeling // Diabetes Care. — 2004. — Vol. 27, № 6. — P. 1487–1495.
9. Freedman D.A. Statistical Models: Theory and Practice. — Cambridge University Press, 2005. — 414 p.
10. Saad M.F., Damani S., Gingerich R.L., Riad-Gabrial M.G. et al. Sexual dimorphism in plasma leptin concentration // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82. — P. 579–584.
11. Böttner A., Kratzsch J., Müller G. et al. Gender differences of adiponectin levels develop during the progression of puberty and are related to serum androgen levels // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89, № 8. — P. 4053–4061.
12. Танянский Д.А., Фирова Э.М., Шатилина Л.В., Денисенко А.Д. Роль адипокинов и неэстерифицированных жирных кислот в развитии инсулинорезистентности // Проблемы эндокринологии. — 2009. — Т. 55, № 3. — С. 13–17.
13. Haluzik M., Parizkova J., Haluzik M.M. Adiponectin and its role in the obesity-induced insulin resistance and related complications // Physiol. Res. — 2004. — Vol. 53. — P. 123–129.
14. Ukkola O., Santaniemi M. Adiponectin: a link between excess adiposity and associated comorbidities? // J. Mol. Med. — 2002. — Vol. 80. — P. 696–702.
15. Триголосова И.В. Нарушения продукции глюкозы печенью и лептина в патогенезе сахарного диабета 2 типа: Дис... канд. мед. наук. — М., 2010. — 93 с.

/59/59.jpg)
/60/60.jpg)
/61/61.jpg)