Газета «Новости медицины и фармации» Антимикробная терапия (223) 2007 (тематический номер)
Вернуться к номеру
Практические вопросы резистентности микроорганизмов к антимикробным препаратам
Авторы: Л.В. БОГУН, к.м.н., Харьковская медицинская академия последипломного образования
Версия для печати
Резистентность микроорганизмов к антимикробным препаратам (АМП) имеет существенное значение для всех участников лечебного процесса: для больного, лечащего врача и руководителей здравоохранения. Неправильный выбор АМП способствует развитию устойчивости микроорганизмов, а несоблюдение санитарных норм в свою очередь ускоряет распространение устойчивых штаммов среди больных и медицинского персонала. Развитие инфекционного процесса, обусловленного устойчивыми штаммами, отрицательно влияет на исход заболевания и существенно повышает стоимость лечения. Поэтому перед клиницистом стоит важная задача: выбрать тактику антимикробной терапии согласно существующим руководствам, но с учетом вероятности инфицирования резистентными штаммами — для возможной корректировки лечения. Это требует оценки тяжести заболевания и факторов риска инфицирования определенными видами/штаммами возбудителей, знания локальных особенностей эпидемиологии. Особенное значение вопросы резистентности приобретают для больных с госпитальным происхождением заболевания, и особенно для больных с крайне тяжелым течением заболевания. Менее актуальны, однако также важны вопросы резистентности для больных с внебольничным происхождением заболевания.
Проблема резистентности микроорганизмов к АМП возникла давно и существует столько же, сколько существуют и сами антибиотики. Вскоре после внедрения пенициллина в клиническую практику были описаны случаи клинических неудач при лечении инфекций, вызванных Staphylococcus aureus , причем причиной неудач было возникнов ение устойчивости к антибиотику [1]. Данный случай является примером приобретенной устойчивости микроорганизма к АМП, которая возникает и развивается по описанным Ч. Дарвином законам борьбы за существование в ответ на появление нового фактора отбора в виде АМП. Существует также и естественная (природная) устойчивость микроорганизмов к АМП, например устойчивость Klebsiella pneumoniae к пенициллину. За последние годы рост резистентности микроорганизмов и осознание неблагоприятных медицинских и экономических последствий этого факта существенно возросли, что находит отражение в национальных и международных руководствах по антимикробной терапии [2, 3] Проблема усугубляется и нехваткой принципиально новых АМП, способных преодолеть рост резистентности [4].
Задача, стоящая перед клиницистом-немикробиологом, заключается в выборе АМП по принципу минимальной достаточности, т.е. с минимально широким спектром антимикробной активности, чтобы не способствовать развитию устойчивости возбудителя, с одной стороны, но и не подвергнуть больного риску неадекватной, недостаточной антимикробной терапии, с другой стороны. Это особенно важно при лечении тяжелых больных, у которых вероятность инфицирования устойчивыми возбудителями повышена. Многими клиницистами-немикробиологами данная проблема, по сути, сводится к дилемме, что предпочесть: «пользу для общества» или «пользу для больного». И очень часто для пользы больного назначается избыточная антимикробная терапия (АМТ) по принципу «на всякий случай» с ненужным парентеральным введением АМП со слишком широким спектром активности. Ну а так как победителей не судят, то такой либеральный подход получает всеобщее одобрение. Но в данном случае победа может оказаться пирровой за счет ухудшения исхода заболевания вследствие побочных явлений и осложнений, в том числе и за счет развития приобретенной резистентности уже в процессе лечения.
В табл. 1 приведены данные о позитивном влиянии ужесточения подхода к выбору АМП, в том числе и на исход заболевания.
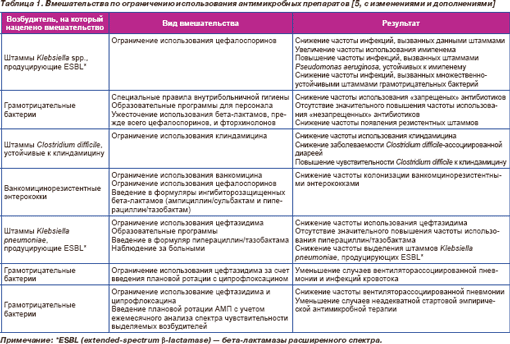
Хотя медицинские и экономические последствия резистентности к АМП достаточно наглядны, доказательная база недостаточна из-за методологической некорректности исследований. Тем не менее, согласно мнению экспертов, которое строится с учетом опубликованных данных, инфицирование устойчивыми штаммами ухудшает прогноз и повышает стоимость лечения [6, 7].
Инфекции, вызванные резистентными штаммами, сопровождаются повышением смертности и удлинением периода госпитализации [8]. Колонизация и инфицирование антибиотикорезистентными бактериями также повышают вероятность назначения больному неадекватной АМТ, под которой понимают назначение антибиотиков с низкой активностью in vitro или ее отсутствием в отношении возбудителя, например, неназначение антигрибковых препаратов больным с фунгемией или назначение пенициллина при инфекциях, обусловленных метициллинорезистентными штаммами S.aureus (MRSA). В ряде исследований было показано увеличение внутрибольничной летальности у больных вентиляторассоциированной пневмонией (ВАП), получавших неадекватную АМТ [9–12], и более того, последующая коррекция неадекватной стартовой АМТ с учетом результатов микробиологических исследований не всегда приводила к снижению риска внутрибольничного летального исхода [10].
Еще одна причина повышения риска неблагоприятного исхода при инфицировании устойчивыми штаммами, помимо неадекватной АМТ, заключается в том, что некоторые антибиотикоустойчивые микроорганизмы приобретают новые факторы вирулентности, которые могут способствовать возрастанию этого риска [13–16].
В то же время негативное влияние на прогноз оказывают не все антибиотикорезистентные микроорганизмы. Например, у больных, госпитализированных по поводу пневмококковой пневмонии и/или бактериемии, наличие резистентности у пневмококка к пенициллину не оказывает существенного влияния на исход, а более важное значение приобретает тяжесть заболевания [17–19]. Данное обстоятельство, по-видимому, обусловлено редкостью сре ди возбудителей штаммов с высокой резистентностью к пенициллину (минимальная подавляющая концентрация (МПК) ≥ 4 мг/мл), даже в странах, где пенициллинорезистентные пневмококки встречаются часто, например в Испании [19]. Кроме того, инфекции дыхательных путей и бактериемия, вызванные умереннорезистентными пневмококками, хорошо поддаются лечению высокими дозами бета-лактамов (пенициллины и цефалоспорины), которые накапливаются в легочной ткани в высоких концентрациях, намного превышающих МПК. Однако реальная ситуация может быть гораздо сложнее, поскольку в странах, где чувствительность пневмококков к пенициллину значительно снижена, больные с пневмонией госпитализируются чаще. Например, во Франции — стране с высокой распространенностью пенициллинорезистентных пневмококков, частота госпитализации превышает на 40 % таковую в Великобритании, где уровень резистентности низкий [20].
Характер назначений антибиотиков существенно влияет как на развитие резистентности микрофлоры у конкретного пациента, так и на структуру региональной резистентности. Так, выделение устойчивых к триметоприму штаммов возбудителей инфекций мочевыводящих путей чаще наблюдается у лиц, принимавших ранее триметоприм или другие АМП [21]. У больных, получавших бета-лактамы или другие АМП в предшествующие 3 месяца, устойчивые к амоксициллину штаммы Haemophilus influenzae выделяются из мокроты достоверно чаще [22]. Эти результаты находят подтверждение и в большом количестве эпидемиологических исследований и наблюдений, в которых продемонстрирована тесная связь между назначением АМП и развитием резистентности микроорганизмов.
При госпитальных инфекциях факторы риска инфицирования резистентными штаммами одинаковы для многих патогенов, но одним из наиболее значимых факторов является предшествующее пребывание в стационаре, прямое (лечение) или косвенное (работа в клинике, пребывание/работа в домах ухода за престарелыми и т.д.) [23].
Общие факторы риска инфицирования/колонизации резистентными штаммами возбудителей госпитальных инфекций ( Staphylococcus aureus , энтерококки, грамотрицательные палочки, Clostridium difficile , Candida spp. ) [23]
— Пожилой возраст.
— Сопутствующая патология.
— Тяжесть заболевания.
— Недавнее пребывание в других лечебных учреждений или учреждений социального ухода.
— Длительная госпитализация.
— Операции на желудочно-кишечном тракте или по трансплантации органов.
— Наличие любых инвазивных устройств (особенно центрального венозного катетера).
— Предшествующее применение антибиотиков (особенно цефалоспоринов).
У больных с внебольничными инфекциями могут иметь значение специфические факторы риска колонизации/инфицирования резистентными возбудителями, для оценки которых требуется тщательный сбор анамнеза и анализ медицинской документации. Так, при оценке пневмококковой инфекции имеет значение пребывание больного в странах с высоким уровнем резистентности пневмококков к пенициллину.
Как уже отмечалось ранее, предшествующая АМТ также повышает вероятность инфицирования штаммами, резистентными к данному препарату/классу препаратов. Поэтому если больной ранее уже получал по любому поводу АМП, относящийся к препаратам 1-го ряда для лечения данной патологии, то следует отдавать предпочтение препаратам альтернативного ряда.
К факторам риска инфицирования резистентными штаммами относятся имевшиеся ранее случаи инфицирования/колонизации резистентными возбудителями. Например, у 29 % больных с инфекцией или колонизацией MRSA впоследствии развивались инфекции, вызванные MRSA [24]. Этот риск был выше при выделении MRSA из носовых ходов или костей/суставов (40–50 %), чем при выделении MRSA из дыхательных путей или мягких тканей (20–30 %). Однако следует помнить, что колонизация является необходимым, но не достаточным условием развития инфекционного процесса, и не всегда инфекция обусловлена колонизирующим микроорганизмом. Например, высевание Pseudomonas aeruginosa с кожных покровов не обязательно означает, что именно этот микроорганизм является возбудителем целлюлита.
В настоящее время все чаще встречаются случаи внебольничных инфекций, вызванных патогенами, которые ранее считались типичными возбудителями внутрибольничных инфекций. В первую очередь речь идет о MRSA, который все чаще выделяется у больных без общепризнанных факторов риска инфицирования данным возбудителем [25, 26].
Специфические факторы риска инфицирования госпитализированных больных метициллинорезистентными штаммами S.aureus представлены в табл. 2 [27].

В клинической практике при определении тактики лечения инфекционного заболевания решение о характере АМТ (например, о необходимости парентерального ведения АМП или о возможности назначения АМП с узким спектром активности) принимается, как правило, на основании клинического опыта. Для более объективного принятия решения создаются прогностические шкалы, примером которых может служить шкала CURB-65 для больных с внебольничными пневмониями [28]. Оценка состояния больного по данной шкале позволяет, например, принять аргументированное решение о возможности лечения пациента в амбулаторных условиях и о назначении антибиотикa внутрь. Однако такие шкалы или узконаправленны, т.е. разработаны для конкретного заболевания, или требуют много детальной информации, что затрудняет их практическое использование. Общий подход, требующий минимального количества информации и применимый «у постели больного», может основываться на сочетании синдрома системного воспалительного ответа (ССВО) и клинической оценки состояния больного [29].
Определение синдрома системного воспалительного ответа [29]
Синдром системного воспалительного ответа присутствует при наличии двух и более признаков:
— Температура тела < 36 °С или > 38°C.
— Частота сердечных сокращений > 90 ударов в минуту.
— Частота дыхательных движений > 20 в минуту.
— Количество лейкоцитов <4 × 10 9 или >12 × 109.
Сепсис — признаки инфекции (анамнез и результаты клинических и дополнительных методов исследования) в сочетании с синдромом системного воспалительного ответа.
Если ССВО обусловлен инфекцией, состояние больного предлагается трактовать как сепсис, а наличие критериев сепсиса в сочетании с признаками полиорганной гипоперфузии позволяет говорить о тяжелом сепсисе. Тяжелый сепсис в сочетании с гипотензией (систолическое артериальное давление (АД) < 90 мм рт.ст.) и отсутствием положительного эффекта от адекватной внутривенной инфузионной терапии позволяет диагностировать септический шок. Данный подход позволяет выделять больных с неблагоприятным прогнозом, поскольку при движении по данной шкале от понятия «сепсис» до понятия «септический шок» наблюдается резкое возрастание смертности больных. В сочетании с оценкой общей клинической картины заболевания данный подход также может служить ориентиром в выборе тактики АМТ: допустимо ли назначение больному АМП первого ряда (больной без факторов риска инфицирования резистентной микрофлорой и без признаков тяжелого течения инфекции) или требуется назначение препаратов с расширенным спектром действия, активным в отношении предполагаемого резистентного возбудителя (больной с высоким риском инфицирования резистентной микрофлорой и признаками тяжелого сепсиса) [30].
Пример принятия клинического решения о выборе антимикробной терапии [30, с изменениями]
Женщина 67 лет поступила в стационар с целлюлитом левой нижней конечности на фоне варикозной язвы. В течение предшествующих 5 дней амбулаторно ей проводилась терапия оксациллином по 250 мг 4 раза в сутки внутрь. В анамнезе год назад — указания на колонизацию MRSA во время стационарного лечения по поводу острого холецистита, терапия по поводу колонизации не проводилась. Общих клинических признаков инфекции (озноб и т.д.), а также каких-либо проявлений синдрома системной воспалительной реакции нет.
Вопросы:
1. Какова наиболее вероятная причина неэффективности пероральной антибиотикотерапии у данной больной?
2. Какой стартовый режим антимикробной терапии из ниже перечисленных является оптимальным (все антибиотики вводятся парентерально)?
A. Ванкомицин 1 г каждые 12 часов.
B. Линезолид 600 мг каждые 12 часов.
C. Оксациллин 1 г каждые 6 часов.
D. Клиндамицин 600 мг каждые 6 часов.
E. Цефтриаксон 1 г каждые 24 часа.
Ответы:
1. Возможно несколько причин неэффективности стартовой пероральной антимикробной терапии. Во-первых, возможно нарушение приверженности лечение: больная могла не принимать антибиотик или нарушать режим его приема. Во-вторых, концентрация антибиотика в месте инфекции могла быть слишком низкой, о чем свидетельствует низкая доза оксациллина, рекомендованная больной. В третьих, возможно наличие недиагностированного хронического остеомиелита (при инфекциях кожи и подкожной клетчатки возможно вовлечение нижележащих тканей, которое не всегда диагностируется). И в четвертых, инфекция могла быть вызвана MRSA или другим возбудителем, устойчивым к оксациллину.
2. Хотя MRSA и является одним из возбудителей целлюлита, это заболевание способны вызывать и другие микроорганизмы: метициллин-чувствительный Staphylococcus aureus (MSSA) или Streptococcus pyogenes. С учетом нетяжелого течения инфекции наиболее предпочтительным препаратом для стартовой антимикробной терапии является оксациллин в адекватной дозе, имеющий наиболее узкий спектр антимикробной активности и наибольшую антистафилококковую эффективность из всех вышеперечисленных препаратов. Такой подход позволяет не подвергать больную действию ванкомицина и снизить частоту назначений ванкомицина в данном стационаре, что существенно снижает риск появления ванкомицин-резистентных штаммов энтерококков (VRE). Если же такой режим окажется неэффективным, то целесообразно назначение антибиотика, активного в отношении MRSA (ванкомицин или линезолид).
Существует множество причин неэффективности АМТ, и не всегда таковой является резистентность возбудителя. К наиболее очевидным причинам относятся неинфекционный характер заболевания, т.е. гипердиагностика инфекции или небактериальный ее характер, когда возбудителями являются вирусы, грибы, простейшие или гельминты. Наглядным примером является неэффективность АМТ при остром бронхите вирусной этиологии.
Еще одной распространенной причиной неэффективности АМТ может быть плохая приверженность больного лечению из-за возникновения побочных эффектов (например, тошноты) или вследствие других причин (забывчивость, неорганизованность и т.д.), хотя у больных, находящихся в стационаре и тем более получающих парентеральную АМТ, последняя группа причин менее вероятна.
Другая причина неэффективности АМТ заключается в неправильном выборе антимикробного препарата, не обладающего достаточной активностью в отношении возбудителя (например, ципрофлоксацин для лечения стрептококкового целлюлита). Но даже при выборе препарата с хорошей активностью его концентрация в очаге инфекции может быть слишком низкой, не достигая МПК, в результате неправильного дозирования или плохой пенетрации в очаг воспаления. При пероральном введении антибиотика большую роль играет его биодоступность (т.е. то количество препарата, которое поступает в системный кровоток). Для многих бета-лактамов этот показатель составляет всего 50–70 % [[31]. Например, при назначении флюклоксациллина (см. выше) в дозе 500 мг каждые 6 часов только часть этой дозы попадет в системный кровоток и еще меньшая часть достигнет locus morbi . Для некоторых бета-лактамов (пенициллин, цефалоспорины, ингибиторозащищенные пенициллины, например амоксициллин/клавуланат) для достижения антибактериального эффекта имеет значение время, в течение которого концентрация антибиотика в крови/ткани превышает МПК для данного возбудителя (времязависимая эффективность) [32]. С практической точки зрения это означает, что для достижения эффекта при назначении этих препаратов большее значение имеет правильное соблюдение интервалов между введениями очередных доз, а повышение разовой дозы при несоблюдении интервала дозирования окажется неэффективным. Интервалы между введениями очередных доз этих препаратов определяются особенностями их фармакокинетики, прежде всего периодом полувыведения. Для чувствительных микроорганизмов, т.е. с низкой МПК, эффективны стандартные дозы препаратов (например, дозировка амоксициллина по 500 мг каждые 8 часов будет адекватной для чувствительных к пенициллину пневмококков). Для патогенов со сниженной чувствительностью и, соответственно, большей МПК потребуется назначение более высоких доз антибиотика с меньшим интервалом (например, для лечения инфекций, вызванных пневмококками с низкой и умеренной устойчивостью к пенициллину, амоксициллин следует назначать по 1 г каждые 6 часов). В рутинной клинической практике предсказать уровень устойчивости микроорганизмов на момент начала АМТ крайне затруднительно, и более того, в клиниках при проведении микробиологических исследований уровень МПК, как правило, не определяют. Поэтому целесообразно рутинное применение режимов АМТ с несколько завышенным режимом дозирования, что и предусматривается в большинстве руководств по антимикробной терапии, посколь ку заниженные концентрации АМП, помимо клинических неудач, способствуют селекции резистентности [33]. При тяжелом течении заболевания предлагается вводить меньшие дозы бета-лактамов внутривенно капельно, достигая таким образом более длительного превышения концентрации препарата над МПК по сравнению с прерывистым введением больших разовых доз [34]. Для тейкопланина (времязависимый антибиотик гликопептидного ряда с длительным периодом полувыведения) с целью более быстрого достижения стойких концентраций в плазме/тканях в начале лечения рекомендуется введение с нагрузочной дозы, что особенно важно для боль ных с тяжелым течением заболевания.
Для других антибиотиков (фторхинолоны, аминогликозиды) имеет значение отношение максимальной концентрации препарата (Cmax) к МПК либо отношение площади под фармакокинетической кривой к МПК (AUC24/MIC) [32]. Для этих препаратов разовая доза имеет большее значение, чем интервал введения, поэтому их относят к дозозависимым антибиотикам. Например, суточную дозу гентамицина можно вводить однократно.
Даже при соблюдении режима введения антибиотиков возможна плохая пенетрация их в очаг воспаления. Это может быть связано как с особенностями самого препарата, так и с факторами со стороны пациента. Например, молекулы гликопептидных антибиотиков ванкомицина и тейкопланина крупные, в связи с чем гликопептиды плохо проникают в некоторые ткани, например в легочную [35]. Наоборот, такие препараты как рифампицин или клиндамицин используются в терапии инфекций костей и суставов из-за хорошего проникновения в эти ткани [36]. Факторы со стороны пациента включают в себя патологию периферических сосудов и хронические заболевания мягких тканей — состояния, значительно затрудняющие проникновение антибиотика в очаг воспаления.
Другими причинами неэффективности антимикробной терапии могут быть:
1) полимикробный характер инфекции, когда выбранный режим АМТ не «перекрывает» всех возбудителей;
2) наличие гнойной инфекции, требующей хирургического дренирования;
3) персистирующие очаги инфекции, например очаги костной деструкции при хроническом остеомиелите, требующие хирургической санации.
Частные вопросы резистентности возбудителей инфекций, наиболее распространенных в общеврачебной практике
Инфекции желудочно-кишечного тракта (ЖКТ)
Наиболее частыми возбудителями инфекций ЖКТ являются Campylobacter spp. и Salmonella spp. Инфекции, вызванные кампилобактериями, характеризуются доброкачественным течением с наклонностью к самовыздоровлению и в большинстве случаев даже при госпитализации больного не требуют АМТ. При необходимости антимикробной терапии в случае тяжелого и/или осложненного течения заболевания препаратами выбора являются макролиды (эритромицин, кларитромицин).
Большинство случаев сальмонеллеза также склонно к самоизлечению и не всегда требует АМТ. Salmonella spp., однако, чаще, чем Campylobacter spp., имеют осложненное течение (например, образование абсцессов) и вызывают бактериемию. АМТ целесообразна у больных с тяжелым сепсисом или с высоким риском неблагоприятного исхода (возраст старше 60 лет, тяжелые атеросклеротические поражения сосудов, например аневризма аорты, искусственные клапаны сердца, гипохлоргидрия, воспалительные заболевания кишечника, сахарный диабет, нарушение функции почек, ревматологические заболевания, иммуносупрессия) [37]. Резистентность к ципрофлоксацину двух наиболее распространенных видов Salmonella spp. ( S.enteritidis и S.typhimurium ) в 2000 году была невысока, 11 и 12% соответственно, и ципрофлоксацин по-прежнему остается препаратом выбора при лечении этих инфекций. В то же время чувствительность к цирофлоксацину других видов Salmonella spp., таких как S.virchow и S.hadar , значительно ниже и не превышает 48 и 52 % соответственно [38].
Имеют значение и географические особенности распространения резистентности возбудителей кишечных инфекций. Например, в ряде эндемичных районов стран Ближнего Востока отмечается высокая распространенность резистентных к ципрофлоксацину штаммов S.typhi [39]. Данные особенности не оказывают существенного влияния на характер назначений антимикробных препаратов в странах Европы, и в Украине в частности, но в редких случаях может иметь место «импортированная» резистентность у лиц, приезжающих из регионов с высоким уровнем устойчивости. Выбор АМП, активного в отношении резистентных штаммов возбудителей кишечных инфекций ( Salmonella spp. и др.), может вызывать серьезные затруднения, поэтому при подозрении или подтверждении инфицирования такими штаммами, особенно при генерализованных формах заболевания, требуется консультация клинического микробиолога или инфекциониста.
Инфекции нижних дыхательных путей
Внебольничная пневмония. Продолжается полемика о том, влияет ли резистентность пневмококков к пенициллину на прогноз при пневмококковой внебольничной пневмонии (ВП). В регионах с высокой распространенностью пенициллинустойчивых пневмококков (ПУП) — Северная Америка, страны Средиземноморья, Восточная Европа, развивающиеся страны — в руководствах по лечению ВП в качестве препаратов первой линии для лечения ВП у госпитализированных больных рекомендуются, как правило, фторхинолоны (левофлоксацин, моксифлоксацин) [40–42]. Однако существуют доказательства эффективности высоких доз бета-лактамов (например, амоксициллин в дозе 1 г 3 раза в сутки) в подавляющем большинстве случаев ВП у госпитализированных больных, вызванных ПУП [17–19]. Тем не менее в регионах с высокой распространенностью ПУП при тяжелом течении ВП, обусловливающем госпитализацию в отделение интенсивной терапии, фторхинолоны имеют преимущество — у этой категории больных высока вероятность этиологической значимости пневмококков с высоким уровнем устойчивости в пенициллину и они имеют наибольший риск неблагоприятного исхода при нерациональной АМТ; кроме того, фторхинолоны обладают активностью в отношении атипичных возбудителей, в том числе и в отношении легионелл, которые могут играть этиологическую роль у больных с тяжелым течением ВП, вернувшихся из эндемичных регионов.
Обострения хронического обструктивного заболевания легких (ХОЗЛ). Streptococcus pneumoniae, Haemophilus influenzae и Moraxella catarrhalis являются наиболее значимыми микроорганизмами, ассоциированными с обострениями ХОЗЛ. Наибольшее значение имеет устойчивость к пенициллину у Haemophilus spp. и Moraxella spp. Больным с легким обострением в качестве препарата первого ряда рекомендуется амоксициллин, препараты второго ряда — амокисициллин/клавуланат или фторхинолоны — целесообразно назначать группам больных, у которых имеется высокая вероятность этиологической роли резистентных штаммов респираторных патогенов — тяжелое течение обострения, неудача терапии препаратами первого ряда.
Инфекции кожи и мягких тканей
Большинство внебольничных инфекций кожи и мягких тканей вызывается Streptococcus pyogenes (стрептококк группы А по Lancefield) и метициллин-чувствительным золотистым стафилококком (MSSA). Streptococcus pyogenes сохраняют свою чувствительность к пенициллину — на настоящий момент устойчивых к пенициллину штаммов не выявлено. Высокие дозы флюкоксациллина/оксациллина (1–2 г каждые 6 часов) в монотерапии или в комбинации с бензилпенициллином «перекрывают» оба микроорганизма. Исключением является некротизирующий фасциит, вызываемый Streptococcus pyogenes и/или анаэробами, требующий добавления клиндамицина для преодоления мнимой резистентности, или так называемого эффекта Eagle (установлен Н. Eagle в 1952 г в опытах на мышах) [43]. Данный эффект возникает в стационарную фазу роста Streptococcus pyogenes , когда прекращает функционировать рецептор пенициллинсвязывающего белка (ПСБ) — мишень действия пенициллинов. Клиндамицин же сохраняет свою активность, поскольку его механизм действия не связан с ПСБ, и кроме того, обладает антитоксическим эффектом, что имеет важное клиническое значение при стрептококковых инфекциях. У больных с некротизирующим фасциитом до получения результатов микробиологического исследования целесообразно включение в схему стартовой эмпирической АМТ препаратов, активных в отношении грамотрицательной флоры (например, ципрофлоксацин).
У больных с факторами риска или с подтвержденной колонизацией MRSA гликопептиды или другие препараты, активные в отношении MRSA, должны использоваться только после неэффективности терапии препаратами первого ряда (тот же флюклоксациллин/оксациллин) или у больных с тяжелым течением инфекции. При лечении инфекций кожи и мягких тканей распространенной ошибкой является считать патогенным любой микроорганизм, выделенный из образцов, взятых с кожных покровов или из раны. Например, Staphylococcus aureus (MSSA или MRSA), Pseudomonas aeruginosa (причем некоторые штаммы могут быть устойчивыми к препаратам первого ряда), коли-формы и анаэробы часто выделяются из образцов, взятых с кожных покровов при хронических варикозных язвах нижних конечностей. Если у такого больного отсутствует эритема и другие признаки активной инфекции, то АМТ ему не показана. Если есть локальные признаки целлюлита легкой степени, то целесообразно назначение препаратов с узким спектром активности (флюклоксациллин/оксациллин), и только при генерализации инфекции или при неэффективности терапии препаратами первого ряда показано применение АМП широкого спектра действия — гликопептида или клиндамицина в зависимости от наличия/отсутствия MRSA в сочетании с ципрофлоксацином.
Инфекции мочевыводящих путей
Большинство внебольничных инфекций мочевыводящих путей (ИМП) вызываются грамотрицательными бактериями ( Escherichia coli, Proteus mirabilis и т.д.). В последние годы серьезную проблему представляет рост устойчивости этих возбудителей к традиционно применявшимся АМП, в частности к триметоприм/сульфаметоксазолу (ко-тримоксазол). Имеются локальные географические особенности распространенности резистентных штаммов, что обусловливает в первую очередь тактику применения антибиотиков. Кроме региональных особенностей, риск инфицирования резистентными штаммами существенно выше у больных пожилого возраста (≥ 65 лет), с мочевым катетером, недавним приемом АМП [44]. Поэтому во многих руководствах по лечению инфекций мочевыводящих путей, в том числе у госпитализированных больных, в качестве препаратов первой линии рекомендуются фторхинолоны, цефалоспорины, амоксициллин/клавуланат.
Еще одной проблемой является переоценка значимости асимптомной бактериурии , которая часто встречается, к примеру, у больных пожилого возраста и, соответственно, нерациональный подход к показаниям к АМТ. Асимптомная бактериурия требует во-первых, подтверждения наличия ИМП на основании выявления массивной бактериурии, а при клинических признаках генерализованной инфекции — исключения других возможных локусов [45]. Неосложненные ИМП у женщин лечатся короткими курсами АМП (3-дневный курс ципрофлоксацина), ИМП у мужчин или осложненное течение ИМП, пиелонефрит требуют минимум 7-дневного курса, в случае простатита необходимый минимум достигает 4 недель [3].
Грамположительная бактериемия
Наиболее часто при бактериемии из образцов крови выделяются Staphylococcus aureus, Streptococcus pneumoniae и стрептококки групп А, В и G. Выделение коагулазонегативного стафилококка, являющегося коммесалом кожных покровов, свидетельствует, как правило, о контаминации (загрязнении) образцов крови в результате нарушения правил асептики/антисептики [38]. В ряде случаев на основании результатов микроскопии и микробиологических исследований микробиолог может предоставить клиницисту предварительную информацию о наиболее вероятном возбудителе. Клиницист же может предположить наиболее вероятный источник бактериемии, что в совокупности с микробиологическим заключением позволяет выбрать оптимальную стартовую эмпирическую терапию. Например, выделение грамположительного диплококка из крови больного с синуситом и лихорадкой с большой вероятностью свидетельствует в пользу пневмококковой бактериемии. Поскольку распространенность пенициллинустойчивых штаммов пневмококка невысока, но вероятна, то стартовая антимикробная терапия данного пациента должна включать препарат с антипневмококковой активностью в высоких дозах — бензилпенициллин 1,2 г каждые 4 часа или амоксициллин 1 г каждые 6 часов внутривенно до момента получения результатов о чувствительности возбудителя по данным микробиологических исследований.
Также крайне важно знать условия возникновения бактериемии, т.е. является ли она внебольничной или госпитальной. Бактериемия, развившаяся в сроки после 48 часов поступления в стационар, является госпитальной по определению. Кроме того, бактериемия у больного, недавно выписанного из стационара, скорее всего также является госпитальной. Бактериемия госпитального происхождения чаще вызывается возбудителями, резистентными к препаратам первого ряда: например госпитальная бактериемия довольно часто вызывается MRSA, в то время как внегоспитальная бактериемия Staphylococcus aureus , как правило, вызывается его чувствительными к метициллину штаммами (MSSA).
Как уже говорилось ранее, Streptococcus pyogenes (стрептококк группы А) остается чувствительным к пенициллину, также не отмечается резистентности к пенициллину у стрептококков группы G и очень низкая резистентность (2 %) к пенициллину отмечается у стрептококков группы В [38]. Во всех группах отмечается рост резистентности к макролидам, что при сохранении тенденций роста, может в будущем поставить под сомнение эффективность макролидов, например в лечении пневмококковых респираторных инфекций.
Грамотрицательная бактериемия
Наиболее часто при грамотрицательных бактериемиях выделяется Escherichia coli [38]. В большинстве случаев источником бактериемии служит ИМП, реже интраабдоминальные инфекции, например инфекции желчевыводящих путей или толстого кишечника. Как правило, большинство внебольничных штаммов сохраняют чувствительность к антибиотикам первого ряда, традиционно назначаемых при инфекциях, вызванных грамотрицательной флорой (амоксициллин/клавуланат, цефалоспорины второго/третьего поколений, ципрофлоксацин) [38]. Резистентность к этим антибиотикам других грамотрицательных микроорганизмов, вызывающих внебольничную бактериемию, таких как Proteus spp. и Klebsiella spp., также остается низкой. Возбудители, вызывающие бактериемию госпитального происхождения, за счет выработки бета-лактамаз расширенного спектра имеют высокий уровень устойчивости к бета-лактамам, включая ингибиторозащищенные и цефалоспорины третьего поколения.
С учетом вышеизложенного и с учетом данных о локальной резистентности микроорганизмов больные с внебольничным происхождением грамотрицательной бактериемии или больные с нетяжелой госпитальной бактериемией могут первоначально получать АМТ один из препаратов первого ряда до получения результатов бактериологического исследования. При подозрении на синегнойную инфекцию, с учетом возможной резистентности Pseudomonas spp., а также у больных с тяжелым сепсисом, особенно при госпитальном происхождении, требуется расширение спектра активности стартовой эмпирической АМП или за счет добавления аминогликозидов к препаратам первого ряда или за счет монотерапии препаратом широкого спектра (пиперациллин/тазобактам, карбапенем). В случае же подозрения/подтверждения этиологической роли микроорганизмов — продуцентов бета-лактамаз расширенного препаратом выбора является карбапенем, но не пиперациллин/тазобактам и не цефтазидим.
Менингит
В последние годы отмечается медленный, но постоянный рост МПК пенициллина для менингококков (в Великобритании частота выделения менингококков с МПК > 0,1 мг/л возросла с < 1 % в 1984 г. до 18 % в 2000 г.) [38], хотя существенного клинического значения этот факт пока еще не имеет. Поскольку пенициллин и другие бета-лактамы (например, цефалоспорины) плохо проникают через гематоэнцефалический барьер, их концентрация в спинномозговой жидкости гораздо ниже, чем в других тканях, например в легких. Поэтому даже относительно небольшой рост МПК для менингококков (и пневмококков) может приводит к клинической неудаче [46]. Но поскольку менингококки остаются высокочувствительными к цефалоспоринам третьего поколения (цефотаксим, цефтриаксон), то именно эти препараты рекомендованы в качестве препаратов первого ряда для лечения менингитов у взрослых в большинстве руководств [47]. Однако для ПУП цефалоспорины не являются препаратами выбора, так как наряду с ростом МПК пенициллина может отмечаться и рост МПК цефалоспоринов. В противоположность пневмококковой пневмонии, когда повышение доз бета-лактамов способно преодолевать устойчивость пневмококков к пенициллину за счет высокой концентрации препарата в легких, при пенициллинустойчивых пневмококковых менингитах низкие концентрации антибиотика в спинномозговой жидкости не всегда способны достигать значений, необходимых для эрадикации возбудителя. Поэтому у больных пневмококковым менингитом при наличии факторов риска инфицирования ПУП или подтверждении роли этого возбудителя необходимо добавление ванкомицина к препаратам первого ряда. Альтернативой ванкомицину, по мнению некоторых экспертов в области инфекционных заболеваний, может служить рифампицин.
1. Abboud F.M., Wiasbren B.A. // Arch. Intern. Med. — 1959. — 104. — 226-33.
2. World Health Organisation. Overcoming antimicrobial resistance. World health report on infectious diseases 2000. http://www.who.int/infectious-disease-report/2000/index-rpt2000_text.html
3. Standing Medical Advisory Committee Sub-Group on Antimicrobial Resistance // The path of least resistance. London: Department of Health, 1998.
4. Wenzel R.P. // NEJM. — 2004. — 351. — 523-24.
5. Kollef M.H., Fraser V.J. // Ann. Intern. Med. — 2001. —134. — 298-314.
6. Cosgrove S.E., Carmelli Y. // Clin. Infect. Dis. — 2003. — 36. — 1433-7.
7. Travers K., Barza M. // Clin. Infect. Dis. — 2002. — 34. —S131-4.
8. Goldmann D.A. et al. // JAMA. — 1996. — 275. — 234-40.
9. Kollef M.H., Ward S. // Chest. — 1998. — 113. — 412-20.
10. Luna C.M. et al. // Chest. — 1997. — 111. — 676-85.
11. Alvarez-Lerma F. // Intensive Care Med. — 1996. — 22. — 387-94.
12. Rello J. et al. // Am. J. Respir. Crit. Care Med. — 1997. — 156. — 196-200.
13. Archer G.L. // Clin. Infect. Dis. — 1998. — 26. — 1179-81.
14. Tarkowski A., Wagner H. // Mol. Med. Today. — 1998. — 4. — 15-8.
15. Rello J. et al. // Am. J. Respir. Crit Care Med. — 1994. — 150. — 1545-9.
16. Van Delden C., Iglewski B.H. // Emerg. Infect. Dis. — 1998. — 4. — 551-60.
17. Pallares R. et al. // NEJM. — 1995. — 333. — 474-80.
18. Ewig S. et al. // Am. J. Respir. Crit. Care Med. — 1999. — 159. — 1835-42.
19. Aspa J., Rajas O., Rodríguez de Castro F., on behalf of the Pneumococcal Pneumonia in Spain Study Group et al. // Clin. Infect. Dis. — 2004. — 38. — 787-98.
20. Singer M.E. et al. // J. Antimicrob. Chemother. — 2003. — 51. — 1269-82.
21. Steinke D.T. et al. // J. Antimicrob. Chemother. — 2001. — 47. — 781-7.
22. Seaton R.A. et al. // J. Antimicrob. Chemother. — 2000. — 46. — 307-9.
23. Safdar N., Maki D.G. // Ann. Intern. Med. — 2002. — 136. — 834-44.
24.Huang S.S., Platt R. // Clin. Infect. Dis. — 2003. — 36. — 281-5.
25. Said-Salim B. et al // Infect. Control. Hosp. Epidemiol. — 2003. — 24. — 451-5.
26. Eady E.A., Cove J.H. // Curr. Opin. Infect. Dis. — 2003. — 16. — 103-24.
27. Solomkin J.S. et al. // Am. J. Surg. — 2004. — 187. — 134-45.
28. Lim W.S. et al. // Thorax. — 2003. — 58. — 377-82.
29. Nyström P.-O. // J. Antimicrob. Chemother. — 1998. — 41 (suppl A). — 1-7.
30. Barlow G., Nathwani D. // Postgrad. Med. J. — 2005. — 81. — 680-692.
31. Barlow G., Nathwani D. // Curr. Opin. Infect. Dis. — 2000. — 13. — 599-607.
32. Drusano G.L. Pharmacodynamics of anti-infectives: target delineation and target attainment // Finch R.G., Greenwood D., Norrby S.R. et al, eds. Antibiotic and chemotherapy: anti-infective agents and their use in therapy. 8th ed. — London: Churchill Livingstone, 2003.
33. Guillemont D., Carbon C., Balkau B. et al. // JAMA. — 1998. — 279. — 365-70.
34. Servais H., Tulkens P.M. // Antimicrob. Agents Chemother. — 2001. — 45. — 2643-7.
35. Pfeiffer R.R. // Rev. Infect. Dis. — 1981. —3 (suppl). — S205-9.
36. Berendt T., Byren I. // Clin. Med. — 2004. —4. — 510-18.
37. Farthing M., Feldman R., Finch R. et al. // J. Infect. — 1996. — 33. — 143-52.
38. Communicable Disease Surveillance Centre. Antimicrobial resistance in England and Wales 2000. Public Health Laboratory Service. http://www.hpa.org.uk/infections/topics_az/antimicrobial_resistance/amr.pdf
39. Lamb V.A. et al. // J. Clin. Microbiol. — 1984. — 20. — 1076-9.
40. American Thoracic Society. Guidelines for the management of adults with community-acquired pneumonia // Am. J. Respir. Crit. Care Med. — 2001. — 163. — 1730-54.
41. Mandell L.A., Marrie T.J., Grossman R.F. and the Canadian Community-Acquired Pneumonia Working Group et al. Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society. The Canadian Community-Acquired Pneumonia Working Group // Clin. Infect. Dis. — 2000. — 31. — 383-421.
42. Bartlett J.G. et al. // Clin. Infect. Dis. — 2000. — 31. — 347-82.
43. Eagle H. // Am. J. Med. — 1952. — 13. — 389-99.
44. Wright S.W. et al. // Am. J. Emerg. Med. — 2000. — 18. — 143-6.
45. Nicolle L., on behalf of the SHEA Long Term Care Committee. Urinary tract infections in long-term-care facilities. // Infect. Control. Hosp. Epidemiol. 2001. — 22. — 167-75.
46. John C.C. // Clin. Infect. Dis. — 1994. — 18. — 188-93.
47. Begg N., Cartwright K.A.V., Cohen J. et al. // J. Infect. — 1999. — 39. — 1-15.
