Газета «Новости медицины и фармации» Антимикробная терапия (223) 2007 (тематический номер)
Вернуться к номеру
Антимикробная резистентность Streptococcus pneumoniae в России в 1999–2005 гг.: результаты многоцентровых проспективных исследований ПеГАС-I и ПеГАС-II
Авторы: Р.С. КОЗЛОВ, О.В. СИВАЯ, К.В. ШПЫНЕВ, О.И. КРЕЧИКОВА, И.В. ГУДКОВ, Л.С. СТРАЧУНСКИЙ, НИИ антимикробной химиотерапии, Смоленск; Е.Д. АГАПОВА, Областная детская клиническая больница, Иркутск; С.М. РОЗАНОВА, Городской центр лабораторной диагностики болезней матери и ребенка, Екатеринбург; Н.М. ФУРЛЕТОВА, Городская клиническая больница № 23 им. «МедСанТруд», Москва; Л.В. ГУДКОВА, Областная клиническая больница, г. Томск; Е.Н. ГУГУЦИДЗЕ, Центральная клиническая больница Управления делами Президента РФ, Москва; Р.Р. ЕГОРОВА, Республиканская больница № 1, Якутск; В.Н. ИЛЬИНА, Областная клиническая больница, Новосибирск; Л.К. КАТОСОВА, Научный центр здоровья детей РАМН, Москва; Ф.К. МАНЕРОВ, Детская клиническая больница № 4, Новокузнецк; Н.Е. МАРУСИНА, Детская республиканская клиническая больница, Казань; И.Г. МУЛТЫХ, Краевой диагностический центр, Краснодар; Г.И. НЕХАЕВА, Городская клиническая больница № 10 «Электроника», Воронеж; Н.М. НУРТДИНОВА, Детская республиканская клиническая больница, Уфа; Е.А. ОРТЕНБЕРГ, кафедра клинической фармакологии, Тюмень; Ш.Х. ПАЛЮТИН, Клиническая инфекционная больница №1, Ярославль; И.В. СМИРНОВ, Государственный медицинский университет им. академика И.П. Павлова, кафедра микробиологии, Рязань; Е.В. ЩЕТИНИН, кафедра клинической фармакологии Ставропольской государственной медицинской академии, Ставрополь; С.М. ШТУРМИНА, Городской ЦСЭН, Ковров; Г.Я. ЦЕНЕВА, НИИЭМ им. Л. Пастера, Санкт-Петербург
Версия для печати
Введение
Streptococcus pneumoniae является одним из основных возбудителей внебольничной пневмонии, обострений хронического бронхита, острого среднего отита, острого синусита. В России, по данным официальной статистики, ежегодно регистрируется около 400 тыс. случаев пневмонии, хотя их предполагаемое число превышает 1,5 млн. При этом пневмококк является основным среди бактериальных возбудителей [1]. Также он является причиной около трети случаев острого среднего отита [2]. Помимо вышеперечисленных заболеваний, S.pneumoniae может вызывать менингит, бактериемию, первичный перитонит. Пневмококковые менингиты занимают ведущее место в структуре бактериальных менингитов неменингококковой этиологии [3].
Отмечаемый во многих странах рост резистентности S.pneumoniae к антимикробным препаратам оказывает влияние на выбор лекарственных средств для эмпирической терапии. Для создания и оптимизации эмпирической терапии пневмококковых инфекций требуются достоверные региональные и локальные данные о резистентности возбудителя, которые могут быть получены путем мониторинга резистентности клинических штаммов S.pneumoniae, выделенных в различных регионах России.
Исследование чувствительности пневмококков, относящихся к «привередливым» микроорганизмам, является трудоемким и дорогостоящим процессом, требующим особых питательных сред и реагентов. В связи с этим рациональным подходом является проведение проспективных многоцентровых микробиологических исследований с централизованным определением чувствительности выделенных микроорганизмов в референтной лаборатории. Для обеспечения возможности сравнивать получаемые данные с результатами международных исследований критически важным является использование общепринятых рекомендаций и критериев интерпретации результатов, и в частности метода микроразведения в бульоне и критериев Института клинических и лабораторных стандартов / Национального комитета по клиническим лабораторным стандартам (Clinical and Laboratory Standards Institute / National Committee for Clinical Laboratory Standards — CLSI/NCCLS).
Целью данного исследования явилось изучение уровня, структуры и фенотипов резистентности S.pneumoniae к антимикробным препаратам в различных регионах России и оценка их динамики в период с 1999 по 2005 г.
Материалы и методы
ПеГАС-I (фаза А (1999–2000 гг.), фаза Б (2001–2003 гг.)) и ПеГАС-II (2004–2005 гг.) яв ляются проспективными многоцен тровыми микробиологическими исследован иями. В 1999–2003 гг. в ПеГАС-I, фаза А, и ПеГАС-I, фаза Б, принимали участие 27 центров (рис. 1А) Центрального (Москва — 6 центров, Ковров, Рязань, Смоленск, Ярославль), Северо-западного (Санкт-Петербург — 3 ц ентра), Южного (Краснодар, Ставрополь), Приволжского (Казань, Нижний Новгород — 2 центра, Уфа), Уральского (Екатеринбург, Тюмень, Челябинск), Сибирского (Иркутск, Новокузнецк, Новосибирск, Томск) и Дальневосточного (Якутск) федеральных округов России. В 2004–2005 гг. в исследовании участвовали 20 центров (рис. 1 б ) Централь ного (Москва — 4 центра, Воронеж, Смол енск, Ярославль), Северо-западного (Вологда), Южного (Краснодар), Приволжского (Казань, Пенза), Уральского (Екатеринбург — 2 центра), Сибирского (Иркутск, Новокузнецк, Новосибирск, Томск — 2 центра) и Дальневосточного (Хабаровск, Якутск) федеральных округов России.
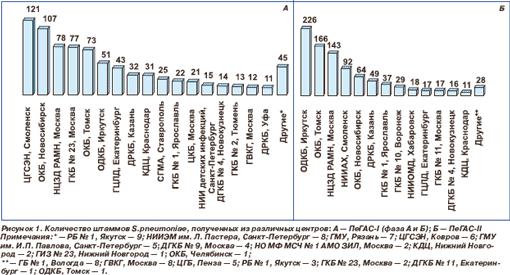
В каждом из центров проводился отбор последовательных клинически значимых штаммов пневмококков, выделенных от пациентов с инфекциями различной локализации.
Центры-участники были обеспечены Колумбийским агаром (bioMerieux, Франция), дисками с оптохином (bioMerieux, Франция) для предварительной идентификации микроорганизмов и транспортной средой (модифицированная среда Дорсэ, НИИ антимикробной химиотерапии СГМА, Смоленск) для пересылки штаммов в центральную микробиологическую лабораторию.
В центральной лаборатории (НИИ антимикробной химиотерапии СГМА) для субкультивирования S.pneumoniae использовали Колумбийский агар (bioMerieux, Франция) c добавлением 5% дефибринированной лошадиной крови. Инкубация проводилась в атмосфере с повышенным содержанием СО2 (3–7 %) при температуре 35 ºС в течение 24 ч. Реидентификация пневмококков осуществлялась на основе морфологии колоний на кровяном агаре, наличия α-гемолиза, чувствительности к оптохину, лизиса в присутствии солей желчных кислот c 10% раствором дезоксихолата натрия (Sigma, США) и/или положительных результатов латекс-агглютинации с использованием набора Slidex Pneumo-Kit (bioMerieux, Франция).
После реидентификации штаммы хранили в пробирках с триптиказо-соевым бульоном (bioMerieux, Франция) с добавлением 10% стерильного глицерина (Sigma, США) при температуре –70 ºС.
В соответствии с рекомендациями CLSI/NCCLS исследование чувствительности S.pneumoniae с определением минимальных подавляющих концентраций (МПК) проводили методом микроразведения в катионсбалансированном бульоне Мюллера — Хинтон (Becton Dickinson, США) с добавлением лизированной лошадиной крови в итоговой концентрации 5 %. Определялась чувствительность микроорганизмов к 16 антимикробным препаратам: пенициллин (Sigma, Германия), амоксициллин (Sigma, Германия), амоксициллин / клавуланат (GlaxoSmithKline, Великобритания), цефтриаксон / цефотаксим (Aventis Pharma, Франция), эритромицин (Sigma, Германия), азитромицин (Pliva, Хорватия), кларитромицин (KRKA, Словения), мидекамицина ацетат (KRKA, Словения), спирамицин (Rhоne-Poulenc Rorer, Франция), клиндамицин (Sigma, Германия), левофлоксацин (Aventis Pharma, Франция), моксифлоксацин (Bayer, Германия), тетрациклин (Sigma, Германия), хлорамфеникол (Fluka, Германия), ко-тримоксазол (Sigma, Германия), ванкомицин (Eli Lilly, США). При тестировании использовали двойные серийные разведения химически чистых субстанций антибиотиков в микротитровальных планшетах («Медполимер», Санкт-Петербург). Из чистой суточной культуры готовили бактериальную суспензию, соответствующую по мутности 0,5 по Мак-Фарланду. Суспензию вносили в лунки микротитровальных планшетов с помощью многоканальных пипеток (Dynatech, Германия). После этого планшеты инкубировали при температуре 35 ºС в течение 20–24 ч в обычных атмосферных условиях.
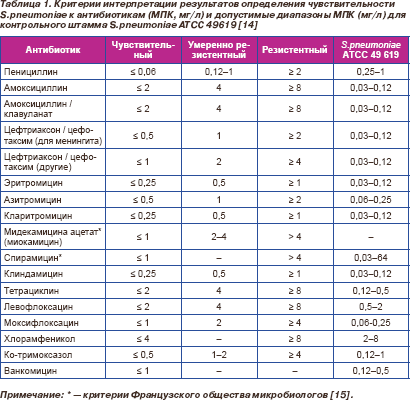
Интерпретацию результатов и контроль качества с использованием контрольного штамма S.pneumoniae ATCC 49 619 проводили при каждом определении чувствительности в соответствии со стандартами CLSI/NCCLS 2004 г. Критерии интерпретации результатов и допустимые значения МПК для контрольного штамма представлены в табл. 1. При интерпретации результатов определения чувствительности к цефтриаксону / цефотаксиму пневмококков, выделенных из спинномозговой жидкости, использовались критерии для менингита.
Ввод, статистическую обработку и анализ данных производили с помощью компьютерных программ Microsoft® Office Excel 2003, SAS — версия 6.12 (SAS Institute, США) и M-Lab (НИИАХ, Смоленск).
Категория «нечувствительные» объеди няла штаммы, обладавшие умеренным и высоким уровнем резистентности. К полирезистентным относили штаммы, устойчивые к 3 и более классам антимикробных препаратов.
Для сравнения уровней резистентности в периоды 1999–2003 гг. и 2004–2005 гг., а также между отдельными федеральными округами использовались критерий χ2 и точный двусторонний критерий Фишера. Достоверными считались различия при p < 0,05.
Результаты
В исследование включено 1704 штамма S.pneumoniae, полученных в период с 1999 по 2005 г.: 791 штамм в 1999–2003 гг. (ПеГАС-I, фаза А — 210, фаза Б — 581) и 913 штаммов в 2004–2005 гг.
Структура клинического материала, из которого были выделены исследованные штаммы S.pneumoniae в рамках исследований ПеГАС-I (фазы А и Б) и ПеГАС-II, представлена на рис. 2. Большинство пневмококков в исследованиях ПеГАС-I и ПеГАС-II были выделены из респираторных образцов (мокрота, жидкость, полученная при бронхоальвеолярном и эндотрахеальном лаваже, аспират синуса, отделяемое среднего уха): 87,4 и 86,7 % соответственно. Из стерильных в норме локусов (спинномозговая жидкость, кровь) в исследованиях ПеГАС-I и ПеГАС-II было выделено соответственно 5,7 и 2,9 % изолятов.

Чувствительность к антимикробным препаратам
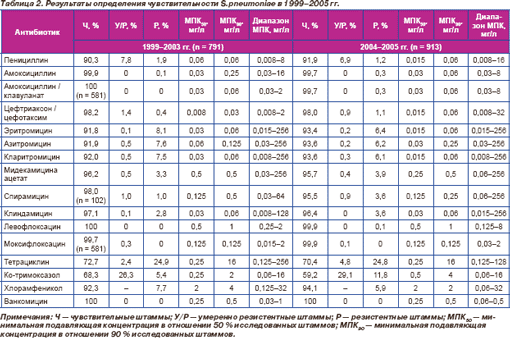
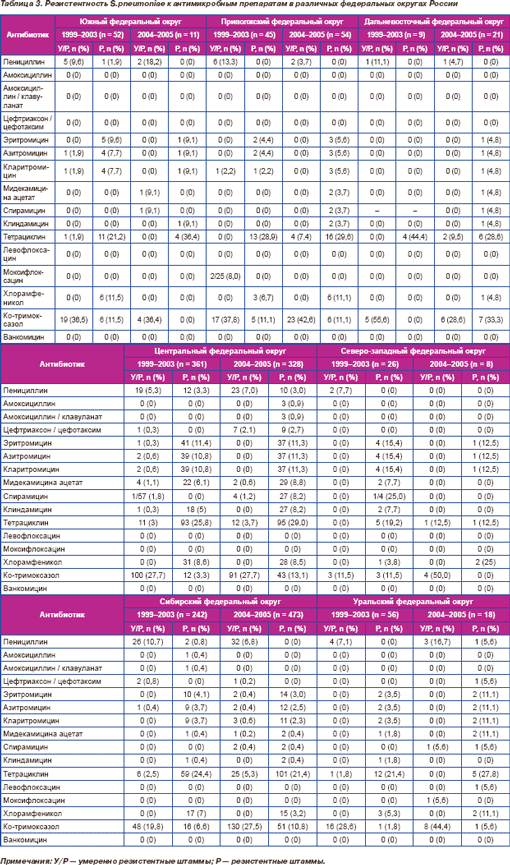
Обобщенные результаты определения чувствительности S.pneumoniae представлены в табл. 2. Резистентность к антимикробным препаратам в различных федеральных округах представлена в табл. 3.
β-лактамы
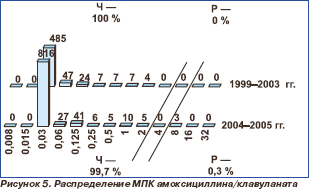
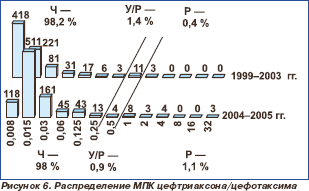
Распределение пневмококков по значениям МПК пенициллинов и цефтриаксона / цефотаксима представлено на рис. 3–6.
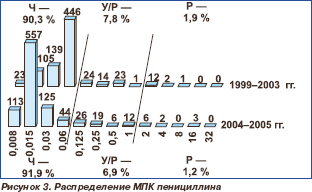

В рамках отчетного периода (1999–2005 гг.) уровень нечувствительности пневмококков к пенициллину оставался относительно стабильным: 8,1–9,7 %, МПК90 остальных штаммов не превышала 0,06 мг/л и находилась в чувствительном диапазоне.
Уровень резистентности к аминопенициллинам (амоксициллин, амоксициллин/клавуланат) сохранялся на стабильно низком уровне и не превышал 0,3 %. В 2004–2005 гг. в Центральном федеральном округе выделено 3 штамма с высоким уровнем резистентности, при этом в других регионах нечувствительные к аминопенициллинам пневмококки отсутствовали.
За указанный период активность цефтриаксона / цефотаксима в отношении всех исследованных штаммов сохранялась на высоком уровне (98,2 % в 1999–2003 гг. и 98,0 % в 2004–2005 гг.). МПК90 в 1999–2003 гг. составила 0,03 мг/л, в 2004–2005 гг. — 0,06 мг/л. Обращает на себя внимание появление штаммов пневмококка с высоким уровнем резистентности к цефтриаксону / цефотаксиму. Если в 1999–2003 гг. нечувствительные к цефтриаксону / цефотаксиму пневмококки были представлены штаммами с невысоким уровнем резистентности (МПК 1–2 мг/л), то в 2004–2005 гг. отмечено появление штаммов с МПК 4 и 32 мг/л. Однако различия в уровне нечувствительности были статистически недостоверны (р = 0,9).
При оценке тенденций изменения чувствительности пневмококков внутри отдельных федеральных округов выявлено, что в Сибирском федеральном округе резистентность к пенициллину достоверно снизилась, составив 11,5 % в 1999–2003 гг. и 6,8 % в 2004–2005 гг. (р = 0,028). В 2004–2005 гг. по сравнению с 1 999–2003 гг. в Центральном федеральном округе произошло статистически достоверное повышение резистентности к цефтриаксону, данные показатели составили 0,3 и 4,8 %, соответственно (р = 0,0001).
Макролиды
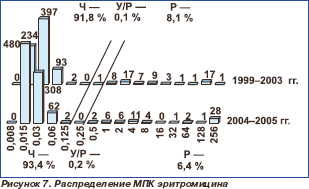
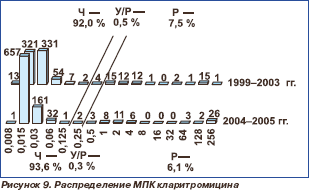
Распределение пневмококков по значениям МПК макролидов представлено на рис. 7–11. В настоящее время все макролиды сохраняют высокую активность в отношении S.pneumoniae. В 1999–2003 гг. нечувствительными к эритромицину были 8,2 % штаммов, к азитромицину 8,1 % и к кларитромицину 8,0 %. Отмечена некоторая тенденция к снижению этих показателей в 2004–2005 гг., когда соответствующие величины составили 6,6, 6,4 и 6,4 %, однако различия между двумя периодами были ста тистически недостоверными (р = 0,227; р = 0,195; р = 0,195). Следует отметить, что значения МПК90 эритромицина и кларитромицина в течение всего исследуемого пе риода оставались стабильными (0,06 мг/л), в то время как МПК90 азитромицина увеличилась с 0,125 мг/л в 1999–2003 гг. до 0,25 мг/л в 2004–2005 гг.
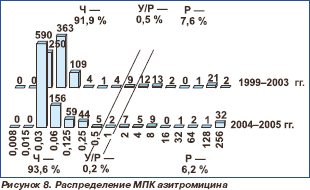
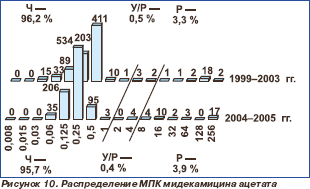
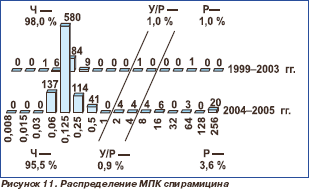
Активность 16-членных макролидов мидекамицина ацетата и спирамицина в отношении протестированных пневмококков сохранялась на высоком уровне. Отмечено статистически незначимое снижение чувствительности к мидекамицина ацетату с 96,2 % в 1999–2003 гг. до 95,7 % в 2004– 2005 гг. (р = 0,617) и к спирамицину с 98,0 % в 1999–2003 гг. до 95,5 % в 2004–2005 гг. (р = 0,305). Нечувствительные к макролидам штаммы были наиболее распространены (более 10 %) в Центральном федеральном округе.
Линкозамиды
Клиндамицин с 1999 по 2005 г. сохранял высокую активность в отношении всех иссле дованных штаммов пневмококков (табл. 2, рис. 12). Чувствительные штаммы составили 97,1 % в 1999–2003 гг. и 96,4 % в 2004–2005 гг. Показатели МПК50 и МПК90 в период с 1999 по 2005 г. не претерпели изменений, составив соответственно 0,03 и 0,06 мг/л.
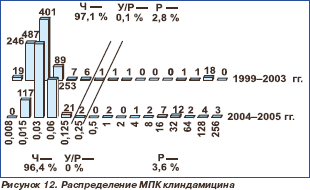
Фторхинолоны
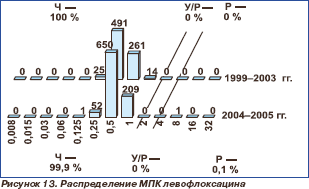
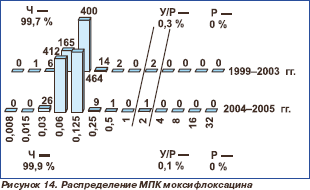
Все исследованные пневмококки в 1999–2003 гг. были чувствительны к левофлоксацину независимо от резистентности к другим классам препаратов (табл. 2, рис. 13) с МПК50 0,5 мг/л и МПК90 1 мг/л. В 2004–2005 гг. в Уральском федеральном округе был выделен один штамм S.pneumoniae с МПК левофлоксацина 8 мг/л. В 1999–2003 гг. в Приволжском федеральном округе получено 2 (0,3 %) штамма с умеренной резистентностью к моксифлоксацину (рис. 14). МПК50 и МПК90 моксифлоксацина составили 0,125 мг/л. В 2004–2005 гг. в Уральском федеральном округе получен 1 (0,1 %) штамм с умеренной резистентностью к мокси- флоксацину. МПК50 и МПК90 не претерпели изменений в сравнении с предыдущими периодами.
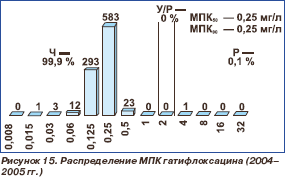
В 2004–2005 гг. у 913 штаммов пневмококков определялась также чувствитель ность к гатифлоксацину (рис. 15). Гати флоксацин проявлял высокую активность (99,9 %) в отношении исследованных пневмококков. МПК 50 и МПК 90 гатифлоксацина были равны 0,25 мг/л.
Тетрациклин
К тетрациклину были нечувствительны 27,3 % пневмококков в 1999–2003 гг. и 29,6 % в 2004–2005 гг., при этом нарастание доли нечувствительных штаммов обусловлено распространением пневмококков с низким уровнем резистентности (МПК 4 мг/л), доля которых в указанные периоды составила 2,4 и 4,8 % соответственно (табл. 2). Величины МПК50 (0,25 мг/л) и МПК90 (16 мг/л) не изменились в 1999–2005 гг.
Ко-тримоксазол
В 2004–2005 гг. отмечены статисти че ски достоверный рост нечувствительности к триметоприму/сульфаметоксазолу (40,8 %) по сравнению с 1999–2003 гг. (31,7 %) (р < 0,0001), а также увеличение показателей МПК50 (0,5 и 0,25 мг/л соответственно) и МПК90 (4 и 2 мг/л соответственно). В Центральном федеральном округе за период исследования произошло достоверное увеличение резистентности пневмококков к ко-тримоксазолу. В 1999–2003 гг. этот показатель составил 31 %, а в 2004–2005 гг. 40,8 % (р = 0,007). Аналогично в Сибирском федеральном округе резистентность к данному препарату увеличилась с 26,4 % в 1999–2003 гг. до 38,3 % в 2004–2005 гг. (р = 0,002).
Хлорамфеникол
Анализ данных об устойчивости пневмо кокков к хлорамфениколу показал некоторое уменьшение устойчивости в 2004–2005 гг. (5,9 %) в сравнении с 1999–2003 гг. (7,7 %), однако эти изменения являются статистически недостоверными (р = 0,140).
Сравнение резистентности к хлорамфениколу в отдельных федеральных округах позволило установить, что статистически достоверным было снижение распространенности нечувствительных штаммов S.pneumoniae в Сибирском федеральном округе (с 7 % в 1999–2003 гг. до 3,2 % в 2004–2005 гг., р = 0,018) при отсутствии достоверных изменений в других округах.
Другие препараты
Ванкомицин на протяжении 1999–2005 гг. был активен в отношении 100 % исследованных штаммов независимо от наличия или особенностей механизмов резистентности к β-лактамным антибиотикам, 14,15, 16-членным макролидам, линкозамидам или фторхинолонам.
Полирезистентность
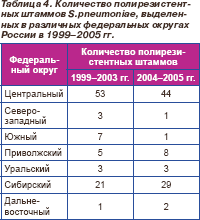
Из всех исследованных пневмококков в 1999–2003 гг. 93 (11,8 %) и в 2004–2005 гг. 88 (9,6 %) штаммов обладали полирезистентностью (устойчивостью к 3 и более классам антибиотиков). Различия в уровне полирезистентности за два периода были статистически недостоверны (р = 0,23). Большинство штаммов в каждый из периодов были выделены из респираторных источников: 87 (93,5 %) и 81 (92,0 %) соответственно. Среди полирезистентных штаммов в 1999–2003 гг. 1 (1,1 %) пневмококк был нечувствительным к амоксициллину, 13 (14,0 %) — к цефтриаксону, а в 2004–2005 гг. таких изолятов было 3 (3,4 %) и 18 (20,5 %) соответственно. Все полирезистентные штаммы сохраняли 100% чувствительность к левофлоксацину, моксифлоксацину и ванкомицину.
Количество полирезистентных пневмококков, выделенных в различных регионах страны в 1999–2005 гг., представлено в табл. 4.
Обсуждение
Постоянное изменение показателей резистентности штаммов S.pneumoniae к антимикробным препаратам под влиянием различных факторов, в том числе и антимикробных средств, делает крайне необходимым мониторинг антибиотикорезистентности данного возбудителя. Проведенные многоцентровые микробиологические исследования ПеГАС-I и ПеГАС-II позволили получить достоверные и сопоставимые данные о чувствительности S.pneumoniae к антимикробным препаратам в различных регионах России.
Поскольку β-лактамные антибиотики в течение многих десятилетий составляют основу терапии пневмококковых инфекций, изменение уровня резистентности к ним оказывает существенное влияние на алгоритмы эмпирической терапии. Данные об устойчивости к β-лактамам в различных регионах мира существенно варьируют. Наравне со странами с высоким уровнем резистентности к пенициллину (США — 34,2 % [4], Венгрия — 60 % [5], Хорватия — 54 %, Румыния — 52 %, Болгария — 49 % [6], Франция — 47,6 %, Испания — 61,9 % [7], Израиль — 35 % [8]) есть государства, где доля пенициллинорезистентных S.pneumoniae по-прежнему остается сравнительно низкой (Австрия — 4,4 %, Германия — 6,0 % [7], Финляндия — 4 %, Швеция — 3 %, Нидерланды — 1 %, Великобритания — 6,7 % [9, 10]). Основываясь на данных исследования 2004–2005 гг. и учитывая относительно невысокий уровень устойчивости (8,1 %), следует сказать, что пенициллин сохраняет свое значение для эмпирической терапии пневмококковых инфекций.
Высокий уровень активности аминопенициллинов (99,7 %), ингибиторозащищенных аминопенициллинов, а также фармакокинетические особенности данных препаратов следует учитывать при выборе терапии нетяжелых инфекций дыхательных путей.
р в 2004–2005 гг.). Эти данные подтверждаются и международным исследованием Alexander Project 1999–2000 гг., в котором соответствующий показатель был равен 98,8 % [11]. В большинстве стран Европы и США уровень устойчивости к цефтриаксону не превышает 6 %, за исключением Франции (12,4 %) и Ирландии (16,7 %). Высокая резистентность к цефтриаксону отмечена в Гонконге (34,2 %) [11].
С учетом особенностей фармакокинетических и фармакодинамических показателей, а также уникального профиля безопасности макролидов препараты этой группы традиционно широко используются для терапии пневмококковых инфекций различной локализации. В последние несколько десятилетий во всем мире наблюдается т енденция роста устойчивости пневмококков к макролидам. Распространенность макролидорезистентных пневмококков в США со ставляет 29,5 % [4], а в некоторых е вропейских странах этот показатель достаточно высок (Франция — 46,1 %, Испания — 43,6 %, Италия — 35,5 %), в то время как в других остается на относительно невысоком уров не (Австрия — 10,0 %, Германия — 10,6 %, Португалия — 10,3 %) [7]. В странах Азии резистентность высока и в среднем составляет око ло 60 % (наиболее высокие показатели во Вьетнаме — 88,3 %, Тайване — 87,2 %, Корее — 85,1 %) [12]. В настоящее время в России проблема макролидорезистентности не является чересчур актуальной, поскольку уровень нечувствительности не превышает 6,6 % для 14-,15-членных макролидов и 4,4 % для 16-членных макролидов ( мидекамицина ацетата). Однако, учитывая растущий объем потребления макролидов с длительным периодом полувыведения — кларитромицина и азитромицина, можно предположить возможный рост резистентности пневмококков в будущем.
Сохраняют высокую активность в отношении пневмококков и линкозамиды, уровень чувствительности к которым был не менее 96,4 %.
Обращает на себя внимание изменение структуры субпопуляции нечувствительных к макролидам штаммов. За период наблюдения произошло изменение ее структуры в сторону преобладания штаммов с высоким уровнем резистентности. В 1999–2003 гг. нечувствительные к эритромицину изоляты были представлены главным образом (69,2 %) пневмококками с невысоким уровнем резистентности (МПК < 32 мг/л). Эти изоляты, вероятно, несут ген mefA, кодирующий механизм резистентности, реализуемый через эффлюкс антибиотика. Данный механизм не обеспечивает устойчивость к 16-членным макролидам и линкозамидам. В 2004–2005 гг. среди нечувствительных к эритромицину пневмококков стали преобладать (52,5 %) штаммы с высоким уровнем резистентности (МПК ≥ 32 мг/л), реализуемым через метилирование рибосом (ген erm) или обусловленным мутацией рибосомальных белков L4, L16, L22 или 23S рРНК. Штаммы, несущие ген erm, сохраняют резистентность как к 14 и 15-членным, так и к 16-членным макролидам, а также линкозамидам, тогда как штаммы, резистентность которых обусловлена мутацией рибосомальных белков, при высокой устойчивости ко всем макролидам сохраняют чувствительность к линкозамидам. Указанным изменением структуры нечувствительной субпопуляции, вероятно, обусловлено нарастание резистентности к мидекамицина ацетату и клиндамицину в 2004–2005 гг., несмотря на тенденцию к снижению общей доли пневмококков, нечувствительных к макролидам.
В 1999–2003 гг. все полученные в России штаммы S.pneumoniae были чувствительны к левофлоксацину, независимо от резистентности к другим классам препаратов. В 2004–2005 гг. в Уральском федеральном округе выделен один штамм, резистентный к левофлоксацину, и один штамм, обладаю щий умеренной резистентностью к мокси флоксацину.
Наибольшую тревогу вызывает высокая резистентность S.pneumoniae в России к тетрациклину и ко-тримоксазолу. Общий уровень нечувствительности к тетрациклину составил 27,3 % в 1999–2003 гг. и 29,6 % в 2004–2005 гг. Относительно высок уровень резистентности к этому препарату в США (16,2 %) [4], в странах Ев ропы (в среднем 25,2 %) [7] и очень велик в странах Азии — 81,6 % [13]. В 2004–2005 гг. в России отмечено нарастание уровня не чувствительности к ко-тримоксазолу (40,8 %) по сравнению с 1999–2003 гг. (31,7 %) (р < 0,0001). Данные значения соответствуют уровню устойчивости к ко-тримоксазолу в Европе в 2001–2003 гг. (33,4 %) [7]. Полученные данные свидетельствуют о необходимости ограничения использования тетрациклинов и ко-тримоксазола при эмпирической терапии пневмококковых инфекций.
С 2005 г. в центральной лаборатории НИИ антимикробной химиотерапии СГМА (Смоленск) определяется чувствительность к антибиотикам клинически значимых штаммов пневмококков, выделенных от пациентов с инфекциями различной локализации в Украине. Ко времени написания работы протестировано 19 штаммов пневмококков, поступивших из центров в Днепропетровске и Киеве. Тенденции антибиотикочувствительности пневмококков в Украине в целом не отличаются от таковых в России, однако из-за небольшого количества поступивших штаммов производить детальный статистический анализ результатов представляется преждевременным.
В настоящее время для терапии менингитов предположительно пневмококковой этиологии в России продолжает применяться хлорамфеникол. В рамках данного исследования пневмококки показали высокую чувствительность in vitro к хлорамфениколу, однако с учетом риска развития серьезных нежелательных реакций (необратимой апластической анемии) данный препарат не следует рекомендовать для эмпирической терапии. Невысокие показ атели резистентности к хлорамфениколу наблюдаются и во многих странах Европы: Австрия — 1,9 %, Бельгия — 2,7 %, Германия — 1,9 %, Италия — 6,7 %, Швейцария — 0 % [7].
Особую терапевтическую проблему представляют полирезистентные штаммы, определяемые как устойчивые к 3 и более классам препаратов. Например, в США распространенность полирезистентных пневмококков составляет 22,2 % [4]. По данным проведенных исследований доля полирезистентности среди штаммов S.pneumoniae в России на протяжении 1999–2005 гг. была сравнительно невысока и относительно стабильна (11,8 % в 1999–2003 гг. и 9,6 % в 2004–2005 гг.). Однако при этом полирезистентные штаммы выделялись во всех регионах страны.
С учетом полученных данных по антибиотикорезистентности S.pneumoniae рекомендации по эмпирической терапии инфекций предположительно пневмококковой этиологии в настоящее время могут быть сформулированы следующим образом.
Для лечения нетяжелых инфекций дыхательных путей (внебольничной пневмонии, среднего отита, синусита) можно рекомендовать следующие группы препаратов: пенициллины, включая аминопенициллины (амоксициллин и амоксициллин/клавуланат для пероральной терапии в амбулаторных условиях), а также 14,15,16-членные макролиды. В качестве альтернативы могут быть использованы «респираторные» фторхинолоны (левофлоксацин, моксифлоксацин), цефалоспорины II–III поколения (цефуроксим, цефуроксим аксетил, цефотаксим, цефтриаксон), линкозамиды.
Для терапии тяжелых инфекций дыхательных путей, включая нозокомиальные, следует использовать амоксициллин / клавуланат (внутривенно), цефалоспорины III–IV поколения (цефтриаксон, цефотаксим, цефепим). Альтернативой могут быть «респираторные» фторхинолоны (левофлоксацин, моксифлоксацин) и карбапенемы, а также ванкомицин.
При лечении инвазивных инфекций (например, менингита) препаратами выбора являются цефалоспорины (цефтриаксон, цефотаксим, цефепим), а альтернативой может быть ванкомицин в комбинации с рифампицином или хлорамфениколом.
Учитывая сравнительно высокую частоту нечувствительности штаммов, следует ограничить использование ко-тримоксазола и тетрациклинов.
Различия в антибиотикорезистентности штаммов S.pneumoniae в различных регионах России, а также ее динамическое изменение со временем диктуют необходимость проведения постоянного мониторинга резистентности с целью дальнейшей оптимизации и рационализации антибактериальной терапии пневмококковых инфекций.
1. Синопальников А.И. Внебольничные инфекции нижних дыхательных пу тей. Пневмония / Под ред. А.Г. Чучалина, А.И. Синопальникова, Л.С. Страчунского. — Москва: Медицинское информационное агентство, 2006. — С. 17-50.
2. Casey J.R., Pichichero M.E. Changes in frequency and pathogens causing acute otitis media in 1995–2003 // Pediatr. Infect. Dis. J. — 2004. — 23 (9). — 824-8.
3. Королева И.С., Белошицкий Г.В., Лыткина И.Н. и соавт. Этиология и лабораторная диагностика гнойных бактериальных менингитов // Эпидемиол. и инфекц. болезни. — 2005. — 3. — 5-9.
4. Doern G.V., Richter S.S., Miller A. et al. Antimicrobial resistance among Streptococcus pneumoniae in the United States: have we begun to turn the corner on resistance to cert ain antimicrobial clas-ses? / / Clin. Infect. Dis. — 2005. — 41. — 139-48.
5. Drugeon H.B. et al. Antimicrobial resistance among Streptococcus pneumoniae isolated in Europe, Turkey, Middle East, Africa and Asia (eBASKET2) // Proceedings of the 44th ICAAC, 2004. — Abstract. — C2-832.
6. Bozdogan B., Appelbaum P.C., Kelly L.M. et al. Activity of telithromycin and seven other agents against 1034 pediatric Streptococcus pneumoniae isolates from ten central and eastern European centers // Clin. Microbiol. Infect. — 2003. — 9. — 653-61.
7. Reinert R.R., Reinert S., van der Lin-den M. et al. Antimicrobial susceptibility of Streptococcus pneumoniae in eight European countries from 2001 to 2003 // Antimicrob. Agents Chemother. — 2005. — 49. — 2903-13.
8. Greenberg D., Dagan R., Muallem M., Porat N. Antibiotic-resistant invasive pediatric Streptococcus pneumoniae clones in Israel // J. Clin. Microbiol. — 2003. — 41. — 5541-5.
9. Bronzwaer S., Buchholz U., Courva-lin P. et al. Comparability of antimicrobial susceptibility test results from 22 European countries and Israel: an external quality assurance exercise of the European Antimicrobial Resistance Surveillance System (EARSS) in collaboration with the United Kingdom National External Quality Assurance Scheme (UK NEQAS) // J. Antimicrob. Chemother. — 2002. — 50. — 953-64.
10. Jones M.E., Blosser-Middleton R.S., Thornsberry C. et al. The activity of levofloxacin and other antimicrobials against clinical isolates of Streptococcus pneumoniae collected worldwide during 1999-2002 // Diagn. Microbiol. Infect. Dis. — 2003. — 47. — 579-86.
11. Jacobs M.R., Felmingham D., Appelbaum P.C., Gruneberg R.N.; The Alexander Project Group. The Alexander Project 1998–2000: susceptibility of pathogens isolated from community-acquired respiratory tract infection to commonly used antimicrobial agents // J. Antimicrob. Chemother. — 2003. — 52. — 229-46.
12. Song J.H., Chang H.H., Suh J.Y. et al. Macrolide resistance and genotypic characterization of Streptococcus pneumoniae in Asian countries: a study of the Asian Network for Surveillance of Resistant Pathogens (ANSORP) // J. Antimicrob. Chemother. — 2004. — 53. — 457-63.
13. Inoue M., Lee N.Y., Hong S.W. et al. PROTEKT 1999–2000: a multicentre study of the antibiotic susceptibility of respiratory tract pathogens in Hong Kong, Japan and South Korea // Int. J. Antimicrob. Agents. — 2004. — 23. — 44-51.
14. National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial susceptibility testing; fourteenth informational supplement. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically — M100–S14. MIC testing supplemental tables // NCCLS. — Villanova, PA, 2004. — 120-122.
15. Statement 1996 CA-SFM. Zone sizes and MIC breakpoints for non-fastidious organisms // Clin. Microbiol. Infect. — 1996. —2. — S46-S48.
