Газета «Новости медицины и фармации» Антимикробная терапия (223) 2007 (тематический номер)
Вернуться к номеру
Дискуссионные вопросы диагностики и антибактериальной терапии внебольничных пневмоний
Авторы: И.Г. БЕРЕЗНЯКОВ, Харьковская медицинская академия последипломного образования
Рубрики: Пульмонология
Разделы: Справочник специалиста
Версия для печати
Введение
Пневмония — острое инфекционное заболевание преимущественно бактериальной этиологии, которое характеризуется очаговым поражением респираторных отделов легких и наличием внутриальвеолярной экссудации [1].
Из данного определения следует, что каждый случай пневмонии рассматривается как новое («острое») заболевание. Поэтому в диагнозе определение «острая» перед словом «пневмония» приводить излишне. В соответствии с современными представлениями хронический воспалительный процесс в альвеолах легких невозможен (за исключением пневмосклероза).
У части пациентов пневмонии на протяжении жизни могут возникать неоднократно, иногда в одних и тех же участках легких. Каждый случай заболевания рассматривается как новый. Среди возможных причин повторных заболеваний пневмониями следует упомянуть:
— наличие бронхоэктазов;
— синдром неподвижных ресничек;
— хронический синусит;
— неврологические заболевания;
— наличие трахеопищеводной фистулы;
— иммунодефициты любого генеза и др.
Поражения легких инфекционной природы, вызванные облигатными для человека патогенами (например, возбудителями чумы (Yersinia pestis) или туляремии (Francisella tularensis)), относятся к соответствующим нозологическим формам (чума, туляремия) и не подпадают под приведенное выше определение пневмоний. Неинфекционные поражения респираторных отделов легких (то есть возникшие под действием физических или химических факторов) получили название пневмонитов/альвеолитов и не рассматриваются вместе с пневмониями.
Классификация пневмоний
Традиционная классификация пневмоний предполагала их разделение по этиологии и локализации и оказалась непригодной для практических нужд. Во-первых, даже в хорошо спланированных и тщательно проконтролированных зарубежных исследованиях идентифицировать возбудителя пневмонии удается только в 30–50 % случаев. Отсутствуют патогномоничные клинические признаки, которые бы позволяли установить этиологический диагноз пневмонии при первом обращении больного за медицинской помощью (редкие исключения — например, долевая (прежнее название — крупозная) пневмония, выявление которой приравнивалось к этиологическому диагнозу пневмококковой пневмонии, — только подтверждают общее правило). Традиционная микробиологическая диагностика трудоемка, а серологическое подтверждение этиологической значимости Mycoplasma pneumoniae и Chlamydophila pneumoniae нередко растягивается на несколько недель и имеет скорее эпидемиологическое, а не клиническое значение.
Во-вторых, точное указание локализации поражения оказывает позитивный психологический эффект (повышает самооценку врача и его авторитет в глазах пациента), но не влияет на выбор антимикробных препаратов, поскольку в современном арсенале лекарственных средств нет препаратов, которые бы «специализировались» на инфекциях в правом или левом легком, верхних или нижних долях, том или ином сегменте легкого и т.д.
Осознание перечисленных фактов стимулировало поиск тех обстоятельств или факторов, которые бы позволили с высокой степенью надежности предсказать вероятных возбудителей пневмонии и назначить адекватную антибактериальную терапию (АБТ) почти всегда эмпирически. В результате современная классификация пневмоний предполагает их следующее разделение:
— внебольничные (вызываются ограниченным рядом аэробных и факультативных анаэробных бактерий с предсказуемым уровнем чувствительности к антибиотикам, а также так называемыми атипичными микроорганизмами);
— нозокомиальные (внутрибольничные, госпитальные; среди возбудителей преобладают аэробные и факультативные анаэробные бактерии (главным образом грамотрицательные), зачастую устойчивые к традиционно используемым антибиотикам, в том числе к представителям сразу нескольких классов антимикробных средств);
— аспирационные (в этиологии заболевания наряду с аэробными и факультативными анаэробными бактериями существенную роль играют строгие анаэробы);
— у лиц с тяжелыми дефектами иммунитета (предсказать возбудителей затруднительно; в этиологии немалое значение придается «необычным» микроорганизмам: грибам (Pneumocystis jiroveci), атипичным микобактериям (комплекс Mycobacterium avium-intracellulare), вирусам и др.).
Этиология внебольничных пневмоний (ВП)
Основными возбудителями нетяжелых ВП являются 4 микроорганизма: Streptococcus pneumoniae, Haemophilus influenzae, Mycoplasma pneumoniae и Chlamydophila pneumoniae. Первые 2 из них относятся к типичным (то есть растущим на обычных средах), хотя и «привередливым» бактериям (их культивирование в лабораторных условиях требует строгого соблюдения предписанных процедур). Последние 2 микроорганизма получили название атипичных (с некоторой натяжкой (в отношении M.pneumoniae) их можно охарактеризовать как внутриклеточные патогены, которые растут только на специальных средах; культуральные исследования дорогостоящи и в рутинной клинической практике не проводятся).
У госпитализированных больных с тяжелой ВП наряду с перечисленными микроорганизмами определенную роль играют Legionella pneumophila (атипичный микроорганизм — внутриклеточный патоген, этиологическую значимость которого в Украине еще предстоит изучить), Staphylococcus aureus, Pseudomonas aeruginosa, представители семейства Enterobacteriaceae (Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis и др.). Данные нескольких десятков зарубежных исследований, посвященных этиологии ВП, суммированы в табл. 1 [2].
Резистентность возбудителей ВП к антибиотикам
В отличие от других медикаментов антимикробные препараты действуют не на компоненты клеток человеческого организма (рецепторы), а на микроорганизмы. При этом каждый антибиотик уничтожает или тормозит рост и размножение всех чувствительных к ним бактерий — вне зависимости от того, повинны они в возникновении заболевания у пациента или нет. Поэтому формирование и совершенствование разнообразных и эффективных механизмов резистентности (устойчивости) к антибиотикам стало условием выживания микроорганизмов в изменившейся окружающей среде.
В принципе суждение о чувствительности или резистентности того или иного возбудителя к конкретному антибиотику должно опираться на оценку вероятности успеха или неуспеха лечения инфекции, вызванной этим микроорганизмом, при использовании данного препарата. В рутинной клинической практике утвердилось упрощенное толкование понятия «резистентность». Так, если концентрация препарата, необходимая для подавления роста и размножения выделенного микроорганизма, ниже той, которая ожидается in vivo , то данный возбудитель трактуется как резистентный. В действительности дело обстоит намного сложнее. Клиническая эффективность зависит не только от активности конкретного антибиотика в отношении данного возбудителя, но и от фармакокинетических параметров (например, способности препарата проникать в очаг инфекции известной локализации и накапливаться там), состояния собственных защитных сил макроорганизма и других факторов [3].
Резистентность может быть природной и приобретенной. О природной резистентности говорят при отсутствии у микроорганизма мишени для действия антибиотика либо если эта мишень недоступна. Бета-лак тамные антибиотики, например, для реализации антибактериального эффекта связываются с ферментами транс- и карбоксипептидазами, участвующими в синтезе наружной стенки бактериальной клетки. Эти ферменты, получившие название пенициллинсвязывающих белков, отсутствуют у микоплазм, лишенных клеточных стенок. Поэтому Mycoplasma spp. обладают природной устойчивостью к бета-лактамам. Другой пример: клеточная стенка большинства грамотрицательных бактерий непроницаема для макролидов. Указанные микроорганизмы также обладают природной устойчивостью к этому классу антибиотиков.
Приобретенная устойчивость развивается либо вследствие мутаций, либо при передаче генов, кодирующих резистентность, от резистентных бактерий чувствительным микроорганизмам.
Рекомендации по АБТ ВП опираются на результаты микробиологических исследований по определению чувствительности к антибиотикам ключевых возбудителей этого заболевания. Такие исследования позволяют отслеживать динамику изменения чувствительности микроорганизмов к основным антибактериальным средствам и вносить коррективы в стандарты терапии. Как правило, профиль резистентности возбудителей внебольничных инфекций существенно не различается в разных регионах страны, что связано с общими традициями использования антибиотиков в условиях одного государства.
В силу разных причин в Украине отсутствуют достоверные данные о распространенности антибиотикорезистентности среди возбудителей ВП. Некоторые ориентиры можно получить при анализе результатов микробиологических исследований, выполненных в европейских государствах.
Ключевая роль среди возбудителей ВП принадлежит, несомненно, S treptococcus pneumoniae (пневмококкам). В отличие от стафилококков и многих грамотрицательных бактерий они не вырабатывают бета-лактамазы. Основной механизм устойчивости S.pneumoniae к пенициллину связан с модификацией мишени для действия данного препарата. К сожалению, устойчивость к пенициллину нередко ассоциируется с устойчивостью к макролидам, тетрациклинам и ко-тримоксазолу [4].
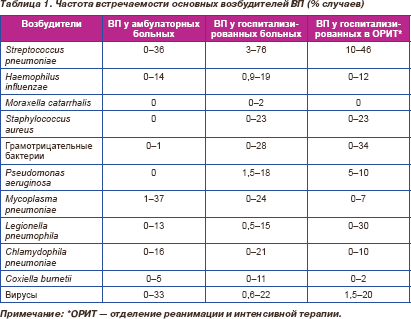
Распространенность пенициллинонечувствительных пневмококков (резистентные (минимальная подавляющая концентрация (МПК) пенициллина > 2 мкг/мл) + умеренно резистентные (МПК 0,12–1,0 мкг/мл) штаммы) в странах Европы представлена на рис. 1, эритромицинорезистентных пневмококков (МПК эритромицина > 1 мкг/мл) — на рис. 2 [5, 6].
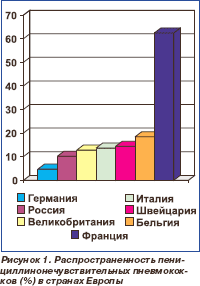
В силу географической близости и общих традиций в использовании антибиотиков наибольший интерес представляют данные, опубликованные в России. Поскольку результаты исследований во всех 7 федеральных округах России существенно не отличались от данных, полученных в среднем по стране, их можно использовать в качестве ориентира для Украины.
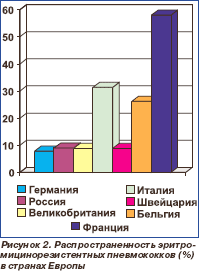
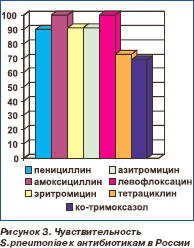
В настоящее время чувствительность пневмококков к пенициллину в России составляет 89,8 %, и лишь 1,9 % штаммов являются высокоустойчивыми. При этом аминопенициллины (амоксициллин), цефалоспорины III поколения и респираторные фторхинолоны (левофлоксацин, гатифлоксацин, моксифлоксацин) сохраняют высокую активность (уровень чувствительности — 100 %). Не составляет пока проблемы и чувствительность к макролидам: 91 % (к эритромицину) — 95,5 % (к миокамицину). В то же время зарегистрировано значительное сни жение чувствительности пневмококков к тетрациклину (27,5 % резистентных штаммов) и ко-тримоксазолу (уровень устойчивости — 31,5 %, рис. 3) [6]. Результаты клинических исследований свидетельствуют, что при небольшом уровне резистентности эффективность АБТ не снижается. Однако лечение становится неэффективным, когда количество резистентных штаммов превышает некий пороговый уровень. Для внебольничных пневмококковых инфекций этот показатель составляет примерно 20–30 % [7].
Наряду с распространенностью резистентности имеет значение ее выраженность. Например, пневмококки считаются чувствительными к пенициллину, если МПК этого антибиотика < 0,06 мкг/мл, умеренно устойчивыми — при МПК 0,12–1,0 мкг/мл и резистентными — при МПК > 2,0 мкг/мл. Однако назначение бензилпенициллина или аминопенициллинов в высоких дозах позволяет в клинических условиях преодолеть умеренную устойчивость пневмококков у больных с пневмониями (но не у пациентов с менингитом).
Вероятными причинами преодоления в клинических условиях резистентности (умеренной) in vitro являются:
— изменение физиологического состояния микроорганизмов при инфекциях и повышение их чувствительности к антибиотикам;
— способность метаболитов антибиотика в организме пациента в ряде случаев потенцировать их фармакологическую активность;
— противовоспалительные эффекты антибактериальных препаратов;
— неадекватность лабораторных критериев чувствительности [8].
В то же время выраженная резистентность пневмококков к пенициллину при ВП, по-видимому, имеет клиническое значение. В ряде исследований продемонстрирована статистически значимая связь между инфицированием лекарственно-устойчивыми S.pneumoniae (DRSP) и длительностью госпитализации, тяжестью пневмонии и наличием гнойных осложнений (эмпиема плевры; абсцесс легкого; остеомиелит), смертностью [9–11].
С учетом изложенного можно заключить, что средствами выбора в лечении внебольничных пневмококковых пневмоний остаются бета-лактамы (аминопенициллины и цефалоспорины III поколения), макролиды и респираторные фторхинолоны. Применение же тетрациклинов (доксициклин) и ко-тримоксазола при этих инфекциях сопряжено с высоким риском клинических неудач и должно быть по крайней мере приостановлено.
Вторым по значимости возбудителем ВП среди типичных микроорганизмов является Haemophilus influenzae (гемофильная палочка). Основной механизм антибиотикоустойчивости этого возбудителя в Европе и США связан с выработкой бета-лактамаз [12], модификация мишени для действия имеет меньшее значение. В настоящее время в России нечувствительность (умеренная резистентность + резистентность) H.influenzae к ампициллину составляет 5,2 %, амоксициллин/клавуланату, цефотаксиму, ципрофлоксацину и левофлоксацину — 0 %, азитромицину — 1,5 %, тетрациклину — 5,0 %. В то же время к ко-тримоксазолу она достигает 29,8 % (рис. 4) [13]. В целом, за исключением ко-тримоксазола, пока нет оснований отказываться от какого-либо класса антибактериальных средств, применяемых для лечения инфекций, вызванных этим микроорганизмом.
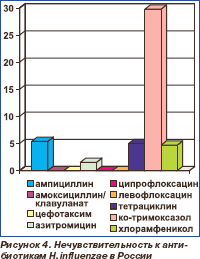
Среди бета-лактамных антибиотиков, которые используются для пероральной те рапии инфекций, вызванных H.influenzae, самыми активными с точки зрения МПК и фармакокинетики/фармакодинамики (ФК/ФД) являются цефиксим и цефподоксим, за которыми следуют амоксициллин/клавуланат и цефуроксим, среди макролидов самая низкая МПК у азитромицина [14, 15]. В то же время ФК/ФД параметры макролидов и результаты некоторых клинических исследований ставят под сомнение эффективность этого класса антибиотиков при инфекциях, вызванных H.influenzae [14, 16]. Кроме того, описаны механизм эффлюкса макролидов (изгнания из микроорганизма с помощью бактериальных насосов) у «диких» штаммов H.influenzae, а у гиперрезистентных к макролидам штаммов — добавочные мутации белков рибосом [17, 18]. Резистентность ко фторхинолонам до сих пор встречается редко [15, 19]. Более того, фторхинолоны (ципро- флоксацин, левофлоксацин, гатифлоксацин и моксифлоксацин) проявляют высокую активность в отношении H.influenzae, резистентных к бета-лактамам и макролидам, вне зависимости от механизма и фенотипа устойчивости [12].
Резистентность атипичных патогенов к антибиотикам у клинических штаммов не встречается, хотя описана в лабораторных условиях. Есть все основания полагать, что в ближайшее время она не станет сколько-нибудь серьезной клинической проблемой.
Диагностика ВП
Диагноз ВП устанавливают при наличии очаговой инфильтрации легочной ткани (по данным рентгенологического исследования органов грудной клетки) и не менее 2 из нижеследующих признаков:
— острое начало заболевания с температурой тела > 38 ºС;
— кашель с выделением мокроты;
— притупление звука/тупость при перкуссии, ослабленное, жесткое или бронхиальное дыхание, фокус звонких мелкопузырчатых хрипов и/или крепитация;
— лейкоцитоз (> 10 × 109/л) или палочкоядерный сдвиг (> 10 %) [1].
При невозможности проведения или категорическом отказе пациента от рентгенологического исследования органов грудной клетки допускается клиническая диагностика ВП. Наиболее значимыми являются объективные (прежде всего аускультативные) признаки: наличие крепитации или звонких влажных хрипов над ограниченным участком легочного поля [20]. Предсказательная ценность выделения гнойной мокроты (с точки зрения вероятности пневмонии) в несколько раз ниже [21]. Изолированные изменения в крови (лейкоцитоз или палочкоядерный сдвиг) крайне неспецифичны.
В то же время клинический (то есть предположительный, убедительно не доказанный) диагноз ВП, по данным зарубежных исследований, подтверждается при последующем рентгенологическом исследовании в 28–39 % случаев [20, 22]. Поэтому всегда, когда возможно, следует добиваться рентгенологической верификации диагноза, а если это недостижимо — отражать в диагнозе его предположительность, например: «Очаговая ВП (указать локализацию — в такой-то доле/сегменте такого-то легкого) клинически».
Где лечить пациента?
Большинство больных с ВП могут лечиться в амбулаторных условиях. Главными достоинствами лечения дома являются удобство и комфорт для пациента, возможность перорального приема антибиотиков, а также меньшая стоимость лечения для системы здравоохранения в целом. Основным условием амбулаторной терапии больных с ВП является минимальный риск неблагоприятного исхода (замедленного выздоровления, развития осложнений и/или смерти). Соответственно, основными кандидатами на лечение в домашних условиях будут больные с нетяжелой ВП.
Для решения вопроса о месте лечения пациента предлагается использовать несколько шкал, наиболее известными из которых являются PSI и CURB-65. Шкала PSI (Pneumonia Severity Index — индекс тяжести пневмонии) насчитывает 20 параметров, включающих в себя демографические факторы, наличие ряда сопутствующих заболеваний, объективных признаков и лабораторных данных. Каждому из параметров присваивается определенное количество баллов. В зависимости от суммы баллов, подсчитанных в процессе обследования, пациент относится к одному из 5 классов риска неблагоприятного исхода. У больных I и II класса риска по шкале PSI риск неблагоприятного исхода самый низкий, и они могут лечиться в домашних условиях.
Основными недостатками шкалы PSI являются следующие:
— громоздкость: врач вынужден учитывать большое количество критериев и должен быть уверен, что не забыл чего-либо и не ошибся в подсчете баллов. Использование же с этой целью компьютеров пока недостижимо в большинстве лечебно-профилактических учреждений Украины;
— трудоемкость: включение в шкалу ряда лабораторных признаков обусловливает зависимость врачебного решения от результатов работы других, нередко нескольких, медработников;
— невозможность принятия быстрого решения: ожидание результатов лабораторных исследований может растянуться на несколько часов и даже дней, в течение которых судьба пациента остается неопределенной;
— непригодность для большинства лечебно-профилактических учреждений Украины, в которых целый ряд лабораторных исследований (например, определение pH или содержания кислорода в артериальной крови) не относится к числу рутинных;
— наконец, шкала PSI изначально разрабатывалась для оценки риска смерти от ВП, а не для решения вопроса о месте лечения пациента.
Для практического использования более удобной представляется шкала CURB-65. Данная аббревиатура расшифровывается так: Confusion (спутанность сознания), Urea ((азот)мочевины > 7 ммоль/л), Respiratory rate (число дыхательных движений > 30/мин), Blood pressure (снижение систолического артериального давления < 90 мм рт.ст. или диастолического давления < 60 мм рт.ст.), 65 — возраст > 65 лет. Больному присваивают по 1 баллу при наличии каждого из вышеперечисленных признаков, после чего подсчитывается сумма баллов. Если итоговая сумма равна 0 или 1, риск смерти от ВП низкий и больные могут лечиться дома. У больных с 2 баллами по шкале CURB-65 риск смерти повышен. Их можно госпитализировать на краткий срок либо лечить в амбулаторных условиях под контролем врача стационара. Если сумма равна или превышает 3 балла, больной относится к группе высокого риска смерти и его следует лечить как пациента с тяжелой ВП в стационаре [23].
Следует иметь в виду, что азот мочевины представляет собой частное от деления концентрации мочевины в крови (ммоль/л) на коэффициент 2,14. Если в условиях данного лечебно-профилактического учреждения определение азота мочевины невозможно или затруднительно, можно использовать шкалу CRB-65 (вариант описанной выше шкалы, за исключением определения плазменной концентрации мочевины) [24]. Критерии интерпретации суммы баллов те же, что и для шкалы CURB-65.
В отличие от шкалы PSI шкала CURB-65/ CRB-65 разрабатывалась специально для определения места лечения пациента. Простота и удобство последней позволяют рекомендовать ее к использованию в Украине. В то же время ряд вопросов нуждается в дальнейших исследованиях:
— возраст: средняя продолжительность жизни в развитых странах Западной Европы и Северной Америки выше, чем в Украи не. Возможно, возрастной критерий (старше 65 лет) следовало бы снизить, например до 60 лет;
— спутанность сознания: целесообразно дать детальное описание термина, например: «смятение; нарушение ориентации во времени, пространстве или в себе, которое может сопровождаться нарушением сознания»;
— наконец, целесообразно накопить и проанализировать опыт использования этой шкалы в отечественных условиях, провести соответствующие пилотные и/или многоцентровые исследования.
Тем не менее даже при наличии такого удобного инструмента для решения вопроса о месте лечения пациента, как шкала CURB-65/CRB-65, окончательное решение во многих случаях будет целиком зависеть от клинического суждения врача. Вот только некоторые примеры:
— осложнения ВП: присоединение абсцесса легких или эмпиемы плевры является веским основанием для госпитализации больного, даже если сумма баллов по шкале CURB-65/CRB-65 будет < 2;
— обострение сопутствующих заболеваний: нетяжелая ВП может стать причиной декомпенсации сахарного диабета, ухудшения клинического течения хронического обструктивного заболевания легких (ХОЗЛ), хронической сердечной или хронической почечной недостаточности. Во всех перечисленных и им подобных случаях также оправдана госпитализация пациента;
— невозможность приема антибиотиков внутрь и/или адекватной организации медицинской помощи на дому: у больных с тошнотой и рвотой, у лиц с синдромом мальабсорбции (нарушенного всасывания в кишечнике) любой этиологии, у пациентов, перенесших оперативные вмешательства на органах желудочно-кишечного тракта с резекцией желудка и/или начальных отделов тонкого кишечника, предпочтение следует отдавать парентеральному введению антибиотиков в условиях стационара. Целесообразно госпитализировать и больных, нуждающихся в уходе со стороны посторонних лиц (пациенты с психическими либо неврологическими заболеваниями; лица с нарушенной памятью или интеллектом; инвалиды; одинокие граждане преклонного возраста и др.), в случаях невозможности организации адекватной медицинской помощи на дому. Так же рекомендуется поступать и с лицами без определенного места жительства;
— настояние пациента: больных с ВП, не желающих лечиться в домашних условиях, следует направлять в стационар даже при нетяжелом течении заболевания;
— наличие множественных факторов риска, не включенных в прогностические шкалы: аргументами в пользу госпитализации пациента могут быть артериальная гипоксемия (насыщение кислородом артериальной крови < 90 %), развившаяся вследствие ВП; шок; неэффективность предшествующей адекватной антибактериальной терапии; истощение; наркомания (с внутривенным введением наркотиков); наличие среди сопутствующих заболеваний редких болезней (серповидно-клеточная анемия, нейромышечные заболевания и др.).
Если принято решение о госпитализации пациента, то прежде всего предстоит решить, в какое именно отделение: общетерапевтическое или отделение реанимации и интенсивной терапии (ОРИТ). Для этого целесообразно разграничивать нетяжелую и тяжелую ВП. Аргументами в пользу разработки критериев тяжелой ВП (и, соответственно, госпитализации в ОРИТ или (в отсутствие последнего) в палату интенсивного наблюдения) являются следующие [25]:
— оптимизация использования ресурсов ОРИТ;
— запоздалый перевод больных в ОРИТ в связи с дыхательной недостаточностью и/или септическим шоком ассоциируется с увеличением смертности;
— этиология тяжелых и нетяжелых ВП несколько отличается, что обусловливает различия в терапевтической тактике;
— необходимость идентификации больных с ВП, которым показана иммуномодулирующая терапия (это, прежде всего, больные с сепсисом).
Общепринятых критериев тяжелой ВП в настоящее время нет. В 2007 г. Американское торакальное общество (ATS) совместно с Американским обществом инфекционистов (IDSA) предложили разделить критерии тяжелой ВП на большие и малые [26]. К большим критериям , каждый из которых является абсолютным показанием для госпитализации в ОРИТ, относятся:
— искусственная вентиляция легких (ИВЛ) с интубацией трахеи;
— септический шок и потребность во введении вазопрессоров.
Малые критерии включают в себя:
— число дыхательных движений ≥ 30 в мин;
— PaO2/FiO2 ≤ 250 (отношение напряжения кислорода в артериальной крови к фракции кислорода во вдыхаемом воздухе);
— инфильтрация двух и более долей легких;
— спутанность сознания/дезориентация;
— уреми я (азот мочевины ≥ 30 мг/дл, или 7,0 ммоль/л);
— лейкопения как результат инфекции (число лейкоцитов < 4,0 × 109/л);
— тромбоцитопения (число тромбоцитов < 100 × 109/л);
— гипотермия (температура тела < 36 ºС);
— гипотензия и потребность в энергичном возмещении жидкости.
Наличие 3 и более малых критериев является основанием для госпитализации в ОРИТ.
Предложенные критерии можно использовать в качестве рабочего инструмента при определении места лечения госпитализированного больного с ВП. Следует иметь в виду, что они еще не прошли проверки в проспективных исследованиях. В числе возможных кандидатов на внесение в перечень малых (как минимум) критериев следует упомянуть гипогликемию (у больных, не страдающих сахарным диабетом), острое алкогольное отравление или абстиненцию у больных алкоголизмом, гипонатриемию, необъяснимый метаболический ацидоз или повышенный уровень лактатов в крови, цирроз печени, асплению.
Какие антибиотики можно использовать для амбулаторного лечения больных с ВП?
Для лечения больных с нетяжелой ВП в амбулаторных условиях обычно используют антибиотики в лекарственных формах для приема внутрь. Перечень наиболее употребительных препаратов охватывает представителей 5 основных классов: бета-лактамы, макролиды, «респираторные» фторхинолоны, тетрациклины (доксициклин) и ко-тримоксазол (триметоприм/сульфаметоксазол). Высокий уровень резистентности пневмококков к ко-тримоксазолу, отсутствие активности в отношении атипичных возбудителей, распространенность в популяции повышенной чувствительности к сульфаниламидам, неоптимальная комбинация триметоприма с сульфаниламидом — эти и другие обстоятельства привели к исключению ко-тримоксазола из числа антимикробных препаратов, которые рекомендуются для эмпирической терапии больных с ВП с обычным уровнем иммунитета. Достоинства и недостатки антибиотиков других классов суммированы ниже.
Бета-лактамы
В клинической практике наиболее употребительными пероральными бета-лактамами для лечения больных с нетяжелой ВП являются аминопенициллины (амоксициллин и амоксициллин/клавуланат) и цефалоспорин II поколения цефуроксим аксетил.
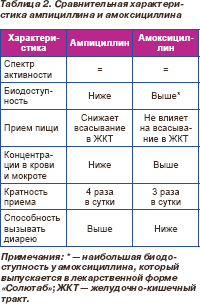
Из двух пероральных аминопенициллинов, зарегистрированных в Украине (ампициллин и амоксициллин), клиническое значение в терапии ВП сохраняет только последний. Сравнительная характеристика обоих антибиотиков представлена в табл. 2.
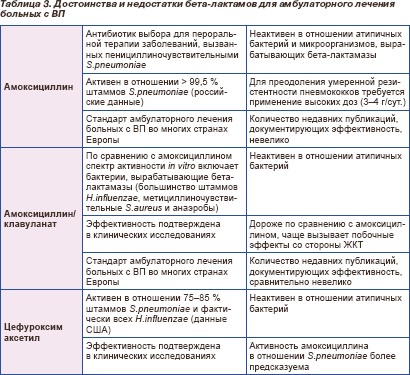
Достоинства и недостатки бета-лактамов как препаратов выбора для лечения больных с ВП в амбулаторных условиях суммированы в табл. 3 [27, с изменениями].
Макролиды
Микробиологическая и клиническая эффективность у больных с ВП доказана прежде всего для эритромицина, азитромицина, кларитромицина и спирамицина. Использование других макролидов для лечения пациентов с ВП нецелесообразно.
Эритромицин первым из макролидов появился на фармацевтическом рынке. В настоящее время его не следует рассматривать в качестве препарата выбора у больных с ВП в силу следующих причин:
— неоптимальная кратность применения: антибиотик дозируется каждые 6 ч;
— неудобство дозирования: большинство производителей выпускают препарат в таблетках по 100 мг, в то время как суточная доза составляет 1–2 г;
— повышенный по сравнению с другими макролидами риск побочных эффектов, часть из которых обусловлена фармакологическими и физико-химическими свойствами медикамента: расстройство стула (эритромицин стимулирует мотилиновые рецепторы в тонком кишечнике и оказывает прокинетическое действие), флебиты в месте инъекций (при использовании лекарственных форм для парентерального применения) и т.д.
Достоинства и недостатки макролидов как препаратов выбора для лечения больных с ВП в амбулаторных условиях суммированы в табл. 4 [27, с изменениями].

Респираторные фторхинолоны
Общепринятая классификация фторхинолонов в настоящее время отсутствует. Для лечения больных с ВП могут использоваться исключительно респираторные, или «новые», фторхинолоны: левофлоксацин, моксифлоксацин и гатифлоксацин (табл. 5). Единственное исключение сделано для ципрофлоксацина, который благодаря высокой активности в отношении Pseudomonas aeruginosa принадлежит к числу препаратов выбора для лечения тяжелых больных с ВП с высоким риском инфицирования синегнойной палочкой (обычно такие пациенты госпитализируются в ОРИТ).

Доксициклин
Доксициклин активен в отношении атипичных бактерий и более 93 % штаммов H.influenzae (российские данные). Препарат относится к числу недорогих антибиотиков и обычно хорошо переносится. Однако высокий уровень резистентности к нему среди S.pneumoniae (в России более 25 %) не позволяет рассматривать доксициклин в качестве препарата выбора. Кроме того, в последние годы этот антибиотик редко используется клиницистами, а количество недавних публикаций, документирующих эффективность у больных с ВП, крайне ограничено.
Насколько значимо наличие у антибиотиков активности в отношении атипичных патогенов для лечения больных с ВП?
С учетом этиологической значимости в возникновении ВП как типичных (S.pneumoniae, H.influenzae), так и атипичных микроорганизмов (M.pneumoniae, C.pneumoniae) следовало бы ожидать, что оптимальными антибиотиками для лечения ВП будут препараты, охватывающие весь спектр предполагаемых возбудителей. В целом этому критерию соответствуют макролиды, тетрациклины (доксициклин) и респираторные фторхинолоны. Именно эти антибиотики рекомендуются для монотерапии больных с ВП в домашних условиях экспертами IDSA и ATS [26], причем препараты первых двух классов рассматриваются в качестве средств первого ряда, а респираторные фторхинолоны — как альтернативные. Американские эксперты особый акцент делают на активности перечисленных классов антибиотиков в отношении атипичных возбудителей. С другой стороны, в согласительных документах, изданных во многих европейских странах (в том числе в Великобритании, России, Украине), препаратами выбора для лечения больных с нетяжелыми ВП без сопутствующих заболеваний и «модифицирующих» факторов являются бета-лактамы (амоксициллин) и макролиды. При этом амоксициллин превосходит макролиды по активности в отношении S.pneumoniae, но не действует на атипичных бактерий. Данный недостаток, по мнению специалистов, нивелируется тем обстоятельством, что ВП, вызванные атипичными микроорганизмами, склонны к спонтанному разрешению, а основная угроза неблагоприятных исходов ассоциируется с пневмококковыми пневмониями.
Таким образом, налицо 2 различных подхода к лечению одинаковых категорий пациентов с одним и тем же заболеванием. Первый, условно говоря, «американский», в качестве препаратов выбора предлагает антибиотики, активные в отношении атипичных микроорганизмов, — макролиды, «респираторные» фторхинолоны, доксициклин. Другой — «европейский» (принятый и в нашей стране) — исходит из того, что бета-лактамы не исчерпали своих возможностей в амбулаторной терапии больных с ВП.
Эффективность бета-лактамов и антибиотиков, активных в отношении внутриклеточных возбудителей (фторхинолоны, макролиды, кетолиды) при лечении нетяжелых ВП, проанализирована в недавних метаанализе и систематическом обзоре [29, 30]. В первый из них были включены 18 рандомизированных клинических исследований (РКИ), всего 6749 больных. РКИ выполнялись как у амбулаторных, так и, главным образом, у госпитализированных больных с нетяжелой ВП, получавших антибиотики внутрь или парентерально. Под клиническими неудачами понимали замедленное разрешение клинической симптоматики, летальных исходов не было. Риск клинических неудач в сравниваемых группах антибиотиков не различался ни во всей популяции пациентов, ни в случаях ВП, вызванных M.pneumoniae и C.pneumoniae (рис. 5). В частности, было подсчитано, что для предотвращения 1 случая неудачи необходимо назначить антибиотики, активные в отношении атипичных патогенов, 185 пациентам. Только при ВП, вызванных Legionella spp., антибиотики, активные в отношении внутриклеточных возбудителей, имели преимущество по сравнению с бета-лактамами: относительный риск (ОР) клинической неудачи был 0,40 (т.е. в 2,5 раза ниже, чем при лечении бета-лактамами) при 95-процентном доверительном интервале (95% ДИ) 0,19–0,85. Поскольку данные микроорганизмы редко вызывают нетяжелые ВП (менее 3 % случаев), авторы метаанализа заключили, что наличие противолегионеллезной активности антибиотика для стартовой терапии нетяжелых ВП не обязательно [29].
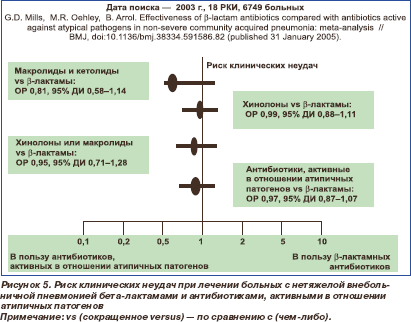
По итогам метаанализа можно сделать следующие выводы:
— данные о преимуществах препаратов, активных в отношении атипичных патогенов, при нетяжелой ВП отсутствуют;
— при нетяжелой ВП, вызванной C.pneumoniae и M.pneumoniae, бета-лактамы не уступают препаратам, активным в отношении атипичных патогенов;
— бета-лактамы — средства выбора монотерапии при нетяжелой ВП.
Особенностью данного метаанализа была сравнительно невысокая частота выявления атипичных патогенов в микробиологически подтвержденных случаях — 7 %. В окончательный анализ включили небольшое число больных старшей возрастной группы, однако у них частота ВП, вызванных атипичными бактериями, как правило, ниже. Остается открытым вопрос и о том, какому именно бета-лактаму следует отдавать предпочтение при лечении больных с нетяжелой ВП. Косвенным ответом на него может быть тот факт, что в 14 из 18 РКИ тестировались амоксициллин и амоксициллин/клавуланат [31].
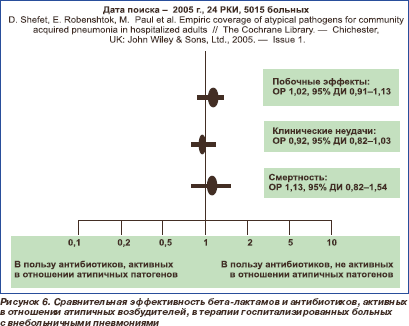
В систематическом обзоре сравнивалась эффективность терапии ВП бета-лактамами и антибиотиками, активными в отношении внутриклеточных возбудителей, исключительно у госпитализированных больных [30]. На этот раз были проанализированы 24 РКИ с общим числом включенных в исследования больных 5015 человек. Вновь не было выявлено различий в частоте клинических неудач при использовании обоих режимов терапии. Более того, смертность больных и частота нежелательных лекарственных явлений (побочных эффектов) не различалась (рис. 6). В группе пациентов, получавших антибиотики, активные в отношении атипичных патогенов, отмечались лучшая эрадикация возбудителей и тенденция к большей клинической эффективности. Однако эти закономерности исчезали, если в анализ включали только РКИ (n = 6), проведенные на самом высоком методологическом уровне.
Заключение
В рамках отдельно взятой статьи невозможно охватить все дискуссионные аспекты диагностики и лечения внебольничных пневмоний. Когда начинать лечение? Как вводить антибиотики? Какова продолжительность антибактериальной терапии? Эти и многие другие вопросы не имеют однозначных ответов. Тем увлекательней их поиск…
1. Протокол надання медичної допомоги хворим на негоспітальну та нозокоміальну (госпітальну) пневмонію у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія. Затверджений наказом МОЗ України від 19.03.2007 р. № 128.
2. Blasi F., Tarsia P., Cosentini R. Etiology and investigation // Torres A., Ewig S., Mandell L., Woodhead M., editors. Respiratory infections. — London: Hodder Arnold, 2006. — P. 337-51.
3. Towner K.J. The problem of resistance // D. Greenwood, editor. Antimicrobial chemotherapy. — 4th ed. — Oxford, New York: Oxford University Press, 2001. — Р. 137-144.
4. Сидоренко С.В., Эйдельштейн М.В. Механизмы резистентности микроорганизмов // Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. — Смоленск: МАКМАХ, 2007. — С. 19-31.
5. Jacobs M.R., Felmingham D., Appelbaum P.C., Grüneberg R.N. and the Alexander Project Group // J. Antimicrob. Chemother . —2003. — 52 (2). — 229-46.
6. Козлов Р.С. Пневмококки: прошлое, настоящее и будущее. — Смоленск: Смоленская государственная медицинская академия, 2005.
7. Яковлев С.В. // Клин. антибиотикотер. — 2001. — 5–6. — 3-10.
8. Bishai W.J. // Antimicrob. Chemother. — 2002. — 49. — 433-6.
9. Ewig S. et al. // Am. J. Rasp. Crypt. Care Med. — 1999. — 159. — 1835-42.
10. Poufs J.F., Bremen R.F., Fickle R.R. & the Franklin County Pneumonia Study Group // JAMA. — 1996. — 275. — 194-8.
11. Metlay J.P. et al. // Clin. Infect. Dis. — 2000. — 30. — 520-8.
12. Pankuch G.A. et al. // Clin. Microbiol. Infect. — 2005. — 11. — 1040–4.
13. Решедько Г.К., Козлов Р.С. Состояние резистентности к антиинфекционным химиопрепаратам в России // Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. — Смоленск: МАКМАХ, 2007. — С. 32-46.
14. Jacobs M.R. // Clin. Microbiol. Infect. — 2001. — 7. — 589-96.
15. Davies T.A. et al. // Antimicrob. Agents Chemother. — 2000. — 44. — 633-9.
16. Dagan R. et al. // Antimicrob. Agents Chemother. — 2000. — 44. — 43-50.
17. Clark C.L. et al. // Antimicrob. Agents Chemother. — 2002. — 46. — 2956-62.
18. Peric M. et al. // Antimicrob. Agents Chemother. — 2003. — 47. — 1017-22.
19. Nazir J. et al. // Clin. Infect. Dis. — 2004. — 38. — 1564-9.
20. Woodhead M.A. et al. // Lancet. — 1987. — 1. — 671-4.
21. Gonzales R., Sande M.A. // Ann. Intern. Med. — 2000. — 133. — 981-90.
22. Melbye H. et al. // Scand. J. Infect. Dis. — 1992. — 24. — 647-55.
23. Lim W.S. et al. // Thorax. — 2003. —58. — 377-82.
24. Capelastegui A. et al. // Eur. Respir. J. — 2006. — 27. — 151-7.
25. Riley P.D. et al. // Crit. Care Med. — 2004. — 32. — 2398-402.
26. Mandell L.A. et al. // Clin. Infect. Dis. — 2007. — 44 (Suppl. 2). — S27-S72.
27. Mandell L.A. et al. // Clin. Inf. Dis. — 2003. — 37. — 1405-33.
28. Salkind A.R. et al. // Ann. Pharmacother. — 2002. — 36. — 1938-43.
29. Mills G.D. et al. // BMJ, doi:10.1136/bmj.38334.591586.82 (published 31 January 2005).
30. Shefet D. et al. // Arch. Intern. Med. — 2005. — 165. — 1992-2000.
31. Woodhead M., Verheij T.J.M. // BMJ. — 2005. — 330. — 460.
