Газета «Новости медицины и фармации» 7 (455) 2013
Вернуться к номеру
Біліопанкреатичне шунтування з дуоденальним виключенням у хворих із морбідним ожирінням: перший клінічний досвід
Авторы: Тодуров І.М., Білянський Л.С., Перехрестенко О.В., Калашніков О.О., Косюхно С.В., Кучерук В.В.,
Національний інститут хірургії та трансплантології імені О.О. Шалімова НАМН України, м. Київ
Рубрики: Хирургия, Эндокринология
Разделы: Справочник специалиста
Версия для печати
 Актуальність
Актуальність
За узагальненими статистичними даними, нині у світі від ожиріння страждає близько 400 млн людей, при цьому ще 1,6 млрд жителів нашої планети мають надлишкову вагу [5, 7]. Інший, проте не менш важливий аспект проблеми ожиріння пов’язаний із вкрай високою частотою розвитку при зазначеній патології тяжких супутніх захворювань (цукрового діабету 2го типу дорослих, дисліпідемії, артеріальної гіпертензії, атеросклерозу, ішемічної хвороби серця, синдрому нічного апное, підвищення ризику онкологічних захворювань), що, у свою чергу, призводить до значного обмеження соціальної активності людей, інвалідизації хворих працездатного віку та суттєво скорочує тривалість їх життя [1, 2, 7, 9].
Згідно з експертною оцінкою ВООЗ, саме ожиріння визнано найбільшою сучасною глобальною загрозою для здоров’я та життя людства [9].
Результати численних клінікоекспериментальних досліджень переконливо доводять і той факт, що дотепер лише хірургічне лікування — це єдиний реальний метод ефективної медичної допомоги хворим із морбідним ожирінням [4, 6, 7].
Серед широкого спектра баріатричних оперативних втручань однією із найбільш ефективних як щодо корекції надлишкової маси тіла, так і усунення вторинних метаболічних порушень та компенсації супутньої патології, проте все ще недостатньо вивчених хірургічних методик є операція біліопанкреатичного шунтування з дуоденальним виключенням за D. Hess — P. Marceau (БПШ із ДВ) [3, 4, 7, 8].
Мета роботи: покращення результатів хірургічного лікування хворих із морбідним ожирінням шляхом оцінки результатів операції біліопанкреатичного шунтування з дуоденальним виключенням.
Матеріали та методи
З 2009 року ми маємо досвід хірургічного лікування 26 пацієнтів із морбідним ожирінням, яким було виконано БПШ із ДВ за D. Hess — P. Marceau.
У дане клінічне дослідження включені 15 хворих із морбідним ожирінням: 9 чоловіків та 6 жінок віком від 29 до 61 року, у середньому 42,6 ± 7,7 року, яким вищезазначене оперативне втручання виконано за період із 2009 по 2011 рік.
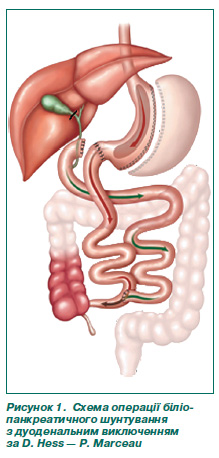
Перший етап операції передбачав виконання sleeveгастректомії, мобілізації та пересічення дванадцятипалої кишки на відстані 3,5–4,5 см від воротаря, холецистектомії. Другий, мальабсорбтивний етап втручання включав формування аліментарної петлі, що залежно від довжини тонкої кишки хворого становила від 230 до 300 см та проводилася заободово з наступним формуванням ручного термінолатерального дуоденоеюноанастомозу. Біліопанкреатична петля включалась у пасаж анастомозом «бік у бік» із формуванням загального каналу довжиною 100 см (рис. 1).
Запланований фіксований термін оцінки результатів оперативних втручань — 6 місяців.
У передопераційному періоді всім хворим виконували комплекс обстежень, спрямованих на виявлення супутніх захворювань та порушень, характерних для метаболічного синдрому, визначали масу тіла, індекс маси тіла (ІМТ), надлишок маси тіла (НМТ). НМТ визначали шляхом віднімання від реальної маси тіла величини ідеальної маси тіла, яку обчислювали за формулою B.J. Devine:
Ідеальна маса тіла (чоловіки, кг) = 50 + 2,3 кг на кожні 2,54 см зросту понад 1,52 м.
Ідеальна маса тіла (жінки, кг) = 45,5 + 2,3 кг на кожні 2,54 см зросту понад 1,52 м.
Оцінка ризику оперативних втручань проводилась за шкалою PPOSSUM (http://www.riskprediction.org.uk/ppindex.php).
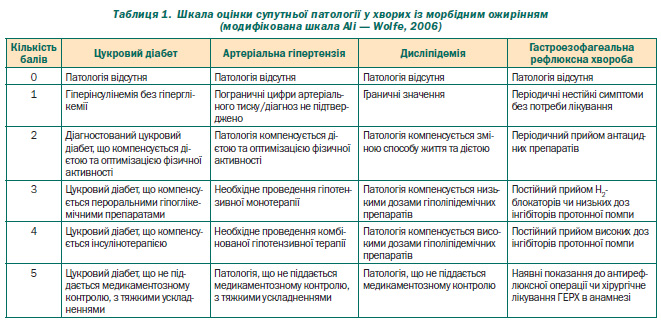
Ступінь вираженості супутньої патології оцінювався за шкалою AORC (табл. 1) — Assessment of ObesityRelated Comorbidity Scale (Ali — Wolfe, 2006) та підтверджувався об’єктивними клініколабораторними та інструментальними даними.
Діагноз метаболічного синдрому встановлювався на основі комбінації критеріїв згідно з рекомендаціями ВООЗ (1999). Уміст інсуліну та Спептиду у венозній крові визначали радіоімунним методом.
Для діагностики цукрового діабету 2го типу використовували критерії Американської діабетичної асоціації (1998), згідно з якими зазначений діагноз встановлювався хворим за наявності:
- більше ніж одного епізоду глікемії натще понад 7 ммоль/л чи/або 11,1 ммоль/л в плазмі крові через 2 год від початку глюкозотолерантного тесту;
- нормального чи підвищеного рівня Среактивного пептиду (понад 0,9 нг/мл) для виключення цукрового діабету 1го типу.
Крім того, за результатами визначення рівня глікемії натще та під час проведення глюкозотолерантного тесту передбачався поділ хворих на групи з нормальною толерантністю до глюкози, з порушенням глікемії натще, з порушенням толерантності до глюкози.
У післяопераційному періоді проведено дослідження динаміки маси тіла та пов’язаних із нею показників, супутньої патології, вивчення ранніх ускладнень.
З метою диференційованої оцінки останніх використано класифікацію Американської колегії хірургів (American College of Surgeons), згідно з якою з огляду на клінічну значимість усі післяопераційні ускладнення поділяються на «малі» та «великі».
Ендоскопічну оцінку вираженості рефлюксезофагіту проведено згідно з ЛосАнджелеською класифікацією.
Статистичну обробку результатів досліджень здійснювали з використанням tкритерію Стьюдента та визначенням вірогідності різниці показників (Р).
Результати
Маса тіла пацієнтів до операції знаходилась у діапазоні від 120 до 205 кг, у середньому 160,5 ± 22,8 кг. ІМТ становив від 41,4 до 75,4 кг/м2, середній показник 53,7 ± 8,9 кг/м2. При цьому у 8 (53,3 %) хворих діагностовано морбідне суперожиріння (ІМТ понад 50 кг/м2). У пацієнтів, включених у дослідження, зафіксовано НМТ від 60 до 141 кг, у середньому — 93,5 ± 21,8 кг.
У передопераційному періоді в усіх хворих діагностовано декілька cyпутніх захворювань та клінічно значимих метаболічних порушень: артеріальна гіпертензія — у 15 (100 %), дисліпідемія — у 15 (100 %), цукровий діабет (ЦД) 2го типу — у 4 (26,6 %), порушення толерантності до глюкози — у 4 (26,6 %), гастроезофагеальна рефлюксна хвороба — в 11 (73,3 %), ерозивний гастродуоденіт — у 4 (26,6 %), грижа передньої черевної стінки — у 2 (13,3 %), жовчнокам’яна хвороба — у 2 (13,3 %), синдром Піквіка — у 3 (20 %), хронічна лімфовенозна недостатність нижніх кінцівок — у 7 (46,6 %) хворих. Інші захворювання — у 4 (26,6 %) пацієнтів.
Діагноз метаболічного синдрому встановлено у 8 (53,3 %) хворих. У 7 (46,7 %) хворих результати глюкозотолерантного тесту були в межах норми. Порушення глікемії натще не виявлено в жодного з хворих.
На момент госпіталізації до клініки 2 хворі на цукровий діабет приймали пероральні гіпоглікемічні препарати, 2 пацієнтам проводилась інсулінотерапія. У всіх хворих з порушенням вуглеводного обміну виявлено гіперінсулінемію.
Установлено, що до операції в усіх хворих дисліпідемія мала комбінований характер. При цьому підвищення рівня тригліцеридів зафіксовано у 9 пацієнтів, холестерину (ХС) ліпопротеїдів низької щільності (ЛПНЩ) — у 10, ХС ліпопротеїдів дуже низької щільності (ЛПДНЩ) — у 7, зниження рівня ХС ліпопротеїдів високої щільності (ЛПВЩ) — у 14 хворих.
У групі хворих на ГЕРХ у 8 (72,7 %) пацієнтів ендоскопічно діагностовано LAA, у 3 (27,3 %) — LAB рефлюксезофагіт.
Прогнозована частота післяопераційних ускладнень та госпітальної летальності за шкалою PPOSSUM становила 35,6 ± 15,5 % та 2,6 ± 4,4 % відповідно.
Передопераційна бальна оцінка вираженості супутньої патології за шкалою AORC Ali — Wolfe: цукровий діабет — 2,4 ± 1,4; дисліпідемія — 3,1 ± 0,9; артеріальна гіпертензія — 3,2 ± 0,7; гастроезофагеальна рефлюксна хвороба — 2,0 ± 0,5 у хворих.
Ранні післяопераційні ускладнення загалом зареєстровані у 4 (26,7 %) хворих (у 2 — серома післяопераційної рани, в 1 хворої — кровотеча з дренажної контрапертури та в 1 пацієнта — шлункова кровотеча з лінії стаплерного шва). Шлункову кровотечу зупинено консервативно без проведення трансфузійної терапії. Жодне вищезазначене ускладнення не потребувало подовження терміну чи повторної госпіталізації хворих та не відносилося до «великих».
Середній термін післяопераційного перебування хворих у стаціонарі — 9,3 ± 1,6 доби. Летальних випадків не було.
Через 6 місяців після операції зафіксована втрата НМТ на 57,0 ± 9,6 %, за показником ІМТ — на 17,9 ± 4,8 кг/м2.
Протягом періоду спостереження відмічена стійка регресія оцінки вираженості супутньої патології за шкалою AORC Ali — Wolfe, що через 6 місяців після операції становила: цукровий діабет — 1,1 ± 0,9; дисліпідемія — 2,8 ± 1,2; артеріальна гіпертензія — 1,9 ± 0,8; гастроезофагеальна рефлюксна хвороба — 0,63 ± 0,60.
Різниця за бальною оцінкою супутньої патології за AORC Ali — Wolfe порівняно з передопераційними показниками статистично значима (p < 0,05), окрім дисліпідемії, що підтверджено об’єктивними клініколабораторними та інструментальними даними.
Так, у групі хворих із цукровим діабетом рівень глікемії натще до операції — 11,1 ± 0,9 ммоль/л, рівень глікозильованого гемоглобіну — 8,1 ± 0,4 %. Через 6 місяців після операції зазначені показники зафіксовані на рівні 5,9 ± 0,9 ммоль/л та 5,1 ± 0,2 % відповідно. У жодного пацієнта рівень глікозильованого гемоглобіну не перевищував 6,0 %. Компенсації цукрового діабету досягнуто без подальшого прийому інсуліну чи пероральних гіпоглікемічних препаратів. У 4 хворих із порушенням толерантності до глюкози контрольний глюкозотолерантний тест — без відхилень від норми. У 7 (87,5 %) пацієнтів із порушенням вуглеводного обміну досягнуто нормалізацію рівня інсуліну, в 1 (12,5 %) пацієнта — гіперінсулінемія зі стійкою тенденцією до регресії.
Незважаючи на тенденцію до зниження рівня загальних ліпідів, тригліцеридів, ХС ЛПДНЩ та ЛПНЩ та підвищення ХС ЛПВЩ, суттєвого покращення показників ліпідного обміну у хворих через 6 місяців після операції не відбулося.
У 13 (86,6 %) хворих протягом періоду спостереження зафіксовано стійку нормалізацію артеріального тиску без потреби проведення гіпотензивної терапії. У 2 (13,4 %) пацієнтів артеріальна гіпертензія ефективно контролювалась монотерапією.
Через 6 місяців після оперативного лікування повну регресію клінічних проявів та ендоскопічної картини гастроезофагельної рефлюксної хвороби зафіксовано в 6 (54,5 %) пацієнтів. У той же час у 3 (27,3 %) хворих спостерігалися періодичні нестійкі симптоми зазначеної патології без використання антацидних препаратів за відсутності ендоскопічних змін слизової оболонки стравоходу. У 2 (18,2 %) пацієнтів ендоскопічно діагностовано LAA рефлюксезофагіт на тлі періодичного прийому інгібіторів протонної помпи.
У жодного із 3 хворих із діагностованим до операції синдромом Піквіка через 6 місяців після виконання БПШ із ДВ клінічних проявів зазначеного клінічного синдрому ми не спостерігали.
Синдром здуття живота (gasbloat syndrome) виник в 1 (6,6 %) пацієнта.
Інших пізніх післяопераційних ускладнень, що вважаються найбільш характерними для БПШ (гіпопротеінемія, анемія, демпінгсиндром, пептичні виразки дуоденоеюноанастомозу) за період спостереження не зафіксовано.
Висновки
Морбідне ожиріння — це хронічне захворювання, що асоційоване з високою частотою супутніх захворювань та специфічних метаболічних порушень, корекція яких є одним із ключових завдань баріатричної хірургії.
Хворі із морбідним ожирінням становлять групу високого операційноанестезіологічного ризику та потребують комплексного мультидисциплінарного підходу, спрямованого на профілактику прогнозованих післяопераційних ускладнень.
Біліопанкреатичне шунтування з дуоденальним виключенням є високоефективним хірургічним втручанням щодо корекції порушень обміну речовин та компенсації супутньої патології у хворих із морбідним ожирінням.
Список літератури знаходиться в редакції