Журнал «» 1 (27) 2013
Вернуться к номеру
Частота серцевих скорочень та артеріальна гіпертензія: вплив на смертність та захворюваність
Авторы: Сіренко Ю.М., ДУ ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска», м. Київ
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Разделы: Медицинское образование
Версия для печати
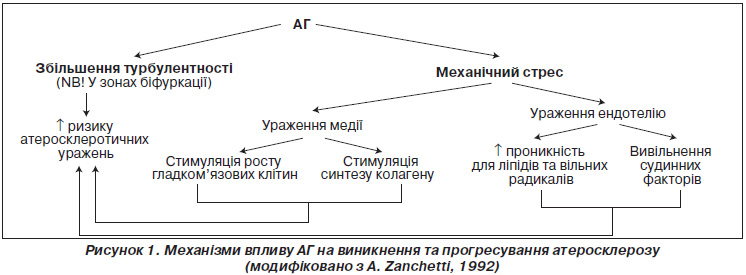
Артеріальна гіпертензія (АГ) — один із найсильніших факторів ризику атеросклерозу. Давно відомо, що АГ провокує атеросклеротичні зміни у стінках артерій та призводить до виникнення ускладнень. Через які патогенетичні механізми АГ може спричинити розвиток атеросклерозу? Найбільш очевидним є механічний вплив на артеріальну стінку. Як турбулентний кровотік, так і механічне пошкодження ендотелію відіграють певну роль у розвитку атеросклерозу. АГ провокує виникнення турбулентного току крові, а гемодинамічне навантаження впливає виключно на місця біфуркацій артеріального дерева. Турбулентний потік крові може викликати появу та прогресування атеросклеротичного ураження на внутрішній поверхні артерій.
Інший механізм — вплив на функцію ендотелію. Ендотелій являє собою проміжну ланку між механічними, гемодинамічними, гуморальними та метаболічними факторами. Пошкодження ендотелію призводить до підвищення проникності судинної стінки з подальшою пенетрацією клітин та молекул із крові, особливо ліпідів та вільних радикалів. Крім того, в пошкодженому ендотелії вивільняються фактори вазоконстрикції, такі як ендотелін-1 та фактори росту. Схематично вплив АГ на виникнення та прогресування атеросклерозу наведено на рис. 1.
Частота серцевих скорочень (ЧСС) визначає величину ударного об’єму, що, у свою чергу, детермінує як величину механічного удару, так і характеристику току крові. Таким чином, величина ЧСС напряму пов’язана із ступенем механічного впливу на стінку судин і, відповідно, реакцією судинної стінки та активністю процесів у ній.
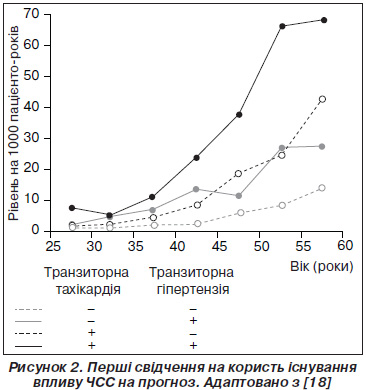
Перші публікації щодо впливу підвищення частоти серцевих скорочень при АГ з’явилися ще в 40-ві роки ХХ століття. У роботі фундаторів сучасної кардіології R.L. Levi, P.D. White зі співавторами (1945) було показано, що наявність транзиторної тахікардії збільшує ризик серцево-судинних ускладнень, а при її поєднанні з АГ у того ж самого пацієнта може підвищити ризик несприятливих подій майже вдвічі [18]. Дані цієї роботи наведені на рис. 2.
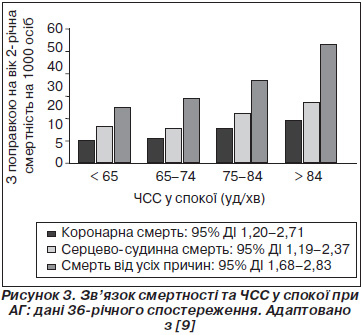
Приблизно через 40 років після перших публікацій були оприлюднені дані аналізу Фремінгемського дослідження за участі 2037 чоловіків із підвищеним артеріальним тиском (АТ). У хворих з артеріальною гіпертензією було виявлено існування уніваріантних (скорегованих за віком) зв’язків між рівнем ЧСС та смертю від усіх причин, смертю від серцево-судинних захворювань, смертю від ІХС [9]. Дані наведені на рис. 3.
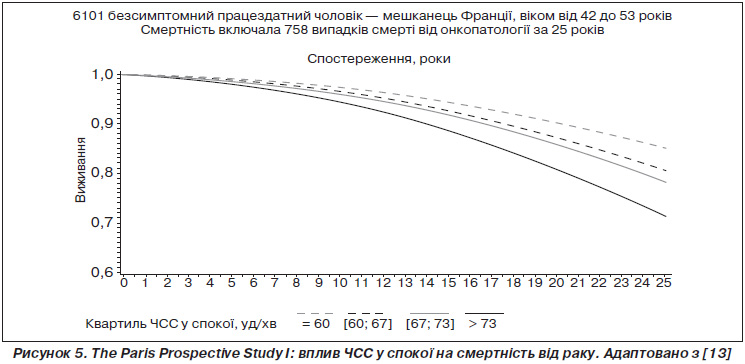
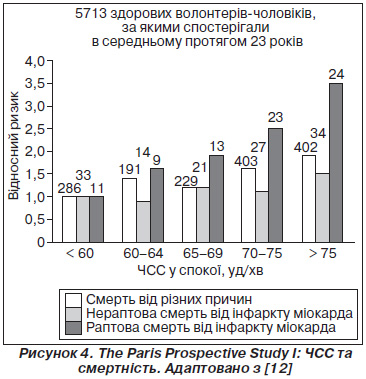
Подібні дані також було отримано в результаті проведення дослідження The Paris Prospective Study I. Вибірка включала майже 6000 чоловіків робочого віку, у яких підвищення рівня ЧСС у стані спокою від 60 до понад 75 уд/хв асоціювалося зі збільшенням рівня 23-річної загальної смертності, а також раптової смерті та смерті від інфаркту міокарда [12]. Дані наведені на рис. 4.
Більше того, аналіз даних цього когортного дослідження виявив, що підвищення ЧСС було предиктором смертності від раку. Дані наведені на рис. 5.
ЧСС — загальний інтегральний показник багатьох фізіологічних систем організму, таких як серцево-судинна, дихальна та нейропсихічна. Автори аналізу вважають, що підвищення ЧСС може бути маркером хронічного стресу й тривоги, які, у свою чергу, можуть також збільшувати ризик раку. Зв’язки ЧСС та наступного зростання смертності від раку були постійними, градованими та високодостовірними. Тому визначення ЧСС — доведений простий та неінвазивний метод стратифікації ризику онкологічних захворювань [13].
Усе більше сучасних публікацій виявляють взаємозв’язок між індивідуальним рівнем ЧСС та генетичним фоном, можливо — типом реактивності серцево-судинної системи або вегетативної регуляції її діяльності. Так, в оригінальній роботі B. Gombojav зі співавторами (2008), проведеній на батьках та нащадках у монгольській популяції, показано, що рівень ЧСС детермінується генами. Автори виявили локалізацію цих генів у декількох локусах. Вони наполягають: «Детальне вивчення генів, які впливають на варіабельність серцевого ритму, може призвести до розкриття патогенетичних механізмів, що лежать в основі варіабельності серцевого ритму та його зв’язку із серцево-судинними захворюваннями, а також до впровадження раціонального терапевтичного втручання» [10].
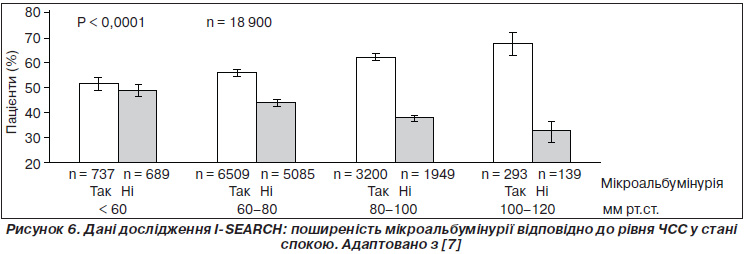
Іншим важливим доказом прогностичної ролі ЧСС є асоціація з ураженням органів-мішеней. Існує достатнє число сучасних публікацій стосовно збільшення ступеня пошкодження органів-мішеней у хворих з артеріальною гіпертензією та збільшеною ЧСС. Якщо зв’язок ЧСС з ураженням аорти та магістральних артерій еластичного типу лежить на поверхні і вкладається в описані вище патогенетичні механізми зв’язку з атеросклерозом та артеріосклерозом, то зв’язок з ураженням нирок має більш складну природу. У міжнародному дослідженні I-SEARCH (International Survey Evaluating Microalbuminuria Routinely by Cardiologists in Patients with Hypertension) на значному клінічному матеріалі (18 900 хворих) було показано, що із зростанням ЧСС (із > 80 уд/хв до < 120 уд/хв) збільшувалася кількість хворих, у яких виявлялася мікроальбумінурія (МАУ), — із 63 до 69 % (P < 0,0001) [7]. Дані наведені на рис. 6. Розвиток дисфункції нирок у пацієнтів із гіпертонічною хворобою та високою ЧСС доводить, що поряд з ураженням головного мозку, серця і судин можуть уражатися й інші органи. Ці результати показують, що ЧСС є незалежним предиктором виникнення МАУ у хворих на АГ із серцево-судинними факторами ризику.
Більше того, у деяких публікаціях протягом останніх 5 років збільшення ЧСС пов’язують із прогресуванням метаболічних розладів та розвитком вісцерального ожиріння при АГ. У роботі Yu. Yano зі співавторами (2011) показано, що у хворих, які отримували антигіпертензивну терапію, висока ЧСС увечері була пов’язана з розвитком вісцерального ожиріння, незалежно від початкового ступеня вираженості підшкірного жиру та ІМТ [35]. Автори вважають, що ці дані можуть пояснити, чому серцево-судинний ризик вищий в осіб із більшою ЧСС. На нашу думку, говорячи про зв’язок зростання ЧСС та ступеня метаболічних порушень, не можна оминути питання симпатичної гіперактивації, що, як відомо, наявна в усіх пацієнтів з ожирінням та метаболічними порушеннями.
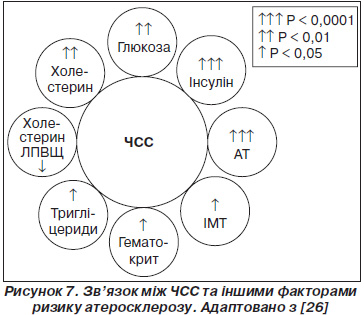
Як уже зазначалося, обговорення механізмів впливу регуляторних систем гомеостазу на ЧСС триває понад 60 років. Пропонувалися різні експериментальні та клінічні моделі. На рис. 7 наведені можливі зв’язки між ЧСС та діяльністю регуляторних систем організму, що було запропоновано P. Palatini та S. Julius у 1997 році [26]. Вони відображають тісний зв’язок між нервовою та гуморальною ланками регуляції гемодинаміки. Крім цього, існують ще й інші механізми регуляції, такі як метаболічні параметри, показники в’язкості крові та ін.
Таким чином, усе вищезазначене дозволяє зробити висновок, що на даний момент існує достатня доказова база, яка дозволяє розглядати підвищення ЧСС як незалежний простий, але сильний фактор ризику серцево-судинної захворюваності та смертності у хворих на АГ. У 2006 році Європейське товариство гіпертензії зібрало групу провідних експертів, які створили та опублікували від імені товариства позиційний документ стосовно виявлення та лікування пацієнтів з АГ та підвищеною ЧСС [24]. У цьому документі експерти товариства розглядають рівень ЧСС як незалежний фактор ризику подальших серцево-судинних ускладнень.
Основні положення документа:
— позитивна кореляція між загальною та/або серцево-судинною смертністю показана в 37 із 39 досліджень;
— така кореляція незалежна від інших факторів ризику розвитку атеросклерозу та серцево-судинних подій;
— вираженість зв’язку подібна до такої при палінні;
— кореляція існує в різних клінічних умовах та в пацієнтів із супутніми захворюваннями або без них;
— корелятивні зв’язки наявні в групах різного віку;
— кореляція спостерігалась і через один рік після початкової оцінки;
— кореляція була меншою для жінок.
У 80-х роках XX століття в науковій літературі почалося обговорення можливого впливу антигіпертензивної терапії не лише на рівень АТ, а й на ЧСС [11]. На той момент основними препаратами, які б виконували дане завдання, були бета-адреноблокатори (БАБ). Їх ефекти порівняно з іншими групами антигіпертензивних засобів, що застосовувалися, були найбільш вивченими, відповідно, їх позиції як препаратів вибору виглядали абсолютно непохитними.
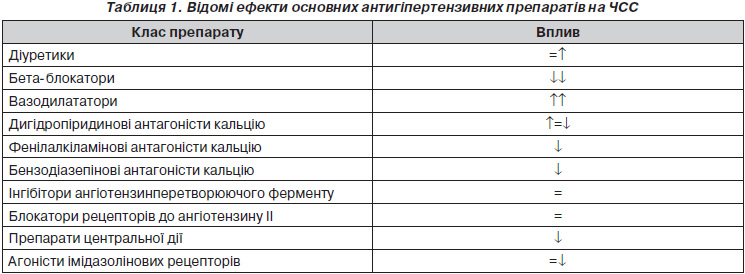
За роки, що минули, рекомендації з лікування АГ змінилися кардинально: список препаратів першого ряду включає не два, а п’ять класів. Існує багато інших антигіпертензивних засобів другого ряду, які можуть змінювати ЧСС. З’явилися нові препарати, що можуть впливати на механізми формування імпульсу в синусовому вузлі й регулювати ЧСС. У табл. 1 наведені добре відомі ефекти на ЧСС основних антигіпертензивних препаратів.
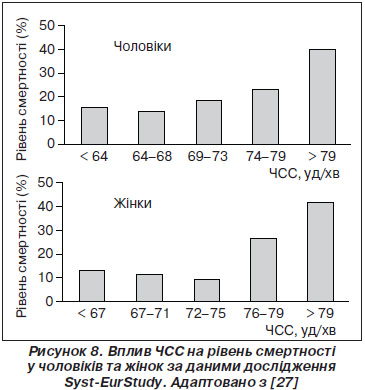
Незважаючи на велику зацікавленість у проблемі впливу ЧСС на прогноз, лише протягом останньої декади було проведено доказову об’єктивізацію впливу антигіпертензивної терапії на ЧСС та прогноз за даними великих клінічних досліджень. Першим за хронологією (2002) був опублікований аналіз бази даних дослідження Syst-Eur. У ньому було зазначено, що незалежно від лікування нітрендипіном або використання плацебо у хворих похилого віку з ізольованою систолічною АГ установлено наявність прямого негативного впливу збільшення ЧСС на прогноз [27]. Дані наведені на рис. 8. Цей вплив був незалежним від позитивного впливу зниження АТ у групі нітрендипіну.
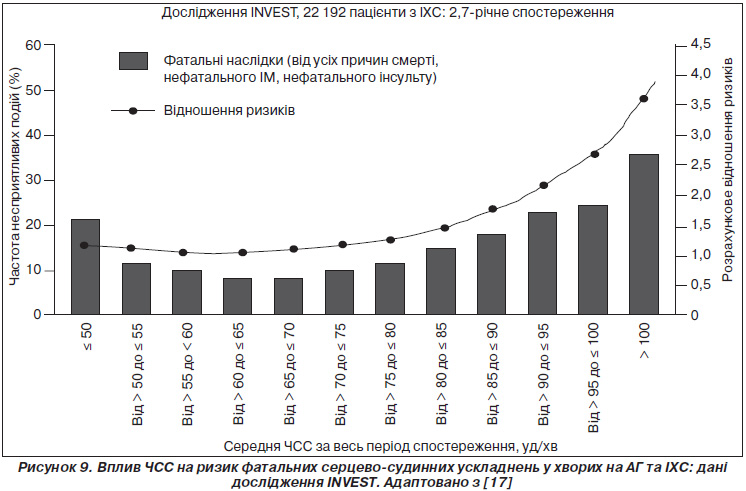
При ретроспективному аналізі результатів дослідження INVEST у пацієнтів з ІХС та АГ (база даних включала 22 192 хворі) високий рівень ЧСС на початку та під час спостереження був пов’язаний із збільшенням ризику фатальних серцево-судинних ускладнень [17]. Дані наведені на рис. 9. Вони підтверджують та доповнюють попередні дані епідеміологічних та інших клінічних досліджень, демонструючи те, як саме пов’язане підвищення ЧСС зі збільшенням ризику. Зв’язок можна описати як J-подібну криву: є серединні значення з мінімальним рівнем ризику, а збільшення або значне зменшення асоційоване із суттєвим зростанням такого ризику. Важливим було те, що достовірне зростання ризику вже спостерігалось у пацієнтів із ЧСС вище 75 уд/хв, що значно нижче від загального визначення тахікардії.
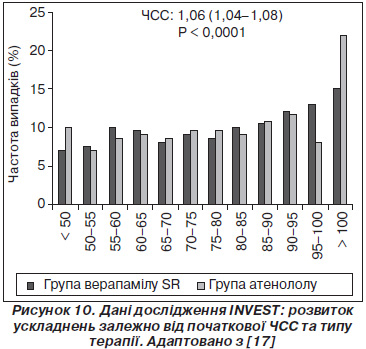
У дослідженні INVEST порівнювали ефективність антигіпертензивної терапії за допомогою верапамілу тривалої дії (верапаміл SR) та атенололу. При необхідності до верапамілу додавали трандалоприл, а до атенололу — гідрохлортіазид. Аналіз ефективності терапії в цьому дослідженні показав відсутність різниці між групами лікування. Так само терапія не впливала на прогностичну значимість підвищеної ЧСС: збільшена ЧСС на початку дослідження та протягом періоду спостереження незалежно від стратегії лікування була пов’язана з ризиком несприятливих подій із наявністю лінійного зв’язку із початковим рівнем ЧСС та J-кривої із рівнем ЧСС під час спостереження, хоча рівень несприятливих подій в цих групах достовірно не відрізнявся [17]. Дані наведені на рис. 10.
На рис. 11 наведено добре відому ілюстрацію із дослідження CAFЕ, що було частиною дослідження ASCOT-BLA [33]. На рис. 11 зображено різні форми пульсової хвилі пацієнтів одного й того ж віку, які приймали для зниження АТ атенолол або амлодипін як монотерапію. Вплив на рівень АТ на плечовій артерії був абсолютно однаковим. При цьому при однаковій початковій форми пульсової хвилі під впливом препаратів спостерігалися принципово різні процеси. Сповільнення ЧСС під впливом атенололу без периферійної вазодилатації приводило до того, що відбита пульсова хвиля поверталася в більш ранню фазу серцевого циклу і її сумація із прямою хвилею спричиняла підвищення центрального аортального тиску. При прийомі амлодипіну ЧСС не зменшувалася, а внаслідок вазодилатації місце відбиття пульсової хвилі зміщувалося на периферію. Таким чином, відбита хвиля поверталася в більш пізню стадію серцевого циклу без накладки на максимум прямої хвилі.
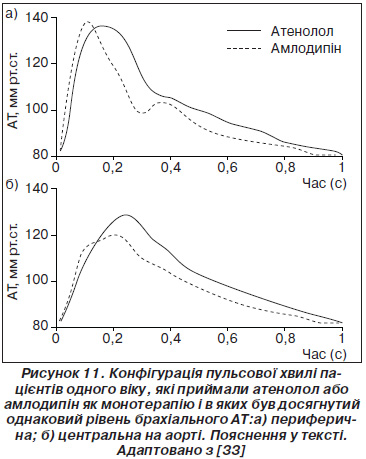
Наслідком цього була відсутність додаткового підвищення центрального аортального тиску при застосуванні амлодипіну. Головний висновок, що в даному випадку можна зробити: визначення АТ виключно на плечовій артерії може призвести до переоцінки впливу БАБ на центральний систолічний тиск в аорті та спричинити недооцінку впливу антагоністів кальцієвих каналів та інгібіторів АПФ. Для повноти оцінки гемодинамічних ефектів антигіпертензивних засобів необхідно знати їх вплив на центральний тиск в аорті.
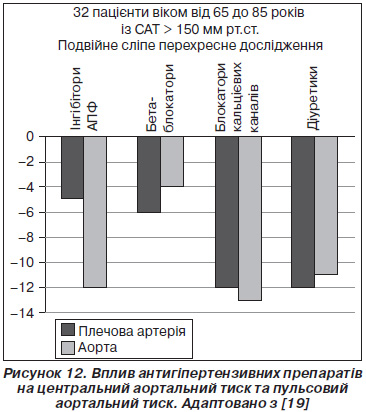
Останніми роками вплив антигіпертензивної терапії на жорсткість артерій та рівень центрального АТ став центральною проблемою в лікуванні хворих на АГ. Але лише декілька публікацій прямо присвячені порівнянню зміни систолічного тиску в аорті під впливом різних медикаментозних препаратів. Найбільш вдалий дизайн, на нашу думку, мало дослідження T. Morgan зі співавторами (2008) [19]. Це було подвійне сліпе перехресне дослідження: одні й ті ж хворі послідовно приймали різні препарати, і ефект терапії різними засобами порівнювали напряму. Дані наведені на рис. 12. Зростання тиску в аорті в групі бета-блокаторів було більшим порівняно з іншими трьома групами препаратів (P < 0,05), а приріст тиску в групі інгібіторів АПФ, антагоністів кальцієвих каналів та діуретиків був меншим, ніж у групі плацебо (P < 0,05). Найбільш низького порівняно з іншими препаратами рівня центрального тиску в аорті вдалося досягти в групі антагоністів кальцієвих каналів та діуретиків.
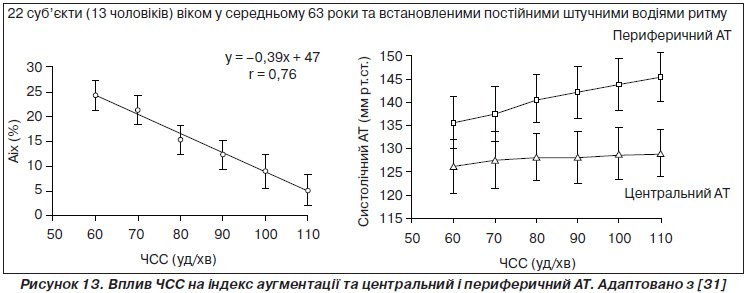
Питання впливу ЧСС на приріст АТ в аорті внаслідок повернення відбитої хвилі в більш ранню фазу серцевого циклу в клініці було досконало вивчено в дуже елегантному дослідженні I. Wilkinson зі співавторами (2000) [31]. У ньому проведене пряме вивчення величини ЧСС у пацієнтів з імплантованими штучними водіями ритму. Результати дослідження наведені на рис. 13. Установили наявність достовірного зворотного лінійного зв’язку між індексом аугментації (AIx) та ЧСС. Під час збільшення частоти стимуляції достовірно зростали рівні периферичного систолічного, діастолічного та середнього АТ.
Автори припускають, що такі зміни центральної гемодинаміки відбулися внаслідок змін у часі повернення відбитої хвилі, які виникли при зміні абсолютної тривалості систоли та зсуву часу повернення відбитої хвилі в діастолу. Також було виявлено позитивний зв’язок між ЧСС та рівнем периферичного АТ та зворотний — між ЧСС та рівнем центрального тиску в аорті. Таким чином, однозначно встановлено, що проста зміна ЧСС без впливу на тонус резистивних судин прямо впливає на структуру серцевого циклу, час повернення відбитої хвилі, індекс аугментації: зниження ЧСС менше певної величини завжди буде збільшувати індекс аугментації, але не завжди це буде супроводжуватися зростанням центрального аортального тиску.
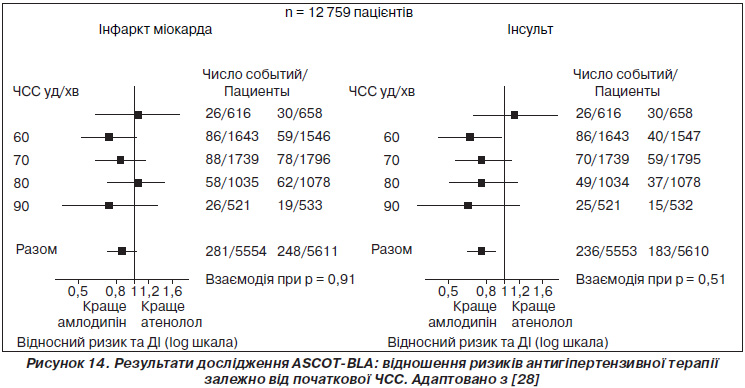
Питання прогностичного значення зміни ЧСС під впливом лікування досліджували і в уже згаданому дослідженні ASCOT-BLA (рис. 14) [28]. У цьому масштабному дослідженні порівнювали ефективність старої (атенолол) та нової (амлодипін) стратегій антигіпертензивної терапії. Для пацієнтів з АГ, які не мали ІХС, достовірно не довели перевагу стратегії зниження початкової ЧСС на фоні прийому атенололу порівняно з лікуванням амлодипіном, що не тільки не змінювало ЧСС, а навіть призводило до її збільшення. Більше того, ризик виникнення судинно-мозкових ускладнень був достовірно меншим у групі амлодипіну. Це автори дослідження прямо пов’язали з більш ефективним зниженням центрального аортального тиску під впливом амлодипіну порівняно з атенололом. Провідні експерти, коментуючи такий результат, погодилися визнати лише, що ці дані свідчать про те, що в подібних групах хворих із гіпертензією без попередньої або наявної ІХС ЧСС, вища від базового рівня, не є показанням для того, щоб віддавати перевагу терапії b-блокаторами. Ми від себе хотіли б додати, що така трактовка результату повинна прийнятна тільки щодо атенололу.
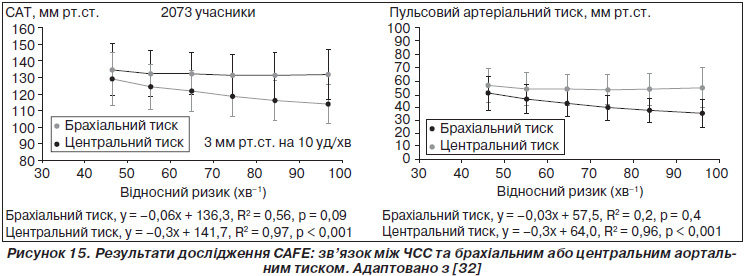
Як зазначалося вище, дослідження CAFЕ було частиною дослідження ASCOT-BLA. Визначення рівня центрального аортального тиску в ньому проводили неінвазивним методом за аналізом контуру пульсової хвилі на апараті Sphygmocor. Отримані дані свідчили, що менший рівень ЧСС асоціювався з вищим центральним систолічним та пульсовим тиском у пацієнтів з АГ, незалежно від типу призначеної медикаментозної терапії [33]. Дані наведені на рис. 15. Між рівнем ЧСС та амплітудою відбитої пульсової хвилі існував достовірний зворотний зв’язок: при кожному зменшенні ЧСС на 10 уд/хв спостерігалося збільшення його величини на 3 мм рт.ст. Величина АТ на плечовій артерії не залежала від ЧСС. Автори дослідження вважають, що, можливо, у цьому і криється основна причина того, що терапія БАБ менш ефективна щодо зниження серцево-судинних подій, особливо інсультів, порівняно з лікуванням іншими препаратами у хворих на АГ. Дане дослідження ставить важливе питання про те, чи будуть спостерігатися подібні ефекти в інших бета-блокаторів, крім атенололу, наприклад у вазодилатуючих бета-блокаторів. Ще одним суперечливим моментом цих результатів є технологічні аспекти дослідження: ЧСС оцінювали на автоматичних приладах для вимірювання АТ, а не за допомогою ЕКГ або звичайного підрахунку частоти пульсу лікарем.
Результати дослідження ASCOT-BLA щодо негативного впливу зниження ЧСС на прогноз, які ми детально обговорили, вступають у певне протиріччя з даними більшості інших досліджень, які проводилися в загальній популяції, та всіма попередніми дослідженнями, що проводилися за участі пацієнтів з АГ. Виявилося, що початковий рівень ЧСС не був предиктором несприятливих наслідків. Крім того, при збільшенні ЧСС навіть не спостерігалося тенденції до збільшення ризику виникнення серцево-судинних подій. Як зазначалося вище, у дослідженнях із вторинної профілактики (наприклад, INVEST) рівень ЧСС виявився більш стійким предиктором серцево-судинних подій, але пацієнтів з ІХС було виключено із дослідження ASCOT.
Але, незважаючи на всі критичні зауваження, завдяки результатам дослідження ASCOT-BLA ми всі знаємо подальшу долю атенололу як антигіпертензивного препарату: на даний момент він не рекомендований як препарат першої лінії.
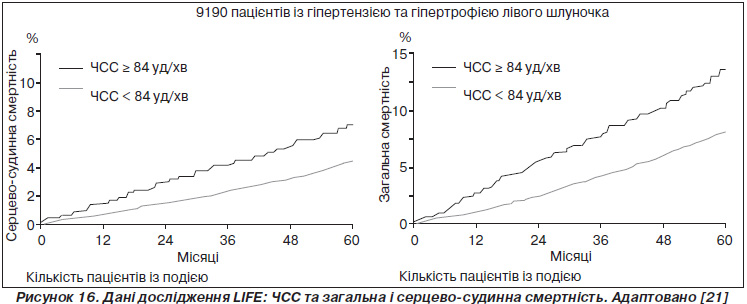
Дані дослідження ASCOT-BLA викликали широку дискусію в науковій літературі. Як доказ положення щодо негативного впливу підвищеної ЧСС проведено аналіз баз даних інших масштабних досліджень. Нижче ми наводимо дані дослідження LIFE, у якому порівнювали ефективність терапії атенололом і лосартаном у пацієнтів з АГ та гіпертрофією лівого шлуночка. Незважаючи на режим терапії, персистування ЧСС ≥ 84 уд/хв або виникнення такої ЧСС протягом дослідження було пов’язане зі зростанням ризику серцево-судинної смерті на 89 % та ризику смерті від усіх причин — на 97 % [21]. Дані наведено на рис. 16. Після поправки результатів по групах лікування стало очевидним, що зростання ЧСС на кожні 10 уд/хв було пов’язане зі зростанням ризику серцево-судинної смертності на 16 % і на 25 % — ризику смерті від інших причин.
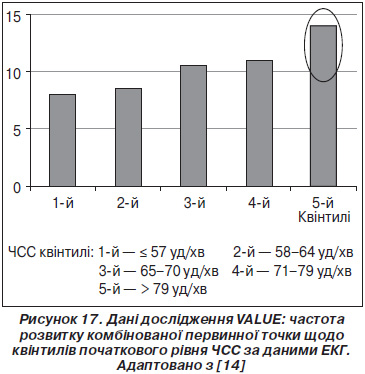
Подібні результати були отримані при ретроспективному аналізі бази даних дослідження VALUE. У цьому дослідженні було показано, що терапія валсартаном та амлодипіном рівнозначно знижувала кількість первинних кінцевих точок серцево-судинної смертності або загальної смертності у пацієнтів з артеріальною гіпертензією та принаймні одним підвищеним фактором ризику. Новий аналіз показав, що достовірне збільшення ризику спостерігалося в пацієнтів із початковим рівнем ЧСС 79 уд/хв і більше, і це збільшення ризику було незалежним від обраної медикаментозної терапії [14]. Дані наведені на рис. 17.
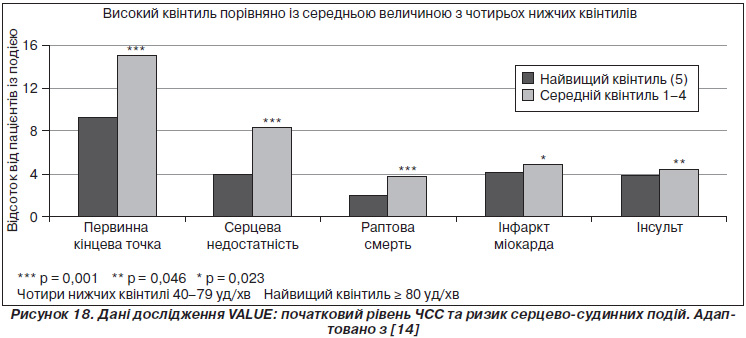
Результати більш детального аналізу показали значне збільшення первинних кінцевих точок у найбільшому квінтилі ЧСС (≥ 79 уд/хв) порівняно з об’єднаними даними інших квінтилів. Дані наведені на рис. 18. Негативний вплив тахікардії під час спостереження не змінювався навіть при досягненні контролю АТ під час дослідження. Пов’язане з цим збільшення первинних кінцевих точок у групі пацієнтів зі збільшеною ЧСС становило близько 68 % при контрольованому АТ та 63 % — при недосягненні контролю АТ (p < 0,0001).
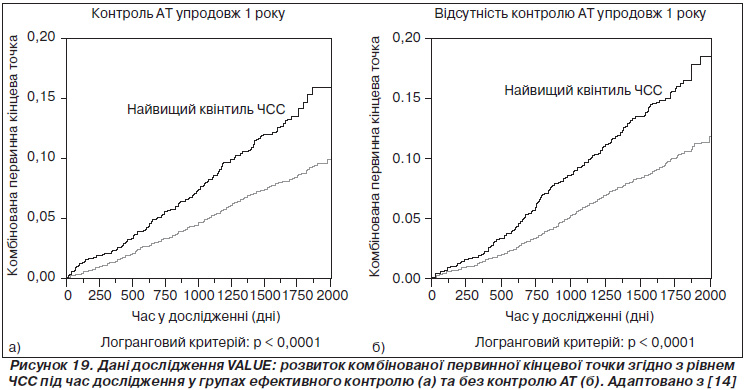
Ще більш цікаві дані було отримано в результаті аналізу рівнів досягнутого АТ та ЧСС під час дослідження. Скореговане відношення ризиків для первинних кінцевих точок для найвищого квінтиля ЧСС під час дослідження проти найнижчого квінтиля становило 1,53 (95% ДІ 1,26–1,85). Частота первинних кінцевих точок у групі найвищої ЧСС порівняно із середнім з об’єднаними чотирма нижчими квінтилями була на 53 % вищою у пацієнтів із добре контрольованим рівнем АТ на етапі 1 рік спостереження (P < 0,001) та на 34 % вище в пацієнтів, у яких не вдалося досягти контролю АТ (P < 0,002). Результати наведені на рис. 19. Ці дані підтверджують те, що підвищення ЧСС — це довгостроковий предиктор серцево-судинних подій у хворих на АГ із високим ризиком, та те, що цей вплив неможливо модифікувати навіть шляхом ефективного контролю АТ.
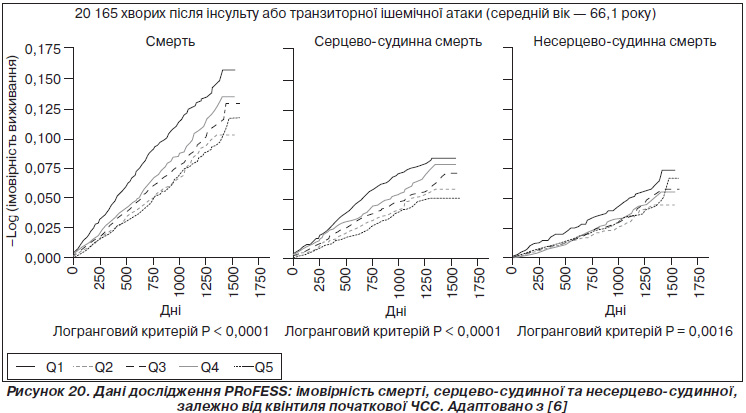
У 2012 році були оприлюднені новітні дані аналізу бази дослідження PRoFESS щодо впливу ЧСС на ефективність вторинної профілактики у хворих після інсульту. У цьому дослідженні взяли участь 20 165 пацієнтів, які перенесли ішемічний інсульт (середній вік 66,1 року; тривалість спостереження 8,6 року), яких було розподілено на квінтилі, залежно від початкового рівня ЧСС. Дані спостереження було проаналізовано залежно від розвитку серцево-судинних ускладнень та функціональних наслідків. Пацієнти у двох квінтилях із найвищою ЧСС (77–82 та 82 уд/хв) були у групі найбільшого ризику (відношення ризиків 1,42 та 1,74, P < 0,0001 для обох випадків) порівняно із найнижчими квінтилями. Подібні результати спостерігалися і для серцево-судинної смертності (до квінтилів 71–≤ 76 уд/хв, відношення ризиків 1,39, P < 0,0001) та несерцево-судинної смерті (від 82 уд/хв, відношення ризиків 1,66, P < 0,0016) [6]. Дані наведені на рис. 20. Ризик розвитку інфаркту міокарда та повторних інсультів не був достовірно пов’язаним із початковим рівнем ЧСС. Таким чином, підвищена ЧСС збільшує ризик смертності в пацієнтів після інсультів, що важливо, низька ЧСС пов’язана із кращими функціональними наслідками й меншими когнітивними розладами після ішемічних інсультів.
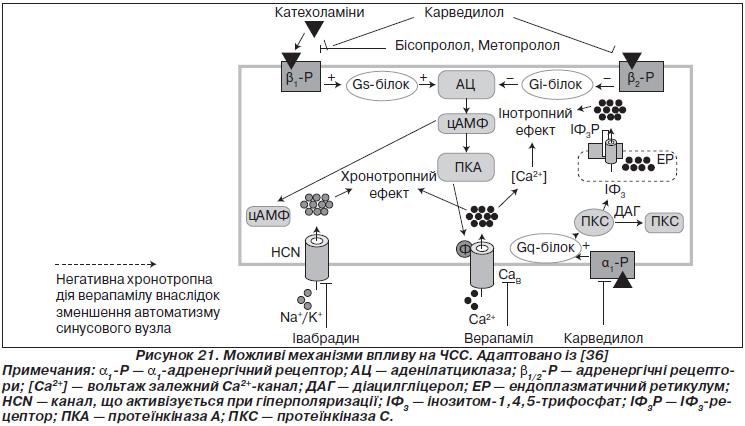
Існує декілька груп препаратів, що застосовують у кардіологічній практиці і які можуть впливати на ЧСС. Одні з них здатні знижувати АТ (бета-адреноблокатори, антагоністи кальцію, резерпін та ін.), а інші — ні (блокатори Іf-каналів, аміодарон та ін.). На рис. 21 наведені основні механізми, через які реалізується вплив на ЧСС. Так, БАБ реалізують свій вплив на ЧСС через a1-адренорецептори, блокуючи ефекти катехоламінів. Івабрадин, єдиний відомий у клініці блокатор Іf-каналів, впливає через калій-натрієві іонні токи в клітинах — генераторах синусового вузла. Зниження частоти серцевих скорочень й уповільнення атріовентрикулярної провідності при застосуванні верапамілу та дилтіазему пов’язане з уповільненням входу кальцієвого потоку в кардіоміоцити синусового та атріовентрикулярного вузлів.
Пригнічення синусового ритму на фоні терапії верапамілом може призвести до зниження швидкості спонтанної діастолічної деполяризації або зсуву передчасного потенціалу дії до менш негативних значень. Верапаміл знижує рівень ініціації спонтанних імпульсів у синусовому вузлі. Цей ефект можливо подолати шляхом введення адреналіну [34]. Антагоністи кальцію за механізмом антигіпертензивної дії є артеріодилататорами. Їх ефект на тонус резистивних судин добре вивчений, вони зміщують до периферії місце відбиття пульсової хвилі. Таким чином, відбита хвиля повертається в більш пізню фазу серцевого циклу й не накладається на пряму хвилю — не відбувається феномену аугментації та, відповідно, зростання центрального тиску в аорті. Крім того, недигідропіридинові блокатори кальцієвих каналів такі, як дилтіазем і верапаміл, ефективні в контролі ЧСС при фібриляції передсердь як у спокої, так і при фізичному навантаженні, але при цьому не знижують толерантність до фізичних навантажень. Механізм дії реалізується через уповільнення проведення через атріовентрикулярний вузол.
Досі невідомо, чи може терапевтичне уповільнення ЧСС покращити серцево-судинний прогноз. Наведені вище наукові дані свідчать про те, що ми не маємо оптимальної стратегії впливу на цей важливий прогностичний фактор. Зрозуміло, що лікування класичними БАБ, незважаючи на ефективне зниження ЧСС, не забезпечило додаткового зменшення серцево-судинного ризику, а в деяких випадках — навпаки. Як було зазначено вище, цей феномен пов’язують із виникненням диссинхронії між роботою серця і периферичних судин. Таким чином, ми вимушені констатувати, що при АГ старі (класичні) БАБ без вазодилатаційного потенціалу не будуть оптимальними для реалізації стратегії зменшення ризику шляхом уповільнення ЧСС. Слід визнати, що можливості верапамілу та дилтіазему в цьому напрямку на сьогодні вивчені недостатньо для того, щоб однозначно рекомендувати їх із такою метою.
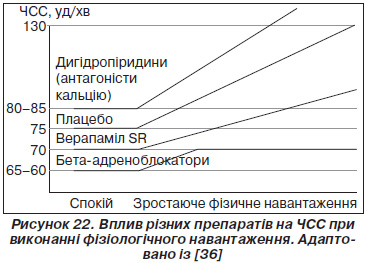
Особливості впливу верапамілу та інших препаратів, які діють на ЧСС (функцію синусового вузла) у здорових добровольців, показано на рис. 22 [36]. Так, під час виконання фізичного навантаження у фізіологічних умовах ЧСС зростає до певного порогу. Дигідропіридинові антагоністи кальцію зміщують цей графік до більш високих значень. БАБ зменшують ЧСС, але на фоні їх дії поріг ЧСС (вихід на плато) зміщується значно униз. На відміну від БАБ при застосуванні верапамілу графік зростання ЧСС зміщується униз, але повторює фізіологічний без раннього виходу на плато.
Для повноти обговорення проблеми не можна оминути увагою дані стосовно застосування нового класу препаратів — блокаторів Іf-каналів. Рандомізоване подвійне сліпе плацебо-контрольоване дослідження BEAUTIFUL установило, що зниження ЧСС за допомогою селективного блокатора Іf-каналів івабрадину не знизило частоту госпіталізацій із приводу серцевої недостатності, що виникла вперше, або погіршення її перебігу у пацієнтів зі стабільною ІХС та дисфункцією лівого шлуночка при збільшенні ризику внаслідок вихідного рівня ЧСС ≥ 70 уд/хв. Хоча в рандомізованому плацебо-контрольованому дослідженні SHIFT івабрадин достовірно знизив частоту комбінованих кінцевих точок серцево-судинної смерті та госпіталізації внаслідок погіршення перебігу СН у пацієнтів із ХСН на початку дослідження. Важливими зауваженнями є те, що івабрадин не впливає на рівень АТ, а також його клінічна ефективність не вивчалась у хворих на АГ.
Висновки
1. У хворих на АГ тахікардія на початку та на фоні лікування — сильний незалежний предиктор серцево-судинних подій.
2. Нормальний рівень АТ на фоні лікування не знижує серцево-судинний ризик, пов’язаний із тахікардією.
3. Рекомендації з лікування АГ повинні розглядати тахікардію як потенційний та клінічно значимий фактор серцево-судинного ризику.
4. Старі БАБ (принаймні атенолол) не підходять для корекції збільшення ЧСС при неускладненій АГ.
5. Верапаміл має більш фізіологічний вплив на функцію синусового вузла, ніж класичні БАБ.
6. Слід дослідити, чи існує користь від сповільнення ЧСС для зниження серцево-судинного ризику при АГ.

1. Aalbers J. Increased heart rate in high-risk hypertensives related to increased heart failure and sudden death // Cardiovasc. J. Afr. — 2010. — Vol. 21. — P. 236.
2. Ahmad R., Ahmad A., Zulfiqar S et al. Relationship of heart rate with hypertension in adult population of Mingora city, district Swat // Biomedica. — 2008. — Vol. 24. — P. 103-107.
3. Al-Reesi A., Al-Zadjali N., Perry J. et al. Do beta-blockers reduce short-term mortality following acute myocardial infarction? A systematic review and meta-analysis // CJEM. — 2008. — Vol. 10. — P. 215-223.
4. Bangalore S., Sawhney S., Messerli F.H. Relation of beta-blocker-induced heart rate lowering and cardioprotection in hypertension // J. Am. Coll. Cardiol. — 2008. — Vol. 52. — P. 1482-1489.
5. Ben-Dov I.Z., Bursztyn M. Increased intervisit blood pressure variability and b-blockade: measurementimprecision related to bradycardia? // Hypertension. — 2010. — Vol. 56. — e48.
6. Bоhm M., Cotton D., Foster L. Et al. Impact of resting heart rate on mortality, disability and cognitive decline in patients after ischaemic stroke // Eur. Heart J. — 2012. — Vol. 33. — P. 2804-2812.
7. Bоhm M., Reil J.C., Danchin N. Et al. Association of heart rate with microalbuminuria in cardiovascular risk patients: data from I-SEARCH // J. Hypertens. — 2008. — Vol. 26. — P. 18-25.
8. Feldman D., Elton T.S., Menachemi D.M. Heart rate control with adrenergic blockade: clinical outcomes in cardiovascular medicine // Vasc. Health Risk Manag. — 2010. — Vol. 6. — P. 387-397.
9. Gillman M.W., Kannel W.B., Belanger A. et al. Influence of heart rate on mortality among persons with hypertension: the Framingham Study // Am. Heart J. — 1993. — Vol. 125. — P. 1148-1154.
10. Gombojav B., Park H., Kim J.I. et al. Heritability and link age study on heart rates in a Mongolian population // Exp. Mol. Med. — 2008. — Vol. 40. — P. 558-564.
11. Hag I., Wadood A. Variation in heart rate with the severity of hypertension // J. Postgrad. Med. Inst. — 1988. — Vol. 3. — P. 10-17.
12. Jouven X., Empana J.P., Schwartz P.J. et al. Heart-rate profile during exercise as a predictor of sudden death // N. Engl. J. Med. — 2005. — Vol. 352. — P. 1951-1958.
13. Jouven X., Escolano S., Celermajer D. Et al. Heart rate and risk of cancer death in healthy men // PLoSOne. — 2011. — Vol. 6(8). — e21310.
14. Julius S., Palatini P., Kjeldsen S. et al. Tachycardia predicts CV events in the VALUE trial // American Society of Hypertension 2010 Scientific Meeting. — 2010. — New York, NY. — Abstract LB-OR-01.
15. Kannel W.B., Kannel C., Paffenbarger R.S. Jr et al. Heart rate and cardiovascular mortality: the Framingham Study // Am. Heart J. — 1987. — Vol. 113. — P. 1489-1494.
16. Kjeldsen S.E., Okin P.M. High resting heart rate predicts mortality, disability, and cognitived eclinein patients after ischaemic stroke: time for additional selective I(f) channel inhibitor trials? // Eur. Heart J. — 2012. — Vol. 33. — P. 2761-2763.
17. Kolloch R., Legler U.F., Champion A. Et al. Impact of resting heart rate on outcomes in hypertensive patients with coronary artery disease: findings from the INternational VErapamil-SR/trandolapril STudy (INVEST) // Eur. Heart J. — 2008. — Vol. 29. — P. 1327-1334.
18. Levy R.L., White P.D., Stroud W.D. et al. Transient tachycardia: prognostic significance alone and in association with transient hypertension // JAMA. — 1945. — Vol. 129. — P. 585-588.
19. Morgan T., Lauri J., Bertram D. Effect of different antihypertensive drug classes on central aortic pressure // Am. J. Hypertens. — 2004. — Vol. 17. — P. 118-123.
20. Muntner P., Shimbo D., Tonelli M. Et al. The relationship between visit-to-visit variability in systolic blood pressure and all-cause mortality in the general population: findings from NHANES III, 1988 to 1994 // Hypertension. — 2011. — Vol. 57. — P. 16016-6.
21. Okin P.M., Kjeldsen S.E., Julius S. Et al. All-cause and cardiovascular mortality in relation to changing heart rate during treatment of hypertensive patients with electrocardiographic left ventricula hypertrophy // Eur. Heart J. — 2010. — Vol. 31. — P. 2271-2279.
22. Palatini P. Elevated heart rate in hypertension: a target for treatment? // J. Am. Coll. Cardiol. — 2010. — Vol. 55. — P. 931.
23. Palatini P. Role of elevated heart rate in the development of cardiovascular disease in hypertension // Hypertension. — 2011. — Vol. 58. — P. 745-750.
24. Palatini P., Benetos A., Grassi G. Et al. Identification and management of the hypertensive patient with elevated heart rate: statement of a European Society of Hypertension Consensus Meeting // J. Hypertens. — 2006. — Vol. 24. — P. 603-610.
25. Palatini P., Graniero G.R., Mormino P. Et al. Relation between physical training and ambulatory blood pressure in stage I hypertensive subjects. Results of the HARVEST Trial. Hypertension and Ambulatory Recording Venetia Study // Circulation. — 1994. — Vol. 90. — P. 2870-2876.
26. Palatini P., Julius S. Heart rate and the cardiovascular risk // J. Hypertens. — 1997. — Vol. 15. — P. 3-17.
27. Palatini P., Thijs L., Staessen J.A. et al. Predictive value of clinic and ambulatory heart rate for mortality in elderly subjects with systolic hypertension // Arch. Intern. Med. — 2002. — Vol. 162. — P. 2313-2321.
28. Poulter N.R., Dobson J.E., Sever P.S. et al. Baseline heart rate, antihypertensive treatment, and prevention of cardiovascular outcomes in ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial) // J. Am. Coll. Cardiol. — 2009. — Vol. 54. — P. 1154-61.
29. Salles G.F., Cardoso C.R., Fonseca L.L. et al. Prognostic significance of baseline heart rate and its interaction with Beta-blocker use in resistant hypertension: a cohort study // Am. J. Hypertens. — 2013. — Vol. 26. — P. 218-226.
30. Tardif J.C. Heart rateas a treatable cardiovascular risk factor // Br. Med. Bull. — 2009. — Vol. 90. — P. 71-84.
31. Wilkinson I.B., MacCallum H., Flint L. Et al. Th einfluence of heart rate on augmentation index and central arterial pressure in humans // J. Physiol. — 2000. — Vol. 525, Pt 1. — P. 263-270.
32. Williams B., Lacy P.S. Impact of heart rate on central aortic pressures and hemodynamics: analysis from the CAFE (Conduit Artery Function Evaluation) study: CAFE-Heart Rate // J. Am. Coll. Cardiol. — 2009. — Vol. 54. — P. 705-713.
33. Williams B., Lacy P.S., Thom S.M. et al. Differential impact of blood pressure-lowering drugs on central aortic pressure and clinical outcomes: principal results of the Conduit Artery Function Evaluation (CAFE) study // Circulation. — 2006. — Vol. 113. — P. 1213-1225.
34. Wit A.L., Cranefield P.F. Effect of verapamil on the sinoatrial and atrioventricular nodes of the rabbit and the mechanism by which it arrestsreentrant atrioventricular nodal tachycardia // Circ. Res. — 1974. — Vol. 35. — P. 413-425.
35. Yano Yu., Haimoto H., Hoshide S. et al. Evening heart rate measured at home is associated with visceral obesity and abnormal fat distribution in patients with hypertension // Amer. J. Hypertension. — 2011. — Vol. 24. — P. 783-788.
36. Загидуллин Н.Ш., Загидуллин Ш.З. Особенности фармакологического воздействия на симпатический тонус и частоту сердечных сокращений при сердечно-сосудистых заболеваниях // Кардиоваскулярная терапия и профилактика. — 2009. — 8(2). — С. 89-94.