Журнал «Медицина неотложных состояний» 1 (48) 2013
Вернуться к номеру
Общие вопросы анестезиологии
Авторы: Думанский Ю.В., чл.-корр. НАМН Украины, д.м.н., профессор
Кабанова Н.В., д.м.н., профессор кафедры анестезиологии и интенсивной терапии ДонНМУ им. М. Горького
Верхулецкий И.Е., завкафедрой хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького, д.м.н., профессор
Синепупов Н.А., доцент кафедры хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького, к.м.н.
Осипов А.Г., доцент кафедры хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького, к.м.н.
Синепупов Д.Н., ассистент кафедры хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького
Рубрики: Семейная медицина/Терапия, Травматология и ортопедия, Анестезиология-реаниматология, Медицина неотложных состояний, Хирургия
Разделы: Медицинское образование
Версия для печати
Актуальность
Боль в настоящее время остается серьезной клинической проблемой, требующей значительных усилий для улучшения качества и эффективности ее терапии. Боль является основным симптомом, вынуждающим людей обращаться за медицинской помощью. Согласно статистическим данным, хроническими болевыми синдромами, являющимися чаще следствием некупированного острого болевого синдрома, в США страдают около 20 млн человек. Это ежегодно оборачивается высокотехнологичному американскому здравоохранению расходами в десятки миллионов долларов в год. По данным ВОЗ, ежегодно в мире умирают свыше 4 млн онкологических больных, не получивших адекватного обезболивания в последние недели жизни. Столь неудовлетворительные результаты объяснялись недостаточным применением обезболивающих средств и преувеличенным страхом развития наркомании у смертельно больных людей. В терминальной стадии заболевания от боли страдают от 55 до 95 % всех онкологических пациентов. При этом боль средней интенсивности испытывают 40–50 %, а очень сильную и невыносимую — 25–30 % пациентов. Вышеуказанные статистические данные говорят об актуальности дальнейшего изучения и лечения болевых синдромов. Несмотря на возросший интерес к проблемам боли, анальгезии и достижениям фундаментальных наук в исследовании болевых механизмов, качество интра- и послеоперационного обезболивания не всегда удовлетворительное.
Система анестезиологической помощи играет важную роль в сохранении здоровья населения Украины. Рост заболеваемости населения и сохраняющийся высокий уровень смертности в стране требуют дальнейшего совершенствования организации системы анестезиологической службы. Хирургическое вмешательство до сих пор остается главным, а во многих случаях — единственным методом, обеспечивающим радикальное лечение заболеваний. С развитием новых технологий расширяются и совершенствуются возможности оперативного лечения, что делает актуальными разработку и внедрение адекватного современного анестезиологического обеспечения операций у пациентов с высокой степенью операционного риска.
Цель занятия общая (уметь): диагностировать синдромы патологии, требующей хирургической коррекции, применять общие принципы и методы анестезиологического обеспечения оперативных вмешательств (табл. 1).
Содержание обучения
I. Теоретические вопросы:
1. Определение анестезиологии как самостоятельной научно-практической медицинской дисциплины об обезболивании и управлении жизненно важными функциями организма. Ее роль и место в современной системе медицинских специальностей. Развитие анестезиологии в Украине и мире. Организация анестезиологического обеспечения в Украине.
2. Наркоз, его виды. Теории наркоза. Классификация современных методов анестезиологического обеспечения. Компоненты и методы анестезии, основные задания: обезболивание, торможение или выключение сознания, мышечная релаксация, поддержание адекватной вентиляции и газообмена, метаболических процессов.
3. Ингаляционный наркоз. Аппаратура и инструментарий для ингаляционного наркоза. Ингаляционные анестетики: эфир, фторотан, закись азота. Компоненты общей анестезии. Этапы анестезиологического обеспечения. Стадии и клиника наркоза. Масочный метод общей анестезии.
4. Неингаляционный наркоз. Препараты для неингаляционной анестезии кетамин, тиопентал натрия, оксибутират натрия, пропофол. Преимущества и недостатки. Стадии и клиника наркоза.
5. Регионарная анестезия. Виды и методы регионарной анестезии. Техника и способы спинальной пункции и катетеризации эпидурального пространства (ЭП).
6. Особенности общей анестезии в амбулаторных и ургентных условиях.
7. Выбор метода обезболивания в ургентной хирургии. Особенности подготовки пациентов к операции и наркозу. Осложнения общей и регионарной анестезии.
8. Профессиональные вредности в анестезиологии.
II. Основные термины и их определения.
Наркоз (греч. narcosis — оцепенение, усыпление) — искусственно вызванное состояние, характеризующееся обратимой утратой сознания, болевой чувствительности, подавлением некоторых рефлексов, расслаблением скелетных мышц. Анестезия — состояние, при котором на фоне потери или сохранения сознания частично либо полностью утрачиваются ощущения, поэтому отсутствует боль. Слово «анестезия» означает «нечувствительность». Она может быть следствием болезни, травмы или введения анестезирующих средств (анестетиков). В общеупотребительном смысле анестезией называют тот или иной способ избавления пациента от боли в процессе хирургических операций. Общая анестезия — анестезиологический метод, заключающийся в вызывании наркоза для безболезненного проведения хирургического вмешательства и создания условий для управления функциями организма. Анестезиологическое пособие (АП) — управление жизненными функциями организма в связи с операцией (и/или травматичной манипуляцией), предназначенное защитить организм от операционного стресса. АП в предоперационном периоде должно обеспечивать коррекцию нарушенных функций организма и создание медикаментозного фона, облегчающего проведение анестезии. Во время операции задача АП состоит в снижении реакций организма на операционную травму, коррекции функциональных расстройств, вызванных оперативным вмешательством, и облегчении работы хирурга. В послеоперационном периоде АП должно включать коррекцию возникших функциональных расстройств, снижение реакций организма на послеоперационный стресс, управление функциями организма в новых условиях.
Компоненты общей анестезии. Долгие годы наркоз был однокомпонентным. Становлением новой эры общего обезболивания можно считать 1942 год, когда канадские ученые Гриффитс и Джонсон (Griffith and Johnson) применили для мышечной релаксации во время наркоза очищенный препарат кураре — интокострин. Если до этого времени существовал мононаркоз, когда одним препаратом достигалось и торможение психического восприятия (потеря сознания — первый компонент общей анестезии), и анальгезия (собственно анальгезия — второй компонент общей анестезии), и мышечная релаксация, то теперь анестетик требовался только для торможения психического восприятия и анальгезии, а мышечная релаксация достигалась другим препаратом. Таким образом, отпадала нужда в углублении наркоза только ради удобства проведения операции в условиях расслабленной скелетной мускулатуры. Токсичность наркоза резко снизилась, уменьшился риск, связанный с ним. Так возник третий компонент общей анестезии — миорелаксация. Возникновение четвертого компонента связано с именами Laborit и Huguenar (1951) и de Castro и Mundeleer (1959). Благодаря им стала применяться нейролептанальгезия, которая обеспечивает адекватную нейровегетативную блокаду и центральную анальгезию. Пятым компонентом общей анестезии является управление жизненно важными функциями пациента во время оперативного вмешательства, проводимого в условиях общей анестезии.
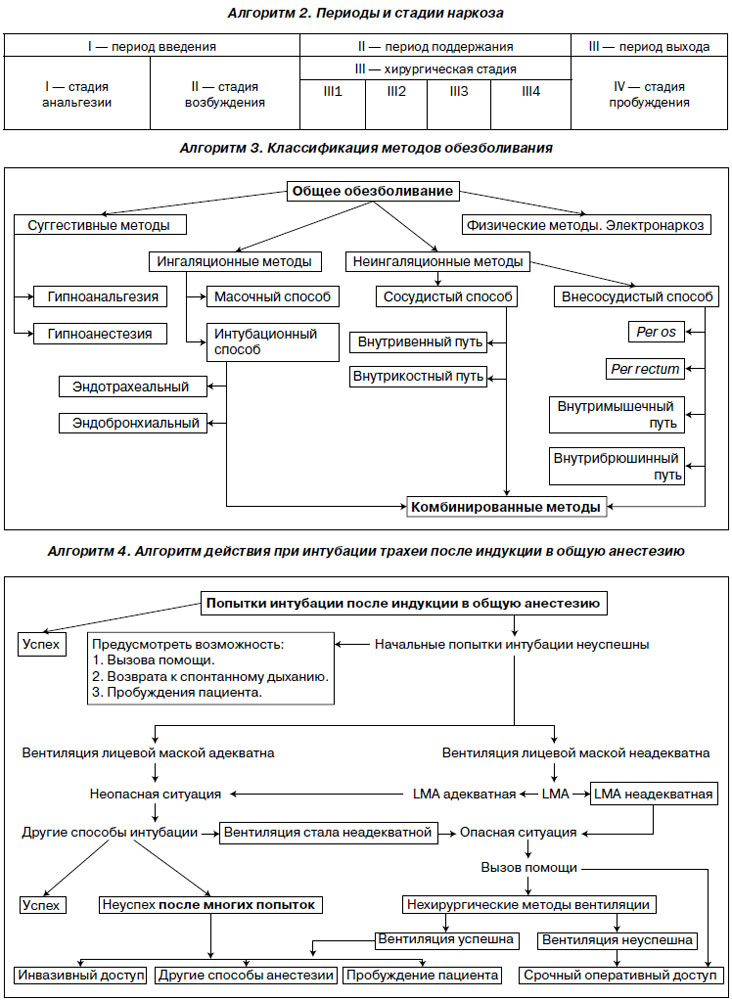
Классификация. Имеются различные классификации общего обезболивания. Наиболее простой и понятной можно считать ингаляционную анестезию (per inhalation) — анестетик поступает в организм пациента через дыхательные пути. Масочный способ — анестетик подается в дыхательные пути больного через маску. Интубационный способ заключается во введении анестезирующих газов или паров вместе с кислородом непосредственно через трахею и бронхи в легкие. Газонаркотическая смесь подается по трубке, введенной через голосовую щель в трахею или бронх. Неингаляционная анестезия — анестетик вводится в организм пациента, минуя дыхательные пути. Суггестивная анестезия — применение способов внушения (гипноза) для устранения боли: а) гипноанальгезия; б) гипноанестезия. Электроанестезия — вид общей анестезии, заключающийся в воздействии электрического тока определенных параметров на структуры мозга. Этот вид обезболивания обязательно должен сочетаться с другими компонентами современного общего обезболивания. Комбинированная анестезия достигается целенаправленным применением нескольких методов анестезии. Комбинированное применение препаратов позволяет существенно уменьшить дозу анестетиков и достичь лучшего эффекта при наименьшем воздействии на функции жизненно важных органов.
Ингаляционные анестетики делятся на две группы:
1. Легкоиспаряющиеся (летучие) жидкости (эфир, фторотан, трихлорэтилен, пентран, хлороформ, энфлюран, изофлюран, севофлюран, десфлюран).
2. Газообразные вещества (закись азота, циклопропан).
Действие анестетика определяется во многом его фармакокинетическими свойствами, особенностью распределения в крови и тканях. Попадая в альвеолы, ингаляционные анестетики проникают в кровь и одновременно выделяются через легкие в неизмененном виде. В зависимости от растворимости анестетиков в крови изменяется соотношение этих двух процессов. Хорошая растворимость в крови обусловливает медленное выведение анестетика из организма (элиминацию), показателем которого является коэффициент распределения «кровь/газ». Чем он выше, тем медленнее выделяется анестетик через легкие и лучше растворяется в крови.
В отличие от нелетучих препаратов эффекты ингаляционных анестетиков связаны с парциальным давлением агента, а не с его концентрацией в крови. Следовательно, если ингаляционный анестетик хорошо растворим в крови, парциальное давление растет медленно, так как значительное количество агента растворяется. Таким образом, при применении агентов, растворимых в крови, начало анестезии бывает замедленным, а при относительно нерастворимых агентах — быстрым. Это правило применимо и для восстановления после анестезии. Сила действия ингаляционных анестетиков классически определяется минимальной альвеолярной концентрацией (МАК). МАК — это альвеолярная концентрация ингаляционного анестетика, при которой у 50 % пациентов со спонтанным дыханием не возникнет двигательного ответа на разрез кожи. МАК обратно пропорциональна жирорастворимости. Чем меньше МАК, тем выше наркотическая активность вещества.
Эфир — прозрачная бесцветная жидкость с характерным специфическим запахом и жгучим вкусом. Эфир легко воспламеняется и взрывается в смеси его паров с кислородом и воздухом, что является одним из недостатков препарата. Эфир является достаточно сильным анестетиком, обладающим большой широтой терапевтического действия. Выводится в неизмененном виде легкими, около 15 % метаболизируется до углекислого газа и воды, приблизительно 4 % метаболизируется в печени до этанола и ацетальдегида.
Особенности действия на организм. Прослеживаются все стадии наркоза (связано с медленной индукцией анестезии); угнетение дыхательного центра предшествует депрессии вазомоторного центра; стимулируется симпатоадреналовая система. Раздражает дыхательные пути, вызывая кашель, задержку дыхания и усиление секреции; стимулирует вентиляцию, уменьшение альвеолярной вентиляции наблюдается при глубокой анестезии; во время поддерживающей анестезии наблюдается расширение бронхов. Оказывает прямое депрессивное влияние на миокард, с которым связано уменьшение сердечного выброса и снижение артериального давления (нивелируется симпатикоадреналовой стимуляцией). Усиление секреции слюнных желез и желез желудка (при глубокой анестезии угнетение секреции); возможны тошнота и рвота; ослабление перистальтики; уменьшение секреции желчи; уменьшение запасов гликогена в печени. Релаксация мышц удовлетворительная. Проникает через плаценту, вызывая депрессию плода. Вызывает гипергликемию, метаболический ацидоз, небольшое увеличение количества эритроцитов, гемоглобина, лейкоцитов, уменьшение времени свертывания крови, олигурию.
Фторотан (флюотан, галотан) — бесцветная прозрачная жидкость с нерезким сладковатым запахом. Пары препарата в смеси с воздухом, кислородом, закисью азота и даже эфиром (до 13 %) не горят и не взрываются. Выводится в неизмененном виде легкими. Около 20 % метаболизируется в печени по оксидазному пути, а конечные продукты выделяются почками. Наркотизирующая активность приблизительно в 4 раза больше эфира.
Особенности действия на организм. Высокая гипнотическая, но малая анальгетическая активность; стадия возбуждения менее выражена; раннее угнетение гортанного и глоточного рефлексов; повышение активности центра n.vagus; угнетение вазомоторного центра; ганглиоблокирующее действие. Не раздражает дыхательные пути; уменьшает секрецию бронхиальных желез; расширяет бронхи; повышает ЧДД, угнетая дыхание по мере углубления наркоза. Прямое депрессивное влияние на миокард, с которым связано уменьшение сердечного выброса и снижение артериального давления. Возможна брадикардия. Повышает возбудимость сердца (повышает чувствительность к катехоламинам), высок риск нарушения ритма. Уменьшает секрецию слюнных желез, возможна печеночная дисфункция (вплоть до быстротекущего некроза печени). Релаксация мышц хорошая.
Энфлюран — чистая, бесцветная летучая жидкость для анестезии с приятным эфирным запахом. Он не воспламеняется в клинических концентрациях, стабилен в присутствии щелочного сорбента углекислоты и не вызывает коррозии металлов. Энфлюран имеет низкий коэффициент растворимости «кровь/газ» (1,9), что обусловливает быстрое установление равновесия между альвеолярным и вдыхаемым парциальным давлением. Таким образом, индукция анестезии и восстановление проходят быстро.
Особенности действия на организм. В средних и высоких концентрациях (выше 3 %) обусловливает появление судорожной активности на ЭЭГ. Не раздражает дыхательные пути и не усиливает секрецию; вызывает дозозависимое снижение альвеолярной вентиляции с повышением ЧДД и уменьшением дыхательного объема. Дозозависимое снижение сократительной способности миокарда, ведущее к уменьшению сердечного выброса и снижению артериального давления. Вызывает рефлекторную тахикардию. Вероятность аритмий мала. Возможно повреждение печеночных клеток. Мышечная релаксация зависит от дозы; потенцирует действие недеполяризующих мышечных релаксантов.
Изофлюран является изомером энфлюрана. Бесцветная летучая жидкость с острым запахом. Стабилен и не взаимодействует с металлом и другими субстанциями. Не воспламеняется в клинических концентрациях. Изофлюран — наименее растворимый (за исключением десфлюрана) из всех современных ингаляционных агентов, поэтому его альвеолярная концентрация быстрее уравновешивается с концентрацией во вдыхаемой смеси. Однако скорость индукции анестезии ограничена из-за резкого запаха препарата. Частота возникновения кашля или задержки дыхания во время индукции анестезии выше, чем при применении фторотана. Минимальный метаболизм практически исключает поражение печени и почек. Влияние на организм подобно энфлюрану, но отличается меньшей выраженностью миокардиальной депрессии. Не вызывает судорожной активности на ЭЭГ. Расширяет коронарные артерии.
Севофлюран не воспламеняется, имеет приятный запах. Препарат устойчив. Быстро индуцирует анестезию. Не раздражает дыхательные пути, респираторная депрессия выражена в меньшей степени, чем у других летучих анестетиков. Меньше влияет на ЧСС, чем изофлюран, и в меньшей степени расширяет коронарные сосуды.
Десфлюран бесцветен, невоспламеняем и не разлагается под действием натриевой извести, света и металлов. Температура кипения десфлюрана 23,5 °С. Давление паров при 20 °С составляет 664 мм рт.ст., поэтому он не может применяться в стандартных испарителях. Для десфлюрана был разработан специальный испаритель (модель ТЕС-6), для которого требуется источник электроэнергии, поскольку он нагревается и в нем создается повышенное давление. Десфлюран имеет эфирный запах, но гораздо менее неприятный, чем у изофлюрана. Индукция анестезии происходит чрезвычайно быстро; правда, ее проведение несколько ограничивается из-за резкого запаха. Однако глубину наркоза можно очень быстро изменить, восстановление протекает быстрее, чем после применения любого другого летучего анестетика. Раздражает дыхательные пути. Угнетение дыхания выражено примерно в той же степени, что и у изофлюрана и энфлюрана. На сердечно-сосудистую систему влияет аналогично изофлюрану, но коронарное обкрадывание в эксперименте на животных не установлено.
Закись азота — веселящий газ. Газ без цвета и запаха со слегка сладковатым привкусом. Из 1 кг жидкой закиси азота образуется 500 л газа. Закись азота хорошо растворяется в воде, тканевых жидкостях, крови и не растворяется в липоидах. В организме ни в какие соединения не вступает, не разлагается, быстро и в неизмененном виде выделяется легкими. В 1,5 раза тяжелее воздуха. Самопроизвольно не воспламеняется, но активно поддерживает процесс горения и даже усиливает взрыв в смеси с эфиром и кислородом, водородом и др. Анальгезирующее действие ее наступает при концентрации во вдыхаемой смеси 35–45 об. %. Сознание выключается при 60–80 об. %. Однако это наблюдается далеко не у всех пациентов — физически крепкие субъекты более устойчивы к действию закиси азота. Стремление достичь наркоза путем увеличения концентрации закиси азота свыше 80 % и уменьшения содержания кислорода во вдыхаемой смеси ниже 20 %, т.е. за счет гипоксии, является недопустимым. Закись азота имеет низкий коэффициент растворимости «кровь/газ» (0,47), поэтому скорость уравновешивания альвеолярной и вдыхаемой концентрации очень высока.
Особенности действия на организм. По сравнению с рассмотренными выше анестетиками закись азота в концентрации до 80 % практически не влияет на функции жизненно важных органов. К неблагоприятным эффектам относятся нарушение синтеза витамина В12 посредством угнетения фермента метионинсинтетазы и влияние на синтез ДНК через метаболизм фолиевой кислоты. Возможны агранулоцитоз и аплазия костного мозга (при длительном контакте). В эксперименте на беременных крысах показано тератогенное действие закиси азота. Слабый анестетик, но обладает выраженным анальгетическим действием. Во избежание гипоксии содержание закиси азота во вдыхаемой смеси не должно превышать 80 %. После прекращения ее ингаляции в течение 5–6 мин продолжают подачу кислорода для предупреждения диффузионной гипоксии.
Внутривенные анестетики. Тиопентал натрия — пористая масса с желтоватым оттенком, легко растворяющаяся в воде. Применяется в 1–2,5 % растворах, приготовленных непосредственно перед наркозом, так как быстро гидролизуется. Растворы тиопентал натрия прозрачны, зеленоватого цвета, с запахом чеснока, имеют резко щелочную реакцию. При соприкосновении с препаратами, имеющими кислую реакцию, выпадает в осадок. Метаболизм осуществляется преимущественно в печени, метаболиты выделяются почками; небольшое количество препарата выделяется почками в неизмененном виде. Общая доза тиопентала натрия не должна превышать 1 г.
Особенности действия на организм. Высокая гипнотическая, но малая анальгетическая активность. Выраженное ваготоническое действие. Угнетение дыхательного центра (возможно апноэ) и вазомоторного центра. Обладает противосудорожной активностью, снижает уровень церебрального метаболизма, угнетает центр терморегуляции (возможна гипотермия). Провоцирует ларингоспазм, повышает тонус бронхиальных мышц, снижает минутный объем вентиляции за счет уменьшения ЧДД и дыхательного объема. Снижает сократительную способность миокарда, обладает ганглиоблокирующим действием — снижение артериального давления до выраженной гипотензии. Возможна брадикардия или рефлекторная тахикардия. Индуцирует микросомальные ферменты печени. Тонус мышц снижается при высокой концентрации агента в крови. Возможны аллергические реакции. Обладает сильным раздражающим действием, вплоть до некрозов при подкожном введении.
Кетамин (калипсол, кеталар) — белое кристаллическое вещество, растворимое в воде. Раствор имеет кислую реакцию. Оказывает сильное анальгезирующее и анестезирующее действие. Усиливает наркотический эффект других анестетиков. Большая широта терапевтического действия (токсическая доза в 20 раз выше наркотической).
Особенности действия на организм. Вызывает диссоциативную анестезию, повышает давление спинномозговой жидкости, возможны галлюцинации, делирий, возбуждение. Дыхание при средних дозах адекватное. Стимулирует сократительную способность миокарда, повышает артериальное давление, увеличивает частоту сердечных сокращений, повышает потребность миокарда в кислороде и его чувствительность к адреналину. Усиливает саливацию. Повышает тонус мышц, наблюдается мышечная ригидность; возможны спонтанные движения.
Оксибутират натрия — натриевая соль гамма-оксимасляной кислоты (ГОМК). Белый с желтоватым оттенком кристаллический порошок, легко растворимый в воде и спирте. По структуре близок к гамма-аминомасляной кислоте (ГАМК), содержащейся в мозговой ткани и участвующей в метаболических процессах ЦНС.
Особенности действия на организм. Оксибутират натрия относится к веществам, химически близким к метаболитам организма, отсюда и малая токсичность препарата. Он незначительно снижает артериальное давление и урежает пульс. Дыхание угнетается в стадии глубокого наркоза за счет уменьшения дыхательного объема, отмечается нарушение ритма (типа Чейна — Стокса), иногда апноэ. Оксибутират натрия снижает содержание калия плазмы на 15–20 %. Других существенных нарушений в организме оксибутират натрия не вызывает. Следует подчеркнуть благотворное влияние препарата на клеточный метаболизм. Участвуя в клеточном обмене, оксибутират натрия не вызывает нарастания кетоновых тел и тем самым не способствует развитию метаболического ацидоза. Как энергетический субстрат для клеточного обмена оксибутират натрия дает лечебный эффект при гипоксических состояниях.
Пропофол (диприван) — дериват фенола. Чрезвычайно жирорастворим, почти не растворяется в воде. Выпускается в виде белой водной эмульсии.
Особенности действия на организм. Снижает внутричерепное давление и уровень мозгового метаболизма, угнетает дыхательный центр. Возможны судороги у больных с эпилепсией. Быстрое восстановление сознания. Возможно апноэ (чаще и более длительное, чем при введении тиопентала). Уменьшает ЧДД и повышает дыхательный объем. Минимальный риск ларинго- и бронхиолоспазма. Снижает артериальное давление (более значительное, чем при введении тиопентала); возможна брадикардия (переходящая в тахикардию). Обладает противорвотным действием. Возможны мышечные фибрилляции, спонтанные движения. Вызывает снижение почечных функций и концентрации кортизола в крови. Обладает местнораздражающим действием.
Миорелаксанты — один из компонентов современной комбинированной анестезии. По механизму действия миорелаксанты делятся на три группы: 1) деполяризующие (дитилин, декаметоний); 2) недеполяризующие (тубокурарин, пипекуроний, панкуроний, атракуриум, векурониум и т.д.); 3) смешанного действия (диоксоний). Практически единственным деполяризующим релаксантом, доступным в клинической практике, является суксаметония хлорид (дитилин, листенон, миорелаксин). Это четвертичное аммониевое соединение, сравнимое с двумя молекулами ацетилхолина, связанными вместе. Два четвертичных аммониевых радикала способны связываться с каждой из альфа-единиц ацетилхолинового рецептора подобно природному медиатору, изменяя структуру рецепторного комплекса и открывая ионный канал. Но на более длительный период, чем это отмечается при действии ацетилхолина. Таким образом, введение дитилина приводит вначале к деполяризации и мышечному сокращению, известному как фасцикуляция. Но поскольку этот эффект сохраняется дольше, чем в физиологических условиях, последующие потенциалы действия не могут пройти, и мышцы расслабляются. Глубокий нейромышечный блок развивается в течение 1 минуты. Препарат очень быстро метаболизируется плазменным ферментом псевдохолинэстеразой (основной путь). Восстановление после нейромышечного блока может начаться в течение 3 минут и полностью завершиться через 12–15 минут. Применение антихолинэстеразных препаратов типа прозерина для снятия действия дитилина противопоказано, так как они подавляют активность и псевдохолинэстеразы. Около 10 % дитилина выделяется с мочой; его метаболизм в печени очень невелик; в плазме происходит некоторое разрушение суксаметония неспецифическими эстеразами. Миопаралитическая активность и, следовательно, длительность действия суксаметония могут изменяться под влиянием ряда факторов — наследственных и приобретенных. Наличие генетически атипичной псевдохолинэстеразы может способствовать возникновению продолжительного апноэ. В подобных случаях метаболизм препарата осуществляется неспецифическими эстеразами. Возможны приобретенные причины снижения активности псевдохолинэстеразы и увеличения продолжительности блока.
Недеполяризующие миорелаксанты принципиально отличаются от деполяризующих по механизму действия. В отличие от дитилина эти препараты не изменяют конформацию ацетилхолиновых рецепторов постсинаптической мембраны (что объясняет отсутствие фасцикуляций), а конкурируют с медиатором (ацетилхолином), обратимо связываясь с одной или двумя альфа-субъединицами рецептора, когда они не заняты нейротрансмиттером. Потенциал концевой пластинки в присутствии недеполяризующих миорелаксантов не достигает критического уровня, необходимого для инициации распространения потенциала действия. А при отсутствии потенциала действия не произойдет выброс Са++ из саркоплазматического ретикулума и мышечное сокращение будет невозможным. Ни один нейромышечный блокатор не метаболизируется в синапсе. Концентрация релаксанта в зоне концевой пластинки снижается за счет его диффузии по градиенту в плазму, оттуда он и выводится. Таким образом, все большее количество рецепторов стимулируется медиатором, что приводит к реверсии блока. Введенные в это время антихолинэстеразные препараты облегчают восстановление нейромышечной проводимости.
Устройство наркозного аппарата. Наркозный аппарат — специальный прибор, предназначенный для подачи пациенту определенных количеств (концентраций) газов и летучих анестетиков. Наркозный аппарат должен позволять проводить при необходимости вспомогательную и искусственную вентиляцию легких.
Основные части наркозного аппарата:
I. Источник газов.
II. Блок дозиметров и испаритель для летучих анестетиков.
III. Дыхательный контур.
1. А. Открытый контур. Открытым способом наркоза называется такой, при котором на вдохе больному подается смесь атмосферного воздуха с наркотическим веществом, а выдох производится в атмосферу.
Б. Полуоткрытый контур. Полуоткрытым способом наркоза называется такой, при котором газонаркотическая смесь подается больному из аппарата (изолирована от окружающей атмосферы), а выдох осуществляется в атмосферу. Кроме тех достоинств, которыми обладает открытый способ наркоза, при полуоткрытом создается возможность насыщения организма кислородом.
2. Реверсивные системы (контуры). В реверсивных системах для устранения углекислого газа, поступающего от пациента в аппарат, используют адсорбер, наполненный химическим поглотителем — адсорбентом. Адсорбция углекислого газа основана на нейтрализации углекислоты натронной известью. Натронная известь состоит из 80 % гидроокиси натрия и кальция — Са(ОН)2, 3 % едкого натра — NaOH, 15 % воды, 2 % окислов железа и алюминия. Углекислый газ, соединяясь с водой из паров выдыхаемого воздуха и из натронной извести, превращается в углекислоту. Углекислота вступает в реакцию с гидроокисями кальция и натрия. Результатом реакции является образование карбонатов, воды и выделение тепла. Углекислый натрий, реагируя с гидроокисью кальция, вновь восстанавливается до гидроокиси натрия. Объем адсорбера равен 500–600 см3. Засыпаемой в поглотитель натронной извести хватает на 2 часа непрерывной работы или на 5–6 часов работы с перерывами. При работе поглотителя, вследствие происходящих в нем химических реакций, выделяется тепло и адсорбер нагревается. Чрезмерный нагрев адсорбера недопустим. Если через 20–25 мин от начала работы адсорбер не становится теплым, то это свидетельствует о низком качестве поглотителя. Реверсивный дыхательный контур может быть циркуляционным и маятниковым. В циркуляционном контуре адсорбер располагается в кольце, состоящем из шланга выдоха, адсорбера и шланга вдоха. Газонаркотическая смесь проходит через адсорбер только на выдохе. Расстояние, на котором расположен адсорбер, не имеет значения при том условии, если у места соединения шланга вдоха и выдоха с дыхательными путями находятся клапаны.
В маятниковом контуре газы одним и тем же путем проходят через поглотитель на вдохе и на выдохе, при этом поглотитель располагается как можно ближе к дыхательным путям пациента с целью уменьшения мертвого пространства. Двукратное прохождение газов через поглотитель способствует их хорошему очищению. Недостатками маятниковой системы являются быстрый перегрев и истощение поглотителя. По отношению к дыхательному контуру испаритель можно располагать вне круга циркуляции газов и в системе циркуляции. При расположении испарителя вне круга циркуляции смесь, поступающая из баллонов, проходит через него один раз; выдыхаемый воздух в испаритель повторно не поступает. Такое размещение испарителя необходимо при использовании мощных анестетиков во избежание увеличения концентрации до опасных величин. Размещение испарителя в системе циркуляции обусловливает дополнительный прирост концентрации анестетика за счет повторного прохождения через него выдыхаемой смеси. Применяется для испарения жидких анестетиков меньшей мощности.
А. Закрытый контур. Закрытым способом наркоза называется такой, при котором создается герметичность в системе «наркозный аппарат — пациент». Выдыхаемые газы полностью сохраняются, очищаются и вновь используются. Так как наркотическое вещество не выбрасывается в атмосферу, а циркулирует в закрытой системе, после насыщения им организма больного нет надобности в подаче больших его доз. Необходимо ингалировать от 400–500 мл до 1 л кислорода. Теоретически следовало бы подавать в минуту лишь то количество кислорода, которое больной поглощает, но вследствие того, что добиться полной герметичности системы «наркозный аппарат — больной» не удается, следует установить газоток кислорода, равный около 1 л в минуту.
Б. Полузакрытый контур. Полузакрытым способом наркоза называется такой, при котором часть выдыхаемых газов проходит через адсорбер с химическим поглотителем, где она очищается от углекислого газа и вновь поступает к больному, а часть выбрасывается в атмосферу. Для проведения наркоза этим способом необходим наркозный аппарат с адсорбером. Полузакрытый способ имеет преимущество перед закрытым, заключающееся в том, что опасность возникновения гиперкапнии и гипертермии при использовании его меньше. Однако при полузакрытом способе больше расходуется газов и наркотических веществ.
Подготовка пациента к общей анестезии. Подготовкой пациента к наркозу называется комплекс мероприятий, направленных на улучшение состояния и создание условий для благоприятного течения наркоза и уменьшения отрицательного воздействия операционной травмы на организм. При всех плановых оперативных вмешательствах проводят следующие мероприятия: беседа с больным о предстоящей операции и анестезии; прекращение приема пищи перед операцией (не менее чем за 5–6 часов); очистительная клизма вечером накануне операции и утром; опорожнение мочевого пузыря; снятие съемных зубных протезов; медикаментозная подготовка (премедикация). Подготовка к анестезии является частью общей предоперационной подготовки. В случае планового оперативного вмешательства первая встреча анестезиолога с пациентом должна состояться за несколько дней до него. Врач налаживает психологический контакт с подопечным и оценивает его соматическое состояние. При сборе анамнеза следует уточнить, производилось ли раньше пациенту оперативное вмешательство, переливание крови, как он их перенес, к каким препаратам имеется непереносимость, не страдает ли пациент аллергическими заболеваниями и особенно бронхиальной астмой. Важно также выяснить, не страдает ли пациент флебитом или тромбофлебитом, так как наличие этих видов патологии служит обоснованием для специальной подготовки к операции с применением антикоагулянтов. Необходимо уточнить, какие заболевания сердца, легких, печени, почек и других органов перенес пациент, какими препаратами лечился (кортикостероидами, антикоагулянтами, сердечными гликозидами). В процессе знакомства с пациентом необходимо обратить внимание на его психическое состояние и при наличии повышенной возбудимости увеличить дозу седативных средств перед операцией. Следует выяснить наличие вредных привычек (курение, алкоголизм, наркомания) в связи с тем, что при этом нередко возникает устойчивость к влиянию общих анестетиков. При осмотре обращают внимание на форму лица, чтобы правильно подобрать маску; на конфигурацию и подвижность шеи, состояние зубов, особенности строения ротовой полости, чтобы быть готовым к трудностям интубации; на выраженность и состояние периферических вен: во время операции и анестезиологического пособия необходимо обеспечить венозный доступ. Проверяют наличие съемных зубных протезов. Большое значение имеет оценка конфигурации и эластичности грудной клетки. Особое внимание уделяют состоянию жизненно важных органов. Любой анестетик оказывает влияние на функции мозга, легких, сердечно-сосудистой системы, печени, почек. Это может проявиться небольшим отклонением в деятельности органа или полным ее прекращением. Очевидно, что выявление патологии со стороны жизненно важных органов играет существенную роль в выборе тактики анестезиологического пособия. На основании полученных при опросе и осмотре пациента данных анестезиолог делает запись в истории болезни с указанием рекомендаций по лечению и дополнительному обследованию. Любое плановое оперативное вмешательство, проводимое под общей анестезией, требует определенного уровня лабораторного и клинического обследования. Обязательными являются рентгенологическое исследование органов грудной клетки, общий анализ мочи и крови, определение группы крови и ее резус-принадлежности, количества сахара и билирубина в крови, основных показателей свертываемости (скорости свертывания, протромбинового индекса, фибриногена). В тех случаях, когда имеются данные о наличии сопутствующих заболеваний, необходима консультация соответствующих специалистов. За день до операции анестезиолог повторно осматривает пациента, оценивает эффективность коррекции функций органов и систем, знакомится с результатами дополнительных исследований. Делая запись в истории болезни, указывает планируемый вид и метод анестезии, степень операционно-анестезиологического риска. Назначает премедикацию.
Классификация операционно-анестезиологического риска
(Приказ Минздрава Украины № 184 от 26.07.1999 г.)
I. Оценка общего состояния пациентов:
Удовлетворительное — 0,5 балла. Соматически здоровые пациенты с локализованными хирургическими заболеваниями без системных расстройств.
Средней тяжести — 1 балл. Пациенты с легкими или умеренными системными расстройствами, которые связаны или не связаны с основным хирургическим заболеванием.
Тяжелое — 2 балла. Пациенты с выраженными системными расстройствами, которые обусловлены или не обусловлены хирургическим заболеванием.
Крайне тяжелое — 4 балла. Пациенты с крайне тяжелыми системными расстройствами, которые связаны или не связаны с хирургическим заболеванием, представляющими опасность для жизни больного без операции или во время операции.
Терминальное — 6 баллов. Пациенты в терминальном состоянии с выраженными явлениями декомпенсации функций жизненно важных органов и систем, при котором можно ожидать смертельного исхода во время операции или в течение ближайших часов без операции.
II. Оценка объема и характера операции:
Малые полостные или небольшие операции на поверхности тела — 0,5 балла.
Более сложные и длительные операции на поверхности тела, позвоночнике, нервных стволах, конечностях и операции на внутренних органах — 1 балл.
Сложные, обширные и продолжительные операции в различных областях хирургии, нейрохирургии, урологии, травматологии, онкологии, эндокринной системы — 1,5 балла.
Сложные или продолжительные операции на сердце и крупных сосудах (без применения аппарата искусственного кровообращения (АИК)), а также расширенные и реконструктивные операции в хирургии различных областей, включая и микрохирургию, — 2 балла.
Сложные операции на сердце и магистральных сосудах (с применением АИК) и операции по пересадке внутренних органов — 2,5 балла.
III. Оценка характера анестезии:
Различные виды местной потенцированной анестезии — 0,5 балла.
Регионарная, эпидуральная, спинномозговая, внутривенная или ингаляционная анестезия с сохранением спонтанного дыхания или кратковременной вспомогательной вентиляцией легких через маску наркозного аппарата — 1 балл.
Обычные стандартные варианты комбинированного эндотрахеального наркоза с использованием ингаляционных или неингаляционных и немедикаментозных средств анестезии — 1,5 балла.
Комбинированный эндотрахеальный наркоз с применением ингаляционных, неингаляционных анестетиков и их сочетаний с методами регионарной анестезии, а также специальных методов анестезии и корригирующей интенсивной терапии, искусственной гипотермии, управляемой гипотензии, инфузионно-трансфузионной терапии, вспомогательного кровообращения, электрокардиостимуляции и др. — 2 балла.
Комбинированный эндотрахеальный наркоз с использованием ингаляционных и неингаляционных анестетиков (в условиях АИК, гипербарической оксигенации и др.) в комплексном применении специальных методов анестезии, интенсивной терапии и реанимации — 2,5 балла.
Степень операционно-анестезиологического риска определяется количеством баллов:
I степень — незначительная — 1,5 балла.
II степень — умеренная — 2–3 балла.
III степень — значительная — 3,5–5 баллов.
IV степень — высокая — 5,5–8 баллов.
V степень — крайне высокая — 8,5–11 баллов.
Примечание: при экстренной анестезии допустимо повышение степени риска на 1 балл.
Премедикадия — медикаментозная подготовка пациента непосредственно перед анестезией. Цель премедикации — создать условия для максимального щажения психики пациента, облегчения введения в наркоз и гладкого течения анестезии. Основные задачи премедикации: 1. Седатация, предотвращение эмоционального предоперационного стресса. 2. Анальгезия и потенцирование действия общих анестетиков. 3. Подавление нежелательных рефлекторных реакций, нейровегетативная стабилизация и уменьшение секреции слизистой дыхательных путей. 4. Уменьшение отрицательного влияния биологически активных веществ, профилактика аллергических реакций.
1. Для седатации и подавления психических реакций применяют снотворные препараты, транквилизаторы, нейролептики. Снотворные (чаще барбитураты) назначают на ночь перед операцией, выполняя одно из правил анестезиологии — «пациент перед операцией должен спать». Часто с целью уменьшения отрицательных эмоциональных переживаний пользуются так называемым малым транквилизатором — диазепамом (седуксен, реланиум). Этот препарат из группы бензодиазепинов оказывает минимальное воздействие на сердечно-сосудистую систему и дыхание при выраженном седативном, снотворном, мышечно-расслабляющем действии. 2. Для анальгезии применяют препараты опиоидного ряда: морфин, промедол, омнопон. Наркотические анальгетики обладают не только обезболивающим эффектом, но и седативным; потенцируют действие общих анестетиков. Необходимо помнить о побочных эффектах опиоидов, основным из которых является угнетение дыхательного центра. 3. Для предупреждения нежелательных вагусных рефлексов и уменьшения секреции слюнных и бронхиальных желез назначают М-холиноблокаторы (атропин, метацин, скополамин). Смещая равновесие вегетативной нервной системы в сторону симпатического отдела, данные препараты могут быть опасны при тахиаритмиях, тиреотоксикозе. Из-за способности повышать внутриглазное давление атропин и его аналоги противопоказаны при глаукоме. 4. Для профилактики аллергических реакций применяют антигистаминные средства — Н1-гистаминоблокаторы: димедрол, пипольфен, супрастин. Кроме того, эти препараты обладают седативным действием. При оценке эффективности премедикации учитывают: 1) внешний вид и поведение пациента; 2) показатели функционального состояния дыхательной и сердечно-сосудистой систем. О неэффективности премедикации свидетельствуют: повышенная возбудимость, отрицательные эмоциональные реакции, гиперемия и влажность кожи, артериальная гипертензия, учащение дыхания. За 1–1,5 часа до операции анестезиолог посещает пациента в палате, оценивая правильность и адекватность его подготовки. После премедикации пациент не должен вставать с кровати, в операционную должен доставляться только на каталке. Клиника наркоза — совокупность изменений центральной нервной системы, сердечно-сосудистой и дыхательной систем, мышечной системы, возникающих при воздействии анестетиков и позволяющих в любой момент времени определить глубину анестезии. Характер и степень этих изменений зависит от вида применяемого анестетика (или сочетания анестетиков), его концентрации, длительности действия, возраста и исходного состояния пациента, сопутствующих заболеваний. Каждому анестетику присуща своя картина воздействия на организм, но имеются и общие черты, главная из которых — стадийность наркоза. Традиционно стадии наркоза рассматривают на примере мононаркоза эфиром.
Клиника масочного наркоза.
Стадии эфирного мононаркоза по Гведелу в модификации И.С. Жорова
I — стадия анальгезии. Эта стадия охватывает период от начала вдыхания паров эфира до потери сознания (выключения функций коры головного мозга). Вначале нарушается ориентация.
Пациент становится говорливым и путано отвечает на вопросы, постепенно впадает в дремотное состояние, из которого его может вывести малейший раздражитель. Болевая чувствительность утрачивается; сохраняется тактильная и температурная чувствительность; обостряется слух.
II — стадия возбуждения. Выраженное двигательное беспокойство. Возможны некоординированные движения в попытке сорвать маску, часто сопровождаются бессвязной речью. Дыхание частое, глубокое, возможна внезапная остановка дыхания из-за гипервентиляции. Глаза совершают плавающие движения, зрачки расширены, реакция на свет сохранена; отмечается слезотечение. Артериальное давление повышено, тахикардия. Кашлевой, глоточный и гортанный рефлексы повышены.
Выраженность стадии возбуждения зависит от ряда факторов: пола, возраста, типа высшей нервной деятельности, вредных привычек (алкоголизм), эффективности премедикации.
III — стадия хирургического наркоза. По мере насыщения организма анестетиком наркоз углубляется и признаки стадии возбуждения постепенно угасают, наркоз переходит в стадию хирургического сна, что характеризуется равномерным дыханием.
III1 — уровень угнетения движений глазных яблок. Признаки возбуждения исчезают, наступает наркотический сон на фоне равномерного дыхания. В дыхании равномерно участвуют мышцы грудной клетки и диафрагма. Вдох и выдох равны по продолжительности. Глазные яблоки совершают медленные кругообразные движения, прекращающиеся к концу стадии. Зрачок суживается до нормальных размеров, хорошо реагирует на свет. Артериальное давление и пульс возвращаются к исходным значениям. Пальпебральный и глотательный рефлексы утрачиваются, глоточный и гортанный рефлексы сохранены. Мышечный тонус сохранен.
III2 — уровень угнетения роговичного рефлекса. Глазные яблоки неподвижны, роговица влажная. Зрачки узкие, реакция на свет сохранена. Роговичный рефлекс утрачивается. Гортанный и глоточный рефлексы отсутствуют. Дыхание ровное, ритмичное. Артериальное давление в пределах исходных значений, пульс несколько учащен. Мышечный тонус снижен.
III3 — уровень угнетения зрачкового рефлекса. Зрачок расширен, фотореакция утрачивается. Роговица сухая. Дыхание поверхностное, асинхронное (вначале сокращается диафрагма, а затем межреберные мышцы). Артериальное давление снижается, выраженная тахикардия. Мышечный тонус значительно снижен.
III4 — уровень угнетения витальных функций (дыхания и гемодинамики). Зрачки предельно расширены, реакция на свет отсутствует. Роговица сухая и тусклая. Межреберные мышцы паретичны, в дыхательных движениях участвует только диафрагма. Самостоятельная вентиляция легких неадекватная. Выраженная артериальная гипотензия. Пульс малого наполнения, нитевидный; тахикардия (которая позже сменяется брадикардией). Угроза жизни пациента.
IV — стадия пробуждения (элиминации). Начинается с момента прекращения поступления анестетика в организм пациента. Клиника напоминает пройденные пациентом стадии наркоза в обратном порядке. Длительность и характер пробуждения могут быть различными, что определяется различными факторами (возраст пациента, исходное состояние, длительность наркоза и т.д.). Поддержание наркоза желательно на уровне III1–III2, углубление анестезии до III3–III4 опасно для жизни пациента.
Периоды. Выделяют три основных периода общей анестезии: 1) период введения в анестезию — вводный наркоз; 2) период поддержания анестезии; 3) период выведения из анестезии.
Вводный наркоз — наркоз, направленный на выключение сознания пациента и достижение глубины анестезии. Этот период начинается с момента начала введения анестетика и заканчивается при достижении хирургической стадии наркоза. Для введения в наркоз можно использовать ингаляционные и неингаляционные препараты. В большинстве случаев предпочтение отдают внутривенной анестезии, так как она обеспечивает быстрое и спокойное выключение сознания без выраженной стадии возбуждения.
Период поддержания анестезии. Период поддержания анестезии начинается с момента достижения хирургической стадии наркоза и заканчивается с момента прекращения подачи анестетика. Основной задачей этого этапа является обеспечение оптимальных условий для работы хирурга и защиты пациента от операционной травмы.
Период выведения из анестезии. Начинается с момента прекращения подачи анестетика.
Осложнения общей анестезии. Осложнениями анестезии следует считать непредвиденные и/или незапланированные нарушения функций, повреждения органов и тканей, вызванные анестезиологическим обеспечением оперативного вмешательства. Осложнения общей анестезии можно классифицировать:
I. По времени возникновения: осложнения в стадии анальгезии, возбуждения, хирургического наркоза и в стадии пробуждения.
II. По механизму: рефлекторные, механические, токсические.
III. В зависимости от пути и метода введения анестетика: осложнения масочного наркоза, интубационного наркоза, неингаляционного наркоза.
IV. По органам и системам: осложнения со стороны нервной системы, со стороны дыхательной системы, со стороны сердечно-сосудистой системы, со стороны печени и почек, метаболические осложнения. Нам представляется более рациональным классифицировать осложнения во время анестезии в зависимости от механизма их возникновения по стадиям наркоза, т.к. некоторые осложнения патогенетически могут возникать именно в той или иной стадии. Предполагая возникновение какого-либо осложнения в определенной стадии наркоза, легче его предвидеть, профилактировать, а в случае возникновения и лечить.
Местное обезболивание (местная анестезия) — это обратимая и намеренно вызванная потеря болевой чувствительности в определенной части тела при полном сохранении сознания. При этом другие виды чувствительности (тактильная, проприорецептивная, холодовая) снижены, но сохранены. Местное обезболивание применяют для проведения хирургических манипуляций и небольших операций, а также для лечения болевых синдромов. Преимуществами местной анестезии являются сохранение сознания, т.е. возможность контакта с пациентом; отсутствие специальной предоперационной подготовки; простота и доступность выполнения; отсутствие дорогостоящей аппаратуры для выполнения. К недостаткам местной анестезии относятся возможные аллергические реакции; психоэмоциональное напряжение пациента при длительных операциях; невозможность применения при обширных и травматичных операциях, когда требуется полная мышечная релаксация (расслабление), и у пациентов с нарушениями функции жизненно важных органов, когда требуются ИВЛ и другие методы защиты от операционной травмы.
Специальной подготовки к местной анестезии не требуется. Однако у эмоционально лабильных людей для предупреждения психологического стресса назначают премедикацию за 30–40 мин до операции. Для этого вводят препараты седативного (успокаивающего) действия — седуксен, реланиум, нейролептики (гипнотики) — дроперидол, наркотический анальгетик — например, промедол. Для профилактики аллергических осложнений вводят антигистаминные препараты (димедрол, супрастин, тавегил). Механизм действия местных анестетиков основан на их способности проникать через мембраны клеток, вызывать обратимую денатурацию белка клетки, нарушать окислительно-восстановительные реакции в клетке и в результате этого блокировать проведение нервного импульса в центральную нервную систему.
Виды местного обезболивания. В зависимости от места воздействия анестетика различают поверхностную и глубокую местную анестезию.
Поверхностная, или терминальная, анестезия. Данная анестезия развивается, когда анестетик непосредственно контактирует с нервными окончаниями, проникая через кожу или слизистые оболочки. Иногда применяют метод охлаждения для достижения терминальной анестезии за счет быстрого испарения с поверхности кожи летучих жидкостей (хлорэтила).
Глубокая анестезия. Выделяют два вида глубокой анестезии.
Инфильтрационная анестезия наступает путем тугой инфильтрации (пропитывания) тканей строго послойно раствором анестетика и заполнения им естественных «футляров» тела — межфасциальных, межмышечных пространств, брыжейки и брюшины. Метод известен во всем мире как метод «ползучего инфильтрата», разработанный русским хирургом А.В. Вишневским в 1928 г. При инфильтрационной анестезии происходит блокада кожных и глубжележащих нервных окончаний.
Проводниковая анестезия развивается вследствие блокады анестетиком проводящих нервных стволов, сплетений или корешков спинного мозга. Этот метод называется проводниковой или регионарной анестезией. При проводниковой анестезии утрачивается болевая чувствительность в зоне (регионе) иннервации проводящих путей нервной системы. Разновидностями проводниковой анестезии являются спинномозговая и эпидуральная анестезия. При спинномозговой анестезии анестетик вводится в субарахноидальное пространство, а при перидуральной (эпидуральной) — в перидуральное пространство. Регионарная анестезия, в отличие от общей, предполагает сохранение у пациента сознания при выключении болевого восприятия путем воздействия на сегменты нервной системы ниже уровня головного мозга. Вместе с тем чаще методики регионарной анестезии применяют на фоне медикаментозного сна (бензодиазепины, пропофол, этомидат), что благоприятно сказывается на психоэмоциональном состоянии больного. В современной анестезиологии отдельные методики регионарных блокад (эпидуральная, плексусная, стволовая) применяют как компонент общей анестезии, особенно в таких специальностях, как торакальная и абдоминальная хирургия. Они обеспечивают более совершенную антиноцицептивную защиту пациента от хирургической агрессии.
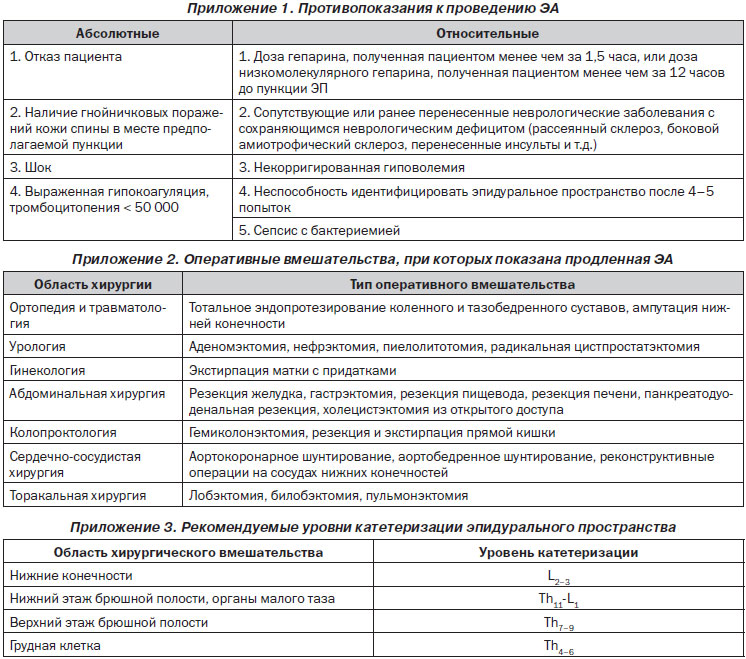
Определение показаний к эпидуральной анальгезии (ЭА). При отсутствии противопоказаний ЭА показана исключительно в тех случаях, когда планируется катетеризация эпидурального пространства и продленная ЭА в послеоперационном периоде. Во всех остальных случаях показана спинальная анестезия.
Подготовка места пункции: 1) двухкратная обработка кожи 0,5% спиртовым раствором хлоргексидина; 2) экспозиция 2 минуты; 3) обкладывание места пункции стерильным операционным бельем.
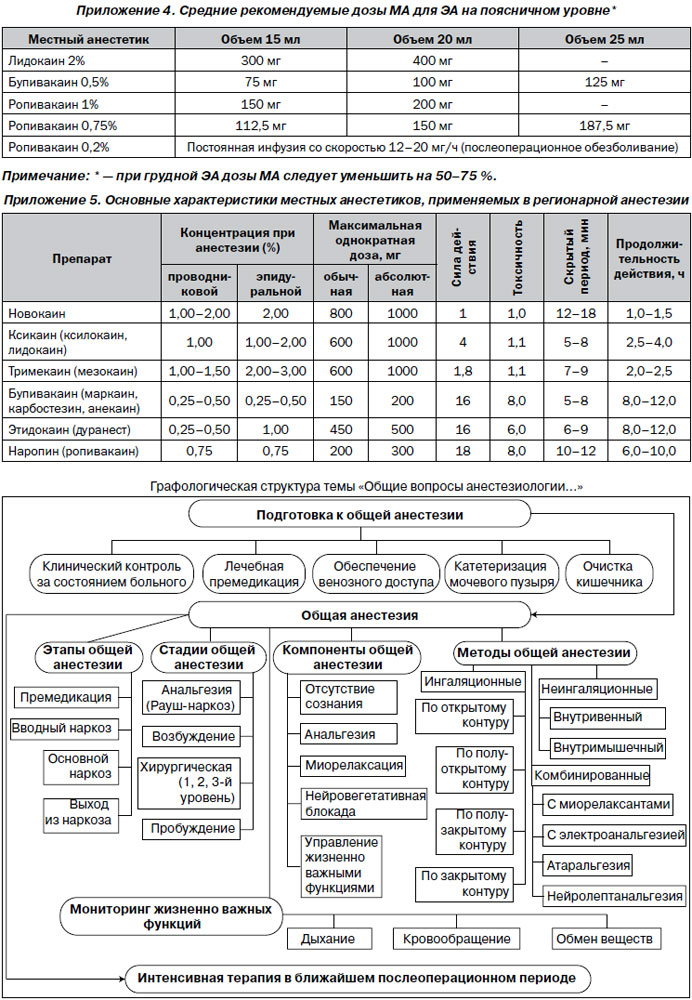
Оснащение и препараты. Допустимо использование только одноразовых расходных материалов. Стандартный набор: 1) игла Туохи 16 или 18G со стилетом; 2) поисковый шприц; 3) эпидуральный катетер; 4) бактериальный фильтр; 5) замок типа Луэр для соединения катетера с бактериальным фильтром. Местные анестетики: лидокаин 2%, бупивакаин (маркаин) 0,5%, ропивакаин (наропин) 0,2, 0,75, 1%, опиоидные анальгетики: морфин 1%, фентанил 0,005%. Применение иных препаратов недопустимо.
Условия выполнения пункции и катетеризации ЭП. Операционная, палата ОРИТ или чистая перевязочная хирургического отделения. Необходимо наличие мешка Амбу, набора для интубации трахеи, дефибриллятора, инфузионных сред и медикаментов для сердечно-легочной реанимации (СЛР). Перед началом процедуры необходимо измерить АД и ЧСС, а также обеспечить надежный венозный доступ и начать инфузию физраствора.
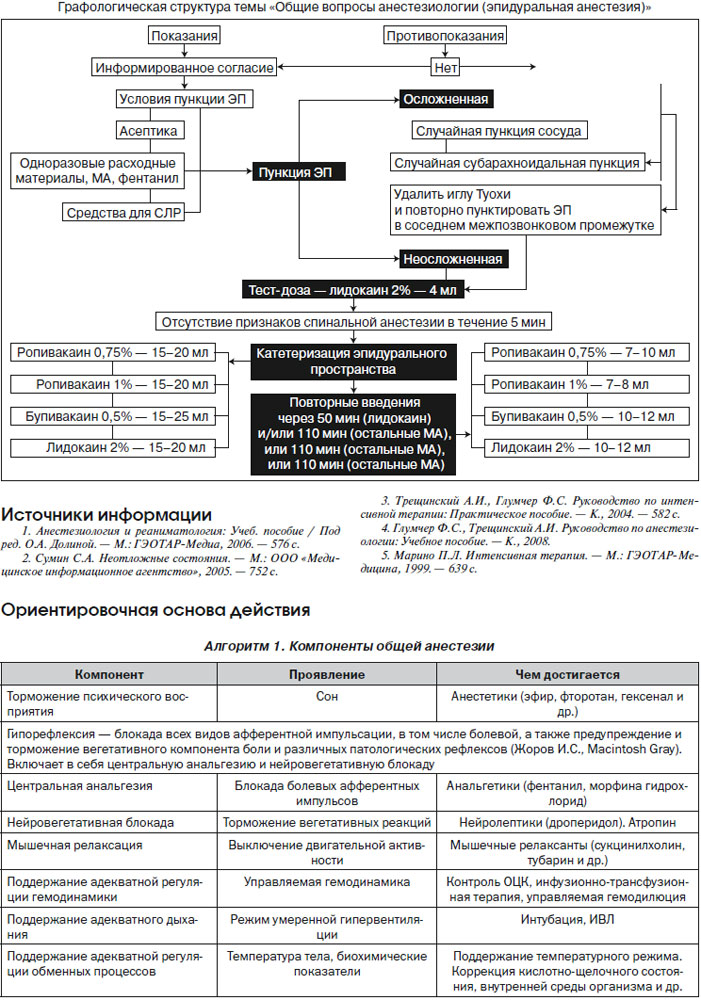
Техника и тактика пункции ЭП. Пункция ЭП в большинстве случаев выполняется в положении пациента лежа на боку, с максимально приведенными к животу коленями, приведенным к груди подбородком и максимально согнутым позвоночником. Анестезия места пункции — 2–3 мл 1% лидокаина. Уровень пункции определяется видом предстоящего хирургического вмешательства. Оптимальный способ идентификации ЭП — тест потери сопротивления (поисковый шприц заполняется физраствором).
Тактика при осложненной пункции ЭП. Вытекающий редкими каплями из иглы Туохи физраствор имеет геморрагическую окраску. Геморрагическое окрашивание может быть обусловлено: а) травмой мягких тканей при проведении иглы Туохи; б) травмой сосуда в ЭП. Для дифференциальной диагностики стерильным шприцом следует ввести в ЭП 5–6 мл физраствора и отсоединить шприц. В первом случае вытекающий из иглы физраствор будет прозрачным или геморрагическое окрашивание будет убывать по интенсивности. В тех случаях, когда вытекающая жидкость сохраняет интенсивное геморрагическое окрашивание, следует предположить ранение сосуда. При этом необходимо удалить иглу Туохи и повторно пунктировать ЭП на один межпозвонковый промежуток выше или ниже исходного уровня. Рекомендуется отказаться от проведения ЭА, если пациент имеет нарушения свертывающей системы, получает или будет получать в послеоперационном периоде антикоагулянты с целью тромбопрофилактики. Диагностирована случайная пункция субарахноидального пространства иглой Туохи: вариант 1 — подтянуть иглу на себя до прекращения оттока ликвора и при помощи поискового шприца убедиться в том, что она осталась в ЭП; вариант 2 — удалить иглу Туохи и повторно пунктировать ЭП на один межпозвонковый промежуток выше или ниже исходного уровня. Убедившись, что игла Туохи находится в ЭП, ввести тест-дозу 2% лидокаина 4 мл. В течение 5 минут наблюдать пациента, чтобы убедиться в отсутствии признаков развития СА. Убедившись в отсутствии признаков СА — катетеризировать ЭП. Катетер должен быть проведен за просвет иглы Туохи на 4–5 см.
Тактика при проблемах с катетеризацией ЭП. Если катетер не удается провести в ЭП на требуемую длину — удалить катетер вместе с иглой (в противном случае возможно срезание кончика катетера кончиком иглы). Повторно пунктировать ЭП, несколько изменив угол наклона иглы. Убедившись в том, что эпидуральный катетер правильно установлен в ЭП, присоединить к нему замок типа Луэр и при помощи шприца объемом 5 мл осуществить аспирационную пробу для того, чтобы исключить: а) внутрисосудистое проникновение катетера; б) субарахноидальное проникновение катетера. Если при аспирационной пробе получена геморрагически окрашенная жидкость — через замок типа Луэр ввести в катетер 4–5 мл физраствора и понаблюдать за оттекающей жидкостью или же произвести ее аспирацию шприцом. Если оттекающая жидкость имеет прозрачный характер или же интенсивность ее окрашивания убывает, ситуация не вызывает опасений. Если геморрагический характер отделяемого сохраняется, высока вероятность внутрисосудистого расположения катетера. При этом необходимо удалить эпидуральный катетер. Дальнейшая тактика определяется таким же образом, как и при непосредственном ранении сосуда иглой Туохи. Если при аспирационной пробе в шприц набирается прозрачная жидкость — следует предположить, что катетер проник в субарахноидальное пространство. Его следует удалить и повторно пунктировать ЭП в другом межпозвонковом промежутке. При отрицательном результате аспирационной пробы к катетеру присоединяют бактериальный фильтр и повторно вводят тест-дозу МА (по той же схеме, что и сразу после пункции ЭП). При отсутствии признаков развития СА в течение 5 минут катетер фиксируют в месте выхода из кожи (оптимально применять специальные фиксаторы типа Epi-Fix или Lockit), к коже спины на протяжении, а затем через плечо выводят на переднюю поверхность грудной клетки. Порт катетера вместе с бактериальным фильтром помещают в пластиковый пакет (в который был упакован эпидуральный катетер в наборе) и фиксируют к коже пластырем. После этого через катетер вводят дозу МА, необходимую для развития ЭА, ориентируясь на уровень пункции и концентрацию раствора по ступенчатой схеме: 5 мл р-ра анестетика — интервал 2 минуты (контроль АД, ЧСС) — введение следующих 5 мл и т.д. Повторные дозы МА (1/2–1/3 от исходной) вводят через 50–60 минут при применении лидокаина и через 110–120 минут при применении бупивакаина и ропивакаина. Оптимальным опиоидным анальгетиком для ЭА во время операции является фентанил, который вводится из расчета 0,05 мг/ч.

1. Анестезиология и реаниматология: Учеб. пособие / Под ред. О.А. Долиной. — М.: ГЭОТАР-Медиа, 2006. — 576 с.
2. Сумин С.А. Неотложные состояния. — М.: ООО «Медицинское информационное агентство», 2005. — 752 с.
3. Трещинский А.И., Глумчер Ф.С. Руководство по интенсивной терапии: Практическое пособие. — К., 2004. — 582 с.
4. Глумчер Ф.С., Трещинский А.И. Руководство по анестезиологии: Учебное пособие. — К., 2008.
5. Марино П.Л. Интенсивная терапия. — М.: ГЭОТАР-Медицина, 1999. — 639 с.