Газета «Новости медицины и фармации» Гастроэнтерология (434) 2012 (тематический номер)
Вернуться к номеру
Целиакия и ее внекишечные проявления
Авторы: А.Э. Дорофеев, Н.Н. Руденко - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
В статье описаны типичные проявления целиакии и заболевания, ассоциируемые с целиакией. Приводятся диагностические критерии и методы коррекции заболевания.
Целиакия, глютен, аутоиммунные заболевания, мальабсорбция, безглютеновая диета.
Около 10 тысяч лет назад человек начал регулярно употреблять продукты переработки злаков и впервые столкнулся с проблемой непереносимости глютена. Как известно, глютен — один из основных белков злаковых (в первую очередь пшеницы), который у некоторых людей может вызывать целый спектр заболеваний. Среди них преобладают иммуноопосредованная аллергия к злакам и целиакия — ситуации, когда глютен реагирует с Т-лимфоцитами слизистой оболочки кишечника. Однако при аллергии развивается IgE-опосредованная реакция, а при целиакии — аутоиммунное заболевание с выработкой антител к тканевой трансглутаминазе (tTG) и эндомизию (EMA). В злаковых семейства Triticeae (пшеница, рожь, ячмень) содержатся глютен и другие белки, вызывающие целиакию. Близок к ним по антигенным свойствам белок овса (овеин),однако его содержание в овсе незначительное, поэтому больные целиакией обычно хорошо переносят небольшие объемы овсяных продуктов (до 40–60 г/сутки). Белки, содержащиеся в рисе, кукурузе, сорго и просе, имеют другую антигенную структуру, а поэтому нетоксичны и могут широко использоваться в диете таких пациентов. Описано более 50 эпитопов глютена, стимулирующих Т-лимфоциты. Наибольшим аллергенным действием обладает фрагмент глиадина, состоящий из 33 аминокислот. Он отличается резистентностью к воздействию желудочных, панкреатических и кишечных протеаз человека [36]. Аллергическая реакция к белкам злаковых развивается в сенсибилизированном организме спустя минуты/часы после повторной экспозиции, в то время как при целиакии до развития клинически выраженного заболевания проходят недели, а иногда и годы.
Болеют целиакией преимущественно европейцы и их потомки в странах Северной Америки и Австралии, что связано с генетической предрасположенностью (носительство HLA-DQ2 и/или HLA-DQ8). У женщин целиакия встречается в 2–3 раза чаще, чем у мужчин. Распространенность составляет 0,2–1 %, причем в последнее время отмечается тенденция к учащению этого заболевания [29, 35]. Распространенность целиакии в нашей стране неизвестна, хотя в относительно близкой к нам по происхождению латвийской популяции антитела к глютену выявлены у 1 % жителей [17]. В странах Азии традиционное питание рисом защищало жителей от развития целиакии, однако все более широкое употребление пшеницы привело к ее распространению и на этом континенте [7]. Так, на севере Индии — регионе с преимущественным потреблением пшеницы — выявление антител составило 1,44 % [20]. Если еще полвека назад целиакия считалась типичным детским заболеванием, то в настоящее время средний возраст ее диагностики составляет около 45 лет, а у четверти пациентов она диагностируется после 60 лет [4]. Причем если у детей с момента появления симптомов до диагностики целиакии проходит около 1 года, то у взрослых этот период растягивается до 10 лет [30].
Целиакия сказывается и на качестве жизни пациентов. Следует отметить, что оно снижается не только при классической (симптомной) форме заболевания, но и при бессимптомной, что связано с пожизненной необходимостью придерживаться безглютеновой диеты. Отмечается достаточно четкая связь между продолжительностью такой диеты и качеством жизни пациентов [5].
К факторам риска развития целиакии, кроме наследственной предрасположенности, относится короткая продолжительность грудного вскармливания, искусственное вскармливание или раннее введение прикорма, содержащего большое количество глютена, а также частые (более 3 за первый год жизни) кишечные инфекции. Поэтому в семьях с предрасположенностью к развитию целиакии грудное вскармливание должно продолжаться не менее 6 месяцев, а глютен в прикорме должен вводиться не раньше 4–6-го месяца [26].
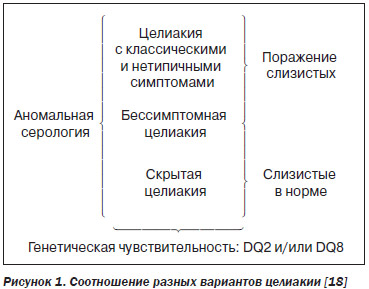
Клинически выделяют классическую (симптомную), атипичную (неклассическую — отсутствует мальабсорбция и/или проявляется внекишечными поражениями) и латентную (бессимптомную, скрытую) целиакию [19]. Следует отметить, что последняя встречается в 7 раз чаще [25]. Соотношение вариантов целиакии обычно сравнивают с айсбергом (рис. 1).
К классическим проявлениям целиакии относится диарея, часто со стеатореей и признаками мальабсорбции: (снижение массы тела, отставание в росте и физическом развитии у детей, анемия, боли в костях, периферическая нейропатия, судороги в мышцах и мышечная слабость, кровоточивость, куриная слепота, безбелковые отеки). Однако в последние годы распространенность этой формы уменьшается и в развитых странах составляет не более 10 % от всех форм целиакии, причем у части пациентов отмечается не диарея, а запор. При классическом течении целиакии выраженность диареи и мальабсорбции варьирует от незначительной до тяжелой, что зависит от степени и уровня поражения тонкой кишки. Так, при сохраненных дистальных отделах кишечника частота стула может не изменяться. Присоединение избыточного бактериального роста в тонкой кишке усугубляет диарею. Интенсивность стеатореи также не всегда одинакова и зависит не только от степени поражения кишечника и количества потребляемого жира, но и от выраженности вторичной панкреатической недостаточности. Примерно у трети больных целиакией отмечается значительное уменьшение секреции холецистокинина/панкреозимина, что закономерно сопровождается снижением выработки панкреатических ферментов и выделения желчи в ответ на попадание пищи в тонкую кишку, что проявляется диареей [15, 22].
Для атипичного течения заболевания характерны такие проявления: депрессия, аутизм, эпилепсия, мигрень и другие виды головной боли, атаксия, герпетиформный дерматит, бесплодие, гипоплазия зубной эмали, афтозный стоматит, IgA-нефропатия, миокардит, артрит/артралгия, легочный гемосидероз, запоры, боль в животе. К атипичным симптомам относятся биохимические нарушения: повышение уровня трансаминаз, щелочной фосфатазы, альбумина, снижение холестерина, коагулопатии.
Также выделяют заболевания, ассоциированные с целиакией. Чаще всего это такие аутоиммунные заболевания, как сахарный диабет 1-го типа (СД1), диффузный токсический зоб, тиреоидит, болезнь Аддисона, гепатит, первичный билиарный цирроз, коллагеновый колит, системная красная волчанка, синдром Шегрена, дилатационная кардиомиопатия, миастения, псориаз, витилиго, гнездная аллопеция. Ассоциируется целиакия и с такими генетическими аномалиями, как синдромы Дауна и Тернера, а также селективным дефицитом IgA [1].
Такое частое сочетание целиакии с аутоиммунными заболеваниями (в 3–10 раз чаще, чем в обычной популяции) может быть связано с общим генотипом (HLA-DQ2 [DQA1*0501 и DQB1*0201]).
Среди ассоциированных с целиакией заболеваний на первом месте стоит сахарный диабет 1-го типа. У детей с СД1 антитела и/или морфологические признаки целиакии определяются у 7,2–11 % в зависимости от континента и страны [3]. Поэтому NICE в 2009 году рекомендовал всем детям с впервые диагностированным СД1 проводить скрининг на целиакию [8].
Около 5 % больных целиакией имеют сопутствующую патологию щитовидной железы (тиреотоксикоз или аутоиммунный тиреоидит), поэтому в рекомендациях ISPAD всем детям с целиакией следует проводить обследование щитовидной железы, а всем пациентам с тиреоидной патологией — скрининг на целиакию [14].
У некоторых пациентов с целиакией развивается тромбоцитоз, что может объясняться сопутствующим гипоспленизмом. В одном из исследований гипоспленизм находили у половины взрослых больных целиакией, причем симптоматика уменьшалась при соблюдении безглютеновой диеты [12]. Достаточно частым внекишечным проявлением целиакии является остеопения/остеопороз, которые встречаются у 70 % больных с диареей и 30–40 % при ее отсутствии, что почти на 50 % увеличивает частоту переломов [27, 39].
Одно из внекишечных проявлений целиакии — герпетиформный дерматит Дюринга. Это кожное заболевание, встречающееся у 5 % больных целиакией. При данной патологии доминирующими антителами являются антитела к эпидермальной трансглутаминазе [31].
Еще одним проявлением аутоиммунного поражения при целиакии оказалась глютеновая атаксия. В данном случае происходит преимущественное поражение мозжечка, причем антитела вырабатываются к мозговой фракции трансглутаминазы и откладываются перивазально [37]. В то же время выраженность кишечных поражений при данной патологии незначительна, так симптомы энтеропатии выявляются у 10 % больных, а морфологическое поражение тонкой кишки только у трети пациентов [34]. В отличие от атаксии, у многих больных с целиакией (особенно при ее классическом течении) отмечается неврологическая симптоматика вследствие дефицита витаминов В и А, которая успешно лечится назначением витаминных комплексов.
Часто целиакия проявляется нарушением менструального цикла. Так, около трети женщин с нелеченной целиакией отмечают аменорею, которая обычно проходит при соблюдении диеты. У девочек, больных целиакией, менархе обычно наступает на год позже, чем у сверстниц. Для взрослых женщин характерны привычное невынашивание беременности и низкая масса тела плода. Мужчины с целиакией достаточно часто страдают импотенцией и олигоспермией [12].
У больных целиакией значительно повышается риск развития панкреатита. Так, согласно шведскому исследованию, вероятность развития панкреатита возрастает почти в 3 раза, а внешнесекреторной панкреатической недостаточности — более чем в 5 раз [33].
Таким образом, чаще всего целиакия проявляется внекишечными или атипичными симптомами.
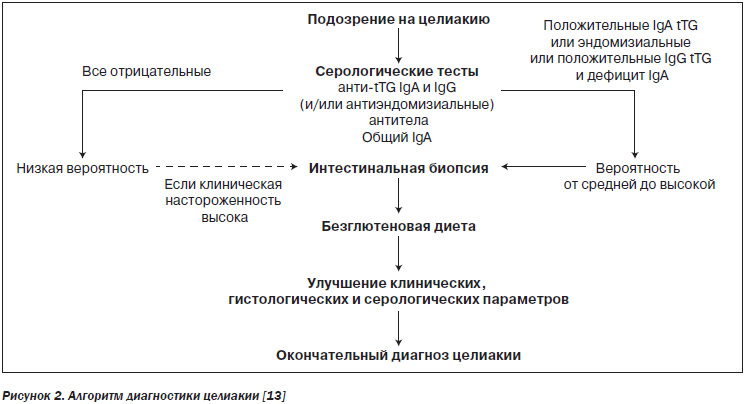
Диагностика целиакии основывается на следующих диагностических критериях:
1. Типичные симптомы целиакии.
2. Положительные антитела класса IgA (TG и/или EMA) в высоких титрах.
3. Генотип HLA-DQ2 и/или HLA-DQ8.
4. Типичные признаки энтеропатии в тонкокишечном биоптате.
5. Положительный ответ на безглютеновую диету.
Причем для выставления диагноза необходимо наличие любых четырех критериев из пяти [6].
Предложен следующий диагностический алгоритм при подозрении на целиакию (рис. 2).
Увеличение выявляемости целиакии в первую очередь связано с проведением диагностических тестов у пациентов не только с клинически выраженным заболеванием, но и при повышенном его риске, а также при ассоциированных с целиакией заболеваниях и состояниях. Кому же необходимо проводить обследование на целиакию? Согласно международным рекомендациям, это целесообразно делать в следующих случаях.
Показано проведение серологических тестов людям с хронической диареей (как с наличием мальабсорбции, так и без нее); с рецидивирующими необъяснимыми симптомами (тошнота, рвота, вздутие живота, абдоминальные боли, слабость, снижение массы тела); железо- и фолиеводефицитной анемией; СРК; наследственной предрасположенностью, аутоиммунными заболеваниями (СД1, герпетиформным дерматитом, тиреоидитом/тиреотоксикозом).
Возможно проведение скрининга у пациентов с другой ассоциированной патологией: болезнью Аддисона, аутоиммунным миокардитом, синдромом Шегрена, ПБЦ, необъяснимой гипертрансаминаземией, афтозным стоматитом, дефицитом витаминов К, Е, D; остеопорозом/остеомаляцией или патологическими переломами, дефектами зубной эмали, аменореей, бесплодием, гиперпаратиреозом, синдромами Дауна и Тернера, необъяснимыми неврологическими изменениями (эпилепсия, нейропатия, атаксия, депрессия), необъяснимыми запором, субфебрилитетом и алопецией. Возможен скрининг целиакии у больных лимфомой, микроскопическим колитом и саркоидозом [8].
Лечение целиакии. В настоящее время доказана эффективность только безглютеновой диеты. На это впервые обратил внимание голландский педиатр Willem Karel Dicke. Когда в годы II Мировой войны изделия из пшеницы стали практически недоступны, у детей с целиакией развилась ремиссия, а при возобновлении поставок пшеницы их состояние вновь ухудшилось [10]. Тогда и был сделан вывод о необходимости соблюдения безглютеновой диеты на протяжении всей жизни пациента. Данная задача является достаточно сложной, так как в готовых продуктах часто содержатся незначительные количества глютена. Разработаны и выпускаются специально изготовленные безглютеновые продукты, однако добиться безопасного уровня глютена в них весьма сложно, к тому же у некоторых пациентов разрешенный остаточный уровень глютена оказывается выше порогового [2]. К недостаткам такого подхода относятся высокая стоимость подобного питания и не всегда приемлемый вкус продуктов, не содержащих глютена. Еще одним недостатком некоторых из них является большое содержание жиров и, соответственно, высокая калорийность [23]. К тому же не во всех странах безглютеновые продукты доступны пациентам. Достаточно серьезной проблемой лечения является невысокая приверженность пациентов (особенно с легким или бессимтомным течением целиакии) к пожизненному соблюдению такой диеты. Ведь в отличие от лактазного дефицита при целиакии отсутствует быстрое и заметное усиление диареи после употребления глютенсодержащих продуктов.
Перспективно использование генно-модифицированной пшеницы, не содержащей токсичных фрагментов глютена. К сожалению, такая пшеница оказалась мало пригодной для выпекания хлеба [38]. Предпринимаются попытки замены пшеничной муки псиллиумом, причем вкусовые качества такого хлеба получили достаточно высокую оценку [41].
Следует отметить, что у части больных (около 30 %) даже строгое соблюдение безглютеновой диеты на протяжении 6–12 месяцев не приводит к клиническому и морфологическому улучшению, что расценивается как резистентная форма целиакии (refractory celiac disease), которая в зависимости от степени зрелости тканевых Т-лимфоцитов делится на два типа. Преобладает второй тип резистентности (с изменеными лимфоцитами), причем у большинства этих пациентов на протяжении нескольких лет развивается тонкокишечная лимфома [9, 21].
В стадии разработки находится еще несколько методов лечения. В первую очередь это применение протеаз, расщепляющих глютен еще до попадания в кишечник. Специфические глютеназы оказались эффективны в расщеплении наиболее аллергенных эпитопов глиадина, что уже на 6-й день сопровождалось значительным снижением глютен-специфичных Т-лимфоцитов, хотя в раннем периоде это не устраняло симптоматику энтеропатии [40]. Интересно применение пробиотиков с целью микробной деструкции глиадина [28]. Другим методом является блокада связывающего глютен участка HLA-DQ2. Возможно связывание самого глютена в просвете кишечника. К сожалению, оба эти метода находятся на стадии доклинической разработки [23]. Некоторого клинического улучшения удалось добиться путем блокады кишечной проницаемости глиадина [16]. Достаточно широко применяемые для лечения других аутоиммунных заболеваний цитостатики и антицитокиновые препараты из-за потенциальных серьезных побочных эффектов в лечении целиакии практически не используются. Только при резистентных к диете формах заболевания возможно применение этих групп препаратов [28].
Учитывая достаточно важную роль избыточного роста микрофлоры в тонкой кишке в поддержании диареи, у больных целиакией определенное значение в ее лечении имеют антибактериальные препараты и пробиотики.
Как уже упоминалось выше, у трети больных с классической целиакией развивается внешнесекреторная панкреатическая недостаточность. Для облегчения симптомов такой диареи оправдано применение панкреатических ферментов, причем эффективность лечения достигает более 90 %. При 6-месячном приеме панкреатина (45 тыс. ЕД липазы/сут) и последующего 4-летнего наблюдения отмечалось достоверное восстановление функции поджелудочной железы, что проявлялось увеличением секреции эластазы. Более чем 40 % больных удалось отменить панкреатин благодаря восстановлению панкреатической функции [11]. Как и при другой внешнесекреторной панкреатической недостаточности, при целиакии предпочтение отдается высокодозированным микрокапсулированным панкреатическим ферментам [24]. Именно такие формы ферментов предлагают использовать в современных руководствах по лечению панкреатической недостаточности [32]. Следует отметить, что применение ферментных препаратов при целиакии является не только симптоматической, заместительной терапией при развернутых формах с явлениями мальабсорбции и панкреатической недостаточности, но и патогенетическим лечением. При начальных стадиях целиакии, ее атипичном течении и внекишечных проявлениях заболевания их использование не только улучшает кишечное пищеварение, но и уменьшает антигенную нагрузку на организм, снижая количество аллергенов и гаптенов. Следовательно, применение панкреатических ферментов, показано при целиакии, особенно в сочетании с недостаточностью функции поджелудочной железы, и других внекишечных проявлениях заболевания.
Таким образом, целиакия — достаточно распространенное в европейской популяции заболевание. Причем у большинства пациентов проявляется внекишечными поражениями либо носит латентный характер. Поэтому врачи всех специальностей должны помнить о целесообразности проведения скрининга целиакии у таких пациентов. Основным методом лечения целиакии до настоящего времени является строгое соблюдение безглютеновой диеты, что в нашей стране сопряжено с большими трудностями. Доступным вспомогательным методом лечения может быть применение панкреатических ферментов для коррекции сопутствующей вторичной панкреатической недостаточности и пробиотиков для ферментации глиадина.
1. Admou B., Essaadouni L., Krati K. et al. Atypical celiac disease: from recognizing to managing // Gastroenterol. Res. Pract. — 2012. — 2012. — 637187.
2. Akobeng A.K., Thomas A.G. Tolerable Amount of Gluten for People With Coeliac Disease // Aliment. Pharmacol. Ther. — 2008. — 27. — 1044-1052.
3. Armstrong M.J., Hegade V.S., Robins G. Advances in Coeliac Disease // Curr. Opin. Gastroenterol. — 2012. — 28(2). — 104-112.
4. Beaumont D.M., Mian M.S. Coeliac disease in old age: «A catch in the rye» // Age Ageing. — 1998 Jul. — 27(4). — 535-8.
5. Bystrцm I.M., Hollйn E., Fдlth-Magnusson K., Johansson A. Health-related quality of life in children and adolescents with celiac disease: from the perspectives of children and parents // Gastroenterol. Res. Pract. — 2012. — 2012. — 986475.
6. Catassi C., Fasano A. Celiac disease diagnosis: simple rules are better than complicated algorithms // Am. J. Med. — 2010. — 123. — 691-693.
7. Catassi C., Gobellis G. Coeliac disease epidemiology is alive and kicking, especially in the developing world // Dig. Liver Dis. — 2007. — 39. — 908-910.
8. Coeliac disease. Clinical guidelines CG86. May 2009. http://www.nice.org.uk/CG86
9. Dewar D.H., Donnelly S.C., McLaughlin S.D. et al. Celiac disease: management of persistent symptoms in patients on a gluten-free diet // World J. Gastroenterol. — 2012 Mar 28. — 18(12). — 1348-56.
10. Dicke W.K. Treatment of celiac disease // Ned. Tijdschr. Geneeskd. — 1951. — 95. — 124-30.
11. Evans K.E., Leeds J.S., Morley S., Sanders D.S. Pancreatic insufficiency in adult celiac disease: do patients require long-term enzyme supplementation? // Dig. Dis. Sci. — 2010 Oct. — 55(10). — 2999-3004.
12. Farrell R.J., Kelly C.P. Celiac Disease and Refractory Celiac Disease // Sleisenger and Fordtran’s Gastrointestinal and Liver Disease. — Ninth Edition. Elsevier Inc, 2010. — V. 2. — 1797-1820.
13. Green P.H.R, Lee A.R. Celiac disease. Textbook of Gastroenterology. 5 Edition / Ed. by Tadataka Yamada. — Blackwell Publishing, 2009. — 1245-1258.
14. Kordonouri O., Maguire A.M., Knip M. et al. ISPAD Clinical Practice Consensus Guidelines 2006–2007. Other complications and associated conditions // Pediatr Diabetes. — 2007 Jun. — 8(3). — 171-6.
15. Leeds J.S., Hopper A.D., Hurlstone D.P. et al. Is exocrine pancreatic insufficiency in adult coeliac disease a cause of persisting symptoms? // Aliment. Pharmacol. Ther. — 2007 Feb 1. — 25(3). — 265-71.
16. Leffler D.A., Kelly C.P., Abdallah H.Z. et al. A Randomized, Double-Blind Study of Larazotide Acetate to Prevent the Activation of Celiac Disease During Gluten Challenge // Am. J. Gastroenterol. — 2012 Jul 24. [Epub ahead of print].
17. Leja M., Kojalo U., Frickauss G. et al. Changing patterns of serological testing for celiac disease in Latvia // J. Gastrointestin. Liver Dis. — 2011. — 20. — 121-126.
18. Lionetti E., Catassi C. New clues in celiac disease epidemiology, pathogenesis, clinical manifestations, and treatment // Int. Rev. Immunol. — 2011 Aug. — 30(4). — 219-31.
19. Ludvigsson J.F., Leffler D.A., Bai J.C. et al. The Oslo definitions for coeliac disease and related terms // Gut. — 2012 Feb 16. [Epub ahead of print].
20. Makharia G.K., Verma A.K., Amarchand R. et al. Prevalence of celiac disease in the northern part of India: a community based study // J. Gastroenterol. Hepatol. — 2011. — 26. — 894-900.
21. Malamut G., Afchain P., Verkarre V. et al. Presentation and long-term follow-up of refractory celiac disease: comparison of type I with type II // Gastroenterology. — 2009 Jan. — 136(1). — 81-90.
22. Maton P.N., Selden A.C., Fitzpatrick M.L., Chadwick V.S. Defective gallbladder emptying and cholecystokinin release in celiac disease: Reversal by gluten-free diet // Gastroenterology. — 1985. — 88. — 391.
23. Moore J.K., West S.R.A., Robins G. Advances in Celiac Disease // Curr. Opin. Gastroenterol. — 2011. — 27(2). — 112-118.
24. Mцssner J., Keim V. Pancreatic enzyme therapy // Dtsch Arztebl Int. — 2010 Aug 1. — 08(34–35). — 578-82.
25. Mustalahti K., Catassi C., Reunanen A. et al. The prevalence of celiac disease in Europe: results of a centralized, international mass screening project. Coeliac EU Cluster, Project Epidemiology // Ann. Med. — 2010 Dec. — 42(8). — 587-95.
26. Naiyer A.J., Green P.H. How important is the timing of gluten introduction for children with celiac disease? // Nat. Clin. Pract. Gastroenterol. Hepatol. — 2005. — 2. — 444.
27. Olmos M., Antelo M., Vazquez H. Systematic review and meta-analysis of observational studies on the prevalence of fractures in coeliac disease // Dig. Liver Dis. — 2008 Jan. — 40(1). — 46-53.
28. Rashtak S., Murray J.A. Coeliac Disease, New Approaches to Therapy // Alimentary Pharmacology & Therapeutics. — 2012. — 35(7). — 768-781.
29. Riddle M.S., Murray J.A., Porter C.K. The Incidence and Risk of Celiac Disease in a Healthy US Adult Population // The American Journal of Gastroenterology. — 2012.
30. Rodrigo-Sбez L., Fuentes-Бlvarez D., Pйrez-Martнnez I. et al. Differences between pediatric and adult celiac disease // Rev. Esp. Enferm. Dig. — 2011 May. — 103(5). — 238-44.
31. Rose C., Armbruster F.P., Ruppert J. et al. Autoantibodies against epidermal transglutaminase are a sensitive diagnostic marker in patients with dermatitis herpetiformis on a normal or gluten-free diet // J. Am. Acad. Dermatol. — 2009. — 61. — 39-43.
32. Rustemović N., Krznarić Z., Bender D.V. et al. Croatian guidelines for the management of pancreatic exocrine insufficiency // Lijec. Vjesn. — 2012 May-Jun. — 134(5–6). — 141-7.
33. Sadr-Azodi O., Sanders D.S., Murray J.A., Ludvigsson J.F. Patients With Celiac Disease Have an Increased Risk for Pancreatitis // Clin. Gastroenterol. Hepatol. — 2012 Jul 16. [Epub ahead of print].
34. Sapone A., Bai J.C., Ciacci C. et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification // BMC Med. — 2012 Feb 7. — 10. — 13.
35. Schapira M., Maisin J.M., Ghilain J.M. et al. Epidemiology of coeliac disease // Acta Gastroenterol. Belg. — 2003. — 66. — 234-236.
36. Shan L., Molberg O., Parrot I. et al. Structural basis for gluten intolerance in celiac sprue // Science. — 2002. — 297. — 2275-2279.
37. Stamnaes J., Dorum S., Fleckenstein B. et al. Gluten T cell epitope targeting by TG3 and TG6; implications for dermatitis herpetiformis and gluten ataxia // Amino Acids. — 2010. — 39. — 1183-1191.
38. Stoven S., Murray J.A., Marietta E. Celiac Disease: Advances in Treatment via Gluten Modification // Clin. Gastroenterol. Hepatol. — 2012 Aug. — 10(8). — 859-62.
39. Thomason K., West J., Logan R.F. et al. Fracture experience of patients with coeliac disease: A population-based survey // Gut. — 2003. — 52. — 518.
40. Tye-Din J.A., Anderson R.P., French R.A. et al. The effects of AVL300 predigestion of gluten on immune response and symptoms in celiac disease in vivo // Clin. Immunol. — 2010. — 134. — 289-295.
41. Zandonadi R.P., Botelho R.B., Araujo W.M. Psyllium as a substitute for gluten in bread // J. Am. Diet. Assoc. — 2009. — 109. — 1781-4.