Журнал «Медико-социальные проблемы семьи» 3-4 (том 17) 2012
Вернуться к номеру
Молекулярный цитогенетический анализ сперматозоидов у бесплодных мужчин методом флюоресцентной гибридизации
Авторы: Шамраев С.Н. - Донецкий национальный медицинский университет им. М. Горького; Рутинский А.И. - Украинско-французский медицинский центр репродуктивных функций человека «Семь+Я»; Бабюк И.А. - Институт неотложной и восстановительной хирургии им. В.К. Гусака
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
В статье проанализированы результаты молекулярно-цитогенетического анализа ядер сперматозоидов методом FISH у 90 пациентов с бесплодием и у 10 условно здоровых фертильных мужчин. Количество пациентов с повышенным уровнем анеуплоидий сперматозоидов в основной группе составило 83,33 %. Средний уровень анеуплоидий в основной группе был 1,91 ± 0,40 % и достоверно превышал таковой в контроле (0,13 ± 0,02 %) в 14,69 раза. У 6,67 % пациентов с бесплодием был отмечен высокий уровень анеуплоидий (от 0,9 до 1,9 %) при нормальных показателях спермограммы. Проведение молекулярно-цитогенетического анализа спермы методом FISH позволяет выявить высокий уровень анеуплоидий ядер сперматозоидов у пациентов с нарушением фертильности. Использование данного метода диагностики показано всем парам, планирующим лечение методом ЭКО/ИКСИ, с целью прогнозирования генетических нарушений эмбрионов и дает возможность генетической селекции у пациентов с высоким уровнем анеуплоидий ядер сперматозоидов.
Мужское бесплодие, патозооспермия, хромосомные аномалии, FISH.
В настоящее время большой интерес у специалистов, занимающихся проблемами бесплодия, вызывают генетические исследования. С одной стороны, это связано с прогрессирующим увеличением удельного веса мужского фактора. За последние 20 лет он изменился с 30 до 50 % и продолжает расти [1].
С другой стороны, среди причин мужской инфертильности довольно большой удельный вес (до 30 %) занимает так называемое идиопатическое бесплодие. Вместе с тем в ряде научных исследований показано, что определенная доля случаев идиопатического бесплодия сопряжена с наличием аномалий хромосом, которые вследствие неэффективной диагностики выявить зачастую не удается [8].
С помощью стандартных критериев ВОЗ, таких, например, как концентрация гамет, их подвижность и морфология, не всегда возможна точная оценка оплодотворяющей способности сперматозоидов. Даже несмотря на значительные отклонения от нормативов, фертильность может сохраняться, и наоборот, при нормозооспермии и исключенном женском факторе беременность не наступает [7].
Одной из причин нарушения репродуктивной функции является наследственная патология, связанная либо с аномалиями хромосом (как числовыми, так и структурными), либо с генными мутациями. При цитогенетическом обследовании лиц с мужским бесплодием 5–15 % из них имеют нарушения кариотипа (при анализе лимфоцитов периферической крови) [4]. В то же время в ряде случаев при нормальном кариотипе в соматических клетках могут определяться значительные нарушения числа и структуры хромосом половых клеток. Хромосомная патология часто сопровождается глубоким нарушением сперматогенеза, приводящим к бесплодию.
Особое внимание к вопросу генетических нарушений у бесплодных мужчин связано с тем, что широкое использование вспомогательных репродуктивных технологий (ВРТ), в том числе ИКСИ, использование для оплодотворения незрелых половых клеток, позволило иметь потомство мужчинам с тяжелыми нарушениями генотипа. Изменения в генотипе родителей, приводящие к нарушению репродукции и невозможности зачатия ребенка естественным путем, при применении программы ВРТ могут передаваться будущему потомству [3].
Цитогенетическое исследование незрелых гамет на разных стадиях их развития у мужчин проблематично вследствие относительной трудности получения материала [2]. Появление молекулярно-цитогенетических методов открыло в изучении хромосом человека и их нарушений новое измерение — субмикроскопический уровень. Метод FISH-анализа (Fluorescence in situ hybridization) позволяет объективно выявлять индивидуальные хромосомы и их отдельные участки на метафазных пластинках (хромосомы в состоянии максимальной конденсации и визуализации) или интерфазных ядрах (деконденсированные хромосомы, без четкой морфологической структуры) на основе особенностей их молекулярно-генетического строения [6].
Для идентификации индивидуальных хромосом при проведении диагностики наиболее эффективны так называемые хромосомоспецифические ДНК-зонды, созданные на основе клонированных последовательностей сателлитной ДНК чело-века [2].
По мнению ряда авторов, у пациентов с низким качеством спермы увеличивается частота дисомии и диплоидии сперматозоидов [2, 3, 5–11, 13].
Цель исследования — изучение уровня анеуплоидий ядер сперматозоидов у пациентов с бесплодием.
Материал и методы
В период с 2011 по 2012 г. нами было обследовано 90 мужчин с диагнозом «бесплодие» (основная группа О) и 10 условно здоровых фертильных мужчин (конт-рольная группа К).
Всем пациентам проводилось стандартное обследование, включающее сбор анамнеза, анализ секрета предстательной железы, исследование на урогенитальные инфекции, определение уровня гонадотропных, половых гормонов, ультразвуковое исследование наружных половых органов и простаты, микроскопическое исследование эякулята с оценкой показателей согласно нормативам ВОЗ. Кроме того, пациентам проводилось FISH-исследование спермы с целью выявления количества анеуплоидий сперматозоидов.
Для определения уровня анеуплоидий сперматозоидов использовалась многоцветная проба AneuVysion для хромосом X, Y, 18 (Abbott-Vysis, USA) [12, 13]. Подготовку препаратов проводили непосредственно после сдачи пациентом эякулята. Необходимый объем спермы помещали в пробирку и трижды отмывали фосфатным буфером, после чего наносили на стекла и сушили 1 час при температуре +50 °С. Затем стекла опускали в емкость с фиксатором и оставляли на 18 часов при температуре –20 °С. Далее проводили деконденсацию путем инкубации в 0,1N растворе натрия гидроксида, ополаскивание стекол в фосфатном буфере, просушивание на воздухе, предгибридизационную подготовку препарата и нанесение пробы СЕР 18/X/Y на предварительно отмеченные зоны гибридизации. Стекло с нанесенными зондами помещали в гибридизатор с установленной программой денатурации и гибридизации при температуре +37 °С с длительностью от 4 до 12 часов. Затем для удаления негибридизовавшихся проб, а также с целью уменьшения кросс-гибридизации альфоидных последовательностей с центромерными участками других хромосом стекла подвергали отмывке. Препараты окрашивали и проводили детекцию флюоресцентных сигналов согласно стандартному протоколу [12]. Микроскопический анализ осуществляли с использованием флюоресцентного микроскопа, оборудованного соответствующим набором фильтров. Для исследования уровня анеуплоидий в сперматозоидах проводили анализ 1000 клеток [9, 13].
Полученные данные обрабатывали с помощью IBM PC с использованием электронной таблицы Excel.
Результаты и обсуждение
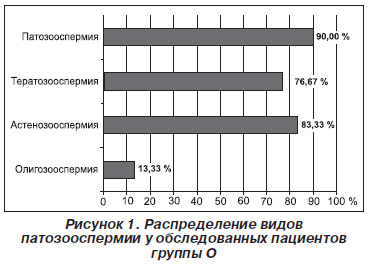
Возраст обследованных пациентов варьировал от 26 до 41 года и в среднем составил в группе О 32,07 ± 0,40 года, К — 32,70 ± 1,27 года (р > 0,05). Продолжительность периода бесплодия у пациентов группы О была от 1 до 9 лет, в среднем 3,06 ± 0,35 года. По данным спермограммы патозооспермия в группе О имела место у 90 % пациентов, астенозооспермия — у 83,33 %, олигозооспермия — у 13,33 %, тератозооспермия — в 76,67 % случаев (рис. 1).
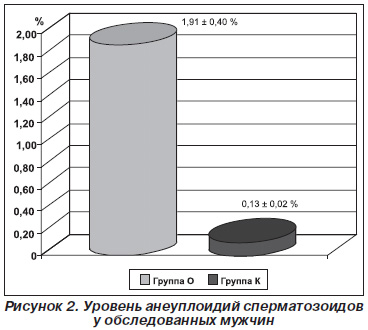
По данным молекулярно-цитогенетического анализа методом FISH уровень анеуплоидий сперматозоидов в группе О варьировал от 0,12 до 8,40 %, тогда как в контроле — от 0,09 до 0,21 % (референсная норма — до 0,25 %) [11]. Количество пациентов с повышенным уровнем анеуплоидий сперматозоидов в группе О составило 75 (83,33 %). Средний уровень анеуплоидий в группе О составил 1,91 ± 0,40 % и превышал таковой в контроле (0,13 ± 0,02 %) в 14,69 раза (p < 0,0001) (рис. 2).
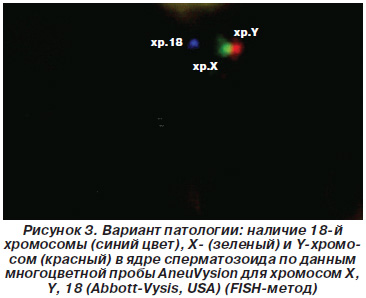
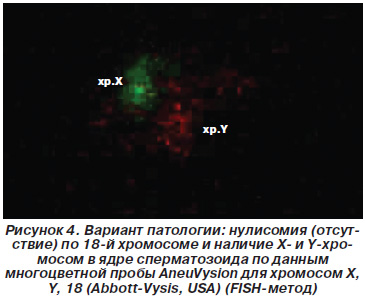
На рис. 3 представлен случай анеуплоидии у пациента Н., 28 лет, с наличием X-, Y- и 18-й хромосомы в ядре сперматозоида, на рис. 4 — случай анеуплоидии у пациента Р., 32 лет, с наличием X- и Y-хромосом и нулисомии по 18-й хромосоме по данным многоцветной пробы AneuVysion для хромосом X, Y, 18 (Abbott-Vysis, USA) (FISH-метод).
При этом у 6 (6,67 %) пациентов группы О был отмечен высокий уровень анеуплоидий (от 0,9 до 1,9 %) при нормальных показателях спермограммы.
Выявлена прямая корреляционная зависимость между уровнем анеуплоидии и наличием: астенозооспермии (r = 0,34, p < 0,0002), тератозооспермии (r = 0,37, p < 0,0001), патозооспермии (r = 0,25, p < 0,007). Не выявлено достоверных корреляционных связей между уровнем анеуплоидии и наличием олигозооспермии.
Наиболее часто встречающимися видами анеуплоидий являлись: наличие двух 18-х хромосом — 70 % случаев, удвоение Х-хромосомы в 8 % случаев, отсутствие одной из половых хромосом — в 4 %.
Выводы
Проведение молекулярно-цитогенетического анализа спермы методом FISH позволяет выявить высокий уровень анеуплоидий ядер сперматозоидов у пациентов с нарушением фертильности.
Наиболее часто встречающимися видами анеуплоидий являлись: наличие двух 18-х хромосом — 70 % случаев, удвоение Х-хромосомы в 8 % случаев, отсутствие одной из половых хромосом — в 4 %.
Выполнение FISH-исследования спермы показано всем пациентам с идиопатическим бесплодием.
Использование данного метода диагностики показано всем парам, планирующим лечение методом ЭКО/ИКСИ, с целью прогнозирования генетических нарушений эмбрионов и дает возможность генетической селекции у пациентов с высоким уровнем анеуплоидий ядер сперматозоидов.
1. Лабораторная диагностика мужского бесплодия / Долгов В.В., Луговская С.А., Фанченко Н.Д. [и др.]. — М.; Тверь: ООО «Издательство «Триада», 2006. — 145 с.
2. Никитин О.Д. Аномалии половых хромосом при мужской инфертильности / О.Д. Никитин, С.В. Базалицкая // Здоровье мужчины. — 2011. — № 4. — C. 151-155.
3. Особенности генотипа мужчин с нарушениями сперматогенеза / Ж.И. Глинкина, Л.Н. Кузьмичев, Л.Б. Киндарова [и др.] // Андрология и генитальная хирургия. — 2010. — № 2. — C. 38-43.
4. Савельева А.П. Структура хромосомной патологии среди пациентов с мужским бесплодием и патозооспермией: Дис... канд. биол. наук: 03.00.15, 03.00.25. — М., 2002. — 167 с.
5. Связь морфологических аномалий сперматозоидов с наличием хромосомных анеуплоидий в их ядрах / А.М. Феськов, И.А. Феськова, Е.С. Жилкова [и др.] // Здоровье мужчины. — 2009. — № 2. — C. 187.
6. Тавокина Л.В. Молекулярно-цитогенетическая диагностика в лечении пациентов с нарушением репродукции / Л.В. Тавокина // Медицинские аспекты здоровья женщины. — 2007. — № 3. — C. 20-24.
7. Трещенков Э.А. Исследование фрагментации ДНК сперматозоидов у мужчин в бесплодных браках / Э.А. Трещенков, С.Г. Жабин, И.И. Павленко // Мат-лы XX ежегодной междунар. конф. РАРЧ «Репродуктивные технологии сегодня и завтра». — 2010. — С. 64-65.
8. Diemer T. Developmental and genetic disorders in spermatogenesis / Diemer T., Desjardins C. // Hum. Reprod. Update. — 1999. — Vol. 5, № 2. — P. 120-140.
9. Frequency of aneuploidy in sperm from patients with extremely severe male factor infertility / Gianaroli L., Magli M.C., Cavallini G. [et al.] // Human. Reproduction. — 2005. — Vol. 20. — P. 2140-2152.
10. Shi Q. Aneuploidy in human spermatozoa: FISH analysis in men with constitutional chromosomal abnormalities, and in infertile men / Shi Q., Martin R.H. // Reproduction. — 2001. — Vol. 121. — P. 655-666.
11. Sperm aneuploidies and low progressive motility / G. Collodel, S. Capitani, B. Baccetti [et al.] // Human Reproduction. — 2007. — Vol. 22, № 7. — P. 1893-1898.
12. Sarrate Z. Fluorescence in situ hybridization (FISH) protocol in human sperm / Sarrate Z., Anton E. // J. Vis. Exp. — 2009. — Vol. 31, № 1. — Р. 1405-1412.
13. Ultrastructural sperm evaluation and 18, X and Y aneuploidies. Studies on varicocele III / Baccetti B., Bruni E., Capitani S. [et al.] // J. Androl. — 2006. — Vol. 27. — P. 94-101.

