Журнал «Медико-социальные проблемы семьи» 3-4 (том 17) 2012
Вернуться к номеру
Біохімічні особливості колагенового обміну при лікуванні нетримання сечі у жінок
Авторы: Желєзна Г.О. - Донецький національний медичний університет ім. М. Горького, Донецький регіональний центр охорони материнства та дитинства
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
Метою даної роботи було вивчення біохімічних особливостей колагенового обміну при лікуванні різних форм нетримання сечі в пацієнток із гінекологічною патологією на тлі дисплазії сполучної тканини. До основної групи увійшли 90 пацієнток із нетриманням сечі й гінекологічною патологією на фоні ДСТ, групу порівняння становили 86 таких пацієнток, а контрольну групу — 35 здорових жінок.
У роботі визначено, що біохімічними маркерами колагенового обміну в жінок із нетриманням сечі й гінекологічною патологією на тлі дисплазії сполучної тканини є естрадіол, концентрація магнію, кальцію в крові, оксипроліну в крові і сечі. Однозначно визначено вплив і взаємозв’язок статевих гормонів (естрадіолу) із перебігом нетримання сечі при дисплазії сполучної тканини у жінок із гінекологічною патологією і вплив на уротелій, що має особливе значення при ургентному і змішаному нетриманні сечі. Важливу роль відіграють магній і кальцій, оскільки магній впливає на транспорт кальцію в організмі, а концентрація кальцію — на рух м’язів, у тому числі сечового міхура. Магній є найважливішим мікроелементом метаболічного гомеостазу — фізіологічний фактор синтезу колагену. Визначення оксипроліну в крові і сечі може бути як скринінговим показником дисплазії сполучної тканини, так і маркером ефективності лікування нетримання сечі при дисплазії сполучної тканини в жінок.
Целью данной работы было изучение биохимических особенностей коллагенового обмена при лечении различных форм недержания мочи у пациенток с гинекологической патологией на фоне дисплазии соединительной ткани. В основную группу вошли 90 пациенток с недержанием мочи и гинекологической патологией на фоне ДСТ, группу сравнения составили 86 таких пациенток, а контрольную группу — 35 здоровых женщин.
В работе определено, что биохимическими маркерами коллагенового обмена у женщин с недержанием мочи и гинекологической патологией на фоне дисплазии соединительной ткани являются эстрадиол, концентрация магния, кальция в крови, оксипролина в крови и моче. Однозначно определены влияние и взаимосвязь половых гормонов (эстрадиола) с течением недержания мочи при дисплазии соединительной ткани у женщин с гинекологической патологией и влияние на уротелий, что имеет особое значение при ургентном и смешанном недержании мочи. Важную роль играют магний и кальций, поскольку магний влияет на транспорт кальция в организме, а концентрация кальция влияет на движение мышц, в том числе мочевого пузыря. Магний является важнейшим микроэлементом метаболического гомеостаза — физиологический фактор синтеза коллагена. Определение оксипролина в крови и моче может быть как скрининговым показателем ДСТ, так и маркером эффективности лечения НМ при ДСТ у женщин.
The aim of this work was to study the biochemical properties of collagen metabolism in the treatment of various forms of urinary incontinence in women with gynecologic diseases against connective tissue dysplasia (CTD). The study group included 90 patients with urinary incontinence and gynecologic pathologies against CTD, comparison group consisted of 86 such patients and the control group — 35 healthy women.
In the work it is defined that biochemical markers of collagen metabolism in women with urinary incontinence and gynecologic pathology secondary to connective tissue dysplasia are estradiol, concentration of magnesium and calcium in the blood, of hydroxyproline in the blood and urine. The effect and correlation of sex hormones (estradiol) and the course of urinary incontinence in connective tissue dysplasia in women with gynecologic diseases and impact on the urothelium were determined unambiguously, that is of particular importance in the urgent and mixed urinary incontinence. Magnesium and calcium play important role, as magnesium influences the transport of calcium in the body, and calcium concentration has an impact on muscle movement, including the bladder. Magnesium is an essential trace element of metabolic homeostasis — the physiological factor in collagen synthesis. Determination of hydroxyproline in the blood and urine may be both screening indicator of CTD and marker of effective treatment of urinary incontinence in women with CTD.
Ургентне, стресове, змішане нетримання сечі, метаболічний гемостаз, біохімічні маркери, дисплазія сполучної тканини.
Ургентное, стрессовое, смешанное недержание мочи, метаболический гемостаз, биохимические маркеры, дисплазия соединительной ткани.
Urgency, stress, mixed urinary incontinence, metabolic homeostasis, biochemical markers, connective tissue dysplasia.
Розлади сечовипускання і нетримання сечі (НС) у жінок на сьогодні залишаються серйозною проблемою, незважаючи на недостатню вивченість етіопатогенетичних ланок захворювання й відсутність єдиного діагностичного й лікувального алгоритму. Однією з важливих причин тяжкості НС є дисплазія сполучної тканини (ДСТ). Порушення структури сполучної тканини має прямий зв’язок із розвитком НС, пролапсом тазових органів та виникненням паравагінальних дефектів. Типи колагену різні у здорових жінок і при НМ. Основними факторами ризику в розвитку інконтиненції вважають зміну сполучної тканини в поєднанні з одним із таких чинників: вагітність, вік хворої та гормональний статус [1–3]. U. Ulmsten та співавтори (1997) виявили, що в жінок із стресовим НС наявне 40% зниження загального колагену в круглій зв’язці й розрізі шкіри порівняно із здоровими жінками. Вони припускають, що зниження колагену призводить до порушення підтримувального урогенітального апарату й зменшує гіпермобільність шийки сечового міхура. У цих роботах також є вказівки на наявність гриж живота, варикозного розширення вен нижніх кінцівок і пролапсу матки в жінок із НС. Проте цей аспект проблеми ДСТ вивчений недостатньо. Частота одиничних зовнішніх фенотипічних ознак надзвичайно висока — у 94 % осіб молодого віку поширеність саме ДСТ становить від 13 до 65 % [4–6].
Наявність ДСТ змінює клінічні симптоми багатьох захворювань і сприяє формуванню тяжких ускладнень із залученням диспластикозалежних органів. Є докази участі і чинників зовнішнього середовища, дефіциту мікро- та макроелементів (магній, цинк, кальцій) в розвитку ДСТ [4, 5]. Завдяки численним роботам В.М. Яковлєва і його учнів за останні 20 років інтерес до ДСТ значно виріс, визначений взаємозв’язок соматичного (у тому числі ендокринного) й репродуктивного здоров’я жінки.
Проте, незважаючи на високу ефективність хірургічних втручань, частота рецидивів нетримання сечі залишається високою (від 6 до 38 %) [2, 3, 7, 8]. Крім того, виконання оперативного лікування стресового нетримання сечі може супроводжуватися рядом серйозних ускладнень, таких як поранення сечового міхура, уретри, кишечника, судин малого таза, обструкція сечових шляхів, інфекції сечових шляхів, остеомієліт лобкових кісток, утворення спайок у порожнині малого таза [8–10]. Унаслідок цього зусилля урогінекологів, які займаються цією проблемою, спрямовані на пошук причин неефективного лікування і нових малоінвазивних, але ефективних методів лікування НС.
Метою даної роботи було вивчення біохімічних особливостей колагенового обміну при лікуванні різних форм нетримання сечі в пацієнток із гінекологічною патологією (ГП) на фоні ДСТ.
Матеріали та методи
Нами визначався вміст магнію, кальцію, оксипроліну в крові, оксипроліну в сечі, естрадіолу в крові до і після лікування. До основної групи увійшли 90 пацієнток із НС і ГП на фоні ДСТ, групу порівняння становили 86 таких пацієнток, а конт-рольну групу — 35 здорових жінок. Основна група і група порівняння розділені на підгрупи залежно від типу НС.
Вік обстежених жінок із НС коливався від 18 до 83 років і в середньому становив 52,52 ± 1,49 року в групі порівняння (50,59 ± 2,81 року — в підгрупі з ургентним НС, 52,13 ± 2,16 року — у підгрупі із змішаним НС і 54,84 ± 3,10 року — у підгрупі зі стресовим НС) і 55,76 ± 1,34 року — в основній групі (52,20 ± 2,16 року — у підгрупі з ургентним НС, 56,43 ± 2,41 року — у підгрупі із змішаним НС і 58,63 ± 2,38 року — у підгрупі із стресовим НС). У контрольній групі середнє значення показника віку дорівнювало 53,03 ± 1,97 року. Статистично значущої відмінності між віковими показниками груп обстеження не спостерігалося (p > 0,05). Усі пацієнтки мали очевидний взаємозв’язок НС із наявністю сполучнотканинної недостатності, викликаної дистрофічними порушеннями й системною дисплазією. Статистичну обробку проводили на персональному комп’ютері за допомогою пакета статистичних програм.
Усі жінки основної групи в комплексному лікуванні отримували препарати кальцію, магнію, плазмоліфтинг парауретрально (1–5 сеансів).
Результати та їх обговорення
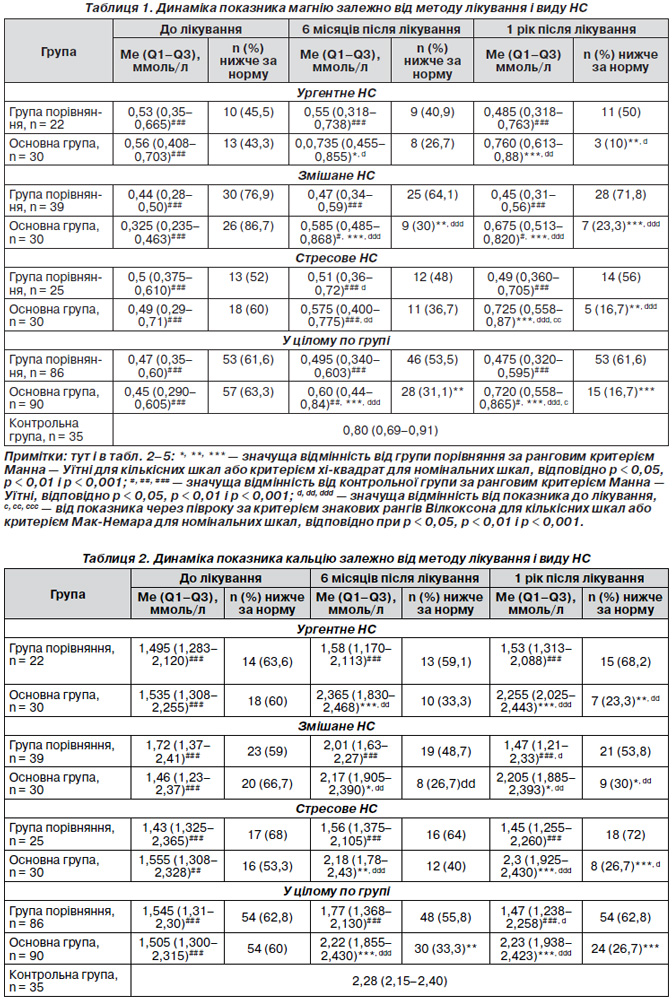
Результати вмісту в сироватці крові магнію й кальцію подані в табл. 1, 2. У наших дослідженнях референтні значення мікроелементів Са і Mg у жінок із НС і ДСТ до лікування в усіх підгрупах вірогідно нижчі, ніж у контрольній групі: Mg — 0,80 (0,69–0,91) ммоль/л, Са — 2,28 (2,15–2,40) ммоль/л. Найбільше зниження концентрації магнію в крові відзначене в групі змішаного нетримання сечі як в основній (на 86,7 % нижче за норму), так і в групі порівняння (на 76,9 % нижче за норму). У цілому по групі — на 63,3 і 61,1 % відповідно.
Відносні порушення обміну кальцію й магнію при ДСТ свідчать передусім про стан мінерального метаболізму тканин, що являє собою електролітний резерв цих катіонів. Виявлені відхилення в мінеральному гомеостазі при ДСТ обумовлені рядом причин, проте провідною та визначальною причиною метаболічної дисфункції є генетично детермінована недосконалість розвитку колагенових структур і регулюючих механізмів, відповідальних за мінералізацію тканин.
Магній є коферментом більш ніж у трьохстах білкових структурах. Із фізіологічної точки зору до 53 % магнію концентрується в кістковій тканині, дентині та емалі зубів і близько 20 % — у тканинах із високою метаболічною активністю (мозок, серце, м’язи, надниркові залози, нирки, печінка). Тільки 10 % усього магнію в організмі людини знаходиться поза клітинами, 90 % магнієвих іонів концентрується всередині клітин у формі Mg2+-ATФази (30 % — у мітохондріях, 50 % — у цитозолі і 10 % — у ядрі) [4, 8, 10]. Дефіцит магнію призводить до збільшення числа дисфункціональних молекул тРНК, таким чином знижуючи й уповільнюючи загальну швидкість білкового синтезу [8]. Отже, дефіцит магнію в сполучній тканині приведе до уповільнення синтезу всіх структурних молекул (включаючи протеоглікани, глікозаміноглікани, колаген та еластин). Оскільки синтез структурних молекул, таких необхідних для відновлення сполучної тканини, сповільнюється, то процеси відновлення також гальмуються, це призводить до погіршення механічних характеристик тканини. Іони магнію можуть модулювати активність відповідних біосинтетичних ферментів. Таким чином, дефіцит магнію може призводити до зниження активності гіалуронсинтетаз і в той же час до підвищення активності гіалуронідаз (оскільки інгібітори не діють при нестачі магнію). Обидва ці процеси призводять до погіршення механічних властивостей ниток гіалуронану й до часткової деградації аморфної речовини, що утворює основу позаклітинного матриксу.
Таким чином, наявні дані дозволяють зробити висновок, що найбільш вірогідні механізми дії дефіциту магнію на сполучну тканину — це посилення деградації колагенових і, можливо, еластинових волокон, а також полісахаридних ниток гіалуронану. Не можна виключити, що посилення поперечних зшивань призведе до грануляризації сполучної тканини, розшарування на «пластинки», що складаються з наполовину деградованих молекул колагену, і в результаті — до зменшення механічної міцності. При достатній концентрації магнію секреція/активність металоматриксних протеаз знижується, що призводить до зменшення деградації й до прискорення білкового синтезу нових молекул колагену.
У результаті застосування магнію, кальцію, місцево — вагінального естрогену й комплексу плазмоліфтингу в основній групі за розробленим алгоритмом і залежно від типу НС ми отримали динамічну стабілізацію показників магнію й кальцію в крові впродовж 6 міс. і утримання їх майже до норми через рік. Ураховуючи, що ДСТ — це хронічний генетично детермінований стан, який вилікувати неможливо, потрібно постійно коригувати метаболічний гомеостаз.
Показники магнію й кальцію в динаміці лікування свідчать про початкове метаболічне неблагополуччя, показники в основній групі і групі порівняння — про необхідність корекції магній-кальцієвого дефіциту для поліпшення складу і якості сполучної тканини. Так, рівень магнію до лікування в основній групі був 0,45 (0,29–0,61) ммоль/л, у групі порівняння — 0,47 (0,35–0,60) ммоль/л, що практично у 2 рази нижче за показники контрольної групи: 0,80 (0,69–0,91) ммоль/л, через 6 міс. — 0,60 (0,44–0,84) ммоль/л і 0,495 (0,34–0,60) ммоль/л відповідно, через 1 рік — 0,72 (0,558–0,865) ммоль/л і 0,475 (0,320–0,595) ммоль/л відповідно. Рівень кальцію до лікування в основній групі був 1,505 (1,300–2,315) ммоль/л, у групі порівняння — 1,545 (1,31–2,300) ммоль/л, що практично в 1,5 раза нижче за показники контрольної групи — 2,28 (2,15–2,40) ммоль/л, через 6 міс. — 2,22 (1,855–2,430) ммоль/л і 1,770 (1,368–2,130) ммоль/л відповідно, через 1 рік — 1,505 (1,300–2,315) ммоль/л і 1,47 (1,238–2,258) ммоль/л відповідно. Чітко простежується тенденція стабілізації показників магнію й кальцію в крові в основній групі на тлі лікування, ця тенденція зберігається й в усіх підгрупах основної групи залежно від типу НС.
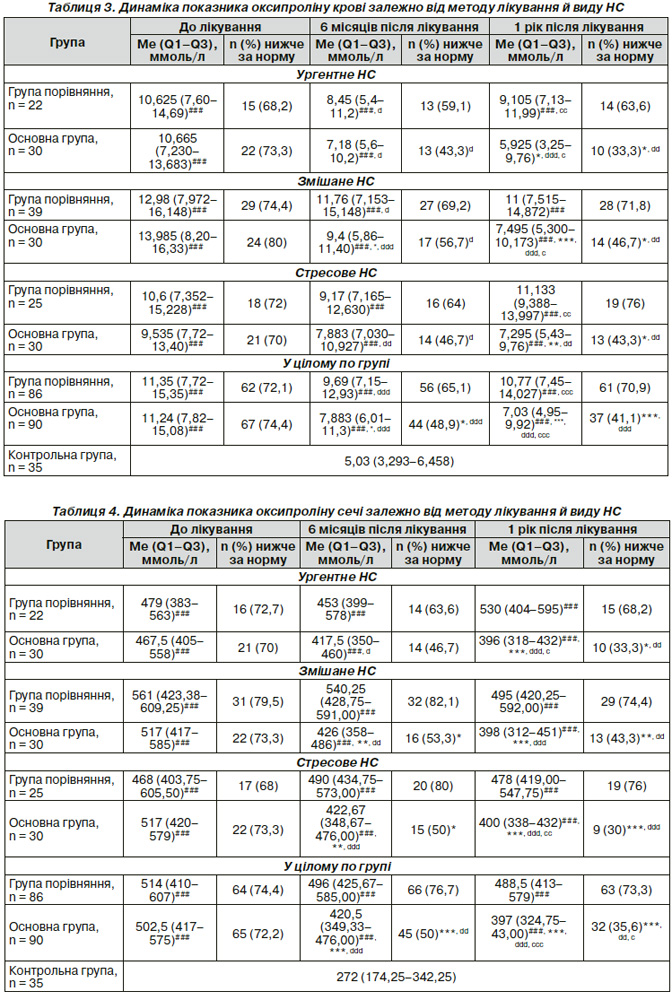
Результати визначення вмісту оксипроліну в крові й сечі подані в табл. 3, 4.
Як видно з табл. 3, 4, медіанне значення показників, що вивчаються, в крові і в сечі значно вище за контрольну групу. У контрольній групі пацієнток оксипролін у крові становив 5,030 (3,293–6,458) ммоль/л, а в сечі — 272,00 (174,25–342,25) ммоль/л. У цілому по групі і підгрупах до лікування як в основній групі, так і в групі порівняння підвищений уміст оксипроліну в крові і сечі зі значущою відмінністю від контрольної групи, р < 0,001.
Найбільш виражена оксипролінемія й оксипролінурія при змішаному нетриманні сечі: в основній групі — 13,985 (8,20–16,33) ммоль/л у крові і 517 (417–585) ммоль/л у сечі; у групі порівняння — 12,98 (7,972–16,148) ммоль/л у крові і 561 (423,38–609,25) ммоль/л у сечі. Так само спостерігається виражена оксипролінемія й оксипролінурія при ургентному і стресовому НС. Це свідчить про тяжкість ДСТ цих пацієнток. Із табл. 3, 4 видно, що значна оксипролінемія й оксипролінурія в усіх підгрупах до лікування свідчить про збільшення швидкості розпаду колагену в організмі за наявності ДСТ. Молекула колагену складається з амінокислот, що представлені в основному проліном, оксипроліном і гліцином, утворюють первинний поліпептидний ланцюг. Виявлення підвищеного рівня оксипроліну в сечі і/або крові — показник посиленого розпаду колагену в організмі. З біохімічних методів найбільш інформативним є визначення оксипроліну в добовій сечі і плазмі крові пацієнток. Підвищення дериватів обміну сполучної тканини свідчить про посилення процесу катаболізму, зниження — про порушення синтезу. Тому як контроль успішності медикаментозної терапії, що проводиться, ми використовували показник умісту оксипроліну в крові і сечі.
Вплив статевих гормонів на метаболізм сполучної тканини відомий. Естроген збільшує кількість тучних клітин, сприяючи набряклості сполучної тканини й формуванню ексудативних реакцій. Під впливом жіночих статевих гормонів відбувається передчасне дозрівання фібробластів і руйнування частини клітин із продукцією легкорозчинного, еластичного колагену.
Колаген, білок сполучної тканини, що надає їй міцності, імовірно, відіграє ключову роль у розвитку нетримання сечі. Поширення волокон колагену в стінці піхви, парауретральній тканині й середній порції леватора заднього проходу дозволяє цьому м’язу контролювати розташування проксимальної частини уретри. У жінок зі стресовим нетриманням сечі відзначається зниження синтезу колагену й значне зниження загальної його кількості, у тому числі в шкірі, круглих зв’язках матки, вагінальному епітелії й міхурово-піхвовій фасції. Versi et al. також відмічають кореляцію між загальним рівнем колагену в шкірі і параметрами уродинаміки. Колаген тазової фасції, можливо, відіграє важливу роль у патогенезі нетримання сечі, раніше була висловлена думка про те, що стресове нетримання сечі в пременопаузі пов’язане, принаймні частково, з порушенням метаболізму сполучної тканини. Виявлений значний вплив естрогену на метаболізм колагену в тазовій сполучній тканині з підвищенням як його синтезу, так і деградації. Нині немає доказів того, що визначена втрата колагену веде до послаблення тканини. Заміщення старого колагену новою тканиною супроводжується збільшенням числа зшивань і може призводити до зміцнення тканини, незважаючи на загальну втрату колагену.
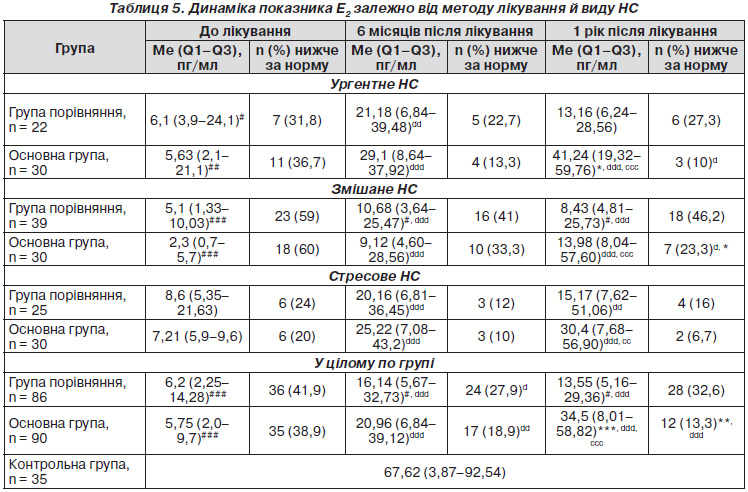
З одного боку, динаміка естрадіолу в крові пацієнток нас цікавила з точки зору гіпоестрогенії в жінок із НС, з іншого боку — як маркер прояву ДСТ у цих жінок. Так, в усіх підгрупах до лікування відзначалася гіпоестрогенія порівняно з контрольною групою — 67,62 (3,87–92,54) пг/мл. У цілому по основній групі — 5,75 (2,0–9,7) пг/мл, у групі порівняння — 6,2 (2,25–14,28) пг/мл. Найбільш виражене зниження концентрації естрадіолу спостерігається при ургентному і змішаному нетриманні сечі — 5,63 (2,1–21,1) пг/мл і 2,3 (0,7–5,7) пг/мл відповідно. Треба відзначити, що при лікуванні групи порівняння загальноприйнятими методами немає стійкої тенденції до збільшення концентрації естрадіолу й утримання її протягом року спостереження на відміну від основної групи. При ургентному НС концентрація естрадіолу становила 5,63 (2,1–21,1) пг/мл, через 6 місяців спостереження — 29,1 (8,64–37,92) пг/мл, через 1 рік — 41,24 (19,32–59,76) пг/мл. При стресовому НС: до лікування — 7,21 (5,9–9,6) пг/мл, через 6 місяців — 20,96 (6,84–39,12) пг/мл, через 1 рік — 30,4 (7,68–56,9) пг/мл. При змішаному НС: до лікування — 2,3 (0,7–5,7) пг/мл, через 6 місяців — 9,12 (4,60–28,56) пг/мл, через 1 рік — 13,98 (8,04–57,6) пг/мл. Результати свідчать про ефективність запропонованої методики лікування НС залежно від типу при ДСТ і, можливо, про вплив естрогену на уротелій.
Висновки
Таким чином, біохімічними маркерами колагенового обміну в жінок із НС і гінекологічною патологією на фоні ДСТ є естрадіол, концентрація магнію, кальцію в крові, оксипроліну в крові і сечі. Однозначний вплив і взаємозв’язок статевих гормонів (естрадіолу) на перебіг НСМ при ДСТ у жінок із гінекологічною патологією і вплив на уротелій, що має особливе значення при ургентному і змішаному НС. Важливу роль відіграють магній і кальцій, оскільки магній впливає на транспорт кальцію в організмі, а концентрація кальцію впливає на рух м’язів, у тому числі сечового міхура. Магній є найважливішим мікроелементом метаболічного гомеостазу — фізіологічний чинник синтезу колагену. Визначення оксипроліну в крові й сечі може бути як скринінговим показником ДСТ, так і маркером ефективності лікування НС при ДСТ у жінок.
1. Аполихина И.А. Эпидемиологические аспекты недержания мочи / И.А. Аполихина, В.М. Адикям // Журн. рос. общества акуш.-гинек. — 2005. — № 1. — С. 12.
2. Буянова С.Н. Диагностика и лечение недержания мочи у женщин / С.Н. Буянова, В.Д. Петрова, М.А. Чечнева // Рос. асс. акуш.-гин. — 2002. — № 4. — С. 52-61.
3. Кулаков В.И Акушерско-гинекологические факторы риска недержания мочи у женщин / В.И. Кулаков // Акуш. и гинек. — 2005. — № 3. — С. 32.
4. Громова О.А. Дисплазия соединительной ткани, клеточная биология и молекулярные механизмы воздействия магния / О.А. Громова, И.Ю. Торшин // Русский медицинский журнал. — 2008. — Т. 16, № 1. — С. 1-10.
5. Кадурина Т.И. Наследственные коллагенопатии / Т.И. Кадурина. — СПб.: Невский диалект, 2000. — 271 с.
6. Дисплазия соединительной ткани / Под ред. Т.И. Кадуриной, В.Н. Горбуновой. — Санкт-Петербург: Элби, 2009. — 714 с.
7. Наследственные нарушения структуры и функции соединительной ткани [Российские национальные рекомендации]. — Москва, 2009. — 66 с.
8. Нестеренко З.В. Феномен дисплазии соединительной ткани / З.Ф. Нестеренко // Український медичний альманах. — 2008. — № 4. — С. 105-109.
9. Спасов А.А. Магний в медицинской практике / А.А. Спасов. — Волгоград, 2000. — 272 с.
10. Senni K. Magnesium and connective tissue / K. Senni, A. Foucault-Bertaud, G. Godeau // Magnes. Res. — 2003. — Vol. 16, № 1. — P. 70-74.
11. Долгов В.В. Лабораторная диагностика нарушений обмена минералов и заболеваний костей: учебное пособие / В.В. Долгов, И.П. Ермакова. — М.: РМАПО, 1998. — 64 с.