Гипертензия развивается у 7–10 % всех беременных, у 4–5 % — в виде преэклампсии (ПЭ). Человечество размышляет над загадкой преэклампсии с античных времен. Человек — единственное животное на планете, у которого описано данное заболевание. Две трети всех беременных с ПЭ — это молодые здоровые первобеременные женщины, тем не менее, перинатальная смертность при этом заболевании возрастает в 20 раз. Ни одна из множества теорий о происхождении ПЭ не позволила разработать надежные методы ее профилактики, так как они касались лишь следствий заболевания, не раскрывая его истинной причины.
В последнее десятилетие появились убедительные доказательства наследственной природы ПЭ. В регионах хромосом 7q36 и 2р13 найдены локусы, ответственные за семейное наследование гипертензии беременных и за развитие ПЭ [4, 5]. Доказано, что существуют генотипы ангиотензиногена: М (метионин) 235 и Т (треонин) 235. Гомозиготы с кодом Т235 при ПЭ встречаются значительно чаще: 87–92 % в сравнении с контролем — 56 % [22]. Обнаружено также наличие мутации в аминокислотном составе ангиотензиногена: замена лейцина на фенилаланин в позиции 10 — месте его расщепления ренином. Мутация существенно меняет взаимодействие ангиотензиногена с ренином и ангиотензинпревращающим ферментом (АПФ), что может вызвать развитие ПЭ у беременных — носителей мутации [16]. У беременных с ПЭ выявлено снижение концентрации и активности ангиотензина и альдостерона при неизменной общей концентрации ренина и ангиотензиногена и повышенной чувствительности к инъекционному ангиотензину [9].
В последние годы открыто существование вариантов генотипа АПФ, связанных с наличием (аллель I) или отсутствием (аллель D) в интроне 16 гена АПФ вставки из 287 нуклеотидов. У пациентов, гомозиготных по аллелю D, уровень АПФ в 2 раза превышает уровень фермента у гомозигот по аллелю I [12]. Полиморфизм гена АПФ и ангиотензиногена слабо связан с частотой и течением хронической артериальной гипертензии (ХАГ) вне беременности [7, 18, 21], но может быть фактором риска развития гипертензии у беременных [28]. Метаанализом, включающим 185 работ, достоверно установлено, что распространенность вариантов генов ренин-ангиотензин-альдостероновой системы (РААС) зависит от возраста и расовой принадлежности [27]. При этом следует указать на отчетливую зависимость частоты ПЭ от расы: белые — 3,71 %, негры — 3,97 %, американские индейцы — 4,81 %, китайцы — 1,44 %, японцы — 1,84 %, жители Филлипин — 2,88 % [30].
C учетом вышеизложенного вполне логично предположить, что в основе ПЭ лежит наследственный (генетический) дефект метаболизма, определяющий особенность РААС, приводящую к недостаточной активности ангиотензина II и, как следствие этого, к уменьшению секреции альдостерона, снижению активности симпатоадреналовой системы, повышению тонуса блуждающего нерва и уменьшению секреции антидиуретического гормона (АДГ).
Здесь уместно отметить результаты исследований отечественных авторов, касающихся активности АПФ при нормальной и осложненной беременности. Показано, что в норме содержание фермента в плазме крови беременных постоянно нарастает к III триместру. У беременных с развившейся впоследствии ПЭ содержание АПФ в плазме крови во II триместре оказалось значительно ниже нормы. В то же время у беременных с ХАГ содержание АПФ было значительно выше нормы во все сроки беременности [2].
Ренин-ангиотензин-альдостероновая система играет центральную роль в поддержании сосудистого тонуса и гомеостаза соли и воды. Нормальная беременность сопровождается дополнительным поступлением 500–900 ммоль хлористого натрия, обеспечивающим рост объема плазмы, заполняющей быстро и существенно увеличивающийся объем сосудистого русла. Одновременное повышение гломерулярной фильтрации (до 50 %) сопровождается огромным количеством фильтруемого натрия: до 30 000 ммоль в сутки при минимуме выделяемого 100–200 ммоль в сутки. Вследствие этого беременные особенно чувствительны к изменениям почечной реабсорбции натрия: при некомпенсированной почечной экскреции быстро развивается гиповолемия [23]. Несостоятельность эндокринного механизма пополнения и поддержания необходимого внутрисосудистого объема жидкости приводит к нарушению течения беременности, что выражается в ряде состояний, обычно описываемых как гестоз (ПЭ) или его осложнения (внутриутробная задержка развития плода (ВЗРП), преждевременные роды).
У беременных с дефектом РААС вследствие недостаточной реабсорбции натрия и воды (альдостерон, АДГ) с ростом срока гестации нарастает относительная гиповолемия. Венозная вазодилатация, развивающаяся при снижении активности симпатоадреналовой системы, снижая венозный возврат, также способствует уменьшению наполнения артериального русла, объем которого в норме составляет около 15 % объема циркулирующей крови (ОЦК). При достижении определенной критической величины гиповолемии снижение давления в сосудах приводит к сокращению гладких мышц и вазоспазму или даже к окклюзии сосуда [1]. Вазоспазм является причиной повреждения эндотелия сосудов, что вызывает гиперагрегацию тромбоцитов, снижение продукции простациклина сосудистой стенкой, изменение микроциркуляции и в конечном счете органную недостаточность, выражающуюся протеинурией, нарушениями функций мозга и печени. Известно, что ПЭ в 50–60 % случаев сопровождается гипоперфузией мозга [8], вызывающей компенсаторную реакцию дилатации его артерий [32]. Отмечено, что патологические изменения в мозге, сердце, печени беременных с ПЭ напоминают таковые при гиповолемии [31], при этом снижение тканевого кровотока характерно для ранних стадий заболевания и регистрируется задолго до его клинических проявлений [3]. Риск судорожного припадка наиболее высок при ПЭ, при ХАГ с протеинурией он ниже в 8 раз, а при ХАГ без протеинурии ниже в 17 раз [10]. Это указывает, что скорее гипоперфузия органов, нежели сосудистые повреждения вследствие гипертензии, определяет клиническую картину ПЭ. Относительная редкость поражения печени при ПЭ, известного как HELLP-синдром, связана с особенностью кровоснабжения этого органа из двух источников: аорты (через печеночную артерию) и воротной вены.
К органам, страдающим от гиповолемии, относится и беременная матка. Так, у беременных с ВЗРП уже в ранние сроки отмечаются признаки уменьшения объема циркулирующей крови: снижение размеров левого предсердия, концентрации натрия в крови, спадение нижней полой вены [14]. Существует предположение об участии системы РААС в процессах, идущих при беременности в спиральных артериях (инвазия трофобласта в мышечный слой), так как в их стенке найдена экспрессия генов ренина, АПФ, рецепторов ангиотензина [25].
Нередким явлением у беременных с ПЭ является нарушение мозгового кровообращения, которое стоит на первом месте среди причин материнской смертности при этом заболевании. Известно, что астроциты мозга, мигрируя и пролиферируя у пораженного участка сосудистого русла, восстанавливают внеклеточный матрикс и тем самым гематоэнцефалический барьер (ГЭБ). Астроциты, лишенные ангиотензиногена, слабо восстанавливают ГЭБ, но это можно корригировать введением ангиотензина II и IV типа [19].
Инсулин блокирует секрецию ангиотензиногена жировыми клетками [6], что при избытке инсулина, провоцируемом контринсулярными гормонами беременности и ожирением, и наследственном дефекте метаболизма ангиотензиногена может способствовать развитию ПЭ, при которой часто наблюдается резистентность к инсулину.
Следует заметить, что рассматриваемые процессы касаются только организма матери, так как, несмотря на то что компоненты РААС (mРНК проренин, ангиотензиноген, рецепторы ангиотензина) представлены в плаценте и эндотелии плода во все сроки беременности [13], признаков повреждения эндотелия сосудов плода при ПЭ не отмечается. Так, продукция оксида азота фетоплацентарным комплексом, его содержание у плода не снижается, а система его синтеза функционирует в повышенном, компенсаторном режиме [17].
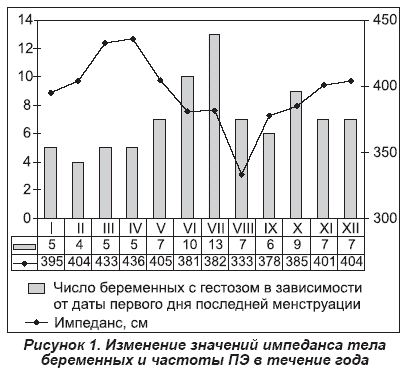
По нашим данным, имеется отчетливая прямая зависимость содержания жидкости в организме беременных, выражаемого в виде импеданса, и длительностью светового дня [20]. В средних широтах это приводит к изменению импеданса в течение года (рис. 1). Вместе с импедансом меняется и частота ПЭ. Эти изменения можно условно представить в виде гармонических колебаний, соответствующие точки которых отстоят друг от друга примерно на 20 недель. Именно к этому сроку у беременных максимально возрастает объем циркулирующей крови, что сопровождается ростом сердечного выброса и снижением ОПСС [24], в 5 раз возрастает активный ренин плазмы [15]. Когда этот срок беременности совпадает с минимальными или снижающимися показателями импеданса, тогда частота ПЭ наиболее низка, и соответственно, наоборот.
При оценке состояния учитываем следующее:
1. Степень недостаточности РААС и реакция сосудистого русла на гиповолемию являются индивидуальными. Поэтому возможен гестоз без гипертензии, ведущий ввиду нарушения МПК к ВЗРП и недонашиванию.
2. При наличии гиповолемии или клинически явного вазоспазма, повышения вязкости крови нарушается «питание» эндотелия с нарушением его функций, что приводит к снижению продукции простациклина и оксида азота, активации тромбоцитов, нарушению баланса «простациклин — тромбоксан» и «замыканию» порочного круга «вазоспазм — эндотелий».
3. Наиболее ранним проявлением нарушения органного кровотока является протеинурия.
4. Несмотря на наличие и прогрессирование артериального вазоспазма, сохраняется венозная вазодилатация. Относительное переполнение венозной части сосудистого русла приводит: а) к сохранению низкого венозного возврата, артериальной гиповолемии, вазоспазма; б) повышению вероятности и степени отеков. При выраженной гиповолемии ПЭ не сопровождается периферическими отеками. Известно, что подобная «сухая» ПЭ сопровождается максимальным риском материнской и перинатальной смертности.
5. Характерное для ПЭ клиническое проявление во второй половине беременности связано с максимальным объемом сосудистого русла в этот ее период: МПК, действие гормонов. Следует отметить, что в норме и, возможно, у женщин с ПЭ до второй половины беременности продолжается рост активности РААС [15], а вместе с этим и рост ОЦК.
6. Относительная гиповолемия, развивающаяся при снижении активности РААС, в зависимости от ее степени может проявляться:
— с ранних сроков беременности — до 16–18 недель. При этом снижение кровоснабжения матки приводит к нарушению инвазии трофобласта в мышечный слой спиральных артерий (в 8–10 недель и 16–18 недель) и формированию неполноценного МПК, что выражается в высоком сопротивлении кровотоку в маточных артериях (МА). При этом возрастает риск ранних проявлений симметричной формы ВЗРП и симптомов недонашивания;
— во второй половине беременности, когда процесс инвазии трофобласта в спиральные артерии завершен. При этом МПК, по данным допплерометрии кровотока в МА, остается в пределах нормы, а риск ВЗРП и недонашивания существенно снижается.
7. После родов у женщины с ПЭ происходят изменение гормонального статуса и редукция сосудистого русла (исчезновение МПК, спадение вен, облитерация сосудов), объем которого уже близок или соответствует ОЦК. Исчезает ишемизированный сосудистый орган — плацента, источник сосудосуживающих стимулов. Как следствие восстанавливаются венозный возврат и сердечный выброс, разрешается гипертензия, восстанавливается органный кровоток, т.е. исчезает клиника гестоза.
8. Практическое отсутствие ПЭ у повторнородящих, видимо, связано со способностью ферментов, в том числе и ферментов РААС, повышать свою активность при повторной «встрече» с субстратом. Однако и при повторной беременности исходно низкий объем плазмы крови приводит к развитию гипертензии [26].
9. Отсутствие заболевания ПЭ среди животных можно связать с функцией прямохождения человека. При горизонтальном или наклонном положении туловища животных даже при относительной гиповолемии и венозной вазодилатации не происходит существенного уменьшения венозного возврата, что мы наблюдаем у человека, и менее выражено снижение сердечного выброса. Возможно также и то, что геном животных в части, регулирующей активность РААС, существенно отличается от генома человека.
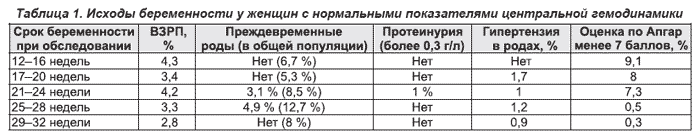
В табл. 1 представлены исходы беременности у женщин с нормальными показателями центральной гемодинамики (ЦГД). Скрининг беременных по показателям ЦГД весьма точно выделяет группу женщин с благоприятными исходами беременности для матери и плода. Беременные с низкими показателями ЦГД нуждаются в более углубленном обследовании, возможно, в условиях стационара.
Необходимо заметить, что клиническая картина гестоза (срок беременности более 20 недель и триада Цангенмейстера) может быть лишь его «маской», так как некоторые распространенные экстрагенитальные заболевания имеют тенденцию к утяжелению течения при беременности и клинически не отличаются от «чистого» гестоза (диабетическая нефропатия, гломерулонефрит). Классическим примером гипертензии является ситуация, именуемая «две почки — один зажим», где роль ишемизированной почки может играть любой орган с локальным дефектом сосудистого русла, а роль «нормальной» почки — весь организм.
Гипертензия беременных (ГБ) является частным случаем универсальной компенсаторной реакции вазоспазма, проявляющейся в особых условиях беременности. Как уже отмечено, при беременности снижается ОПСС и растет объем сосудистого русла, что вызывает явление «обкрадывания» кровотока в пораженном органе, а редукция кровотока провоцирует реакцию вазоспазма, поддерживающего адекватный органный кровоток. При нормальных параметрах центральной гемодинамики нет признаков органной ишемии и беременность заканчивается благоприятно. Вне беременности редукция кровотока в пораженном органе не настолько существенна, чтобы вызвать общий вазоспазм. Однако в зрелые годы эта причина имеет высокую вероятность реализации с развитием ХАГ, что и доказано статистически для женщин с ГБ.
По нашему мнению, ХАГ необходимо рассматривать как компенсаторную реакцию, направленную на поддержание адекватного кровоснабжения в зоне с редуцированным сосудистым руслом. При нормальном ОЦК и сердечном выбросе органный кровоток, как правило, не нарушен и беременность завершается благоприятно. В отдельных случаях при выраженном нарушении кровотока в пораженном органе (например, значительная редукция гломерулярного аппарата) на фоне снижения ОПСС вследствие увеличения объема сосудистого русла, что характерно для беременности, особенно для поздних ее сроков, возможно появление признаков органной ишемии: усиление гипертензии или увеличение / появление протеинурии, т.е. клиники ПЭ.
Вполне вероятен вариант сочетания у беременной исходной гиповолемии и экстрагенитального заболевания, связанного с редукцией органного кровотока, — ПЭ «в маске». Данная ситуация характерна для первобеременных с явной или скрытой экстрагенитальной патологией. Сочетание нарушения регионарного кровотока вследствие основного заболевания и гиповолемии, связанной с недостаточной активностью РААС, с высокой вероятностью приводит к ранней и тяжелой гипертензии, сочетающейся с выраженными нарушениями органного кровотока (высокой протеинурией, признаками поражения мозга и печени), т.е. к развитию клинической картины тяжелой ПЭ.
Исходя из вышеизложенного, можно сделать общие выводы:
1. Гестоз является наследственно обусловленным заболеванием беременных, возникающим вследствие неадекватной адаптации гемодинамики матери к особым условиям беременности.
2. Гестоз не является заболеванием второй половины беременности, когда чаще возникают его проявления, но возникает и развивается с началом беременности.
3. Гестоз является более широким понятием, встречается чаще и оказывает большее влияние на исходы беременности, чем клиническая картина ПЭ, являющаяся конечной стадией его развития или проявлением тяжелого экстрагенитального заболевания.
4. Клиническая картина ПЭ является синдромом, вызванным органной ишемией, развивающейся вследствие либо выраженной гиповолемии, что составляет основу гестоза, либо экстрагенитального заболевания, проявляющегося или изменяющего свое течение на более тяжелое в особых гемодинамических условиях беременности.
5. Клинические проявления синдрома ПЭ отличаются крайним разнообразием, что связано с генетическим полиморфизмом основной причины и частым присутствием экстрагенитальной патологии.
Лечебно-профилактические мероприятия должны быть направлены:
1) на обеспечение венозного возврата, чему способствуют положение на левом боку, венотоники, мышечная активность. Известно, что умеренная физическая активность во время беременности существенно увеличивает темпы роста и массу плода и плаценты [11];
2) поддержание адекватного внутрисосудистого объема. Этому способствует расширение питьевого режима, достаточное потребление поваренной соли. Известно, что нагрузка солью увеличивает экспрессию рецепторов ангиотензина в почках, причем больше у особей с отсутствием гена ангиотензиногена [29];
3) своевременное и бережное, преимущественно консервативное родоразрешение.
Кроме того, следует отметить, что, во-первых, инфузионная терапия, направленная на увеличение объема плазмы крови, не имеет решающего значения в лечении гестоза и профилактике его тяжелого течения, так как:
— должна начинаться с момента появления гиповолемии и быть постоянной, что практически невозможно;
— необходимо вводить препарат, длительно (сутками) находящийся в сосудистом русле, но такого препарата не существует;
— бессмысленна и скорее вредна у беременных с нормальными объемными показателями ЦГД (ХАГ, гипертензия беременных);
— если она проводится после появления гипертензии, это не устраняет артериальной гиповолемии, но ведет к перегрузке венозного русла, нарастанию отеков, повышенному риску отека легких и мозга.
Во-вторых, следует считать нецелесообразным:
— начало лечения с гипотензивной терапии, ухудшающей органный кровоток. Гипотензивная терапия является профилактикой инсульта и показана лишь в ситуациях, когда САД приближается к уровню 130 мм рт.ст., угрожающему нарушением ауторегуляции мозгового кровотока;
— ограничение соли и жидкости, усугубляющее гиповолемию;
— назначать мочегонные средства, особенно у беременных с клиникой преэклампсии. Исключением являются ситуации отека мозга, легких и ОПН;
— значительное ограничение мышечной активности беременной. До настоящего времени не найдено научных доказательств пользы строгого постельного режима у женщин с ПЭ.
В третьих, препараты, влияющие на гемостаз (антитромбоцитарные средства, гепарин) не дают существенного положительного эффекта у беременных с ПЭ, так как процессы, на которые они воздействуют, вторичны и являются компенсаторными следствиями нарушения функции эндотелия.
Изложенный взгляд на происхождение и ведение гипертензии у беременных, хотя он и согласуется с последними достижениями современной научной мысли, безусловно, не является окончательным решением этой сложной проблемы и требует дополнительного изучения и существенных уточнений. Однако уже сегодня он открывает отчетливые перспективы научных исследований, направленных на разработку конкретных и действенных лечебно-профилактических мероприятий в отношении гестоза, позволяет внести определенные коррективы в традиционные рекомендации и принципы ведения беременных с гипертензией и клиникой ПЭ.
Список литературы
1. Джонсон П. Периферическое кровообращение: Пер. с англ. — Москва, 1982.
2. Пестрикова Т.Ю., Блощинская И.А., Юрасова Е.А., Витько Н.Ю. // Проблемы беременности. — 2001. — № 3. — С. 57-58.
3. Anim-Nyame N., Sooranna S.R., Johnson M.R. et al. // Cardiovasc. Res. — 2001. — Vol. 50. — P. 603-609.
4. Arngrimsson R., Hayward C., Nadaud S. et al. // Am. J. Hum. Genet. — 1997. — Vol. 61. — P. 354-362.
5. Arngrimsson R., Siguroardottir S., Frigge M.L. et al. // Hum. molecular genetics. — 1999. — Vol. 8. — P. 1799-1805.
6. Aubert J., Safonova I., Negrel R., Ailhaud G. // Biochem. biophys. res. commun. — 1998. — Vol. 250. — P. 77-82.
7. Beige J., Zilch O., Hohenbleicher H. et al. // J. Hypertens. — 1997. — Vol. 15. — P. 503-508.
8. Belfort M.A., Grunewald C., Saade G.R. et al. // Acta Obstetr. Gynecol. Scand. — 1999. — Vol. 78. — P. 586-591.
9. Brown M. A., Wang J., Whitworth J.A. // Clin. exp. hypertens. — 1997. — Vol. 19. — P. 713-726.
10. Burrows R.F., Burrows E.A. // Am. J. Obstetr. Gyn. — 1995. — Vol. 173, part 1. — P. 929-935.
11. Clapp J.F., Kim H., Burciu B., Lopez B. // Am. J. Obstet. Gyn. — 2000. — Vol. 183. — P. 1484-1488.
12. Clarkson P., Prasad N., Macbeod C. et al. // J. Hypertens. — 1997. — Vol. 15. — P. 995-1000.
13. Cooper A.C., Robinson G., Vinson G.P. et al. // Placenta. — 1999. — Vol. 20. — P. 467-474.
14. Duvecott J.J., Cheriex E.C., Pieters F.A. et al. // Obstet. Gyn. — 1995. — Vol. 85. — P. 361-367.
15. Godard C., Gaillard R., Vallotton M.B. // Nephron. — 1976. — Vol. 17. — 353-360.
16. Inoue I., Rohrwasser A., Helin C. et al. // J. Biol. Chem. — 1995. — Vol. 270. — P. 1430-1436.
17. Iorioi R.D., Marinoni E., Emiliani S., Villaccio B., Cosmi E.V. // Europ. J. Obstet. Gyn. Reprod. Biol. — 1998. — Vol. 76. — P. 65-70.
18. Jeunemaitre X., Lifton R.P., Hunt S.C. et al. // Nature Genet. — 1992. — Vol. 1. — P. 72-75.
19. Kakinuma J., Hama H., Sugiyama F. et al. // Nat. Med. — 1998. — Vol. 4. — P. 1078-1080.
20. Karpov A.U., Shmelev V.I., Okhapkin M.B. et al. // XI International conference on electrical bio-impedance. — Norvay, 2001. — P. 305-308.
21. Kato N., Sugiyama T., Morita H. et al. // J. Hypertens. — 1999. — Vol. 17. — P. 757-763.
22. Kobshi J. // Hokkaido Igaku Zasshi. — 1995. — Vol. 70. — P. 649-657.
23. Lenfant G., Gifford R.W., Zuzpan F.P. // Am. J. Obstetr. Gyn. — 1990. — Vol. 163. — P. 1689-1712.
24. Leib A., Pressman E. // The Johns Hopkins manual of gynecology and obstetrics / Ed. by N.C. Lambrow, A.N. Morse, E.E. Wallach. — 1999. — P. 112-123.
25. Morgan T., Craven C., Ward K. // Hypertension. — 1998. — Vol. 32. — P. 683-687.
26. Spaanderman M.E.A., Aardenburg R., Ekhart T.H.A. et al. // Europ. J. Obstetr. Gyn. reprod. biol. — 2001. — Vol. 95. — P. 218-221.
27. Staessen J.A., Ginocchio G., Wang J.G. et al. // J. Hypertens. — 1997. — Vol. 15, suppl. 4. — P. 196-344.
28. Staessen J.A., Wang J.G., Ginicchio G. et al. // J. Hypertens. — 1997. — Vol. 15, suppl. 4. — P. 386.
29. Tamura K., Umemura S., Sumida J. et al. // Hypertension — 1998. — Vol. 32. — P. 223-227.
30. USA national vital statistics report. — 1999. — Vol. 47, № 18.
31. Zamorski M.A., Green L.A. // Am. Fam. Physician. — 1996. — Vol. 53. — P. 1595-1604.
32. Zatic J., Aranyosi J., Mihalka L. et al. // Gynecol. Obstetr. Invest. — 2001. — Vol. 51. — P. 223-227.


