Антифосфолипидный синдром (АФС) — симптомокомплекс, включающий рецидивирующие венозные и артериальные тромбозы, различные формы акушерской патологии, тромбоцитопению, разнообразные неврологические, сердечно-сосудистые, гематологические и другие нарушения, серологическими маркерами которого являются АТ к фосфолипидам (ФЛ), АТ к кардиолипину (аКЛ), волчаночный АГ (ВА), b2-гликопротеин-1-кофакторозависимые АТ.
В основе АФС лежит образование в организме в высоком титре бимодальных аутоантител, взаимодействующих с отрицательно заряженными мембранными фосфолипидами (МФ) и связанными с ними гликопротеинами (ГП) [1].
Изучение АФС началось с 1907 г. с разработки лабораторного метода диагностики сифилиса. В сыворотке больных были обнаружены АТ, названные реагинами. В 1941 г. установлено, что активным антигенным компонентом в этой тест-системе является фосфолипидкардиолипин (КЛ). Начиная с 1938 г. установлено, что у многих людей обнаруживается положительная реакция Вассермана при отсутствии каких-либо признаков сифилитической инфекции. Этот феномен назван биологической ложноположительной RW (Б-ЛПРВ). Оказалось, что Б-ЛПРВ встречается в двух основных вариантах:
— остром;
— хроническом.
В первом случае у больных с несифилитической инфекцией Б-ЛПРВ исчезает с выздоровлением и длительность ее обнаружения не превышает 6 мес. Во втором случае может сохраняться в течение многих лет при отсутствии видимого причинного фактора.
В начале 50-х годов установлено, что хроническая Б?ЛПРВ часто встречается при аутоиммунных заболеваниях, особенно СКВ (30–44 %). Были описаны случаи наличия в плазме больных СКВ фактора, ингибирующего свертываемость крови. Несмотря на то, что этот фактор обнаруживался и у пациентов, не страдающих СКВ, он получил название волчаночный антикоагулянт (ВА). Дальнейшие наблюдения показали, что ВА — иммуноглобулин, влияние которого на комплекс «протромбин — тромбин» реализуется через взаимодействие с фосфолипидной порцией протромбин-активированного комплекса.
Несмотря на способность ВА подавлять свертываемость крови, у больных с ВА очень редко развиваются геморрагии. В 1963 г. были описаны случаи тромбоэмболических (ТЭ) осложнений. Геморрагии же встречаются только при дефиците тромбоцитов или протромбина.
В 1983 г. после разработки радиоиммунных методов определения АТ к КЛ была выявлена сильная ассоциация между наличием аКЛ, ВА, Б-ЛПРВ и развитием тромботических осложнений и тромбоцитопенией. В 1986 г. был описан новый клинико-лабораторный симптомокомплекс, ассоциирующийся с наличием аКЛ и включающий рецидивирующий тромбоз, спонтанные аборты, тромбоцитопению, неврологические нарушения — антикардиолипиновый синдром (в последующем — АФС). В дальнейшем выявлено, что АФС может развиваться и при отсутствии СКВ, что позволило сформулировать концепцию существования АФС. Это привлекло внимание к данной проблеме специалистов различных медицинских специальностей [1, 2, 4, 5].
Классификация антифосфолипидного синдрома
1. Клинические варианты:
а) первичный АФС;
б) вторичный АФС:
— при ревматических и аутоиммунных заболеваниях;
— злокачественных новообразованиях;
— применении лекарственных препаратов;
— инфекционных заболеваниях;
— наличии иных причин;
в) другие варианты:
— «катастрофический» АФС;
— ряд микроангиопатических синдромов (тромботическая тромбоцитопения, гемолитико-уремический синдром, НЕLLР-синдром);
— синдром гипотромбинемии;
— диссеминированная внутрисосудистая коагуляция;
— АФС в сочетании с васкулитом.
2. Серологические варианты:
а) серопозитивный АФС с аКЛ и/или ВА;
б) серонегативный:
— с IgМ аФЛ, реагирующими с фосфатидилхолином;
— с АФС, реагирующими с фосфатидилэтаноламином;
— с антителами, реагирующими с b-2-ГП-1-кофакторзависимыми аФЛ.
Главной особенностью АФС является высокая ангиотропность и тромбогенность. В дебюте этого синдрома чаще доминируют цереброваскулярные поражения — от снижения памяти, постоянной головной боли, мигрени, преходящих нарушений мозгового кровообращения и зрения до тромбозов сосудов мозга, синусов, тромботических инсультов, эпилепсии и синдрома Снеддона. Дебютными могут быть флеботромбозы конечностей (с ТЭЛА и без нее), синдром Рейно [1, 2].
Показания к определению АТ к фосфолипидам (аФЛ):
1. Все больные с системной красной волчанкой.
2. Вероятный тромбоз до 40 лет.
3. Необычная локализация тромбоза (например, мезентериальные вены).
4. Необъясненный неонатальный тромбоз.
5. Идиопатическая тромбоцитопения (исключить болезнь Мошковича).
6. Артериальный тромбоз до 40 лет.
7. Кожный некроз на фоне приема непрямых антикоагулянтов.
8. Необъяснимое удлинение активированного частичного тромбопластинового времени (АЧТВ).
9. Рецидивирующие спонтанные аборты (2 и больше).
10. Ранний острый инфаркт миокарда (ОИМ).
11. Наличие родственников с тромботическими нарушениями.
Моменты, на которых важно остановиться при сборе анамнеза у больного с АФС:
Наследственность
Наличие у родственников:
— ревматических заболеваний;
— рецидивирующих инсультов (особенно в возрасте до 50 лет);
— рецидивирующих инфарктов (особенно в возрасте до 50 лет);
— рецидивирующего тромбофлебита;
— в анамнезе — спонтанные аборты, эклампсия, преэклампсия.
Существует наследственная предрасположенность для развития АФС.
Инфекции
В случае, если больному ранее определялись аКЛ, была ли связь выявления антител с обострением хронической инфекции или с развитием острой инфекции.
Появление антител к фосфолипидам при инфекциях часто не сопровождается образованием тромбозов.
Прием лекарственных препаратов:
— гормональных контрацептивов;
— новокаинамида;
— хинидина;
— гидралазина (входит в состав апрессина);
— психотропных препаратов.
Прием некоторых препаратов может вызвать волчаночноподобный синдром (дифференциальная диагностика с системной красной волчанкой) или способность к повышенной выработке антител к фосфолипидам.
Наличие онкологических заболеваний
При онкологических заболеваниях может быть выявлено повышенное образование антител к фосфолипидам.
Клинические проявления антифосфолипидного синдрома
Кожа:
— сетчатое ливедо — это сосудистая сеточка в виде синеватых пятен на голенях, бедрах, кистях, особенно хорошо выявляемая при охлаждении;
— тромбоз одной из центральных вен;
— геморрагии и инфаркты;
— поверхностная сыпь в виде точечных геморрагий, напоминающих васкулит;
— некроз кожи дистальных отделов нижних конечностей;
— хронические язвы конечностей;
— кровоизлияние в подногтевое ложе («симтом занозы»);
— кожные узелки;
— подошвенная и ладонная эритема.
Конечности:
— тромбоз глубоких вен (как осложнение, может развиться тромбоэмболия легочной артерии);
— тромбофлебит;
— ишемия — возникает в результате хронического артериального тромбоза и проявляется участками мышечных атрофий;
— гангрена.
Крупные сосуды:
— синдром верхней полой вены — резкое покраснение лица, вздутие шейных сосудов;
— синдром нижней полой вены;
— синдром дуги аорты — резко повышается АД на руках, большая разница минимального АД на руках и ногах, шум на аорте.
Кости:
— асептический некроз;
— транзиторный остеопороз в отсутствие приема глюкокортикоидов.
Почки:
— тромбоз почечной артерии;
— инфаркт почки;
— внутриклубочковый микротромбоз (почечная тромботическая микроангиопатия) с последующим развитием гломерулосклероза и хронической почечной недостаточностью.
Глаза:
— тромбоз вен сетчатки;
— тромбоз артерий и артериол сетчатки;
— атрофия зрительного нерва;
— инфаркты сетчатки;
— мелкие экссудаты, появляющиеся вследствие окклюзии артериол сетчатки.
Надпочечники:
— тромбоз центральной вены;
— геморрагии и инфаркты;
— надпочечниковая недостаточность;
— болезнь Аддисона.
Если больной получает глюкокортикоиды, диагностика патологии надпочечников достаточно трудна.
Акушерская патология:
— привычное невынашивание беременности — спонтанные аборты (наличие 2 и более спонтанных абортов в анамнезе при обязательном исключении акушерской патологии);
— внутриутробная гибель плода;
— гестоз, особенно тяжелые его проявления: преэклампсия и эклампсия;
— хорея беременных;
— задержка внутриутробного развития плода;
— преждевременные роды.
Основные механизмы развития акушерской патологии при АФС:
1. Тромбоз сосудов плаценты.
2. Развитие инфаркта и недостаточности плаценты.
3. Угнетение синтеза простациклина, дефицит которого обусловливает гипертонус миометрия, выкидыши.
Лабораторные критерии при АФС
1. Антитела к кардиолипину IgG или IgM в сыворотке в средних или высоких титрах выявляются по крайней мере в 2 раза в течение 6 недель при определении с помощью стандартизированного иммуноферментного метода, позволяющего определять зависимые от b-2-гликопротеина (ГП) антитела.
2. ВА, выявляемый в плазме по крайней мере 2 раза в течение 6 недель стандартизированным методом, включающим следующие этапы:
а) удлинение зависимого от фосфолипидов свертывания крови при использовании скринингового теста (активированное частичное тромбопластиновое время, каолиновый тест, тест с ядом гадюки Рассела, протромбиновое время, текстариновое время);
б) неспособность корригировать удлиненное время свертывания крови по данным скрининговых тестов при смешивании с нормальной бестромбоцитарной плазмой;
в) замедление удлиненного времени свертывания крови при добавлении избытка фосфолипидов;
г) исключение других коагулопатий (ингибиторы фактора VIII или гепарина).
Примечание. Для постановки достоверного АФС необходимы по крайней мере 1 клинический и 1 лабораторный критерий [1, 2, 4].
Профилактика и лечение АФС
Профилактика и лечение тромбозов при АФС — не менее сложная задача, чем его корректная диагностика. Это связано с неоднородностью патогенетических механизмов, лежащих в основе АФС, полиморфизмом клинических проявлений, отсутствием достоверных клинических и лабораторных показателей, позволяющих прогнозировать рецидивирование тромботических нарушений. Фактически до сих пор не разработаны общепринятые на международном уровне стандарты, касающиеся тактики ведения пациентов с различными формами АФС, а предлагаемые в настоящее время рекомендации основаны на результатах открытых испытаний или ретроспективного анализа исходов заболевания. Следует сразу подчеркнуть, что глюкокортикоиды (ГК), а также цитотоксические препараты и плазмоферез при АФС применяются только для подавления активности основного заболевания (например, СКВ) или при катастрофическом АФС. В остальных случаях они неэффективны (и даже противопоказаны), поскольку длительная глюкокортикоидная терапия потенциально может увеличивать риск рецидивирования тромбозов, а некоторые цитотоксические препараты (и ГК) увеличивают риск развития осложнений антикоагулянтной терапии [4, 6].
Очевидно, что поскольку для АФС характерен высокий риск рецидивирования тромбозов, подавляющее большинство пациентов нуждаются в проведении профилактической антикоагулянтной терапии в течение длительного времени, иногда пожизненно. Исключение могут составить пациенты со стойкой (в течение нескольких лет) нормализацией уровня аФЛ в отсутствие рецидивов тромбозов. Однако и в этом случае риск рецидивирования тромбозов не может быть полностью исключен, и пациенты нуждаются в тщательном динамическом наблюдении и, вероятно, приеме низких доз аспирина.
Рекомендации по профилактике и лечению тромбозов у пациентов с АФС суммированы в табл. 1.
Увеличение уровня аФЛ в отсутствие клинических признаков АФС
Одним из наиболее спорных является вопрос о целесообразности профилактического лечения пациентов с положительными результатами аФЛ, но без клинических признаков АФС. Как уже отмечалось, достоверные прогностические факторы развития (или рецидивирования) тромбозов и акушерской патологии не установлены. Выделяют следующие факторы риска, которые необходимо учитывать при разработке тактики ведения пациентов.
Полагают, что риск развития (и рецидивирования) тромбозов при АФС можно снизить путем исключения факторов риска, но истинная эффективность этих рекомендаций неизвестна.

По мнению подавляющего большинства исследователей, у лиц с высоким уровнем аФЛ в сыворотке, но без клинических признаков АФС (в том числе у беременных без акушерской патологии в анамнезе) можно ограничиться назначением низких доз аспирина. Однако определенный риск развития тромботических осложнений обусловливает необходимость в тщательном динамическом наблюдении этих пациентов. Дополнительный профилактический эффект, вероятно, могут оказать аминохинолиновые (антималярийные) препараты (в первую очередь — гидроксихлорохин). Известно, что наряду с противовоспалительным эффектом гидроксихлорохин дает определенные антитромботический (подавляет агрегацию и адгезию тромбоцитов, уменьшает размер тромба) и гиполипидемический эффекты. Однако хотя применение гидроксихлорохина у пациентов с СКВ позволяет снизить частоту тромботических осложнений, неизвестно, насколько целесообразно использование этого препарата у людей с высоким уровнем аФЛ при отсутствии других заболеваний [6, 7].

Лечение венозных и артериальных тромбозов
Монотерапия низкими дозами аспирина не позволяет снизить риск развития рецидивов тромбозов при АФС. Поэтому общепринятый способ профилактики тромбозов, эффективность которого доказана в длительных исследованиях на большом клиническом материале, — лечение непрямыми антикоагулянтами, в первую очередь варфарином. Поскольку применение непрямых антикоагулянтов увеличивает риск развития кровотечений, лечение должно проводиться под тщательным клиническим и лабораторным контролем. Напомним, что лабораторный контроль лечения непрямыми антикоагулянтами основан на определении протромбинового времени. Для стандартизации результатов этого теста рекомендуют оценивать международное нормализованное отношение (МНО), которое учитывает влияние используемого в тесте тромбопластина на величину протромбинового времени.
Тактика лечения варфарином при АФС такая же, как и при других тромбофилиях, и заключается в назначении насыщающей дозы (5–10 мг/сут.) в течение первых 2 дней, а затем, с учетом МНО, подборе оптимальной дозы препарата. Назначение варфарина в начальной дозе 5 мг предпочтительней, так как реже приводит к избыточной антикоагуляции (увеличение МНО > 3) и транзиторной гиперкоагуляции. Последняя связана со снижением уровня белка С в течение первых 36 ч лечения варфарином. При риске рецидивирования артериальных тромбозов у пациентов с АФС следует использовать высокие дозы варфарина, позволяющие поддерживать МНО > 3, а при венозных — средние дозы (МНО 2–3). Лечение варфарином обычно позволяет надежно предупреждать рецидивы венозных тромбозов, но у некоторых пациентов с артериальными тромбозами оно недостаточно эффективно. В этих случаях возможно проведение комбинированной терапии непрямыми антикоагулянтами и низкими дозами аспирина (и/или дипиридомола), которая наиболее оправдана у лиц молодого возраста без факторов риска развития кровотечений (вторичный АФС, тромбоцитопения, нарушение функции тромбоцитов, связанные с наличием ВА, дефекты протромбина). Следует особо подчеркнуть, что прерывание приема непрямых антикоагулянтов, как правило, приводит к рецидиву тромбозов (иногда развитию катастрофического АФС), причем риск развития повторных тромбозов особенно высок в первые 6 мес. после отмены непрямых коагулянтов.
Прием непрямых антикоагулянтов связан с неизбежным риском развития кровотечений, особенно при МНО > 4, и у пациентов с такими факторами риска кровоточивости, как пожилой возраст, неконтролируемая артериальная гипертония (систолическое АД > 180 мм рт.ст., диастолическое АД > 100 мм рт.ст.), язвенная болезнь желудка, прием алкоголя, прием нестероидных противовоспалительных препаратов (НПВП) и др. Кроме того, у многих пациентов с АФС наблюдаются спонтанные колебания МНО, что затрудняет подбор эффективной и безопасной дозы варфарина. При этом колебания МНО связаны с приемом лекарственных препаратов, влияющих на метаболизм непрямых антикоагулянтов, многие из которых широко используются в ревматологии (например, цитостатики, ГК, аллопуринол, НПВП, цефалоспорины и др.). Необходимо обратить внимание на трудность подбора дозы непрямых антикоагулянтов при наличии в крови ВА, присутствие которого иногда приводит к ложноположительным результатам, то есть к увеличению протромбинового времени и МНО. В некоторых случаях резистентность к непрямым антикоагулянтам у пациентов с АФС имеет генетическую природу и связана с мутацией факторов V и II свертывания крови. Носителям мутации фактора V следует крайне осторожно назначать непрямые антикоагулянты, прием которых может привести к гиперкоагуляции и образованию обширных язв кожи. При резистентности активированного белка С наблюдаются такие осложнения, как липодерматосклероз, образование дистальных трофических язв, развитие которых связано с распространенным микрососудистым тромбозом [1, 2].
Центральное место в лечении острых тромботических осложнений при АФС занимают прямой антикоагулянт — гепарин и особенно препараты низкомолекулярного гепарина. Тактика применения прямых антикоагулянтов у пациентов с АФС не отличается от общепринятой и детально изложена в специальной литературе. Если больные до этого не получали непрямых антикоагулянтов, то их следует назначить в течение первых 24–48 ч от начала гепаринотерапии. Лечение гепарином следует проводить по крайней мере до момента достижения МНО в пределах 2–3. У пациентов с риском рецидивирования тромбозов в течение длительного времени должна проводиться интенсивная профилактика с использованием низкомолекулярного гепарина.

Для лечения катастрофического АФС используется весь арсенал методов интенсивной и противовоспалительной терапии, применяемый для лечения критических состояний при ревматических болезнях. Эффективность терапии в определенной степени зависит от возможности устранить факторы, провоцирующие его развитие, например подавление инфекции и/или активности основного заболевания. Развитие этого синдрома фактически является единственным абсолютным показанием к проведению сеансов плазмофереза у пациентов с АФС, которые следует сочетать с максимально интенсивной антикоагулянтной терапией, использованием для замещения свежезамороженной плазмы и в отсутствие противопоказаний проведением пульс-терапии ГК и циклофосфамидом. Отдельные клинические наблюдения свидетельствуют об определенной эффективности внутривенного введения иммуноглобулина (сандоглобулин или октагама) [3, 8, 9].
В настоящее время стандартом профилактики рецидивирующих потерь плода (а также венозных и артериальных тромбозов в послеродовом периоде) при АФС является применение низких доз аспирина (81 мг/сут.) в сочетании с низкомолекулярным гепарином в течение всего периода беременности и по крайней мере 6 мес. после родов. Следует особо подчеркнуть существенные преимущества препаратов низкомолекулярного гепарина, которые почти полностью вытеснили нефракционированный гепарин при лечении венозных тромбозов и акушерской патологии у пациенток с АФС [4, 5].
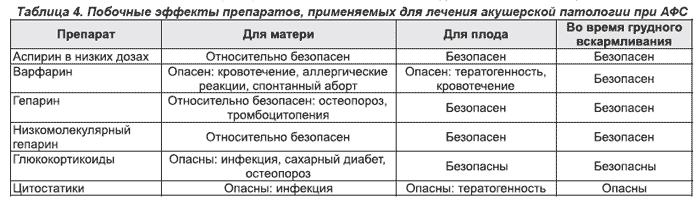
Необходимо также иметь в виду, что лечение аспирином и гепарином позволяет снизить риск развития венозных и артериальных тромбозов, которые нередко развиваются у пациенток с АФС на фоне беременности. Использование непрямых антикоагулянтов противопоказано, так как это приводит к варфариновой эмбриопатии, характеризующейся нарушением роста эпифизов и гипоплазией носовой перегородки, а также неврологическими нарушениями плода. Лечение средними / высокими дозами ГК, популярное в 80-х годах XX века, в настоящее время практически не применяется из-за побочных эффектов как у матери, так и у плода и отсутствия доказательств их эффективности. Применение ГК оправдано только при вторичном АФС и направлено на лечение не АФС, а основного заболевания. Необходимо помнить, что перед родами нельзя отменять ГК, и женщинам, получающим ГК во время беременности, во время родов следует дополнительно внутривенно вводить ГК, для того чтобы избежать надпочечниковой недостаточности. При родоразрешении кесаревым сечением введение низкомолекулярных гепаринов отменяется за 2–3 дня до операции и возобновляется в послеродовом периоде с последующим переходом на прием непрямых антикоагулянтов. Ниже даны рекомендации по наблюдению во время беременности, а также перечислены наиболее часто используемые при АФС препараты и их побочные действия (табл. 4).
Рекомендации по динамическому наблюдению пациенток с АФС во время беременности
1. В начале беременности:
— ЭхоКГ для исключения вегетации на клапанах;
— анализ мочи: суточная протеинурия, клиренс креатинина;
— биохимическое исследование: печеночные ферменты.
2. В процессе беременности:
— тромбоциты каждую неделю в течение первых 3 нед. от начала лечения гепарином, затем 1 раз в месяц.
— обучение: самостоятельное выявление признаков тромбоза. Измерение массы тела, АД, уровня белка в моче (для ранней диагностики преэклампсии и НЕLLР-синдрома);
— ультразвуковое исследование плода (каждые 4–6 нед. начиная с 18–20-й недели беременности) для оценки роста плода;
— число сердечных сокращений у плода начиная с 32–34-й нед. гестации. У пациенток с преэклампсией требуется более тщательный мониторинг. При соблюдении представленных рекомендаций удается увеличить до 70–80 % частоту успешных родов у женщин с двумя и более эпизодами потери плода в анамнезе. В то же время даже в случае успешных родов у пациенток с АФС отмечается увеличение частоты преэклампсии, задержки роста плода, преждевременных родов и других форм акушерской патологии. При этом у женщин с АФС, как правило, рождаются здоровые дети, у которых не наблюдается признаков нарушения физического и нейропсихического развития, тромбозов и др. по крайней мере в течение 5 лет наблюдения [4, 5].
Гематологические осложнения
Умеренная тромбоцитопения, нередко наблюдавшаяся у пациентов с АФС, не требует специального лечения. При вторичном АФС в рамках СКВ тромбоцитопения обычно хорошо компенсируется ГК, аминохинолиновыми препаратами, а в резистентных случаях — низкими дозами аспирина. Тактика лечения резистентной тяжелой тромбоцитопении (менее 50–109/л), создающей угрозу кровотечений, до конца не разработана. Этим пациентам наряду с применением ГК в высоких дозах целесообразно внутривенное введение иммуноглобулина. Имеются данные об определенной эффективности препарата даназол, обладающего слабой андрогенной активностью [1, 2].
В тех случаях, когда гепарины усиливают тромбоцитопению, необходима немедленная отмена этих препаратов и перевод больных на синтетические пентасахариды (арикстра и др.). Последние не образуют комплексов с антигепариновым фактром тромбоцитов и не вызывают тромбоцитопению. Препаратами выбора могут быть средства прямого анитромботического действия (гирудины, мелоготран), а также гликозаминогликаны (сулодексид). При АФС сулодексид вводят в/м по 600 ЛПЛ ЕД/сут. в течение 20 дней, а затем по 250 ЛПЛ ЕД 2 раза в сутки 2–3 месяца. При проявлении нарушений микроциркуляции применяют курсовое лечение ангиопротекторами — эндотелином по 150 мг 2 раза в сутки или детралексом — по 2 табл. 2 раза в сутки 2–3месяца [1, 2].
Таким образом, в настоящее время разработаны достаточно эффективные методы профилактики и лечения АФС, применение которых позволяет существенно улучшить прогноз у пациентов с этой тяжелой патологией. Успех лечения зависит не только от правильного выбора препаратов, но и от возможности проведения тщательного наблюдения за больным для предупреждения побочных эффектов. Бурный прогресс, который наблюдается в последние годы в области создания новых антикоагулянтных препаратов, позволяет надеяться на то, что в дальнейшем лечение АФС будет еще более эффективным и безопасным [1, 2, 4, 6].




